Идиопатической парциальной эпилепсии детского возраста

Эпилепсии известны с давних времен, еще с глубокой древности. Их интенсивное изучение проводилось на протяжении предыдущего столетия, особенно в последние десятилетия. За это время знания углублялись, а взгляды на эпилепсии как заболевания менялись, прошли несколько этапов.
На первом этапе считали, что эпилепсии – это наследственные заболевания. В США существовали законы (только в 1982 г. был отменен последний), согласно которым больным эпилепсией запрещалось вступать в брак и иметь детей. Такие больные подвергались принудительной стерилизации.
Второй этап был связан с бурным развитием методов диагностики, использованием новых достижений науки и техники. Этот период характеризовался полным отрицанием роли генетических факторов в возникновении эпилепсий. После появления методов нейровизуализации и их широкого применения в обследовании больных эпилепсиями утвердилось мнение, что все эпилепсии являются симптоматическими. Исследователи стали считать, что в основе всех случаев эпилепсий лежат органические поражения головного мозга, если же эти поражения выявить не удается, то это связано с тем, что методы диагностики недостаточно совершенны, в дальнейшем, с появлением новых, более совершенных, причина возникновения эпилепсий (этиология) всегда будет установлена.
На современном этапе признается существование как симптоматических, так и генетически обусловленных эпилепсий. Существует мнение, что влияние на манифестацию эпилепсий оказывают 2 фактора: наследственная отягощенность и внешние воздействия (инфекции, травмы, интоксикации и др.).
На схеме показано влияние различных факторов на возникновение эпилепсий (В.А. Карлов, 2001).
За последнее десятилетие удалось картировать гены многих эпилептических синдромов, которые являются составляющей таких наследственных болезней, как болезнь Лафора, сиалидоз, болезнь Гоше, галактосиалидоз и др. (табл. 1).
Кроме заболеваний с картированными генами, при которых эпилептический припадок является одним из синдромов в структуре заболевания, существуют идиопатические эпилепсии (ИЭ), при которых эпилептический припадок является основным и, в большинстве случаев, единственным признаком заболевания.
При некоторых формах эпилепсий полный набор генов, с которыми ассоциируется каждое из заболеваний, не установлен. К таким заболеваниям относят доброкачественную эпилепсию детского возраста с затылочными пароксизмами, доброкачественную парциальную эпилепсию (ПЭ) с аффективными пароксизмами, семейную височную эпилепсию и первичную эпилепсию чтения.
При некоторых формах эпилепсий известно только то, что за возникновение и развитие болезни отвечает один или несколько генов. Моногенные и полигенные эпилепсии представлены в таблице 2.
К формам эпилепсий с установленными генами относят: доброкачественные семейные припадки новорожденных, генерализованные эпилепсии с фебрильными судорогами (+), аутосомно-доминантную ночную лобнодолевую эпилепсию и аутосомно-доминантную ПЭ со слуховыми симптомами (табл. 3).
Ранее считали, что ИЭ могут быть только генерализованные формы. Однако в процессе исследований было установлено, что некоторые ПЭ также являются идиопатическими. К настоящему времени установлены следующие идиопатические парциальные эпилепсии:
- Роландическая или доброкачественная эпилепсия (РЭ) детского возраста с центротемпоральными пиками.
- Доброкачественная ПЭ детского возраста с затылочными пароксизмами (синдром Гасто) и ее вариант, отмечающийся у детей более раннего возраста – синдром Панайотопулоса.
- Доброкачественная ПЭ с аффективными симптомами (синдром Далла-Бернардина).
- Аутосомно-доминантная лобная эпилепсия с ночными пароксизмами.
- Семейная височная эпилепсия.
- Эпилепсия чтения.
- ПЭ со слуховыми симптомами;
- Семейная ПЭ с вариабельным фокусом.
Только 3 из всех идиопатических парциальных эпилепсий дебютируют исключительно в детском возрасте. К таким формам относят РЭ, синдромы Гасто и Панайотопулоса, синдром Далла-Бернардина.
ИЭ определяются по следующим признакам:
- возрастзависимый дебют;
- наличие припадков только одного типа, отсутствие их трансформации;
- отсутствие неврологической симптоматики;
- отсутствие интеллектуально-мнестических и психических нарушений;
- эффективность медикаментозного лечения, в большинстве случаев – монотерапии;
- благоприятный прогноз в виде полного исчезновения приступов (в большинстве случаев).
Основные различия идиопатических и симптоматических эпилепсий представлены в таблице 4.
Роландическая эпилепсия
Из всех форм идиопатических парциальных эпилепсий в детском возрасте зачастую встречается РЭ (доброкачественная ПЭ с центрально-темпоральными пиками). Доля этой формы эпилепсий составляет 10-20% от всех эпилепсий детского возраста.
Дебют РЭ наблюдается в возрасте 2-12 лет (пики возникновения заболевания приходятся на возраст 3 и 9 лет). Мальчики болеют чаще, чем девочки. Клиническая характеристика приступов заключается в следующем:
- возникают в ночное время суток;
- короткие (длительность до нескольких минут);
- после пробуждения или в дневное время суток ощущаются, предшествующие приступу, парестезии в области языка, глотки;
- наблюдаются гемифациальные или фацио-брахиальные подергивания, сопровождающиеся выраженным слюнотечением;
- припадки иногда генерализуются, захватывая все тело.
После окончания припадка временно пропадает речь. Припадки редкие, с частотой 1-2 в месяц.
Полная терапевтическая ремиссия наступает до возраста 15 лет в 97% случаев.
Базовыми препаратами для лечения РЭ являются препараты вальпроевой кислоты в суточной дозе 20-30 мг/кг массы тела. В случаях их неэффективности рекомендуются карбамазепины (10-20 мг/кг/сут) или дифенин (3-5 мг/кг/сут). Политерапия и применение барбитуратов противопоказаны.
Синдром Панайотопулоса
Для синдрома Панайотопулоса характерен возраст дебюта 1-9 лет, пик возникновения заболевания приходится на 3-6 лет. Типичным является возникновение припадков в ночное время. Приступы очень длительные, от 30 минут до 7 часов (в среднем 2 часа). Клиническими особенностями припадков являются вегетативные проявления, длительная утрата сознания, тенденция к статусному течению.
При синдроме Панайотопулоса в 93% эпилептические припадки сопровождаются вегетативными проявлениями. Из всех вегетативных симптомов наиболее частыми являются тошнота, позывы на рвоту, рвота. Кожные покровы во время припадка бледные, реже отмечается их покраснение; зрачки чаще всего расширены; нарушение сознания сопровождается недержанием мочи и кала. Практически всегда наблюдаются слабо выраженные нарушения дыхания и сердечного ритма, но в некоторых случаях достигающие остановки сердца. Иногда отмечается гиперсаливация, нарушение моторики кишечника, нарушение терморегуляции.
Сознание нарушено у 94% больных. Практически у всех пациентов наблюдается отведение глазных яблок в одну из сторон. Во время приступа ребенок обмякает, реже (в 26%) наступают гемиконвульсии, еще реже (в 20%) – генерализованные тонико-клонические или клонико-тонические судороги.
У 44% детей с этим синдромом наблюдается так называемый вегетативный эпилептический статус, длительностью до 7 часов.
После эпилептического припадка наступает сон, длящийся несколько часов. По его окончании каких-либо субъективных или объективных нарушений не отмечается.
Частота припадков невелика, иногда за все время заболевания бывает только 1 припадок.
Использование компьютерной томографии или магнитно-резонансной томографии не выявляет поражений мозговых структур. Дети имеют нормальное психоэмоциональное и интеллектуальное развитие.
При ЭЭГ-исследовании фиксируется медленная активность со спайками (у 2/3 пациентов только в затылочных отведениях). ЭЭГ-нарушения проявляются только при записи с закрытыми глазами. Если пациент открывает глаза, изменения исчезают. ЭЭГ пациента с синдромом Панайотопулоса представлена на рисунке 3.
Ремиссия наступает к 9 годам у 92% пациентов.
Синдром Гасто
Эпилепсия Гасто характеризуется более поздним началом – от 3 до 15 лет, средний возраст дебюта заболевания – 8 лет.
Приступы чаще проявляются в дневное время суток (2/3 случаев), бывают очень короткими (от нескольких секунд до 3 минут), реже отмечаются при пробуждении.
Клиническая картина: наличие парциальных сенсорных приступов со зрительными нарушениями, элементарных зрительных галлюцинаций, частые случаи кратковременной слепоты или частичной потери зрения, реже встречаются сложные зрительные галлюцинации и иллюзии. Версивный компонент с поворотом головы и глаз контрлатерально очагу наблюдается у 70% больных. Также имеются симптомы распространения возбуждения из затылочной доли в виде гемиконвульсий (43%), комплексных фокальных припадков (14%), дисфазии, адверсивных припадков (25%), вторично-генерализованных тонико-клонических судорог (13%).
Постприступная мигреноподобная головная боль встречается у половины больных. Иктальная рвота бывает очень редко.
Прогноз: ремиссия в 82% к 15 годам.
В таблице 5 представлены различия между синдромами Панайотопулоса и Гасто.
Для предотвращения припадков назначается базовый препарат – вальпроат (30-50 мг/кг в 2-3 приема), а также препараты – карбамазепин (20-30 мг/кг/сут) и клоназепам (0,15 мг/кг/сут). При отсутствии адекватного лечения приступы могут возникать спонтанно, во время разговора и т.д.
Синдром Далла-Бернардина возникает в возрасте от 2 до 9 лет, клинически проявляется приступами внезапного страха или ужаса, сопровождающимися жевательными, глотательными автоматизмами, остановкой речи, вегетативными симптомами, гиперкинезами, абортивными болями. Приступы развиваются сразу после засыпания или в дневное время суток с продолжительностью в 1-2 минуты.
Препаратами 1-й линии выбора при синдроме Далла-Бернардина являются карбамазепины (10-20 мг/кг/сут массы). При их неэффективности могут применяться дифенин (2-3 мг/кг/сут) и препараты вальпроевой кислоты (20-30 мг/кг/сут). Показана исключительно монотерапия. В целом прогноз благоприятный, в редких случаях приступы могут сохраняться у пациентов старше 18 лет.
Результатом генетических исследований является выделение идиопатических парциальных эпилепсий в самостоятельные нозологические формы. Углубление знаний детских неврологов об особенностях клинической картины и течения, ЭЭГ-паттернов и результатах нейровизуализации, характерных для этих форм заболевания, позволяют своевременно отдифференцировать их от симптоматических парциальных эпилепсий. Это имеет принципиальное значение в выборе адекватной терапии – лечения с помощью монотерапии, назначения препаратов вальпроевой кислоты, наиболее эффективных при идиопатических формах. Идиопатические парциальные эпилепсии, по сравнению с симптоматическими, имеют более благоприятный прогноз, что определяет тактику ведения – отсутствие необходимости длительного лечения, возможность отмены антиэпилептических препаратов в определенные возрастные периоды.
Патогенез нарушения
Хотя первые симптомы возникают у детей в возрасте от двух до восьми лет, выделяют отдельную фокус-группу больных, у которых заболевание проявляется в 4-6-летнем возрасте.
В некоторых случаях болезнь трансформируется из синдрома Веста, диагноз которого ставят деткам до года. Тогда синдром будет развиваться по одному из сценариев:
- инфантильные спазмы синдрома Веста сменяются тоническими приступами, пропуская скрытую форму и переходят в синдром Леннокса-Гасто;
- детские спазмы синдрома Веста проходят, отмечается улучшение психомоторного развития.
Комплекс провоцирующих факторов
На сегодняшний день конкретные причины, провоцирующие этот вид эпилепсии не известны. К факторам риска можно отнести:
- кислородное голодание плода в пренатальном периоде ;
- поражения головного мозга ребёнка в пренатальный и натальный период — преждевременные роды, физиологическое недоразвитие;
- инфекционные поражения мозга вследствие краснухи, энцефалита, менингита;
- кортикальная дисплазия — нарушение строения коры головного мозга;
- туберозный склероз — доброкачественные опухоли во множестве тканей и органов.
- идиопатический фактор — болезнь развивается по неизвестным причинам;
- генетическая предрасположенность .
Диагностика синдрома Леннокса-Гасто
Диагноз заболевания ставится на основе проведения таких мероприятий:
- Сбор анамнеза — в каком возрасте появились первые симптомы, как проходили роды, имелись ли в семье больные эпилепсией, как протекало умственное и физическое развитие ребёнка.
- Неврологическое обследование — беседа с ребёнком, использование специальных тестов и шкал для выявления задержки в умственном развитии.
- Электроэнцефалография — анализ электрической активности в головном мозге. У больных обнаруживаются диффузные медленные острые волны. Процедура проводится в течение целого дня в состоянии бодрствования и покоя, что позволяет отследить частоту приступов.
- МРТ и КТ — послойное обследование строения мозга с целью обнаружения повреждения его структур.
Лечение заболевания Леннокса-Гасто предполагает использование нескольких методов.
Пациента консультируют невролог и эпилептолог. Чтобы установить и подтвердить диагноз, врач анализирует клинические признаки, собирает анамнестическую информацию, проводит неврологический осмотр и направляет больного на дополнительные обследования. В рамках диагностики могут выполнять электроэнцефалографию, компьютерную, магнитно-резонансную и позитронно-эмиссионную томографию.
В 1939 году специалистами впервые были освещены и подробно описаны изменения ЭЭГ, представляющие собой довольно медленное диффузное проявление активности, которым соответствует частота 2 Гц.
Эти изменения в научной среде получили специальное название – petit mal. Уже к середине прошлого века зарубежными специалистами был выделен целых ряд эпилептических пароксизмов, которые были определены как самостоятельный синдром, что определило конкретные критерии, по которым пациентам ставился диагноз эпилепсия.
Эта патология является на сегодняшний день довольно распространенной формой детского заболевания, по информации из различных источников его можно наблюдать в 3-11% всех зафиксированных случаев постановки диагноза эпилепсии у детей.
Мальчик с синдромом Леннокса-Гасто
Лечению предшествует тщательная диагностика, на первоначальном этапе она заключается в беседе специалиста с родителями ребенка, основная цель заключается в выяснении следующих вопросов:
- период, когда у ребенка произошел первый приступ;
- количество перенесенных приступов и их периодичность;
- длительность проявления симптоматики;
- наличие у ребенка каких-либо тяжелых заболеваний (при положительном ответе требуется информация обо всех препаратах, которые он принимал или принимает);
- наличие травм головы, которые могли привести к повреждению головного мозга;
- наличие осложнений, которые сопровождали процесс родов;
- проблемы ребенка в образовательном процессе;
- возможные нарушения в поведении.
Для того чтобы зафиксировать и подтвердить наличие у ребенка синдрома Леннокса-Гасто специалист проводит оценочную и аналитическую деятельность по трем критериям:
- разновидность возникающих приступов и насколько тяжело они лечатся;
- наличие задержек в психическом развитии и общие нарушения, связанные с мыслительной деятельностью;
- данные электроэнцефалографий, показывающие всю картину изменения или нарушения частот мозговых волн.
Характеристика припадков
Дети с синдромом Леннокса-Гасто подвергаются частым приступам эпилептических припадков в тяжёлой форме. Клиническая картина болезни выглядит следующим образом:
У некоторых детей первым симптомом заболевания может быть приступ с продолжительностью до полу — часа или же продолжительные непрерывные приступы. Это экстренное состояние, которое требует неотложной медицинской помощи.
У многих детей с болезнью Леннокса-Гасто присутствует умственное недоразвитие, и как следствие — трудности в обучении, а также когнитивные (поведенческие) расстройства, например, отсутствие чувства самосохранения, демонстративность, импульсивность.
Клиническая картина
В подавляющем большинстве случаев болезнь начинает проявляться у детей в возрасте 1-7 лет, для болезни характерны разные пароксизмы, которые могут различаться не только по своему характеру, но и по периодичности проявления. Чаще все они фиксируются при бодрствовании, в отдельных случаях в период пробуждения, во сне и во время активного бодрствования фактически не возникают.
Со временем специалисты стали разделять разнообразные формы данного синдрома. Одной из них является криптогенная разновидность, при которой до возникновения недуга ребенок растет здоровым и нормально развивается.
Симптоматическая форма начинает проявляться после получения серьезных травм головного мозга либо, если еще до проявления синдрома было зафиксировано отставание в психическом развитии. Симптоматическая разновидность заболевания встречается значительно чаще, в общей статистике она фиксируется в 75% случаев, если ребенку был поставлен диагноз рассматриваемой патологии.
Данный синдром считается одной из тяжелейших форм проявления эпилепсии в основном по той причине, что его очень трудно вылечить.
На сегодняшний день продолжаются разработки, и специалисты формируют новые терапевтические методики для помощи больным детям. Первые приступы могут быть зафиксированы в любом возрасте от 2 до 6 лет, но в большинстве случаев это происходит в 5 лет.
С этого момента начинает наблюдаться задержка в общем развитии, в школьном возрасте больные дети зачастую испытывают сложности с учебной программой, иногда это приобретает крайне тяжелую форму. Параллельно могут возникнуть расстройства в поведении.
Ситуация усложняется тем, что каждый ребенок проявляет индивидуальную реакцию на синдром Леннокса-Гасто и зачастую довольно сложно построить прогноз дальнейшего развития событий. Иногда терапевтические практики отличаются высокой эффективностью, значительно снижая количество происходящих приступов, но в ряде случаев они оказываются бессильны.
В отдельных случаях приступам сопутствуют сильные судороги, со временем начинают наблюдаться проблемы, связанные с процессом мышления, развитие постепенно останавливается.
Причины синдрома Леннокса-Гасто
До сих пор не изучены и не установлены точные причины, которые вызывают у детей синдром Леннокса-Гасто. В отдельных случаях по заключениям специалистов данное заболевание возникало из-за следующих факторов:
- пониженное количество кислорода, которое получал плод в период беременности;
- нехватка веса у новорожденного, зачастую вызываемая преждевременными родами;
- травмы головного мозга тяжелой степени, которые были нанесены ребенку в период беременности или во время рождения;
- перенесение инфекционных заболеваний, способных поражать головной мозг, например, менингита или краснухи;
- судорожные реакции, начавшиеся еще в период младенчества;
- ряд заболеваний, в том числе туберозный склероз или кортикальная дисплазия.
Этиология развития заболевания до конца не изучена. В большинстве случаев недуг провоцируется генетическими патологиями, возникающими внутриутробно или в первый год жизни ребенка. Болезнь может образоваться на фоне гипоксии плода, внутриутробных инфекций (краснухи, цитомегалии, простого герпеса, токсоплазмоза), родовой травмы, недоношенности, асфиксии новорожденного, тяжелых инфекционных заболеваний (менингита, энцефалита), гидроцефалии, кортикальной дисплазии, гипоплазии мозолистого тела, метаболических нарушений, туберозного склероза. У некоторых пациентов недуг проявляется при прогрессировании синдрома Веста.
Наиболее распространенные причины:
- Генетические предрасположенность.
- Нейрокожные расстройства.
- Посттравматическая гипоксически-ишемическая энцефалопатия.
- Менингит.
- Пороки развития мозга.
- Перинатальное удушье.
- Серьезное повреждение мозга.
- Инфекции центральной нервной системы.
- Дегенеративные заболевания.
- Наследственные нарушения обмена веществ.
В 30-35% случаев причина неясна. Лечение очень сложное, так как оно очень устойчиво к обычной терапии. Лекарства первого выбора включают вальпроат и бензодиазепины (то есть клоназепам, нитразепам, клобазам), в зависимости от наиболее частого типа эпилептического приступа у пациента.
Как правило, более чем один препарат пописан, чтобы уменьшить признаки. Например, пациент может принимать смесь ламотриджина, вальпроата или топирамата. У некоторых детей наблюдается улучшение, но обычно они со временем вырабатывают терпимость к лекарству, так что они теряют способность контролировать приступы.
Лечение длится всю жизнь. Основная цель — улучшить качество жизни пациента за счет снижения частоты приступов эпилепсии, хотя полная ремиссия невозможна. В дополнение к медикаментозному лечению существуют другие методы лечения, включая кетогенную диету, стимуляцию блуждающего нерва и хирургическое лечение.
Сегодня долгосрочный прогноз ужасает: уровень смертности до 11 лет составляет 10%. Хорошо то, что исследователи каждый день усердно работают над улучшением этих показателей и уже добились значительных успехов в последние годы благодаря прогрессу технологии.
Медикаментозная терапия
Цель терапии — снижение частоты приступов. Препараты подбираются индивидуально с учётом минимального возникновения побочных эффектов.
Назначаются следующие противосудорожные препараты:
- Клобазам;
- Руфинамид;
- Дивальпроат натрия;
- Ламотриджин;
- Топирамат;
- Депакин;
- Карбамазепин;
Зачастую применение одного средства не даёт нужных результатов. Препараты назначаются комплексно, и приём строго контролируется лечащим врачом.
Хирургическое лечение
В случае отсутствия положительного эффекта после проведения медикаментозной терапии, проводится хирургическое лечение с использованием различных методов:
- Имплантация стимулятора блуждающего нерва . Выполняется посредством вшивания в области ключицы специального устройства с электродом, передающим электрические импульсы на блуждающий нерв. Этот метод позволяет снизить количество припадков. Как показывает практика, более чем у половины пациентов благодаря этому методу частота приступов заметно снижается.
- Имплантация RNS-стимулятора под кожу головы, который генерирует электроды в область мозга. Электроды непрерывно фиксируют электрическую активность мозга, и в момент начала приступа стимулятор подаёт электрические импульсы, которые подавляют эпилептический очаг.
- Каллозотомия — рассечение мозолистого тела, которое представляет собой пучок нервов, соединяющий между собой полушария мозга и передающий эпилептические импульсы из одной части мозга в другую. После проведённой операции приступы не пропадают совсем, но становятся менее интенсивны, т. к. импульсы не генерируются из одного полушария в другое. Обычно такое лечение применяется в случаях неконтролируемых эпилептических припадков.
Особенности питания
Очень часто наряду с другими терапевтическими методами применяется кетогенная диета. Она представляет собой снижение потребления углеводов и увеличение потребления жиров.
Кроме этого, рекомендуются продукты с низким гликемическим индексом, т. е. те, которые снижают уровень сахара в крови. К ним относятся: фрукты, овощи, бобовые, цельнозерновые продукты, обезжиренное молоко.
Во время такой диеты врач должен контролировать возможность уменьшения доз принимаемых препаратов.
Осложнения и прогноз
Заболевание в большинстве случаев имеет неблагоприятный прогноз. Около 10% больных умирают в возрасте десяти лет, это связано с тяжёлыми травмами во время приступов.
Практически у всех больных детей наблюдается умственная отсталость в той или иной степени, половина больных не способны к самообслуживанию.
Также к осложнениям можно отнести:
- устойчивость припадков в связи с резистентностью к лечению;
- сохранность умственного дефекта, который не исчезает;
- расстройство социальной и трудовой адаптации.
Предупредить возникновение данного заболевания невозможно. Основными профилактическими мерами в данном случае можно считать:
- Поддержание высокого качества жизни — здоровый образ жизни, полноценный восьмичасовой сон, правильное питание, избегание влияния стрессовых факторов.
- Квалифицированное лечение на протяжении всей жизни . Ни в коем случае нельзя самостоятельно менять схему лечения или прерывать его.
В настоящее время эпилепсия входит в пятерку наиболее распространенных неврологических заболеваний. Она нередко дебютирует уже в детском возрасте и относится к потенциально инвалидизирующим патологиям. Причем в большинстве случаев диагностируется идиопатическая форма эпилепсии. Это классический и наиболее часто встречающийся вариант заболевания, с несколькими клиническими разновидностями и вариантами течения.
Что это за болезнь

Эпилепсией называют хроническое заболевание, обусловленное патологией на уровне головного мозга и проявляющееся преимущественно приступами (припадками) судорожного и бессудорожного характера. Свойственны ей и другие, менее яркие симптомы. Изучением всех связанных с эпилептической болезнью проблем занимается особая наука эпилептология, но в повседневной клинической практике диагностику и лечение нередко проводит невролог (невропатолог).
Согласно действующей классификации, эпилепсия подразделяется на идиопатическую, симптоматическую и криптогенную. Эти неоднородные по происхождению и симптоматике состояния отличаются друг от друга характером изменений в центральной нервной системе.
Идиопатическая эпилепсия относится к самостоятельно возникающим заболеваниям. Раньше ее называли истинной, генуинной, первичной. Она характеризуется несколькими признаками:
- В головном мозге нет органических (структурных) изменений. Поэтому такой форме болезни не свойственны очерченная очаговая неврологическая симптоматика, задержка психомоторного развития или когнитивный регресс. Современные высокоточные методы нейровизуализации оказываются не информативными.
- Приводящие к припадкам нарушения носят функциональный характер и не обусловлены действием каких-либо внешних факторов или появившихся в течение жизни заболеваний.
- Склонность к раннему проявлению симптоматики. Идиопатическая эпилепсия в 70-75% случаев дебютирует в детском возрасте, с основным пиком заболеваемости у подростков в 9-14 лет. Поэтому обычно речь идет о детских и ювенильных (юношеских) формах болезни.
- Наследственная предрасположенность. В настоящее время выделено около 500 генов в соматических хромосомах, мутация в которых может стать причиной эпилепсии. Многие формы болезни характеризуется аутосомно-доминантным или рецессивным типом наследования.
- Достаточно высокая чувствительность к современным противосудорожным препаратам. Это позволяет в большинстве случаев добиться значительного урежения приступов или даже перевести заболевание в стойкую ремиссию.
На долю идиопатических типов приходится около 70-75% случаев эпилепсии с различными клиническими проявлениями, при этом преобладают ее генерализованные формы.
Что происходит в мозге при идиопатической эпилепсии
Болезнь не связана с локальной гибелью или ишемией (выраженным кислородным голоданием) нервных клеток, опухолевым ростом, внутричерепной гипертензией, пороками развития или какими-либо другими патологическими процессами. Все изменения носят функциональный характер и формируются на клеточном и биохимическом уровнях.
Согласно современным представлениям, значительная часть случаев идиопатической эпилепсии обусловлена каналопатией – дисфункцией ионных каналов в стенках нервных клеток. Такая проблема обычно обусловлена патологией одного или нескольких генов, кодирующих структуру трансмембранных белков.
Результатом подобных каналопатий становится дефект транспорта отдельных ионов (калия, натрия) или целых молекул нейромедиаторов (ГАМК, ацетилхолина и др.), что приводит к комплексу нарушений:
- изменение скорости проведения сигналов в нервной ткани, склонность к каскадному распространению пароксизмальных импульсов;
- поддержание дисбаланса между процессами торможения и возбуждения в головном мозге, с преобладанием активирующих влияний;
- создание предпосылок для чрезмерной стойкой деполяризации на поверхности нейронов (она может быть запущена выраженным ионным дисбалансом или избыточным количеством глутамата, причем в подавляющем большинстве случаев без явного провоцирующего фактора).
При идиопатической эпилепсии соседние нейроны очень легко синхронизируются друг с другом, что объясняет склонность к быстрому тотальному распространению пароксизмально возникшего гипервозбуждения. В этот процесс генерализации вовлекаются и подкорковые регулирующие структуры, что ускоряет передачу эпилептического импульса. В результате возбуждение охватывает практически весь головной мозг, провоцируя приступ с различной симптоматикой.
При этом у каждого пациента формируется собственная достаточно стабильная схема вовлечения и реакции различных мозговых структур. Это определяет характерную клиническую картину болезни, с преобладанием определенных симптомов во время приступа.
Основные проявления
Ключевое проявление эпилепсии – разнообразные приступы, которые могут комбинироваться друг с другом или существовать в изолированном виде. Они бывают судорожными (сопровождающимися неконтролируемой пароксизмальной активностью скелетных мышц) и бессудорожными, фокальными и генерализованными.
Нередко развитию приступа предшествует аура. А при серии следующих друг за другом припадков с генерализацией говорят о развитии эпилептического статуса, что чревато развитием отека головного мозга.
Судорожные приступы
При идиопатической эпилепсии возможно появление приступов любого типа. Но преобладание одного из них или характерная трансформация разных видов друг в друга позволяет дифференцировать формы болезни.
К основным вариантам припадков относят:
Для большинства идиопатических форм болезни не свойственно развитие неврологического дефицита и выпадение высших корковых функций. Физическое и интеллектуальное развитие у детей обычно не страдает, если нет осложняющих ситуацию сопутствующих заболеваний и предшествующих перинатальных вредностей.
Изменения личности по эпилептическому типу возникают нечасто, лишь при тяжело протекающих формах болезни с частыми плохо контролируемыми генерализованными приступами и эпистатусами.
Классификация
В настоящее время общепризнанной считается классификация, основы которой были приняты еще в 1981 году Международной Лигой по борьбе с эпилепсией (Киото, Япония). При этом учитывается характер имеющихся у пациента приступов, с оценкой их разновидности и склонности к генерализации.
В соответствии с таким подходом, все варианты болезни подразделяются на 2 основные группы: генерализованные и парциальные (фокальные). Внутри каждой их них имеется несколько различных заболеваний, отличающихся по клинической картине, времени проявления симптомов и прогнозу.
Выделяют несколько основных клинических разновидностей (по действующей классификации ILAE от 1989 г.):
- Детская абсансная эпилепсия – бессудорожный вариант заболевания с доказанной наследственной природой. Характеризуется частыми многократными приступами по типу абсанса у детей 4-9 лет. На нее приходится 10-17% от всех идиопатических форм.
- Ювенильная (юношеская) абсансная эпилепсия, с дебютом в подростковом возрасте. Диагностируется примерно в 12% случаев, у ⅔ пациентов дебютирует в возрасте 9-13 лет. При этом первоначально у ребенка могут возникать и типичные генерализованные судорожные приступы, а в последующем преобладают абсансы.
- Доброкачественная младенческая миоклонус-эпилепсия. Дебютирует в возрасте от 4 мес. до 3 лет с миоклонических вздрагиваний, в последующем эти приступы приобретают генерализованный характер. Чаще заболевают мальчики.
- Ювенильная миоклонус-эпилепсия или синдром Янца. Распространенность колеблется от 4 до 12%. Патология связана с дефектом генов на коротком плече 6 соматической хромосомы. В клинике преобладают миоклонические припадки, хотя они могут дополняться эпизодически возникающими абсансами и генерализованными судорожными приступами.
- Идиопатическая эпилепсия с генерализованными судорожными приступами (изолированными).
- Эпилепсия с генерализованными судорожными приступами периода пробуждения. Заболевание с доказанной генетической детерминированностью и дебютом преимущественно в 9–11-летнем возрасте. Характеризуется появлением типичных генерализованных припадков с тонико-клоническими судорогами в просоночном состоянии.
- Эпилепсия с фотосенсибилизацией. Характеризуется рефлекторным возникновением приступов в ответ на зрительную стимуляцию, с преобладанием генерализованных судорожных тонико-клонических припадков. Пик заболеваемости приходится на возраст 12-14 лет, но первичные проявления возможны вплоть до 25-летнего возраста.
Генерализованная идиопатическая эпилепсия – самый частый вариант заболевания, именно она определяет почти ⅔ случаев эпиприпадков в детском и подростковом возрасте.
Эта полиморфная группа включает несколько заболеваний.
- Доброкачественные семейные судороги у новорожденных или доброкачественная семейная неонатальная эпилепсия
Один из прогностически благоприятных вариантов заболевания, несмотря на очень ранний дебют симптоматики. Первые проявления отмечаются обычно уже на 1-й неделе жизни ребенка, в виде фокальных коротких приступов с апноэ. В последующем могут присоединяться двигательные автоматизмы или клонические подергивания. Симптоматика обычно угасает к началу 2-го года жизни. Заболевание относится к редким и имеет аутосомно-доминантный тип наследования.
- Идиопатическая парциальная эпилепсия с лобными автоматизмами
Дает о себе знать обычно в возрасте 2-8 лет. Характерна дифференцировка симптоматики в ночное и дневное время. В состоянии бодрствования у ребенка преобладают сложные парциальные и абсансоподобные приступы, а во сне появляются гемифациальные (с вовлечением половины лица) моторные припадки, которые иногда имеют склонность к вторичной генерализации. Активный период болезни длится несколько лет, после чего обычно наступает стойкая ремиссия.
- Затылочная доброкачественная эпилепсия с поздним началом (синдром Гасто)
Пик заболеваемости в 8-9 лет. Проявляется непродолжительными сложными по структуре фокальными приступами: начало припадка со зрительных галлюцинаций, которые сменяются кратковременным исчезновением зрения (корковой слепотой) и односторонними клоническими судорогами. Выход из приступа через мигренозные боли.
- Семейная височная эпилепсия
Характеризуется простыми или сложными парциальными припадками и предшествующей психосенсорной аурой. Один из вариантов болезни – приступы в виде слуховых галлюцинаций, иногда дополняющиеся вегетативными расстройствами. Дебютирует обычно в подростковом возрасте, но нередко первые ее проявления возникают лишь к 25-30 годам. Очень хорошо поддается медикаментозной терапии и не склонна к трансформации или генерализации.
В последние годы некоторыми исследователями выделяется еще одна особая форма болезни: идиопатическая фокальная эпилепсия с псевдогенерализованными приступами. У пациентов с таким диагнозом изначально возникающие фокальные приступы быстро развертываются и усложняются, что клинически выглядит как их генерализация. Но при этом ЭЭГ однозначно показывает, что происходит лишь вторичная билатеральная синхронизация, без тотального охвата всего мозга.
К редким формам заболевания относится синдром Панайотопулоса или идиопатическая затылочная эпилепсия с ранним началом, дебютирующая в возрасте от 1 до 13 лет. Характеризуется тяжело протекающими приступами с ротацией (поворотом) глаз, выраженным вегетативным компонентом и длительно сохраняющимся бессознательным состоянием. Чаще всего они начинаются в период сна, и нередко первым проявлением припадка становится не приносящая облегчения рвота.
Риск развития эпилептического статуса при синдроме Панайотопулоса очень высокий. Но заболевание в целом оценивается как прогностически благоприятное, с доброкачественным течением и сохранностью у ребенка интеллектуально-мнестических функций. В большинстве случаев приступы возникают редко, всего 1-3 раза в течение жизни, не оказывают негативного влияния на развитие ребенка и на общее состояние его здоровья.
Диагностика
Обследование включает консультацию невролога, функциональную диагностику (ЭЭГ, сомнография, суточное мониторирование) и современные методы нейровизуализации для исключения органической причины припадков.
Чаще всего для исследования головного мозга назначают МРТ или КТ, предпочтительно с ангиопрограммой и дополнительным контрастным усилением. Это позволяет исключить объемные образования, пороки развития, выраженные нарушения ликвородинамики, сосудистые изменения (в том числе врожденные мальформации) и другую патологию, способную привести к очаговой эпилептической активности. Такое обследование необходимо для дифференциальной диагностики и подтверждения идиопатической природы заболевания.
Информативность ЭЭГ может быть различной. Это зависит от периода, когда проводилось исследование, формы и тяжести течения болезни. В приступный период ЭЭГ выявляет генерализованную синхронизированную билатеральную (двустороннюю, с охватом обоих полушарий головного мозга) эпилептическую активность по типу пик-волна. Разряды короткие, обычно провоцируются гипервентиляцией и фотостимуляцией, вероятность их выявления повышается при депривации (целенаправленном лишении) сна.
В большинстве случаев в межприступную (интериктальную) фазу ЭЭГ не выявляет полипиковой и генерализованной судорожной активности, общий (основной) ритм сохранен. Функциональные признаки структурных дефектов не характерны. Исключение составляет ювенильная миоклонус-эпилепсия, при которой аномальная ЭЭГ выявляется практически постоянно у 80-95% пациентов.
При некоторых формах заболевания могут выявляться также другие аномалии: доминирующий окципитальный (затылочный) дельта-ритм, эпизодическое бифронтальное (в лобных отделах обоих полушарий) замедление ритма и др.
Как лечить
Пациентам с любыми эпилептическими припадками показана диспансеризация с регулярным контролем состояния. Лечение подбирается индивидуально неврологом или эпилептологом. Иногда требуется также участие психиатра, если клиническая картина включает психовегетативные пароксизмы, обманы восприятия (галлюцинации), нарушения поведения и когнитивные расстройства.
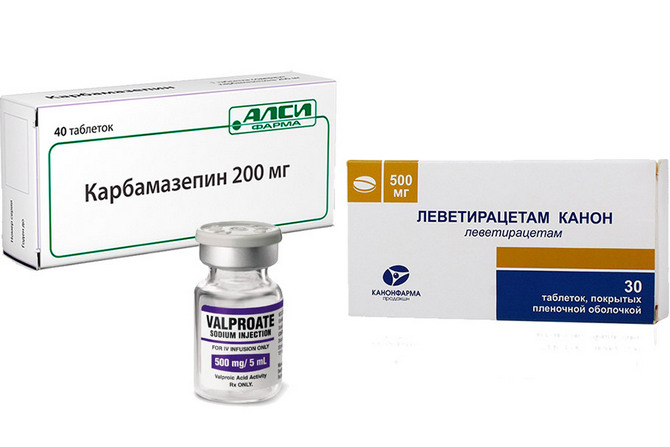
Противосудорожные препараты применяемые в терапии идиопатической эпилепсии
Основой лечения является медикаментозная терапия, с использованием антиконвульсантов (противосудорожных средств) различных групп. К наиболее употребимым препаратам относят:
- препараты вальпроевой кислоты (вальпроаты);
- Леветирацетам (Топирамат);
- Карбамазепин.
Препараты и схема их приема подбираются индивидуально, с учетом вида возникающих у пациента припадков. Лечение начинают с назначения малых доз средства 1 линии, с последующим подбором дозировки. При его недостаточной эффективности принимается решение о смене препарата или переходе на комбинированную терапию.
Противосудорожные средства принимаются постоянно, при этом необходимо регулярно контролировать картину крови и биохимические показатели работы печени. Продолжать лечение рекомендуется в течение не менее 5 лет после последнего приступа, отмена препаратов проводится постепенно, под контролем врача.
У 3-5% пациентов встречается медикаментозная резистентность – устойчивость к применяемым лекарствам, с отсутствием положительной динамики даже на комбинированной терапии достаточными дозами. В этом случае при некоторых формах заболевания может быть принято решение о целесообразности хирургического лечения, с проведением резективных или функциональных операций на головном мозге. Иногда проводят также стимуляцию блуждающего нерва.
К немедикаментозным методикам относят соблюдение режима дня, исключение провоцирующих (стимулирующих) факторов и диету. Желательно избегать потребления кофе, крепкого чая, чрезмерно острой пищи, алкоголя, тонизирующих напитков. Иногда врач дает рекомендации о переводе пациента на кетогенную диету – особую систему питания, когда ведущим источником энергии становятся жиры, а углеводы в рационе строго ограничиваются.
Прогноз
В целом идиопатические формы эпилепсии имеют относительно благоприятный прогноз. Многие из них дебютируют в детско-подростковом возрасте и в последующем постепенно угасают, иногда давая о себе знать лишь при явных провоцирующих факторах у взрослых.
Исключение составляют некоторые тяжело протекающие формы эпилепсии. Резистентность (устойчивость) к терапии нередко отмечается также у абсансных форм болезни, что требует тщательного подбора комбинации препаратов. Но даже в этом случае у ⅓ пациентов удается достичь лишь улучшения в виде значительного урежения и упрощения абсансов и исчезновения дополняющих их судорожных припадков.
Возможна также трансформация форм болезни друг в друга, несмотря на изначальное поражение разных генов. Например, эпилепсия с генерализованными приступами пробуждения может перейти в ювенильные формы абсансной или миоклонической эпилепсии. А у 30% девочек она в последующем трансформируется в катамениальную эпилепсию, при которой первично-генерализованные судорожные приступы возникают в предменструальный период.
Но в большинстве случаев удается добиться хорошего медикаментозного контроля над частотой и выраженностью приступов, избежать социально-бытовой дезадаптации пациентов и сохранить хороший темп интеллектуального развития ребенка. В стойкую ремиссию уходят 65-85% пациентов, причем большинству из них во взрослом возрасте уже не требуется постоянная поддерживающая терапия.
Читайте также:


