Операция корковая дисплазия при эпилепсии

Фокальная корковая дисплазия — аномалия структуры коры головного мозга, затрагивающая её ограниченный участок. Клинически проявляется фокальными двигательными эпиприступами с потерей сознания, но небольшой продолжительностью. Диагностируется неврологом или эпилептологом по данным ЭЭГ, специально проведённого МР-сканирования, субдуральной электрокортикографии, ПЭТ головного мозга. Как правило, эпилепсия при корковой дисплазии устойчива к проводимой противоэпилептической терапии. Альтернативным методом лечения выступает нейрохирургическая резекция участка дисплазии.
- Причины фокальной корковой дисплазии
- Классификация фокальной корковой дисплазии
- Симптомы фокальной корковой дисплазии
- Диагностика фокальной корковой дисплазии
- Лечение фокальной корковой дисплазии
- Прогноз при фокальной корковой дисплазии
- Цены на лечение
Общие сведения
Фокальная корковая дисплазия (ФКД) — возникшее в период внутриутробного развития локальное нарушение в строении мозговой коры. Является самым частым этиофактором развития эпилепсии у детей. По данным международного исследования ILAE (2005 г.) ФКД была диагностирована у 31% детей с эпилепсией. Отличительными особенностями эпилептических пароксизмов при ФКД являются: устойчивость к проводимой противоэпилептической терапии, агрессивное течение с развитием у детей задержки психического развития и эпилептической энцефалопатии, эффективность нейрохирургических способов лечения.
Локальные диспластические изменения коры располагаются преимущественно в височных и лобных долях. Они слабо заметны на макроскопическом уровне, что затрудняет диагностику ФКД даже при помощи таких современных методов нейровизуализации как МРТ. Проблемы диагностики ФКД особо актуальны в практической неврологии и педиатрии, поскольку её выявление как причины эпилептических пароксизмов имеет решающее значение для выбора эффективной лечебной тактики в отношении резистентных форм эпилепсии.

Причины фокальной корковой дисплазии
ФКД обусловлена нарушением окончательных этапов развития церебральной коры (кортикогенеза) во внутриутробном периоде. В результате нарушений миграции и дифференцировки клеток коры образуется участок с аномальными нейронами, патологической утолщенностью, уплощенностью извилин или изменённой архитектоникой (появлением клеток, типичных для одного слоя, в другом слое коры). Формирование фокальной корковой дисплазии происходит незадолго до родов — за 4-6 недель до окончания периода внутриутробного развития. Более тяжёлые формы пороков мозговой коры (например, полимикрогирия, гемимегалэнцефалия) связаны с нарушениями конца 2-го начала 3-его триместра беременности.
Нельзя исключить генетическую природу ведущего к ФКД сбоя в кортикогенезе. Так, у многих пациентов обнаружены изменения в гене TSC1, которые также наблюдаются при туберозном склерозе. В настоящее время проводятся международные исследования по поиску генетического субстрата корковых дисплазий.
Классификация фокальной корковой дисплазии
До недавнего времени выделяли 2 основных типа ФКД. В 2011 г. была разработана новая классификация, в которую включён 3-й тип, ассоциированный с другим основным поражением церебральных структур. Согласно этой классификации выделяют:
ФКД I типа — локальное нарушение архитектоники коры: радиальное (IA), тангенциальное (IB) или смешанное (IC). Выявляется у 1,7% обследованных практически здоровых людей.
ФКД II типа — очаговое нарушение цитоархитектоники с наличием аномальных нейронов (IIA) и так называемых баллонных клеток (IIB). Как правило, дисплазия затрагивает лобные доли.
ФКД III типа — вторичное нарушение корковой архитектоники, обусловленное другой патологией: мезиальным темпоральным склерозом (IIIA), глиальной опухолью (IIIB), мальформацией сосудов головного мозга (IIIC) или другими нарушениями (IIID) — энцефалитом Расмуссена, нейроинфекцией, посттравматическими или постишемическими изменениями и пр.
Симптомы фокальной корковой дисплазии
Ведущим клиническим проявлением ФКД выступает фокальная эпилепсия. Как правило, она манифестирует в детском возрасте. Эпилептические пароксизмы отличаются своей кратковременностью — длятся не более минуты. Среди них преобладают сложные (с расстройством сознания) фокальные моторные приступы, зачастую с автоматизмами в начальном периоде пароксизма. Спутанность сознания в постприступный период выражена незначительно. Характерны двигательные феномены и внезапные падения. Вторичная генерализация эпиприступов происходит заметно быстрее, чем при височной эпилепсии.
Возраст дебюта эпилепсии и сопутствующая клиническая симптоматика зависят от типа, выраженности и расположения очага корковой дисплазии. Ранняя манифестация аномалии обычно сопровождается задержкой психического развития ребёнка и когнитивными нарушениями.
ФКД I типа имеет менее тяжёлое течение и не всегда проявляется эпиприступами. У ряда пациентов она приводит к затруднению в познавательной деятельности и проблемам в обучении. ФКД II типа сопровождается тяжёлыми парциальными и вторично генерализованными эпиприступами. У многих пациентов наблюдается эпилептический статус. Клиника и течение ФКД III типа зависит от характера основной патологии.
Диагностика фокальной корковой дисплазии
Основной метод диагностики ФКД — магнитно-резонансная томография. Она должна выполняться по специальному протоколу с толщиной срезов 1-2 мм. Только такое тщательное сканирование способно выявить минимальные структурные изменения мозговой коры. В МРТ диагностике корковой дисплазии имеет значение опыт и квалификация рентгенолога. Поэтому при необходимости результаты исследования следует показать более опытному в этом вопросе специалисту.
Выявление зоны начала эпилептического приступа возможно при помощи ПЭТ, совмещённой с МРТ-изображением. При этом радиофармпрепарат должен быть введён пациенту после первого же пароксизмального разряда. Такое исследование особенно ценно при МРТ-негативных случаях ФКД и при несовпадении очага, визуализируемого на МРТ, с данными ЭЭГ. Для более точного определения расположения эпилептогенного очага проводится инвазивная электрокортикография с установкой субдуральных электродов, требующая краниотомии.
Лечение фокальной корковой дисплазии
Терапию начинают с подбора эффективного противосудорожного препарата и его дозы. Пациента совместно курируют эпилептолог и невролог. Возможно применение карбамазепина, препаратов вальпроевой к-ты, диазепама, леветирацетама, топирамата и др. антиконвульсантов. Однако зачастую эпилепсия при ФКД оказывается резистентной к противосудорожной терапии. В таких случаях ставится вопрос о хирургическом лечении и проводится консультация нейрохирурга.
Поскольку диспластические изменения носят фокальный характер, то хирургическое удаление патологического очага является эффективным способом лечения ФКД. В начале нейрохирургического вмешательства проводится электростимуляция и индивидуальная интраоперационная кортикография с составлением карты функционально важных участков коры, что позволяет избежать их травмирования в ходе операции. Многие нейрохирурги настаивают на целесообразности как можно более радикального удаления диспластического очага для достижения наилучших результатов лечения. Сложность заключается в широком распространении зоны точечно расположенных патологически изменённых клеток вокруг основного очага и невозможности их полного удаления. Распространённые и билатеральные эпилептогенные поражения являются противопоказанием к хирургическому лечению.
Прогноз зависит от типа ФКД, своевременности проведённого лечения, радикальности удаления участка корковой дисплазии. Консервативная терапия, как правило, не даёт желаемого результата. Длительное течение эпилепсии в детском возрасте чревато нарушением нервно-психического развития с исходом в олигофрению.
Хирургическое лечение наиболее эффективно при единичном хорошо локализуемом очаге. По некоторым данным полное отсутствие пароксизмов или их значительное урежение наблюдается у 60% прооперированных пациентов. Однако спустя 10 лет приступы отсутствуют только у 32%. По всей видимости, рецидив эпилепсии в таких случаях связан с неполным удалением эпилептогенных элементов.
Стойкие послеоперационные неврологические расстройства отмечаются в 2% случаев, при распространённых поражениях — в 6%. Риск их развития повышен при проведении лобэктомии и вмешательствах вблизи функционально значимых участков коры.
Тактика предхирургического обследования пациентов детского возраста
Как известно, эпилепсия является одним из наиболее часто встречающихся неврологических заболеваний. Эпидемиологические исследования свидетельствуют о высокой распространенности эпилепсии у детей: от 5,2 до 8,1 на 1000 [1]. К сожалению, несмотря на появление множества новых противоэпилептических препаратов, доля фармакорезистентной эпилепсии в популяции больных этим заболеванием не изменилась и составляет около 30% , как и 30 лет назад [2,3]. В этой связи, одной из главных задач является поиск новых способов лечения многочисленной группы фармакорезистентных эпилепсий, наносящих непоправимый ущерб здоровью пациентов. В первую очередь это хирургическое лечение, которое, в случае полного удаления эпилептогенной зоны, может навсегда освободить пациента от эпилептических приступов и пожизненной зависимости от химиотерапии антиконвульсантами. Однако само оперативное вмешательство является заключительным звеном длительного и трудоёмкого предоперационного обследования, проводимого неврологами, нейрофизиологами, нейропсихологами, специалистами по визуализации, целью которого является достоверная идентификация эпилептогенной зоны.
Предоперационное обследование включает в себя несколько этапов.
- признание факта истинной резистентности эпилепсии,
- установление этиологии и фокального генеза эпилепсии,
- определение локализации эпилептогенной зоны,
- анализ вероятности повреждения функционально значимых зон при оперативном вмешательстве,
- определение целесообразности хирургического лечения,
- определение оптимального объема оперативного вмешательства.
С целью стандартизации полученных во время предхирургического обследования данных, указывающих на локализацию поражения, нами использовалась терминология, предложенная Luders H. [4]:
Эпилептогенное поражение. Анатомический дефект (органический субстрат), определяющийся при нейровизуализации, который теоретически является причиной развития эпилепсии.
Зона начала приступа. Корковая зона начала приступа в соответствии с ЭЭГ записью.
Ирритативная зона (зона раздражения). Область коры, которая продуцирует интериктальную эпилептиформную активность на ЭЭГ.
Симптоматогенная зона. Область коры, которая при активации эпилептиформными разрядами продуцирует первичную симптоматику приступа.
Зона функционального дефицита. Область коры, которая обнаруживает функциональные нарушения при использовании методов функциональной нейровизуализации, нейропсихологического тестирования, неврологического осмотра и других тестов.
Эпилептогенная зона. Область коры, в которой зарождается иктальная активность. Это тот первичный регион, из которого эпилептический приступ берет начало, полностью или частично. Без эпилептогенной зоны невозможна генерация эпилептического приступа. Эта область может быть определена только теоретически. Хирургическая резекция, приводящая к прекращению приступов, означает, что удаленная область включала всю эпилептогенную зону. Однако невозможно определить какая часть удалённой коры была неэпилептогенной.
Выше указывались этапы предоперационного обследования, которые необходимо выполнить для получения полноценной и достоверной информации. Мы остановимся на каждом из них более подробно.
Для того, чтобы принять решение о проведении предхирургического обследования, в первую очередь необходима констатация факта фармакологической резистентности эпилепсии. Общепризнанные критерии резистентности предложили Kwan P. и Brodie M. J. в 2001 году [2], в соответствии с которыми продолжительность активного течения заболевания должна быть не менее 2-х лет, в течение которых применение 2-х и более уместных, назначенных в адекватной дозе и хорошо переносимых антиэпилептических препаратов (АЭП) в режимах монотерапия – монотерапия, монотерапия – комбинация не имело эффекта. Учитывается также частота (более 12 в год) и тяжесть приступов, хотя данный критерий не является жестким и требует индивидуального подхода. В случае симптоматических энцефалопатий детского возраста (персистирующие неонатальные судороги, синдром Отахары, синдром инфантильных спазмов, фокальная эпилепсия с ESES) признание резистентности должно следовать сразу после установления диагноза, т.к. 2-х летнее ожидание приведет к формированию необратимого когнитивного дефекта, который сохранится даже после успешного хирургического вмешательства.
В группе пациентов с истинной резистентностью к АЭП также проводится селекция с целью выбора того или иного метода немедикаментозной терапии. Безусловно, в первую очередь, следует оценивать показания к хирургическому лечению, т.к. в настоящее время именно оперативное вмешательство является наиболее эффективным при некурабельных формах фокальной эпилепсии. Однако далеко не все пациенты с фокальной резистентной эпилепсией становятся кандидатами на хирургию. В нашей клинике, в таких случаях, определяются показания к проведению кетогенной диеты, имплантации стимулятора n. Vagus, а также к участию в клинических исследованиях новых антиконвульсантов.
Существует ряд патологических субстратов некурабельной фокальной эпилепсии, которые требуют обязательного обследования на предмет возможности хирургического лечения. К ним относятся односторонние пороки развития коры головного мозга (локальные, гемисферные), туберозный склероз, синдром Штурге-Вебера, артериовенозные мальформации, каверномы, последствия инсультов, опухоли, последствия нейроинфекций, энцефалит Расмуссена, медиальный темпоральный склероз, последствия травм [9].
Главной целью предхирургического обследования является максимально точное определение локализации эпилептогенной зоны. Данная задача решается путем тщательного анализа и сопоставления локализаций ирритативной зоны и интериктального замедления, симптоматогенной зоны, зоны начала приступа, зоны эпилептогенного поражения и зоны функционального дефицита. Помимо этого, в случае близости или наложения эпилептогенной зоны на функционально значимые зоны коры (моторная, речевая, зрительная кора) проводится картирование с целью определения локализации последних. Картирование может проводиться с помощью неивазивных методик, таких как функциональная МРТ, магнитостимуляция и экстракраниальная электростимуляция, а также с помощью инвазивных электродов путем прямой электростимуляции коры. На заключительном этапе обследования определяется целесообразность проведения хирургического вмешательства, а в случае положительного решения – объем оперативного вмешательства.
В настоящее время в нашей клинике, в соответствии с международными стандартами, принят следующий алгоритм предоперационного обследования:
I фаза – используются любые неинвазивные или малоинвазивные методы обследования к которым относятся ВЭЭГ мониторинг, МРТ, функциональная МРТ (ФМРТ), позитронно-эмиссионная томография (ПЭТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ/SPECT), магнитоэнцефалография (МЭГ), имплантация сфеноидальных электродов.
III фаза – это непосредственно оперативное вмешательство. На данном этапе также применяются нейрофизиологические методы обследования, а именно кортикография, мэппинг коры путем прямой электростимуляции и, реже, вызванные потенциалы (ВП).
Для наглядности мы приводим описание клинического случая фокальной корковой дисплазии, вызвавшей фокальную некурабельную эпилепсию (синдром Веста) у пациентки 2 лет 9 месяцев.
Анастасия К. поступила в отделение на предхирургическое обследование по поводу некурабельных, ежедневных эпилептических приступов, семиологически соответствующих серийным атоническим приступам с тоническим компонентом.
Анамнез жизни и заболевания: от 2-й беременности (1-я - здоровый ребенок), протекавшей на фоне угрозы прерывания в 30 недель, находилась в стационаре на сохранении. Роды на 40-41 неделе со стимуляцией. Масса 3200, рост 50 см, оценка по шкале Апгар 8/9 б. Выписана на 5 день. До 5 месяцев развивалась в соответствии с возрастом. В возрасте 6 месяцев появились ежедневные приступы по типу серийных или одиночных флексорных инфантильных спазмов. Получала следующие антиконвульсанты без значимого эффекта: дексаметазон, депакин, конвулекс, топамакс, ламиктал, клоназепам.
При поступлении в стационар НПЦ в неврологическом статусе: парезов нет, ходит самостоятельно, элементы динамической атаксии, задержка психо-речевого развития средней степени. По данным видео-ЭЭГ мониторинга: в интериктальной записи регистрируется преимущественно диффузная эпилептиформная активность, периодически отмечается амплитудный акцент разрядов в левом полушарии без четкой и устойчивой локальности (Рис. 1); зарегистрирована серия атонических приступов с тоническим компонентом, которые сопровождались в ЭЭГ лёгким диффузным падением амплитуды биопотенциалов (электродекремент), без указания на локальную зону начала приступов.

Рис. 1 Пациентка А.К., 2г 9мес. Интериктальная ЭЭГ. Преимущественно диффузные разряды пик-волновых комплексов с неустойчивым амплитудным акцентом по левому полушарию.
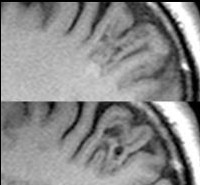
На МРТ выявлена трансмантийная фокальная корковая дисплазия (ФКД) в левой теменной области, а также заподозрены диспластические изменения в передних отделах левой височной доли в виде стушеванности границ между серым и белым веществом (Рис. 2).

Рис. 2 Пациентка А.К., 2г 9мес. МРТ. А - аксиальный срез, режим FLAIR. Зона измененного МР сигнала в левой теменной доле. Б – коронарный срез, режим Т2, стушеванность границ серое/белое вещество в области полюса левой височной доли.
Результаты проведенного неинвазивного обследования не смогли ответить на следующие вопросы: где локализуется зона начала приступов?, участвует ли височная доля в эпилептогенезе? В результате был разработан алгоритм проведения инвазивного мониторинга с целью точной идентификации зоны начала приступов и картирования моторной коры, в связи с непосредственной близостью последней к зоне ФКД. 48 электродный грид (решетка электродов) был имплантирован в область зоны ФКД в теменных отделах и покрывал близлежащие участки лобной, височной и затылочной коры. 2 стрипа (полоски электродов) по 8 и 4 электрода были установлены на височную долю, при этом 8-канальный электрод огибал полюс височной доли спереди, а 4-х канальный – был подведен под базис височной доли в непосредственной близости к гиппокампу (рис. 3,4).

Рис. 3 Пациентка А.К., 2г 9мес. 48-канальный грид, расположенный на поверхности лобно-теменной коры левого полушария

Рис. 4 Пациентка А.К., 2г 9мес. Компьютерная томограмма, демонстрирующая расположение субдуральных электродов.
Продолжительность записи составила двое суток. В результате исследования были получены данные о наличии двух независимых эпилептогенных зон: в теменных отделах в области ФКД и височных отделах в области полюса и гиппокампа (рис. 5). Также было выполнено картирование моторной коры, которая располагалась в обычном месте, в области передней центральной извилины. На основании полученных данных была составлена карта полушария, указывающая на локализацию эпилептогенных зон и моторной коры, а также разработана тактика операции (Рис. 6).

Рис. 5 Пациентка А.К., 2г 9мес. Субдуральный мониторинг. Регистрируются спайки в области ФКД, а также независимые разряды в области полюса височной доли и парагиппокампальной извилины.

Рис. 6 Пациентка А.К., 2г 9мес. Схема расположения эпилептогенных зон и моторной коры, составленная в результате проведения субдурального мониторинга и мэппинга коры.
После завершения обследования была произведена операция: париетальная резекция области ФКД, передняя темпоральная резекция. С момента проведения операции приступы не повторялись, а электроэнцефалограмма нормализовалась. Сроки катамнестического наблюдения составили 2 года, исход по классификации послеоперационных исходов Angel: Ia (Рис. 7).

Рис. 7 Пациентка А.К., 2г 9мес. МРТ после операции.
Результаты обследования и лечения пациента позволяют сделать следующие выводы:
- четко визуализирующаяся ФКД может сочетаться с малозаметными диспластичными эпилептогенными участками коры в соседних регионах,
- ФКД часто требует субдуральной записи ЭЭГ в связи с тем, что её визуализирующаяся часть является неполным отражением истинной площади поражения.
Продемонстрированный клинический случай, является одним из наиболее удачных примеров хирургического лечения ФКД, однако часто достижение 100%-ной ликвидации припадков бывает затруднительно по ряду причин, связанных с особенностями данного вида мальформации, приводящей к крайне агрессивному течению эпилепсии. Даже в настоящее время, несмотря на использование таких современных методов исследования как ОФЭКТ (SPECT), ПЭТ, МЭГ и субдуральный мониторинг уровень успешных послеоперационных исходов в мире не превышает 60-70%.
В заключении мы приводим результаты хирургического лечения 46 пациентов, прошедших предоперационное обследование в НПЦ медицинской помощи детям (таб. 1). В качестве оперативного вмешательства применялись резекции или дисконнекции эпилептогенных зон, включая гемисферэктомию (функциональную/анатомическую) в случае обширных гемисферных повреждений. Из таблицы 1 видно, что наиболее нестабильные исходы наблюдаются при фокальных корковых дисплазиях, ДНЭТ, рубцово-атрофических и диффузных изменениях. Особенно, это касается ФКД, при которых визуализирующаяся часть аномальной коры является лишь небольшим участком обширной мальформации. Неудачи хирургии при ДНЭТ и рубцово-атрофических поражениях были обусловлены невозможностью полноценной резекции в связи с расположением зоны повреждения в области функционально значимых участков коры мозга (речевая и моторная зоны). В общей сложности полный контроль над припадками был достигнут у 28 (61%) пациентов из 46 (исход по Angel: класс I). Полученные результаты обнадеживают, особенно с учетом факта абсолютной резистентности к фармакотерапии. Оперативное вмешательство у большинства таких пациентов кардинально меняет прогноз в сторону положительного и, что очень важно, освобождает пациента от пожизненной зависимости от АЭП.
Этиология
Исход по Angel
Дисплазия головного мозга – это дефект внутриутробного развития, характеризующийся массовым или локальным нарушением формирования нервной ткани. Заболевание имеет множество вариантов развития, среди которых, например, фокальная корковая дисплазия, или образование полостей в отдельных участках мозга. Дисплазия сосудов головного мозга – один из вариантов, затрагивающий нарушение формирования артерий и вен.
Причины
Дисплазия обуславливается нарушением созревания головного мозга в период формирования центральной нервной системы во время развития плода. Из-за неправильного дозревания и миграции клеток, в участке головного мозга образуются дефекты.
Фокальная корковая дисплазия, например, формируется на 1-2 месяца до родов. Степень патологии определяется временем воздействия патологического фактора: в первый и второй триместр беременности плод наиболее уязвим. Поэтому воздействие даже незначительного фактора в первые 6 месяцев может привести к грубым дефектам мозга.
В дисплазии решающую роль играет повреждение генетической информации, из-за которой и происходит сбой дифференциации нервных клеток. Также имеют значения такие факторы:
- Окружающая среда: загрязнение, избыточная инсоляция, радиация.
- Питание и вредные привычки беременной.
- Перенесенные мамой заболевания, особенно инфекционной природы.
Классификация и симптомы
Дисплазия головного мозга имеет разновидности:
Это заболевание характеризуется нарушением строения коркового шара головного мозга. Чаще всего располагается в лобной и височной доле. Подразделяется на три типа:
- 1 тип – локальное ограниченное поражение мозга; характеризуется легким течением и редкостью эпилептических припадков; проявляется преимущественно задержкой развития;
- 2 тип – локальное поражение, углубляющееся во все шары коры мозга; проявляется локальными припадками и задержкой нервно-психического развития;
- 3 тип – полная дисплазия коры больших полушарий в результате нейроинфекции и мальформации сосудов; характеризуется тяжелым нарушением умственных способностей и генерализованнымы эпилептическими припадками.
Корковая дисплазия проявляется фокальной эпилепсией, которая впервые проявляется в раннем возрасте. Дисплазия головного мозга у детей по фокальному типу проявляется кратковременной потерей сознания во время припадков. Также наблюдаются синдромы нарушения сознания, например, сумеречное помрачение.
Эпилепсия при фокальной дисплазии проявляется преимущественно двигательными расстройствами, при которых развивается спутанность сознания и дезориентация в пространстве. В таком случае больные внезапно падают. Характерна генерализация приступов, когда судороги возникают во всех скелетных мышцах.
Психическое и интеллектуальное развитие зависит от возраста, в котором дебютировала первая эпилепсия: чем раньше она началась, тем глубже будет задержка психики и когнитивных способностей.

Клиническая картина характеризуется эпилептическими припадками, если область дисплазии находится в пределах больших полушарий. Также наблюдаются дефицитарные неврологические симптомы:
- гемипарез – частичное ослабление мышечной силы в половине тела;
- расстройство деятельности черепно-мозговых нервов;
- нарушение сознания: оглушенность, ступор;
- снижение точности зрения.
Симптомокомплекс поликистоза также включает общемозговые симптомы:
- головная боль, головокружение;
- тошнота;
- апатия, раздражительность, нарушение сна, эмоциональная лабильность;
- вегетативные нарушения в виде потливости, нарушения аппетита, расстройства стула и дрожания рук.
Третья разновидность – венозная дисплазия. Однако она часто имеет бессимптомное течение. Если симптомы и есть, они проявляются в виде дефицитарных неврологических признаков. Часто венозная дисплазия имитирует сосудистую мальформацию. Несмотря на скрытность течения, дисплазия (редко) грозит геморрагическим инсультом и тромбозом вен.

Диагностика и лечение
Фокальная корковая дисплазия лечится противосудорожными препаратами. Обычно назначают препараты вальпроевой кислоты, Сибазон, Диазепам или Карбамазепин. Часто эпилепсия при фокально дисплазии не поддается терапии. В таком случае показана операция.
Поликистоз можно диагностировать с помощью таких исследований:
Специфика диагностики заключается в том, что поликистоз диагностируется применением комбинации методов: нужно использовать сразу несколько способов исследования, так как ни один из них не дает точных сведений. Используя в комбинации ангиографию, часто одновременно выявляется венозная дисплазия головного мозга.
Больным с поликистозом показано хирургическое лечение. Обычно патология легко поддается оперативному вмешательству из-за того, что поликистоз имеет четкие и выраженные границы.
Если очаги поликистоза находятся в функционально значимых зонах головного мозга, применяют выжидательную тактику, а оперативное вмешательство оставляют на задний план.
Венозная дисплазия диагностируется магнитно-резонансной томографией и ангиографией. Обыкновенно методы выявляют аномальное расширение вен мозга.
Дисплазия вен часто не нуждается в лечении, так как имеет бессимптомную клиническую картину и обнаруживается на исследовании головного мозга случайно. К лечению дисплазии приступают в том случае, когда она сочетается с другими сосудистыми патологиями мозга, например, с сосудистой мальформацией.
Пороки развития коры (ПРК), также известные, как нарушения нейрональной миграции или кортикальная дисплазия, включают гетерогенную группу заболеваний в результате изменения трех эмбриологических периодов, происходящих между 8-й и 16-й неделями внутриутробной жизни: клеточная пролиферация зародышевых листков, миграция нейронов и организация клеток в коре головного мозга.
Такой измененный кортикогенез может быть генетически детерминированным или возникнуть в результате экзогенной травмы (внутриутробные и/или даже перинатальные причины), хотя его этиопатогенез часто неясен. Сложный и многофакторный этиопатогенез пороков развития коры (ПРК) объясняется их возможную связь с некоторыми неврологическими синдромами.
Пороки развития коры (ПРК) являются одними из ведущих причин детской ФРЭ (до 40% детей с ФРЭ и половина из тех, кто подвергается хирургическому лечению эпилепсии при воздействии ПРК). Даже если электрокортикография демонстрирует эпилептизацию диспластической коры, внутренние механизмы начала припадков по-прежнему остаются практически неизвестными. Последние молекулярные исследования на животных и человеческих клетках указывают на роль NMDA и АМРА-рецепторы глутамата.
Различные формы порока развития коры (ПРК) отличаются макроскопически, но имеют ряд общих микроскопических особенностей, как серого, так и белого вещества. Они включают:
1. Кортикальную деламинацию (корковая ламинарная и столбчатая дезорганизация).
2. Плохую дифференциацию серого/белого вещества.
3. Отсутствие миелинизации.
4. Глиоз.
5. Микроскопическая нейрональная гетеротопия (островки неправильно расположенных нейронов).
6. Волокона Розенталя (периваскулярные эозинофильные тельца и волокна в результате дегенерации астроглии).
7. Баллонные клетки (аномальные и сильно увеличенные в размере клетки, со стекловидной и эозинофильной цитоплазмой и эксцентричным ядром, имеющие иногда положительный ответ на глиальные маркеры, а иногда и на нейронные).
8. Гигантские нейроны (увеличение размеров нейронов с центральными ядрами и нормальной морфологией).
9. Незрелые нейроны (нормального размера, круглой формы и однородными нейронами, с большим и незрелым ядром, небольшой цитоплазмой и нормальной морфологией).
10. Дисморфоз нейронов (нервные клетки с аномальным размером, формой, ядром, цитоплазмой и дендритами, имеющие тигроид и цитоплазматические нейрофиламенты).
Порок развития коры (ПРК) может включать в себя только некоторые области коры (фокальная корковая дисплазия) или несколько долей (квадрантная дисплазия) до целого полушария (гемимегалэнцефалия).
а) Очаговые пороки развития. Фокальная кортикальная дисплазия (ФКД). ФКД является локализованным ПРК, наиболее часто связанным с ФРЭ в детском возрасте. Она включает в себя целый спектр изменений, начиная от легкой корковой деструкции до более тяжелых форм. По данным Palmini et al., она может быть разделена на два типа. Тип IA/B нелегко обнаружить при МРТ, его клиническая картина варьирует от отсутствия эпилепсии до ФРЭ и когнитивных нарушений. Тип ПА/В, как правило, хорошо распознается при МРТ (см. ниже), часто связан с плохо поддающейся лечению и катастрофической эпилепсией, и имеет, соотвественно, худший прогноз.
Приступы и неврологические симптомы варьируют в зависимости от расположения ФКТ, которая, как правило, имеет вневисочную локализацию (и часто располагается около роландовой борозды). Фокальные двигательные припадки и генерализованный эпилептический статус, о которых сообщается в 30% случаев в детстве и подростковом возрасте, с течением времени становятся более отягощенными. Раннее начало припадков связано с худшими результатами и более высокой частотой неврологических нарушений и умственной отсталости. Сенсорно-моторный дефицит описывается у 50-75% пациентов, у половины из которых уровень IQ ниже 80.
Паттерны ЭЭГ обычно состоят из изолированных эпилептиформных разрядов и фокальных замедлений, часто вовлекая более протяженные участки мозга, чем анатомические границы патологического очага, и /или серий повторяющихся эпилептиформных разрядов (4-10 Гц ритмические спайк-волны или 2-7 Гц ритмические острые волны), как правило, более ограниченных, чем размер поражения по данным нейровизуализации.
ФКД, выявляемая при МРТ, характеризуется очаговым утолщением коры головного мозга, затенением на границе серого и белого вещества, повышением сигнала на Т2-взвешенных и протонной плотности последовательностях (от поверхности коры до желудочка в случае фокальной трансмантийной дисплазии), иногда повышением после введения контрастного вещества. Примерно в одной трети случаев данные МРТ в норме.
Тотальное хирургическое иссечение очагов дисплазии является одним из наиболее важных прогностических факторов. Результат зависит от правильного предоперационного планирования на основе нейровизуализации и по интраоперационным находкам, выявляемым хирургом. Достижение контроля над припадками ожидается в 60-75% случаев. Такой уровень имеет тенденцию к снижению со временем, так что требуется длительное наблюдение.
Эпилепсия поражает 35-85% пациентов с шизэнцефалией, как правило, начиная с первых двух десятилетий жизни и, обычно, проявляется более ранним началом и худшими результатами при двусторонних и/или открытых формах. Часто присутствуют задержка психического развития и двигательный дефицит. Хирургическое лечение малоэффективно.
2. Склероз гиппокампа (СГ). Атрофии гиппокампа (50-85%) и миндалевидного тела (30-60%), которые часто встречаются у детей с пороком развития коры (ПРК) височной доли, а также у лиц с вневисочными мальформациями (до 35%), но они могут возникнуть также изолированно (чистый СГ). Нет особых различий между чистым СГ и СГ с сопутствующим пороком развития коры (ПРК) относительно анамнеза, приступов и прогноза, а приступы исчезают после операции у 90% пациентов.
3. Гетеротопия серого вещества. Это неправильное положение массы серого вещества, локализованной перивентрикулярно или в подкорковом белом веществе, часто двустороннее, в результате нарушения процесса миграции. Картина эпилептических припадков разнообразна; лучший результат наблюдается при изолированных формах (как правило, при вовлечении области желудочкового треугольника).
б) Диффузная полушарная мальформация:
Микроскопические особенности ГМЭ отчасти или полностью совпадают с описанными для других пороков развития коры (ПРК). Макроскопически определяются увеличенные полушария, гиперваскуляризация и широкий спектр аномалий развития коры (например, агирия, пахигирия, полимикрогирия, лиссэнцефалия). Такие изменения могут включать в себя все полушарие или его часть (как правило, задние отделы), в височной доле часто отмечается атрофия.
Асимметричная макрокрания, как правило, не проявляющаяся повышенным внутричерепным давлением, является типичным внешним проявлением.
Гемимегалэнцефалия (ГМЭ) является наиболее тяжелой формой ПРК, а у большинства пациентов в течение нескольких недель или месяцев с момента рождения развивается КЭ. Типичная клиническая триада состоит из ФРЭ, контралатерального медленно прогрессирующего гемипареза и гемианопсии, с (тяжелой) задержкой психомоторного развития. Припадки возникают почти у 90% пациентов, могут наблюдаться большинство из синдромов, представленных в таблице ниже. Эпилепсия обычно начинается в раннем послеродовом периоде, как мягкие парциальные припадки и/или асимметричные спазмы и/или латерализованные миоклонические подергивания, часто превращаясь в синдром Ота-хара или синдром Веста. Впоследствии могут появляться синдром Леннокса-Гасто или тяжелые моторные парциальные припадки/кортикальная эпилепсия. Ранняя резистентность к противосудорожной терапии является практически правилом.
Гомолатеральная желудочковая система, как правило, расширена, с прямым фронтальным рогом и расширенным затылочным, но она также может быть нормальной или уменьшенной. На поздних стадиях болезни пораженное полушарие может атрофироваться.
Даже сопряженная с высокой смертностью и инвалидизацией гемисферэктомия является выбором при лечении ГМЭ. На самом деле, практически у 80-90% пациентов, подвергнутых гемисферэктомии, отмечается длительный период без судорог, с таким же уровнем показателей, как при менее тяжелой форме ФРЭ, требующей гемисферэктомии. Тем не менее, двигательные и когнитивные результаты могут оставаться плохими у значительной доли оперированных пациентов.
Мультилобарная кортикальная дисплазия включает полушарную ПРК, которая не может быть классифицирована как ГМЭ из-за менее распространенных диспластических областей и довольно больших неизмененных регионов. Заднеквадрантная дисплазия, в соответствии с определением, данным D’Agostino et al., является своеобразным ПРК, вовлекающим височную, затылочную и теменную доли (постцентральная извилина исключена). Этиопатогенетическая гипотеза будет такой же, как при ГМЭ, с частичным вовлечением полушария чем можно объяснить мозаичность. Гистологические, клинические характеристики и нейровизуализации похожи на ГМЭ, за исключением вовлечения структур передних отделов полушария и более легкого клинического течения. Можно выполнять мультилобарные резекции вместо гемисферэктомии, получая такие же хорошие результаты с небольшим хирургическим риском, если только нет предоперационного моторного дефицита и/или ЭЭГ аномалии не являются гологемисферическими.
Читайте также:


