Сужение сосудов головного мозга лечение эпилепсия
ЖУРНАЛ "MEDI.RU - ЭПИЛЕПСИЯ"
А.И. Федин, д. м. н., профессор, заведующий кафедрой неврологии ФДПО
В последние годы во всех развитых странах отмечается существенный рост эпилепсии у взрослых (эпилепсия с поздним дебютом), а также отмечается тенденция к старению населения. Среди взрослых пациентов с эпилепсией особую группу представляет контингент пожилых больных. У пожилых пациентов (ПП) первичная заболеваемость эпилепсией в 2,5–3 раза выше, чем в других возрастных группах, включая детей и молодых взрослых. Это связано и с тем, что ПП имеют большее число факторов риска эпилептических приступов по сравнению с другими возрастными группами за счет сопутствующей церебральной и соматической патологии.
В целом, по данным Международной противоэпилептической лиги, частота симптоматических фокальных эпилепсией сосудистого генеза составляет 6–8%. Васкулярные проблемы, которые могут быть ассоциированы с развитием эпилепсии, включают следующие заболевания: нарушения мозгового кровообращения ишемического и геморрагического типа, артериовенозные и кавернозные мальформации, болезнь мойямойя, церебральную аутосомно-доминантную артериопатию с субкортикальными инфарктами и лейкоэнцефалопатией, антифосфолипидный синдром, церебральную амилоидную ангиопатию, изолированный церебральный ангиит, синдромы Элерса – Данлоса, Марфана, болезнь Такаясу и др.
У пожилых пациентов чаще других цереброваскулярных заболеваний отмечаются: хроническая ишемия мозга и последствия острых нарушений мозгового кровообращения. Интересен факт, что пациенты, у которых эпилептические приступы развились в пожилом возрасте, имеют повышенный риск развития инсульта (Hendry J., 2004).
Первое наиболее крупное исследование по изучению проблемы постинсультной эпилепсии (ПИЭ) в России при анализе 26 тыс. наблюдений показало, что частота ПИЭ после геморрагического инсульта (внутримозговое кровоизлияние) составила 8,69% случаев, после ишемического инсульта – 4,12% случаев. Интересно, что частота эпилептических приступов при ТИА была достаточно высокой и составила 8,8% случаев (Прохорова Э.С., 1982). Однако в те годы для выявления характера инсульта нейровизуализация не применялась.
По данным А.Б. Гехт и соавт. (2003), частота развития ПИЭ в российской популяции составила в целом 9,6%. У 6% больных приступы развились в течение первой недели от начала инсульта. Авторы отметили, что развитие ранних эпилептических приступов оказывало негативное влияние на течение восстановительного периода инсульта, предрасполагало к сохранению тяжести неврологических нарушений, низким показателям выживаемости и риску развития повторного инсульта в течение двух лет. Эпилептические приступы через 7 дней и более после инсульта развивались у 5,4% больных, у 60% пациентов ПИЭ развилась в сроки между 3-м и 12-м месяцами восстановительного периода.
Наиболее значимыми факторами риска развития ПИЭ были: пожилой возраст, мерцательная аритмия, тяжесть инсульта, а также курение, злоупотребление алкоголем.
Необходимо, обсуждая актуальность проблемы, подчеркнуть сложности диагностики пароксизмальных расстройств эпилептического и неэпилептического генеза у ПП, поскольку у них преобладают фокальные компоненты приступов (автоматизмы, атипичные абсансы, речевой арест, односторонние приступы с развитием постприступного паралича Тодда и др.), которые могут расцениваться практическими врачами как состояния неэпилептического генеза, например как психомоторное возбуждение, корковые и полушарные инфаркты. Особую трудность диагностики вызывают бессудорожные формы эпилептического статуса (Карлов В.А. 1969, 2007).
С другой стороны, заболевания сердечно-сосудистой системы, эндокринная патология могут маскироваться под эпилептические приступы. При этом больным могут ошибочно назначаться противоэпилептические препараты (ПЭП) и врачи ошибочно делают заключение о фармакорезистентности приступов на фоне проводимой терапии. Поэтому у ПП при диагностике ПИЭ рекомендуется проводить комплексное кардиологическое обследование, обследование эндокринной системы, видео-ЭЭГ-мониторинг с полиграфической регистрацией и другие дополнительные исследования. Не только соматическая патология, но также и деменция могут осложнять диагностику и наблюдение ПП с пароксизмальными расстройствами, включая эпилепсию.
Клинические проявления приступов совпадают с локализацией ишемического очага значительно чаще при возникновении ранних приступов, чем при поздних приступах, о чем будет сказано ниже.
Сроки возникновения и патогенез сосудистой эпилепсии
Показан наибольший риск развития эпилептических приступов после геморрагических инсультов, корковых инфарктов, а также при инсультах с обширным (в пределах более одной доли) поражением головного мозга (Lancman et al., 1993).
Одной из особенностей у пациентов с ПИЭ является изменение цереброваскулярной реактивности преимущественно в вертебробазилярной системе по сравнению с каротидной, что в определенной степени может быть причиной недостаточностиантиэпилептической системы у таких больных.
Важно остановиться на корреляционных аспектах очаговых изменений при ПИЭ. При ранних проявлениях эпилептических приступов у больных с инсультом определяется отчетливая связь клинической феноменологии и сторонности эпилептического очага, по мере же временного отдаления от острого периода клинико-электроэнцефалографические и нейровизуализационные диссоциации нарастают, что, вероятно, определяет подключение других механизмов формирования эпилепсии, схожих с таковыми при хронической ишемии головного мозга без острых сосудистых событий в анамнезе.
Лечение эпилепсии
Трудности фармакотерапии ПИЭ у пожилых связаны с возрастными физиологическими изменениями организма, нарушением абсорбции лекарств, специфической фармакокинетикой и измененной чувствительностью к ПЭП. У ПП отмечается уменьшение следующих процессов, влияющих на назначение ПЭП: связывание ПЭП белками плазмы, метаболизма в печени, активности ферментов и почечной экскреции. Также следует подбирать ПЭП, не ухудшающие когнитивные функции, которые у пожилых пациентов нередко могут быть снижены. К таким препаратам относят вальпроаты, ламотриджин, габапентин, лакосамид.
В целом основные принципы лечения сосудистой эпилепсии остаются стандартными для фокальной эпилепсии. Средствами выбора при фокальной эпилепсии, в том числе у больных пожилого возраста, являются: карбамазепин и его модифицированные молекулы, новые противоэпилептические препараты, рекомендованные для старта лечения фокальной эпилепсии, и препараты вальпроевой кислоты (Депакин Хроно или Хроносфера).
Перечисленные препараты у пожилых пациентов не менее эффективны, чем в молодом возрасте. Необходимо помнить, что, поскольку метаболизм базисных препаратов происходит преимущественно в печени, их доза у больных пожилого возраста может быть несколько уменьшена. Целесообразен мониторинг концентрации препаратов в крови.
Патогенетическое лечение сосудистой эпилепсии и реабилитация представляют собой сложную и не до конца решенную проблему. Наличие у больного с цереброваскулярной патологией эпилептических приступов необходимо учитывать при проведении комплексной терапии. Так, при назначении ноотропной, нейропротективной, метаболической терапии нужно избегать лекарственных препаратов, которые могут оказывать стимулирующее эпилептогенез действие. При ишемическо-гипоксическом каскаде депрессия синтеза АТФ (энергодефицит) сопровождается одновременной активацией выброса высокореактивных свободных радикалов и интермедиатов кислорода со свободной валентностью (окислительный стресс).
Энергодефицит и окислительный стресс являются звеньями одной патологической цепи, так как первичный энергодефицит делает невозможным полноценную трансформацию метаболитов в циклах анаэробного и аэробного гликолиза. Для улучшения кровообращения мозга нужно выбирать препараты из группы цереброваскулярных, фармакологические эффекты кото- рых включают: релаксирующее действие на гладкие мышцы артерий (дилатация артерий); влияние на реологические свойства крови; косвенное нейрометаболическое действие. Например, препарат Трентал, который улучшает агрегацию не только тромбоцитов, но и эритроцитов, уменьшает размер агрегантов, восстанавливает нарушенную деформируемость эритроцитов, способствуя доставке кислорода в ткани. Кроме того, получено экспериментальное подтверждение выраженной анти-оксидантной активности Трентала (Муравьев А.В. и соавт., 2005).
Нередкой сопутствующей патологией у пожилых пациентов с ПИЭ является сахарный диабет (СД). На протяжении многих лет во всем мире активно дискутируется вопрос о том, можно ли пациентам с СД, в том числе пожилым, назначать антитромбоцитарные препараты на длительный срок. Согласно последним рекомендациям Американской Диабетической Ассоциации (American Diabetes Association, doi: 10.2337/dc16-S012), наличие ретинопатии не является противопоказанием к длительному приему аспирина с кардиопротек-тивной целью, так как аспирин не повышает риск кровоизлияний в сетчатку. Влияние Трентала на агрегацию тромбоцитов несравнимо меньше воздействия аспирина на этот процесс, поэтому длительный прием Трентала следует считать не менее безопасным в данном аспекте. В экспериментальных работах было показано также дополнительное преимущество Трентала у таких больных, связанное с его противовоспалительным действием, способным стабилизировать течение микрососудистых осложнений СД, таких как ретинопатия и нефропа-тия (Navarro J.F. с соавт., 2005).
Таким образом, изучение сосудистой эпилепсии, выявление факторов риска, а также усовершенствования вопросов диагностики и лечения эпилепсии и сопутствующей патологии у больных с цереброваскулярными нарушениями является важной медицинской задачей.
Ошибки ведения больных с ПИЭ
Зачастую производится назначение блокаторов натриевых каналов - карбамазепина и его модифицированных молекул (обычно в стационарах при дебюте эпилепсии после перенесенной сосудистой катастрофы или на фоне хронической ишемии головного мозга) - ПП с кардиальной патологией, с другими соматическими заболеваниями, что может приводить даже к развитию угрозы жизни. Также может резко снижаться качество жизни в целом вследствие нейротоксических эффектов, которые в большинстве случаев практически сразу обнаруживают карбамазепин и его производные. Например, может усиливаться уже имеющаяся атаксия, что вкупе с диплопией приводит даже к падениям и травмам. Седация и сонливость, которые могут развиться практически с первых дней приема обсуждаемых ПЭП, могут ошибочно приниматься за иные состояния. Важным аспектом применения карбамазепина являются неблагоприятные лекарственные интеракции. Карбамазепин может значительно ускорять метаболизм совместно назначаемых с ним препаратов (не только ПЭП, но и препаратов других групп), что приводит к снижению их концентрации в крови и декомпенсации сопутствующей патологии.
Головной мозг весьма чувствителен ко всякому нарушению кровоснабжения и в особенности к недостатку кислорода, так как вследствие своих незначительных энергетических резервов он неспособен к продолжительному анаэробному существованию. Между тем потребность головного мозга в энергетических ресурсах очень велика: хотя вес его составляет всего 2% веса всего тела, мозг потребляет около 20% всего кислорода, усваиваемого организмом в состоянии покоя.
Интенсивность кровоснабжения мозга зависит от кровяного давления и от сопротивления мозговых сосудов. Регулятором этого сопротивления является тонус сосудов, обусловленный взаимодействием многих факторов. Одни из них (повышенное напряжение СО2, ацидоз, парасимпатическая активность, падающее кровяное давление) вызывают расширение мозговых сосудов, другие же (повышенное напряжение О2, алкалоз, симпатическая активность, повышающееся кровяное давление) - их сужение. Падение давления СО2 (например, при гипервентиляции) приводит к сужению сосудов и к пониженному кровоснабжению.
Ишемия. При ослаблении обмена веществ вследствие ишемии, гипоксемии, недостатка глюкозы или энзимов нервные клетки становятся сверхвозбудимыми. Внезапная и полная остановка мозгового кровоснабжения приводит за 10-15 секунд к прекращению электрической активности мозга. Когда спустя 20-30 секунд кровообращение восстанавливается, возникают эпилептические разряды. Обусловленная ишемией повышенная возбудимость становится очевидной, когда появляется возможность восстановления кровообращения.
Гипоксемия. Внезапная и полная аноксия или ишемия может парализовать нейроны головного мозга прежде, чем проявится мимолетный подъем возбудимости в эпилептическом разряде. Если аноксия продолжается менее 2 минут, изменения обратимы; частичный недостаток О2 может переноситься в течение большего времени. В то время как полная аноксия, парализуя клеточную функцию, прерывает судороги, частичный недостаток О2 может их вызвать, так как при гипоксии нервная ткань вследствие деполяризации становится временно сверхвозбудимой. Возникновение судорог при недостатке О2 зависит от степени гипоксии, интенсивности патологического раздражения, а также от региональных различий в восприимчивости по отношению к недостатку О2. При недостатке СО2 и связанном с этим алкалозе отдача О2 в ткани затруднена, а кроме того, вследствие перевозбуждения вазомоторного центра временно возникает периферический вазомоторный спазм. В связи с этим Сельбах ставит вопрос, не является ли обусловленное таким путем нарушение обмена О2 в тканях центральной нервной системы фактором, провоцирующим припадок. Для возникновения и продления судорожного припадка необходимо наряду с хорошим кровоснабжением мозга и достаточное снабжение О2. Это доказывается опытом Буи, которому удалось с помощью непрерывного и одновременного введения О2, СО2 и средств, поддерживающих кровообращение, продлить вызванные электротоком судороги до 1 часа 37 минут. Постконвульсивный покой, равно как и переход от тонической стадии к клонической, этот автор объясняет недостатком О2. Припадок оканчивается, когда приток О2 и питательных веществ для клеточного обмена оказывается меньшим, чем их потребление.
Поступление 3-5% смесей СО2 противодействует синхронизационной тенденции на электроэнцефалограмме. При одновременной даче О2 и СО2 Буи наблюдал только абортивные шоки и судорожные потенциалы в глубоких областях головного мозга без участия коры, но не видел больших припадков. Содержание СО2 в артериальной и венозной крови при малых припадках находится на низком уровне, а при больших - на высоком, обратное вдыхание выдыхаемого воздуха предотвращает припадок. В том обстоятельстве, что содержание расширяющего мозговые сосуды СО2 в крови многих больных эпилепсией, у которых в данное время нет больших припадков, оказывается временно чрезвычайно низким, Сельбах усматривает фактор, способствующий появлению припадка; дальнейшее уменьшение СО2 в результате гипервентиляции, которая в первую очередь провоцирует абсансы, усиливает действие этого фактора.
Кровяное давление. По мнению Сельбаха, падение кровяного давления, которое иногда наблюдается при гипоксии и гипокапнии, может, вероятно, служить последним толчком к появлению припадка. Раздражение sinus caroticus, вызывающее у здоровых людей бледность, брадикардию и падение кровяного давления, у больного эпилепсией может вызвать припадок. Это, однако, не значит, что резкого снижения кровяного давления и брадикардии достаточно для его возникновения.
Поздние эпилептические припадки Крапф связывает патогенетически не столько с гипертонией, сколько с колебанием кровяного давления, обусловленным сверхвозбудимостью вазомоторных центров. Повышенную восприимчивость сосудов к различным раздражениям Бумке считает признаком повышенной судорожной готовности. Фриш связывает повышение кровяного давления с изменениями в белковом обмене. В увеличении содержания высокодисперсных альбуминов перед припадком он усматривает причину сужения сосудов.
Вазомоторные теории. Нотхнагел объяснял эпилептический припадок возбуждением судорожных центров в варолиевом мосту и в продолговатом мозгу. Говерс и Бинсвангер отклонили вазомоторную теорию, но Форстер высказался за то, что внезапный спазм сосудов является хотя и не единственной, но все же важной причиной припадков. Фриш усматривает в вазомоторных процессах важный, но не обязательный фактор возникновения припадка. Из 500 случаев, посмертно подвергнутых патологоанатомической обработке, только в 5,6% были обнаружены сердечно-сосудистые заболевания. Корнмультер и Джансен наблюдали судорожные потенциалы в коре и без видимых изменений кровообращения, а потому отвергают теорию, связывающую припадки с сосудистым спазмом. При электросудорожном припадке церебральный ангиоспазм не может быть причиной судорог уже хронологически, так как припадок следует мгновенно за включением тока. Ангиоспазмы считаются в настоящее время признаком уже начавшегося припадка, вызывающим изменения в центральном сосудистом аппарате. Подъем кровяного давления обусловлен центрально и начинается с генерализации припадка.
В случае припадка кровоснабжение мозга увеличивается на 60%, а усвоение мозгом кислорода - на 100%. Показатели электрогенеза повышаются при электросудорожном припадке в 12 раз при отведении от кожи головы и в 50 раз при отведении от поверхности головного мозга.
Артериовенозные анастомозы. Недостаточное кровоснабжение больших участков мозговой ткани во время припадка, несмотря на увеличение поступления крови, объясняется тем, что вследствие открытия многочисленных прекапиллярных и артериовенозных анастомозов кровяной ток во многих местах обходит капиллярную сеть. При длящемся несколько часов подряд эпилептическом статусе патогенетическое значение, несомненно, имеют ишемические состояния в мозгу. Решающими являются не ангиоспазмы до припадка, а возникающие во время судорог. Как отмечает тот же автор, необратимые аноксемические повреждения ткани создаются не гипоксией мозговой ткани, обусловленной усилением - в связи с припадком - клеточно-окислительных процессов, а лишь вазомоторным вторичным образованием участков олигемии.
Мертенс полагает, что такие факторы, как гипогликемия, нарушения мозгового кровоснабжения, а также расстройства взаимодействия ацетилхолин - холинэстераза играют роль в развитии судорожного процесса, но лишь при наличии выраженных обменных аномалий, тогда как сдвиги в минеральном и водном балансе полностью координированы с ритмикой эпилептических припадков. Поскольку эпилептический процесс характеризуется аномалиями в образовании и распространении биотоков мозга, вполне естественно искать корреляции между нарушением обменных процессов и повышением проницаемости клеточной мембраны.
Сердечные заболевания редко сопровождаются судорожными припадками; чаще всего эти припадки бывают при митральных пороках: они появляются преимущественно ночью и сопровождаются приступом удушья. При тяжелой сердечной недостаточности, высоком кровяном давлении, склерозе сосудов мозга, облитерирующем эндартериите, мерцательной аритмии желудочков вследствие поражения электрическим током патогенетически решающим моментом всегда являются расстройства мозгового кровообращения.
Сужение сосудов головного мозга – это не заболевание, а симптом, который сопровождает сразу несколько патологий. Чаще всего на начальных стадиях он проявляется головными болями и снижением памяти. Многие пациенты принимают эти признаки за переутомление и не обращаются к врачу. Однако прогрессирование патологий может привести к инсульту или слабоумию. При наличии проявлений сужения сосудов головного мозга обязательно обращайтесь к врачу! Чем раньше начать лечение, тем благоприятнее прогноз.
Запишитесь на прием в Поликлинике Отрадное в удобное для вас время! Опытные врачи направят вас на исследования и по их результатам определят причины сужения сосудов головного мозга в вашем случае. Далее будет разработан индивидуальный план лечения, благодаря которому вы сможете избежать осложнений и повысите качество жизни.
Сосуды головного мозга
Наш мозг ежедневно справляется с огромными нагрузками. Для нормального функционирования ему необходимо много питательных веществ и кислорода. Они доставляются в мозг с кровотоком через 4 магистральные артерии: 2 сонные и 2 позвоночные. Ответвления магистральных сосудов образуют у основания мозга своеобразный круг. Он называется виллизиевым – в честь ученого Томаса Уиллиса, который в 17 веке впервые представил его описание. Этот круг позволяет компенсировать кровообращение при поражении одного или нескольких магистральных сосудов. Компенсаторная способность этого сплетения очень высока. В некоторых случаях даже при патологических процессах в 3 из 4 магистральных артерий человек может ощущать лишь незначительный дискомфорт.
Однако компенсаторные возможности все же не бесконечны. Поэтому рано или поздно поражения сосудов головного мозга будут проявляться заметными нарушениями.
В состоянии покоя головному мозгу для нормального функционирования требуется около 15% объема крови, циркулирующей во всем организме. К нему поступает около 25% кислорода, вдыхаемого человеком. Сосуды головного мозга ежедневно подвержены огромным нагрузкам. При этом в здоровом состоянии они невероятно эластичны. Однако при регулярном воздействии неблагоприятных факторов они способны сузиться, что приведет к недостатку кислорода и питательных веществ в тканях мозга, что негативно скажется на его работе.
Справка! Недостаточность кровоснабжения головного мозга называют дисциркуляторной энцефалопатией.
Классификация стеноза сосудов головного мозга
По форме сужение бывает:
- Острым – такое состояние способно повлечь за собой инсульт или летальный исход.
- Хроническим – развивается постепенно, медленно, человек может длительное время ничего не подозревать о патологических процессах.
Хроническое сужение сосудов имеет 3 стадии развития:
- При первой пациент испытывает незначительные головные боли, сонливость, хроническую усталость, наблюдает у себя рассеянность и небольшую забывчивость.
- На второй проявляются сильные головные боли, расстройства походки, значительное снижение трудоспособности, перепады настроения, сбои функционирования мочевыделительной системы.
- На третьей стадии развивается деменция (слабоумие) – пациент теряет самостоятельность и способность бытового самообслуживания, наблюдаются явные проблемы с координацией движений, непроизвольные мочеиспускания.
Почему возникает стеноз сосудов головного мозга
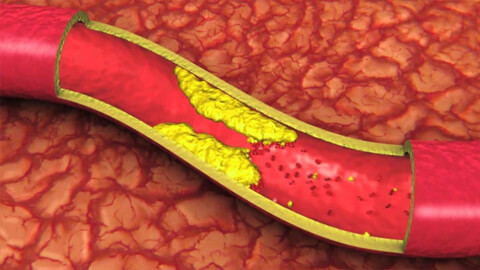
Главными причинами сужения сосудов головного мозга являются:
- Атеросклероз.
- Гипертоническая болезнь.
- Шейный остеохондроз.
Атеросклероз сосудов головного мозга – патологический процесс, при котором из-за нарушения липидного обмена на стенках артерий образуются холестериновые бляшки. Бляшки, разрастаясь, со временем замещаются соединительной тканью. Это сужает просвет сосуда и уменьшает его проходимость. Наиболее подвержены атеросклерозу сонные артерии. Бляшка может полностью закупорить просвет сосуда.
Гипертоническая болезнь – это хроническая патология, при которой наблюдается артериальная гипертензия (повышение давления), в большинстве случаев по неустановленным причинам. Этим заболеванием страдают до 40% людей. Регулярные перепады давления сказываются на эластичности сосудов. Их ткань патологически изменяется, стенки уплотняются, появляются локальные сужения. Со временем просвет сосуда способен полностью закрыться.
Остеохондроз шейного отдела проявляется деформацией межпозвонковых дисков. Они способны зажимать позвоночные артерии, по которым к мозгу поступает кровь.
Сужение сосудов головного мозга может наблюдаться у пациентов любого возраста, включая детей. В группе риска находятся люди, страдающие такими заболеваниями, как:
- Сахарный диабет.
- Сердечно-сосудистые патологии (сбои сердечного ритма, ишемическая болезнь и т.д.).
- Гиперхолестеринемия (повышенный холестерин).
Также возможность сужения сосудов головного мозга повышают:
- Курение.
- Злоупотребление спиртным.
- Малоподвижный образ жизни.
- Частые стрессы и эмоциональные перенапряжения.
- Умственные перегрузки.
- Редкое пребывание на свежем воздухе – при недостатке кислорода может повыситься артериальное давление.
- Лишний вес.
- Генетическая предрасположенность к сердечно-сосудистым заболеваниям.
Симптомы сужения сосудов головного мозга

На начальных стадиях сужение проявляется следующими признаками:
- Снижением памяти (особенно часто в таких ситуациях люди забывают события, которые происходили с ними совсем недавно).
- Ухудшением обучаемости и трудоспособности.
- Головокружениями.
- Хронической усталостью.
- Потерей интереса к происходящему.
- Депрессивными состояниями.
- Перепадами настроения.
- Эмоциональной неустойчивостью.
- Проблемами с концентрацией внимания.
- Расстройствами сна: бессонницей, тревожным сном.
Если лечение провести на данном этапе, то нарушения можно устранить и восстановить качество жизни пациента.
При прогрессировании патологии наблюдаются:
- Нарушения речи.
- Шум в голове.
- Снижение слуха.
- Дрожание рук.
- Неловкость движений.
- Изменение походки.
Осложнения
Длительно суженные сосуды головного мозга способны стать причиной развития:
- Слабоумия.
- Геморрагического инсульта – проявляется разрывом сосуда с последующим кровоизлиянием в головной мозг.
- Ишемического инсульта – нарушения кровоснабжения отделов мозга из-за закупорки сосудов.
Диагностика

Диагностику сужения сосудов головного мозга осуществляет невролог. Для оценки состояния сосудов и кровотока в них назначаются:
- Ультразвуковая допплерография – позволяет изучить скорость кровотока и выявить сужения сосудов.
- Ангиография – дает возможность оценить состояние нервных стволов сосудов.
- Дуплексное сканирование – для определения состояния стенок сосудов, выявления сужений, атеросклеротических бляшек и тромбов.
- ЭКГ.
- Оценка состояния глазного дна – клетки глазного дна связаны с нейронами мозга, и сосудистые нарушения и изменение нервных клеток в области глазного дна могут говорить о патологиях головного мозга.
Лечение
Необходимо устранить причину сужения сосудов, так как если этого не сделать, патология будет прогрессировать. Проводится лечение гипертонической болезни, атеросклероза или шейного остеохондроза. При гипертонии назначают:
- Гипотензивные препараты (снижающие давление).
- Антиагреганты – медикаменты, предупреждающие возникновение тромбов.
- Витаминные комплексы с содержанием витаминов С, PP и B6.
- Диету с ограничением употребления соли.
Лечение атеросклероза подразумевает:
- Статины – снижающие уровень холестерина в крови.
- Диету с ограничением животных жиров.
При шейном остеохондрозе назначают:
- Ношение корсета для поддержания правильного положения спины и шеи.
- Болеутоляющие.
- Противовоспалительные препараты.
- Физиотерапевтические процедуры.
- Массаж.
- Лечебная физкультура.
Также проводится симптоматическая терапия. В зависимости от нарушений, вызванных сужением сосудов, могут быть назначены:
- Препараты, улучшающие обменные процессы в мозге – при потере памяти.
- Лекарства, укрепляющие сосуды – при головокружениях.
- Массаж и лечебная физкультура – при расстройствах двигательных функций.
- Антидепрессанты и успокоительные – при эмоциональных расстройствах и депрессии.
Для профилактики мультиинфарктных состояний мозга пациенты принимают антикоагулянты – препараты, снижающие свертываемость крови.
При нарушении кровотока более чем на 50% может быть назначено хирургическое лечение – стентирование. Это расширение с помощью стента – каркаса, который устанавливают в просвет сосуда. Операция позволяет расширить сосуд и восстановить в нем кровоток.
Профилактика сужения сосудов головного мозга
Полностью избежать вероятности сужения сосудов головного мозга достаточно сложно. Однако некоторые профилактические мероприятия позволят значительно снизить риск развития патологии. Необходимо:
- Пересмотреть рацион.
- Уделять внимание умеренным физическим нагрузкам, чтобы не допускать застойных процессов.
- Избавиться от лишнего веса, если он есть.
- Отказаться от вредных привычек.
- Стараться чаще бывать на свежем воздухе, организовывая активный досуг.
- Тренировать стрессоустойчивость.
Пересмотр рациона подразумевает:
- Включение в него максимально богатых полезными веществами продуктов: свежих овощей и фруктов, нежирного мяса, рыбы, зелени.
- Сокращение употребления вредной еды: копченостей, жирной, соленой пищи.
Профилактикой сужения сосудов головного мозга также является регулярное прохождение медицинских профилактических осмотров. Если это делать ежегодно, то изменения можно будет выявить на ранних стадиях, когда они достаточно легко корректируются.

Сложившиеся представления о механизмах развития церебральной ишемии подразумевают возникновение несоответствия между имеющимся кровоснабжением и потребностями мозговой ткани. К наиболее важным достижениям в области клинической ангионеврологии относится современная концепция гетерогенности ишемического инсульта, в основе которой лежит представление о многообразии причин и механизмов развития острого очагового ишемического повреждения мозга. Величина обратимого и необратимого повреждения мозга в значительной степени зависит от состояния гемодинамического, коллатерального, перфузионного и метаболического резервов мозга. Патологическая извитость магистральных артерий головы - наследственно детерминированная функциональная неполноценность соединительной ткани - встречается не менее чем у 10 % населения. Среди основньгх форм поражений интракраниальных артерий выделяют перегибы и петлеобразования, аневризматические расширения артерий, артериовенозные аневризмы. Чрезмерная извилистость сосудов способствует формированию в них тромбов. У 71 % больных с окклюзией артерий отмечен извитой ход сосудов. Недоразвитие артерий головного мозга в виде гипоплазии или стеноза задней нижней мозжечковой артерии и/или базилярной артерии, редко нижняя передняя мозжечковая артерия и извитость позвоночной артерии являются причинами снижения слуха и глухоты.
Слабые анастомозы артерий головного мозга вызывают церебральную ишемию после дискэктомии шейного отдела позвоночника. При болезнях Паркинсона и Альцгеймера нейровизуализационные и патологоанатомические исследования в 20-30 % случаев обнаружили цереброваскулярные поражения, а в основе деменции может быть сосудистое заболевание головного мозга. Структурные изменения сосудов головного мозга, снижение скорости кровотока и наличие в 30 % стеноза в средней мозговой артерии могут стать предпосылками развития инсульта у больных с синдромом апноэ во сне.
При аномалии Киммерле необходимо учитывать наличие врожденных изменений позвоночных артерий. Диспластические нарушения в области краниовертебрального перехода в 2 раза чаще отмечены при патологической извитости позвоночных артерий, в меньшей степени за счет гипоплазии позвоночных артерий. До 51,9 % больных с мальформацией Киари и сирингомиелией имеют особенности строения артериального круга большого мозга. Извитости, асимметрии и гипоплазии позвоночных артерий с признаками нарушения кровотока характерны для вертебробазилярной недостаточности вследствие шейной дорсопатии и отмечены в 76,6 % случаев при центральном вестибулокохлеарном синдроме.
Артериальное русло головного мозга оказывается пораженным и при таких системных заболеваниях организма, как ревматоидный артрит, узелковый полиартериит, болезнь Такаясу, болезнь Шенлейна-Геноха, При проведении стоматологических манипуляций у больных с болезнью Штурге-Вебера или Реклингхаузена как типичных нейрофиброматозов возможно развитие угрожающего кровотечения. Первичное поражение церебральных артерий в виде васкулита и эндартериита лежит в основе развития нейросифилиса и приводит к вторичному страданию нервной ткани и возникновению инфарктов в головном мозге. Церебральный васкулит и герпетический церебральный васкулит могут развиться на фоне герпетической инфекции. При ишемических инсультах в 70 % наблюдений в ткани головного мозга, наряду с изменениями, обусловленными острым нарушением мозгового кровообращения, отмечаются очаговые поражения, сходные с изменениями при менингоэнцефалитах, вызванных опоясывающим и простым герпесом.
Изменения строения артерий головного мозга необходимо учитывать при оценке онкологических метастазов, а также у 40 % больных с тяжелой черепно-мозговой травмой при выявлении травматических субарахноидальных кровоизлияний и сопутствующего ангиографического вазоспазма.
По ходу выполнения изысканий по изучению взаимосвязи вариантов артерий головного мозга человека с цереброваскулярными расстройствами в рамках острых нарушений мозгового кровообращения и хронической ишемии головного мозга у нас сложились наблюдения о взаимосвязи вариантов строения и топографии артерий головного мозга человека с рядом других нозологических единиц. В этой связи мы представляем результаты собственных исследований о вариантах развития артерий головного мозга человека с различными видами эпилепсий.
Всем пациентам проводилось комплексное клинико-инструментальное исследование, включающее данные клинического обследования невролога, терапевта и офтальмолога, стандартные лабораторные данные, электрокардиографию, флюорографию или обзорную рентгенографию органов грудной клетки. По показаниям были проведены консультации и обследования у нейрохирурга, гинеколога, отоларинголога, кардиолога, эндокринолога и психотерапевта; исследование когнитивной сферы по краткой шкале оценки психического статуса или миниисследование психического статуса, транскраниальная допплерография, электроэнцефалография. Всем пациентам были вьшолнены магнитно—резонансная томография (МРТ) и магнитно-резонансная ангиография (МРА).
Согласно полученным данным, варианты строения и топографии артериального круга большого мозга верифицированы всего в 27 случаях (61,4 % наблюдений) из 44 больных с эпилепсией или энцефалопатиями с ведущими эпилептиформными синдромами. Среди проанализированной группы пациентов с различными видами эпилепсий выявлены следующие варианты строения и топографтии артериального круга большого мозга:
1) изгиб обеих передних мозговых артерий у 1 (3,7 %) пациента;
2) гипоплазия левой позвоночной артерии у 2 (7,4 %) пациентов;
3) задняя трифуркация обеих внутренних сонных артерий и передняя трифуркация левой внутренней сонной артерии, гипоплазия базилярной артерии у 3 (11,1 %) пациентов;
4) передняя трифуркация левой внутренней сонной артерии, гипоплазия базилярной артерии у 6 (22,2 %) пациентов (рис. 1);
5) гипоплазия правой позвоночной артерии, аплазия задней соединительной артерии справа у 4 (14,8 %) пациентов;
6) гипоплазия правой позвоночной артерии, гипоплазия базилярной артерии у 5 (18,5 %) пациентов (рис. 2);
7) передняя трифуркация левой внутренней сонной артерии, гипоплазия задней соединительной артерии` гипоплазия правой задней мозговой артерии у 3 (11,1 %) пациентов;
8) извитость обеих позвоночных артерий у 2 (7,4 %) пациентов;
9) гипоплазия и извитость обеих позвоночных артерий у 1 (3,7 %) пациента,
Ниже приведены достаточно показательные клинические наблюдения из совокупности собственных исследований.


Таким образом, считаем необходимым, сделать следующие выводы.
1. Варианты строения и топографии артериального круга большого мозга могут рассматриваться в качестве предикторов эпилептиформных феноменов структур головного мозга.
2. При различных церебральных пароксизмах, очевидно, есть целесообразность в исследовании артериального круга большого мозга.
3. Варианты строения и топографии артериального круга большого мозга в каждом конкретном случае следует рассматривать с точки зрения малых аномалий развития.
Читайте также:


