Анкета для больных с болезнью паркинсона

Для болезни Паркинсона характерны медленно прогрессирующие неврологические и познавательно-мыслительные нарушения. Проблема диагностики заболевания заключается в беспечном отношении родственников и врачей к первым симптомам. Типичные признаки поражения нервной системы расцениваются как проявление естественного старения организма. Заподозрить заболевание можно на ранних стадиях при помощи тестов и опросников для оценки неврологического и психологического статуса. Многие из них просты и не требуют больших усилий и трат времени, поэтому близкие родственники могут самостоятельно провести тест на болезнь Паркинсона в домашних условиях.

Тесты для оценки памяти

Другим способом оценки памяти и способности к запоминанию является тест-опросник. Метод обладает меньшей информативностью, потому что при тестировании не исключен субъективный фактор (человек может предоставить недостоверную информацию). Этот тест подходит не только для самого пациента с болезнью Паркинсона, но и для его близких родственников. О нарушении памяти говорят при положительном ответе два и более раза. Тест на Паркинсона состоит из следующих вопросов:
- За последний месяц вы забывали выключить газ, утюг или воду?
- Теряли ли вы вещи за последний месяц? Если да, то сколько раз?
- Казалось ли вам, что близкий родственник выглядит совсем иначе и вы его не узнаете?
- У вас есть трудности с тем, чтобы вспомнить номер телефона или какую-либо дату?
- У вас есть чувство растерянности в ранее хорошо знакомом районе или местности?
Еще одним несложным методом для выявления заболевания и сопутствующих психических расстройств является тест на воспроизведение дат. Пациента просят сказать, когда родился он сам или его ближайшие родственники. Долгое размышление, неспособность ответить на вопрос или нелепые ответы (например, 45.03.1173) являются неблагоприятным признаком.
Тесты для оценки внимания и мышления
Быстрым способом выявить нарушения мышления и интеллекта являются математические задачи. Пациенту предлагают решить примеры с простыми арифметическими действиями (сложение, вычитание, умножение). Вторым этапом тестирования является обратный счет с вычитанием числа 7. Тестируемый должен от заданного числа (обычно 100 или 1000) отнять 7, затем назвать полученную разность. Арифметическое действие выполняется не менее трех раз.

Важно! Неспособность выполнить элементарные арифметические действия является признаком тяжелого нарушения интеллекта и мышления.
Доступным методом выявления нарушений внимания является цифровой тест. При его проведении пациенту называют 5 чисел из первого десятка со скоростью 1 число в секунду. Тестируемый должен повторить цифры в прямом и обратном порядке. Для оценки внимания также можно использовать графические карточки. Перед пациентом раскладывают 10 изображений и дают 60 секунд для запоминания. Затем тестируемого просят отвернуться и убирают одну из карточек. Пациент должен определить, какое из изображений отсутствует.

Комбинированные тесты и опросники

В клинической практике используется еще один комплексный тест – Монреальский опросник оценки когнитивных функций. Он применяется врачами-психиатрами для выявления деменции на фоне болезни Паркинсона. Тест считается сложным и требует 30-60 минут для прохождения. Он состоит из нескольких блоков и оценивает все высшие мозговые функции человека:
- абстрактное и пространственное мышление;
- скорость реакции;
- способность к запоминанию и воспроизведению информации;
- общий уровень интеллекта;
- внимание, его подвижность и переключаемость;
- оптико-пространственная деятельность (способность определять расположение, величину, и удаленность предмета).
Тест на болезнь Паркинсона заключается в рисовании ломанной линии, объемного предмета (куб, параллелепипед), циферблата часов с заданным временем. В опроснике также присутствуют арифметические действия, воспроизведение названных слов, называние чисел в обратном порядке, простые логические задачи.
Тесты для выявления неврологических нарушений
Для болезни Паркинсона характерна не только потеря памяти или познавательно-мыслительная дисфункция, но и поражение экстрапирамидной системы головного мозга. Она отвечает за движения, мышечный тонус и поддержание позы. Выявить начальные признаки болезни Паркинсона можно при помощи простого неврологического тестирования.

| Тест | Норма | Болезнь Паркинсона |
|---|---|---|
| Хождение по ровной местности | Ритмичные шаги со скоростью 80-100 в минуту (для пожилых людей – в комфортном для них темпе), содружественные движения рук во время ходьбы. При походке туловище расположено вертикально. | При ходьбе центр тяжести смещен и туловище наклонено вперед. Движение осуществляется мелкими шаркающими шагами, руки прикованы к туловищу и обездвижены. |
| Мимический тест с нахмуриванием лба | Отчетливо видны 3-4 продольные складки на лбу. | Мимические морщины отсутствуют. |
| Графический тест | Индивидуальный почерк, сформированный с детства. | Искажение почерка из-за дрожи: медленное и прерывистое написание букв, мелкий шрифт (микрография). |
| Тест для определения мышечного тонуса | Сгибание руки (конечность сгибается не самим пациентом, а другим человеком) в локтевом суставе происходит плавно и без затруднений, затем конечность приобретает физиологическое и удобное положение. | Сгибание руки пациента требует приложения усилий и происходит прерывисто, а конечность остается в заданном положении. |

Видео
123

Рубрика: Медицина
Дата публикации: 18.04.2016 2016-04-18
Статья просмотрена: 865 раз
В статье приведены собственные результаты исследования оценки качества жизни пациентов с болезнью Паркинсона и вторичным паркинсонизмом.
Ключевые слова: болезнь Паркинсона, вторичный паркинсонизм, оценка качества жизни.
Resume: The article presents the results of its own studies life quality assessment of patients with Parkinson’s disease and secondary parkinsonism.
Keywords: Parkinson’s disease, secondary parkinsonism, life quality assessment.
Актуальность. Болезнь Паркинсона (БП) — идиопатическое медленно прогрессирующее нейродегенеративное заболевание головного мозга, основой которого является поражение пигментсодержащих дофаминергических нейронов плотной части черной субстанции с накоплением в них белка -синуклеина и образованием особых внутриклеточных включений (телец Леви).Двигательные расстройства, необходимость частого приема лекарственных средств, ограничение повседневной активности приводят к ухудшению качества жизни пациентов. Для болезни Паркинсона характерны также вегетативные и психические расстройства, которые приводят к стойкому ограничению всех аспектов нормальной жизни человека. Изучение качества жизни (КЖ)пациентов важнодля совершенствования стратегии и тактики повышения эффективности оказания медицинской помощи населению.
Цель: оценка КЖ больных с БП и вторичным паркинсонизмом для разработки рекомендаций по лечению и реабилитации, помогающих решению проблем, затрудняющих жизнедеятельность пациента.
Задачи:
- Оценить КЖ пациентов с БП и вторичным паркинсонизмом при помощи опросников SF-36 и EQ-5D;
- Сформулировать индивидуальные рекомендации пациентам с БП для улучшения их повседневной активности и способности функционировать в соответствиис обычными жизненными задачами.
Результаты иих обсуждение. Средний возраст пациентов с болезнью Паркинсона и вторичным паркинсонизмом составил 67,5±6,3 и 62,3±13,05 лет соответственно, тяжесть БП по Хен-Яру 2,07±0,85. Длительность заболевания в среднем составила 5,5±2,1 лет.В группе пациентов с БП у 75 % имелись немоторные нарушения. 54,6 % опрошенных отметили, что их здоровье стало гораздо хуже, чем год назад; 50,0 % утверждают, что не испытывают никакой физической боли, умеренную и сильную боль испытываю 32,0 % и 18,0 % соответственно.
С помощью опросника SF-36 произведён расчёт четырех показателей, характеризующих физический статус респондента (физическое функционирование,роль физических проблем в ограничении жизнедеятельности, интенсивность боли, общее состояние здоровье), и четырех показателей, отражающих его психологический статус (психическое здоровье, роль эмоционального состояния в ограничении жизнедеятельности, социальное функционирование, жизненная активность). При обработке данных (рисунок 1) были выявлены достаточны низкие баллы, что свидетельствует о невысоком уровне КЖ пациентов в исследуемых группах.
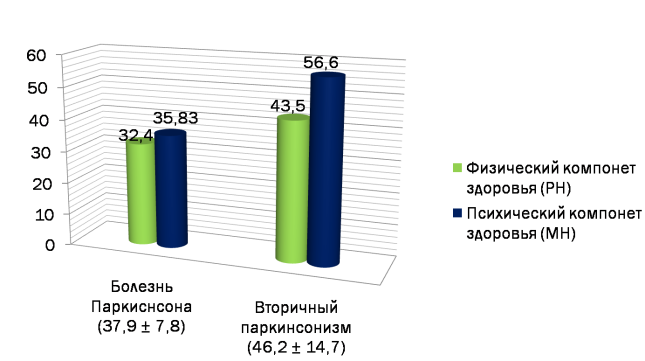
Рис. 1. Физический и психический компоненты здоровья в исследуемой группе (SF-36)
Результаты приведены на графике в виде балльных оценок по 8 шкалам (рисунок 2). Статистически значимые различия получились по показателю RE (эмоциональное функционирование).
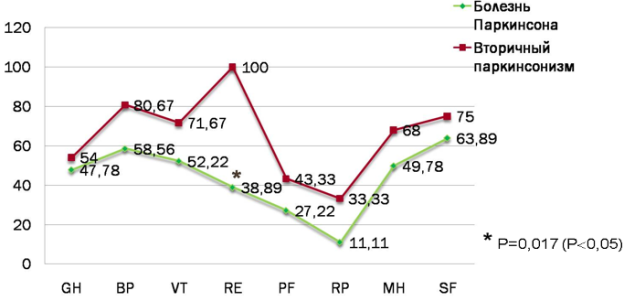
Рис. 2. Показатели качества жизни по шкале SF-36
Были оценены немоторные проявления заболевания (рисунок 3), которые не только сопровождают все стадии БП, но и в значительной степени определяют КЖ этих пациентов и нередко являются причиной их инвалидизации. У пациентов с БП в большей степени выражены немоторные нарушения.
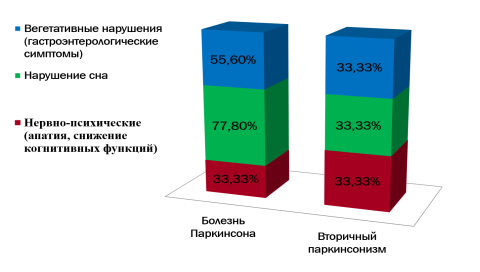
Рис. 3. Немоторные нарушения в исследуемых группах
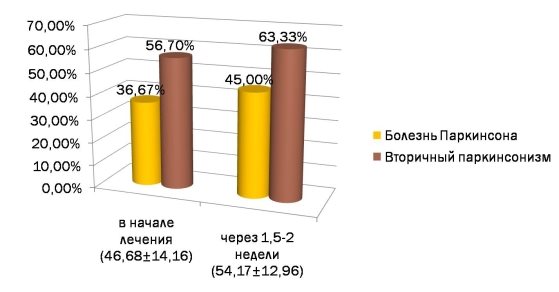
Рис. 4. Состояние здоровья пациентов, по их мнению, при исследовании по опроснику EQ-5D
Динамика по шкале EQ-5D через 1,5–2 недели пребывания встационаре (n=12)
Шкалы опросника EQ-5D
Степень выраженности нарушений
Первоначальное тестирование (%)
Повторное тестирование через 1,5–2 недели (%) (после медикаментозной терапии, физиотерапии, массажа)
Аннотация научной статьи по клинической медицине, автор научной работы — Кривонос Ольга Владимировна
Похожие темы научных работ по клинической медицине , автор научной работы — Кривонос Ольга Владимировна
IMPROVING ORGANIZATIONAL MEASURES FOR EARLY DETECTION OF PATIENTS WITH PARKINSON’S DISEASE
Background. Given the recent trend towards increased share of the elderly and senile population in the developed countries, late degenerative diseases of the nervous system become of greater importance for theoretical and practical medicine. Nowadays, Parkinson’s disease is one of the most common diseases of the nervous system that are characterized by degenerative changes. Medical and social importance of this serious disease is emphasized by the trend towards population ageing and, on the other hand, prolonged life of patients with Parkinson’s disease given the existing early detection and adequate treatment. Therefore, a future increase in prevalence of Parkinson’s disease can be predicted in the coming years not only among the elderly but younger ages as well. The aim of the study was to develop and implement at the regional level a package of measures to organize early detection of patients with Parkinson’s disease at primary care settings. Objectives of the study included the following ones: a) to study organization of detection of patients with Parkinson’s disease at medical facilities under the Federal Medical and Biological Agency of the Russian Federation in the restricted administrative and territorial entities; b) to develop a stage-wise model of early detection of patients with Parkinson’s disease and evaluate the results. Methods and data: data from medical documents and sociological survey. Results. The new stage-wide organizational model for early detection of patients with Parkinson’s was tested and implemented at primary care facilities of the restricted administrative and territorial entities. The developed model includes the following new organizational technologies: setting up clinical and diagnostic offices for care delivery to patients with extrapyramidal diseases at the outpatient departments of medical facilities in the restricted administrative and territorial entities.
Электронный научный журнал Эл №ФС77-28654
Усовершенствование мероприятий по организации своевременного выявления больных болезнью Паркинсона
Improving organizational measures for early detection of patients with Parkinson’s disease
A.I. Burnazyan Federal Medical Biophysical Center, Moscow
Цель исследования: Разработать и внедрить на региональном уровне комплекс мероприятий по организации своевременного выявления больных болезнью Паркинсона в медицинских организациях, оказывающих первичную медико-санитарную помощь.
Задачи исследования, а) изучить организацию выявления больных с болезнью Паркинсона в закрытых административно-территориальных образований системы Федерального медико-биологического агентства России; б) разработать модель этапности оказания медицинской помощи по своевременному выявлению больных болезнью Паркинсона и оценить результаты.
Материалы и методы исследования: в работе использовались методы выкопировки данных из медицинской документации и социологический опрос.
Результаты. В медицинских организациях закрытых административнотерриториальных образований, оказывающих первичную медико-санитарную помощь была апробирована и внедрена новая модель организации выявления больных болезнью Паркинсона с поэтапными мероприятиями. В созданной модели новыми из организационных технологий стало выделение клинико-диагностических кабинетов для оказания медицинской помощи больным с экстрапирамидными заболеваниями на базе амбулаторнополиклинических отделений медицинских организаций закрытых административнотерриториальных образований.
Ключевые слова: болезнь Паркинсона; клинико-диагностический кабинет; своевременное выявление больных болезнью Паркинсона; регистр.
Abstract. Background. Given the recent trend towards increased share of the elderly and senile population in the developed countries, late degenerative diseases of the nervous system become of greater importance for theoretical and practical medicine. Nowadays, Parkinson’s disease is one of the most common diseases of the nervous system that are characterized by degenerative changes.
Medical and social importance of this serious disease is emphasized by the trend towards population ageing and, on the other hand, prolonged life of patients with Parkinson’s disease given the existing early detection and adequate treatment. Therefore, a future increase in prevalence of Parkinson’s disease can be predicted in the coming years not only among the elderly but younger ages as well.
The aim of the study was to develop and implement at the regional level a package of measures to organize early detection of patients with Parkinson’s disease at primary care settings.
Objectives of the study included the following ones: a) to study organization of detection of patients with Parkinson’s disease at medical facilities under the Federal Medical and Biological Agency of the Russian Federation in the restricted administrative and territorial entities; b) to develop a stage-wise model of early detection of patients with Parkinson’s disease and evaluate the results.
Methods and data: data from medical documents and sociological survey.
Results. The new stage-wide organizational model for early detection of patients with Parkinson’s was tested and implemented at primary care facilities of the restricted administrative and territorial entities. The developed model includes the following new organizational technologies: setting up clinical and diagnostic offices for care delivery to patients with extrapyramidal diseases at the outpatient departments of medical facilities in the restricted administrative and territorial entities.
Keywords: Parkinson’s disease; clinical and diagnostic office; early detection of patients with Parkinson’s disease; register.
Введение. По данным ВОЗ (WHO, 2009) в мире первичная заболеваемость БП составляет от 4,5 до 19 на 100 тысяч населения в год. По оценке ВОЗ достоверными при выявлении больных при обращаемости могут считаться показатели от 9,7 до 13,8 на 100 тысяч населения ежегодно. Общая заболеваемость (распространенность) БП по данным ВОЗ колеблется от 18,0 до 328,0 на 100 тысяч населения. При этом в ряде стран мира общая заболеваемость БП превышает средний уровень в несколько раз [1,2,3]. Кроме того, заболеваемость и распространенность болезнью Паркинсона растет по мере общего старения населения. По прогнозам к 2030 году число больных увеличиться, более чем в два раза и будет достигать от 8,7 до 9,3 миллионов [4]. Что говорит о социальной значимости заболевания и требует своевременной диагностики и лечения.
В Российской Федерации по данным федеральной статистической отчетности на 2012 год общая заболеваемость БП составила 71,4 на 100 тысяч населения, а первичная заболеваемость - 6,9 на 100 тысяч населения в год, что говорит о недовыявлении больных. Другие эпидемиологические данные по Российской Федерации в рамках научных исследований показали довольно большой разброс: по распространенности от 54,8 до 139,9 на 100 тыс. населения, заболеваемости от 8,6 до 16,3 на 100 тыс. населения в год [5, 6, 7, 8, 9, 10]. По данным литературных и научных исследований одним из инструментов по сбору и мониторированию основных эпидемиологических показателей (распространенность,
заболеваемость, летальность и смертность) является внедрение и ведение организованных регистров больных БП [1,3, 4,5,6].
До настоящего времени не проводилось масштабных сплошных клиникоэпидемиологических исследований болезни Паркинсона, позволяющих мониторировать основные эпидемиологические показатели, как распространенность, заболеваемость и смертность с определением причин смерти. При этом важной составляющей является разработка комплекса мероприятий по организации своевременного выявления больных БП.
Результаты и обсуждение. Комплекс мероприятий по своевременному выявлению больных показал улучшение диагностики болезни Паркинсона: за 4 года увеличилось число больных на ранней стадии заболевания, в основном за счет впервые выявленных больных. Начиная с 2010 года, к 2012 году число больных на ранней стадии увеличилось в 2 раза (с 14,4% до 21,2% человек, Р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Модель описывает этапность организации от регистратора (на первом этапе) до врача-невролога (на втором этапе) c обследованием и установлением диагноза. Особое внимание уделялось группам населения, старше трудоспособного возраста. При установлении у пациентов признаков БП мы использовали признанные международные клинические критерии диагноза.
Успешному решению диагностических задач по выявлению БП врачом первичного звена здравоохранения способствовало обучение персонала и повышение грамотности больных по вопросам клинических проявлений заболевания.
Важная роль в организации обследования населения при БП отводилась врачу-неврологу медицинской организации, оказывающей первичную медико-санитарную помощь, который осуществлял контроль за выполнением врачом первичного звена здравоохранения клинического минимума обследования при БП, а также проводил оценку полноты выборки пациентов, нуждающихся в таком обследовании.
На третьем этапе после выполнения клинического диагностического минимума пациенты с подозрением на БП направлялись к врачам-неврологам специально созданных клинико-диагностических кабинетов по территориальному признаку. Врач-невролог, впервые диагностировавший случай заболевания, вносил данные о пациенте в регистр больных и осуществлял постановку больного на диспансерное наблюдение.
В целях повышения качества и объёма оказываемой медицинской помощи больным с экстрапирамидными заболеваниями и повышения эффективности диспансерного наблюдения организован Федеральный неврологический Центр экстрапирамидных и психического здоровья в ФГБУ ФМБЦ им. А.И. Бурназяна ФМБА России, куда в сложных диагностических и лечебных случаях направлялись больные. Также Центр в рамках своих задач осуществлял организацию всей системы мониторинга в целом (рисунок 1.).
Рис. 1. Организационная модель оказания медицинской помощи больным БП на
В результате проведенных мероприятий по организации и внедрении модели организации выявления больных БП по данным регистра ЗАТО показатели общей заболеваемости к 2012 году составили 118,7 случаев на 100 тысяч взрослого населения, показатели ежегодной первичной заболеваемости достигли в 2010 и 2011 годах 25,7 и 22,7 случаев на 100 тысяч взрослого населения. Что говорит не только о приросте больных БП, но и об эффективности применения ежегодного мониторирования заболевания с целью показания объективной картины заболеваемости. При сравнении с данными официальной статистики в Российской Федерации наблюдалось ежегодное недовыявление не менее 32,0% больных болезнью Паркинсона, что говорит об эффективности совершенствования системы выявления данной группы больных среди населения и их регистрации. Риск развития болезни Паркинсона у мужчин во всех возрастных категориях был выше, чем у женщин: в возрасте от 40 до 69 лет - на 11,3%, в возрасте 70-74 лет - на 13,0%, а в возрасте 75 лет и старше - на 9,9%.
Улучшилась диагностика болезни Паркинсона: за 4 года увеличилось число больных на ранней стадии заболевания, в основном за счет впервые выявленных больных. Начиная с 2010 года, к 2012 году число больных на ранней стадии увеличилось в 2 раза (с 14,4% до 21,2% человек, Р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
5. Levin O.S., Dokadina L.V. Epidemiology of parkinsonism and Parkinson disease. Nevrologicheskij zhurnal 2005;(5):41-48. (In Russian).
6. Pohabov D.V, Abramov V.G., Nesterova Ju.V. Epidemiology of parkinsonism. 1-st National Congress. Moscow. 2008: 20-27. (In Russian).
7. Trifonova N.Ju. Some problems of information provision for health and social rehabilitation of various profile patients. Mediko-social'naja jekspertiza i reabilitacija 2007; (2):19-20. (In Russian).
8. Trifonova N.Ju., Ashanina N.M. The role of outpatient facilities in rehabilitation of patients with chronic pathology. “Health and Education in XXI century: Conceptions of diseases and civilization”, X International Congress. Moscow. 2009. p. 75-76. (In Russian).
9. Dorsey ER, Constantinescu R, Thompson JP, Biglan KM, Holloway RG, Kieburtz K, et al. Projected number of people with Parkinson disease in the most populous nations, 2005 through 2030. Neurology 2007;68:384-386.
10.Driver JA, Logroscino G, Gaziano JM, Kurth T. Incidence and remaining lifetime risk of Parkinson disease in advanced age. Neurology 2009;72:432-438.





Болезнь Паркинсона (БП) – хроническое заболевание головного мозга. Основные проявления (симптомы) заболевания связаны с уменьшением количества нервных клеток, вырабатывающих вещество дофамин. Дофамин участвует в передаче нервны импульсов для обеспечения нормальной двигательной активности. Недостаток дофамина в отделах мозга, участвующих в регуляции движений, является основной причиной замедленности и ограничения выполнения привычных движений.
БП по распространенности занимает 4 место после деменции, эпилепсии, цереброваскулярной патологии у пациентов старшей возрастной группы. Таким образом, около 1-2% людей старше 65 лет страдают БП. В зависимости от того, в каком возрасте выявляются первые признаки БП, выделяют следующие формы: ювенильная форма – начало до 20 лет; раннее начало – до 40 лет; типичное начало – старше 60 лет.
Уже в течение многих лет обсуждается возможность генетической предрасположенности, но генетический фактор не всегда играет главную роль, т.к. на долю семейных форм паркинсонизма приходится всего около 5-10 %, в то время как спорадический паркинсонизм встречается в 80-90% случаев. Генетические факторы наибольшее значение играют при раннем начале заболевания, а в более поздней возрастной группе большее значение приобретают другие факторы, такие как инволюционные изменения в головном мозге и факторы внешней среды или токсические факторы.
Патогенетическую основу БП составляет резкое уменьшение количества дофамина в черной субстанции и полосатом теле. Синтез дофамина происходит в телах дофаминергических нейронов, располагающихся в компактной зоне черной субстанции. Здесь он образуется в виде небольших пузырьков – гранул, которые по аксонам нигростиарных нейронов транспортируются к окончаниям аксонов в хвостатом ядре и скапливаются перед пресинаптической мембраной. Под влиянием приходящих нервных импульсов происходит выход квантов медиатора в синаптическую щель, который оказывает воздействие на дофаминергические рецепторы постсинаптической мембраны и вызывает её деполяризацию. Предполагается, что около 80% дофамина поглощается обратно в пресинаптическое пространство или инактивируется при помощи фермента КОМТ (катехол –О-метилтрансферазы) или МАО-В (моноаминооксидазы типа В). Наиболее вероятными механизмами повреждения нейронов при БП являются: окисдативный стресс; повышенное содержание ионов железа; выявлены специфичные ферментативные дефекты комплекса I дыхательной цепи в митохондриях черной субстанции; индукция процессов апоптоза, вследствие эксайтотоксического влияния глутамата и аспартата. Но реальный пусковой фактор этих процессов до конца не определен. Помимо дофаминергических нейронов черной субстанции при болезни Паркинсона дегенерации подвергаются и другие группы нейронов, в том числе нейроны дорсального ядра блуждающего нерва, нейроны обонятельной луковицы, норадренергические нейроны голубого пятна, серотонинергические нейроны ядер шва, холинергические нейроны ядра Мейнерта, а также нейроны коры больших полушарий и некоторые вегетативные сплетения. В силу этого, помимо дефицита дофамина, возникает дисфункция серотонинергических, норадренергических и холинергических систем. С поражением экстранигральных структур связаны такие проявления болезни, как аносмия, вегетативная недостаточность, депрессия, деменция.
Болезнь Паркинсона начинается постепенно, медленно прогрессирует. От момента появления первых неспецифических (домоторных проявлений таких как: констипация, нарушения сна, потеря обоняния, депрессия, расстройство поведения в фазе быстрого сна) до основных двигательных симптомов проходит 10-15 лет. Первые двигательные симптомы БП появляются когда гибнет более 50 % нейронов черной субстанции, а снижение уровня дофамина составляет до 80 %.
| Премоторная симптоматика | Связь со структурами головного мозга | Стадия по Брааку |
| Констипация (запор) | Дорсальное ядро вагуса; нейроны брюшного сплетения. | 1 |
| Нарушение сна или потеря обоняния | Обонятельная луковица; переднее ольфакторное ядро | 1 |
| Депрессия | Голубоватое место, ядра шва. | 2 |
| Расстройство поведения в фазе быстрого сна (REM) | Дорзальная часть среднего мозга и мост; голубоватое место. | 2 |
| Акинезия | Черное вещество. | 3 |
Основными в клинической картине являются двигательные симптомы:
БП проявляется клинически не только двигательными нарушениями, но и имеет целый спектр недвигательных проявлений, которые встречаются у всех пациентов независимо от возраста дебюта заболевания и стадии болезни:
- Когнитивные нарушения
- Аффективные нарушения (депрессия, тревога, апатия, обсессивно-компульсивный синдром)
- Поведенческие нарушения (пристрастие к азартным играм, компульсивный шоппинг, гиперсексуальность, булимия)
- Психические нарушения (галлюцинации, бред, делирий)
- Нарушения сна (инсомния, гиперсомния, парасомния)
Вегетативные нарушения при БП:
- Ортостатическая гипотензия
- Сальность покровов головы, повышенное образование ушной серы.
- Сиалорея
- Потливость
- Дистальный гипергидроз
- Нарушение мочеиспускания
- Запоры
- Вагоинсулярные кризы
Классификация болезни Паркинсона проводится по форме, стадии и темпу прогрессирования заболевания.
Формы заболевания. В зависимости от преобладания в клинической картине того или иного симптома выделяют следующие формы: смешанную (акинетико-ригидно-дрожательную), акинетико-ригидную и дрожательную. Смешанная форма выявляется в 60–70 % случаев болезни Паркинсона, акинетико-ригидная — в 15–20 % случаев болезни Паркинсона, дрожательная — в 5–10 % случаев болезни Паркинсона. По мере прогрессирования заболевания его форма может меняться.
Стадии заболевания. Общепризнанной является классификация стадий болезни Паркинсона, предложенная Hoehn и Yarh (1967):
1 стадия – Гемипаркинсонизм (односторонние проявления)
1,5 стадия – односторонние проявления с вовлечением аксиальной мускулатуры.
2 стадия – Двусторонние нарушения без нарушения равновесия.
2,5 стадия – Двусторонние нарушения с начальными проявлениями постуральной неустойчивости, но с самостоятельным восстановлением равновесия при толчковой пробе.
3 стадия – Двусторонние нарушения с присоединением постуральных нарушений.
4 стадия – Выраженные нарушения, но может стоять и ходить без посторонней помощи
5 стадия – полная инвалидизация. Больной прикован к постели или к инвалидному креслу.
Выделяют три варианта темпа прогрессирования болезни Паркинсона (при условии адекватного лечения):
- быстрый темп прогрессирования, при котором смена стадий заболевания (первая — вторая или вторая — третья) происходит в течение 2 или менее лет;
- умеренный темп прогрессирования, при котором смена стадий происходит более чем за 2 года, но не более чем за 5 лет;
- медленный темп прогрессирования со сменой стадий более чем через 5 лет.
В настоящее время для клинической диагностики болезни Паркинсона чаще всего используют критерии банка головного мозга Общества болезни Паркинсона Великобритании (A. Hughes et al., 1992).
Гипокинезия в сочетании не менее чем с одним из следующих симптомов:
- мышечная ригидность;
- тремор покоя с частотой 4-6 ГЦ;
- постуральная неустойчивость.
Критерии исключения болезни Паркинсона:
- повторные инсульты в анамнезе со ступенеобразным прогрессированием симптомов паркинсонизма;
- повторные черепно-мозговые травмы в анамнезе;
- энцефалит в анемнезе;
- окулогирные кризы;
- лечение нейролептиками на момент появления симптомов;
- семейный характер заболевания (более 1 родственника с аналогичным заболеванием);
- наличие длительной ремиссии;
- строго односторонняя симптоматика более 3 лет;
- паралич взора вниз;
- ранняя быстро прогрессирующая вегетативная недостаточность;
- мозжечковые знаки;
- рано развивающаяся деменция с нарушениями памяти, речи, праксиса;
- симптом Бабинского;
- наличие атрофии мозжечка или сообщающейся гидроцефалии на компьютерной томографии;
- отсутствие реакции на высокие дозы леводопы (при исключении мальабсорбции);
- контакт с токсическими веществами, вызывающими паркинсонизм.
Критерии, подтверждающие диагноз болезни Паркинсона (не менее 3):
- одностороннее начало;
- тремор покоя;
- прогрессирующее течение;
- сохранение асимметрии симптоматики с преобладанием на первоначально вовлеченной стороне;
- высокая эффективность препаратов леводопы (уменьшение симптомов на 70–100 %);
- выраженные хореиформные дискинезии, индуцированные леводопой;
- сохранение реакции на леводопу в течение 5 лет и более;
- продолжительность заболевания в течение 10 лет и более.
Дифференциальная диагностика болезни Паркинсона проводится со следующими заболеваниями: эссенциальный тремор, юношеский (ювенильный) паркинсонизм, лекарственный паркинсонизм, сосудистый паркинсонизм, прогрессирующий надъядерный паралич (синдром Стила — Ричардсона — Ольшевского), мультисистемная атрофия, болезнь диффузных систем Леви, гепатолентикулярная дегенерация.
Дополнительные методы исследования.
- Структурная нейровизуализация – КТ, МРТ – малоинформативны для диагностики БП и используются для исключения вторичного паркинсонизма.
- Функциональная нейровизуализация (ПЭТ с флюородопой, ОФЭКТ) возможность этих методов высока, т.к. позволяют выявить изменения дофаминового обмена за 4-6 лет до появления клинических симптомов, но в данный момент это является технически сложным и дорогим методом исследования, что не позволяет использовать его в рутинной практики для выявления БП.
- Транскраниальная сонография – выявляет повышенную гиперэхогенность черной субстанции, за счет повышенного содержания трехвалентного железа, которые выявляются у 80-90 % пациентов с БП.
- Обонятельные тесты (Пенсильванский тест) Обонятельная дисфункция это наиболее ранний домоторный признак БП. Наиболее часто используется это тест, если в клинике преобладает дрожание, проводя дифференциальную диагностику между эссенциальным тремором и БП, потому что только для идиопатического паркинсонизма будет характерно изменение обонятельных тестов.
В лечении болезни Паркинсона можно выделить три основных направления:
- Нейропротекторная терапия, целью которой является замедлить или остановить дегенерацию нейронов головного мозга. В последние годы экспериментальные и клинические испытания прошли несколько десятков средств, потенциально способных влиять на различные стадии нейродегенеративного каскада гибели клеток (антиоксиданты, антагонисты глутамата, блокаторы кальциевых каналов, противовоспалительные средства, трофические факторы и т.д.), однако пока их эффективность доказать не удалось.
- симптоматическая терапия, позволяющая уменьшить основные симптомы заболевания за счет коррекции возникающего в мозге нейрохимического и нейрофизиологического дисбаланса;
- физическая и социально-психологическая реабилитация.
В настоящее время лечение проводят, ориентируясь главным образом на симптоматический эффект препаратов. На данный момент к числу противопаркинсонических средств, применяемых при болезни Паркинсона, относят 6 групп лекарственных средств:
- препараты, содержащие леводопу (предшественника дофамина) - обеспечивают повышение синтеза дофамина в мозге;
- агонисты дофаминовых рецепторов – стимуляция рецепторов чувствительных к дофамину;
- трициклические антидепрессанты – торможение процесса обратного поглащения (захвата) дофамина пресинаптическими структурами;
- препараты амантадина – стимуляция процесса выброса (высвобождения) дофамина из пресинаптической терминали;
- ингибиторы моноаминооксидазы типа В;
- ингибиторы катехол-О-метилтрансферазы – торможение катаболизма (распада) дофамина;
Поскольку механизм действия препаратов этих групп различен, при необходимости их можно сочетать в рамках комбинированной терапии.
Медикаментозная терапия пациентов с болезнью Паркинсона подбирается индивидуально для каждого клинического случая и зависит от ряда факторов, в том числе от выраженности функциональной недостаточности, формы заболевания, возраста больного, индивидуальной чувствительности к препаратам, фармакоэкономических соображений.
Задачей терапии является восстановление нарушенных двигательных функций при использовании минимальных эффективных доз препаратов. В течение первых месяцев болезни, когда проявления заболевания минимальны и не нарушают повседневной социальной или бытовой активности, лекарственная терапия может не назначаться. В начале лечения обычно прибегают к монотерапии, а в случае снижения ее эффективности при прогрессировании болезни — к комбинированной терапии.
Немедикаментозные методы лечения.
Лечение хронических заболеваний наряду с назначением лекарственных средств требует осуществления мер по социально-психологической поддержке больных. Образовательные программы должны предоставлять больным выборочную информацию о заболевании, необходимую для формирования у них ощущения контроля над болезнью. В комплекс лечения должны входить нейропсихологический тренинг, речевая терапия, лечебная гимнастика.
Регулярные физические занятия, включающие аэробные упражнения, упражнения в изометрическом режиме, на растяжение и координацию, способны, не уменьшая паркинсонических симптомов, улучшить подвижность больных. Важное значение имеет полноценное питание, позволяющее предотвратить снижение веса и утрату мышечной массы. Для осуществления всего комплекса мер по медико-социальной реабилитации больных целесообразно создать специальную службу. Необходима подготовка специально обученных средних медработников, которые координировали бы работу социальных служб, обучали родственников приемам ухода, занимались образованием больных.
При неэффективности консервативной терапии, особенно когда выраженные дискинезии не позволяют назначать дозы препаратов леводопы, необходимые для коррекции симптомов болезни Паркинсона, ставится вопрос об оперативном лечении (паллидотомия, таламотомия, вживление внутримозговых стимуляторов в бледный шар, таламус, субталамическое ядро, внутримозговая трансплантация эмбриональной ткани надпочечника или черной субстанции).
Читайте также:


