Блоки проведения по нервам
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Блок проведения – электрофизиологический феномен снижения амплитуды или площади моторного ответа при стимуляции в проксимальной точке относительно дистального ответа. Сегодня продолжается обсуждение значения блока проведения в диагностике демиелинизирующих и аксональных нейропатий, а также критериев диагностики состояний, при которых регистрируется этот феномен.
Цель обзора литературы – осветить тему блока проведения по нерву как электрофизиологического феномена в свете клинических проявлений, для определения его роли в диагностике ряда болезней периферических нервов. В литературе нет единого мнения, какие параметры моторного ответа следует использовать в качестве критериев частичного блока проведения. Разнообразие патогенетических форм, при которых можно обнаружить блок проведения, не позволяет рассматривать этот феномен как признак исключительно демиелинизирующего поражения нервов. Общие и частные патофизиологические механизмы формирования блока проведения при разных нейропатиях необходимо изучать отдельно в рамках каждой нозологической формы. Нозологическая неспецифичность блока приведения не позволяет судить о диагнозе, тем не менее в совокупности с клиническими и анамнестическими данными обнаружение блока приведения может быть основным аргументом в диагностике ряда болезней периферических нервов.
117258 Москва, ул. Кржижановского, 17/2
Айсылу Фанзировна Муртазина
117258 Москва, ул. Кржижановского, 17/2,
115522 Москва, ул. Москворечье, 1
1. Denny-Brown D., Brenner C. Paralysis of nerve induced by direct pressure and by tourniquet. Arch Neur Psych 1944;51(1):1–26. DOI: 10.1001/archneurpsyc.1944.02290250007001.
2. Van den Bergh P.Y., Hadden R.D., Bouche P. et al. European Federation of Neurological Societies/Peripheral Nerve Society guideline on management of chronic inflammatory demyelinating polyradiculoneuropathy: report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society first revision. Eur J Neurol 2010;17(3):356–63. PMID: 20456730. DOI: 10.1111/j.1468-1331.2009.02930.x.
3. Olney R.K., Lewis R.A., Putnam T.D. et al. Consensus criteria for the diagnosis of multifocal motor neuropathy. Muscle Nerve 2003;27(1):117–21. PMID: 12508306. DOI: 10.1002/mus.10317.
4. Hadden R.D., Cornblath D.R., Hughes R.A. et al. Electrophysiological classification of Guillain–Barré syndrome: clinical associations and outcome. Plasma exchange/sandoglobulin Guillain–Barré syndrome trial group. Ann Neurol 1998;44(5):780–8. PMID: 9818934. DOI: 10.1002/ana.410440512.
5. Rajabally Y.A., Durand M.C., Mitchell J. et al. Electrophysiological diagnosis of Guillain–Barré syndrome subtype: could a single study suffice? J Neurol Neurosurg Psychiatry 2015;86(1):115–9. PMID: 24816419. DOI: 10.1136/jnnp-2014-307815.
6. Uncini A., Kuwabara S. Electrodiagnostic criteria for Guillain–Barrè syndrome: a critical revision and the need for an update. Clin Neurophysiol 2012;123(8):1487–95. PMID: 22480600. DOI: 10.1016/j.clinph.2012.01.025.
7. Rajabally Y.A., Jacob S. Proximal nerve conduction studies in chronic inflammatory demyelinating polyneuropathy. Clin Neurophysiol 2006;117(9):2079–84. PMID: 16859987. DOI: 10.1016/j.clinph.2006.05.028.
8. Van den Berg-Vos R.M., Franssen H., Wokke J.H. et al. Multifocal motor neuropathy: diagnostic criteria that predict the response to immunoglobulin treatment. Ann Neurol 2000;48(6):919–26. PMID: 11117549. DOI: 10.1002/1531-8249(200012)48:6 3.0.co;2-j.
9. Nobile-Orazio E., Cappellari A., Meucci N. et al. Multifocal motor neuropathy: clinical and immunological features and response to IVIg in relation to the presence and degree of motor conduction block. J Neurol Neurosurg Psychiatry 2002;72(6):761–6. PMID: 12023421. DOI: 10.1136/jnnp.72.6.761.
10. Delmont E., Azulay J.P., Giorgi R. et al. Multifocal motor neuropathy with and without conduction block: a single entity? Neurology 2006;67(4):592–6. PMID: 16924010. DOI: 10.1212/01.wnl.0000234063.51897.20.
11. Dumitru D., Amato A., Zwarts M. Electrodiagnostic Medicine. 2nd Edition. Philadelphia: Hanley & Belfus, 2001. 1524 p.
12. Feasby T.E., Brown W.F., Gilbert J.J., Hahn A.F. The pathological basis of conduction block in human neuropathies. J Neurol Neurosurg Psychiatry 1985;48(3):239–44. PMID: 3981192. DOI: 10.1136/jnnp.48.3.239.
13. Preston D.S., Barbara E.S. Electromyography and Neuromuscular Disorders. 3rd Edition. China: Elsevier Inc., 2013. 664 p.
14. Leis A.A., Michael P. Schenk Atlas of Nerve Conduction Studies and Electromyography. USA: Oxford University Press, 2013. 336 p.
15. Fowler T.J., Danta G., Gilliatt R.W. Recovery of nerve conduction after a pneumatic tourniquet: observations on the hind-limb of the baboon. J Neurol Neurosurg Psychiatry 1972;35(5): 638–47. PMID: 4628467. DOI: 10.1136/jnnp.35.5.638.
16. Otani Y., Yermakov L.M., Dupree J.L., Susuki K. Chronic peripheral nerve compression disrupts paranodal axoglial junctions. Muscle Nerve 2017;55(4): 544–54. PMID: 27463510. DOI:10.1002/mus.25273.
17. Uncini A., Kuwabara S. Nodopathies of the peripheral nerve: an emerging concept. J Neurol Neurosurg Psychiatry 2015;86(11):1186–95. PMID: 25699569. DOI: 10.1136/jnnp-2014-310097.
18. Arroyo E.J., Scherer S.S. On the molecular architecture of myelinated fibers. Histochem Cell Biol 2000;113(1):1–18. PMID: 10664064. DOI: 10.1007/s004180050001.
19. Rios J.C., Rubin M., St Martin M. et al. Paranodal interactions regulate expression of sodium channel subtypes and provide a diffusion barrier for the node of Ranvier. J Neurosci 2003;23(18):7001–11. PMID: 12904461. DOI: 10.1523/JNEUROSCI.23-18-07001.2003.
20. Ng J.K.M., Malotka J., Kawakami N. et al. Neurofascin as a target for autoantibodies in peripheral neuropathies. Neurology 2012;79(23):2241–8. PMID: 3100406. DOI: 10.1212/WNL.0b013e31827689ad.
21. Doppler K., Appeltshauser L., Wilhelmi K. et al. Destruction of paranodal architecture in inflammatory neuropathy with anti-contactin-1 autoantibodies. J Neurol Neurosurg Psychiatry 2015;86:720–8. PMID: 25694474. DOI: 10.1136/jnnp-2014-309916.
22. Kaji R. Physiology of conduction block in multifocal motor neuropathy and other demyelinating neuropathies. Muscle Nerve 2003;27(3):285–96. PMID: 12635114. DOI: 10.1002/mus.10273.
23. Franssen H. Electrophysiology in demyelinating polyneuropathies. Expert Rev Neurother 2008;8(3):417–31. PMID: 18345972. DOI: 10.1586/14737175.8.3.417.
24. Neary D., Ochoa J., Gilliatt R.W. Sub-clinical entrapment neuropathy in man. J Neurol Sci 1975;24(3):283–98. PMID: 1117305. DOI: 10.1016/0022-510X(75)90248-8.
25. Arroyo E.J., Sirkowski E.E., Chitale R., Scherer S.S. Acute demyelination disrupts the molecular organization of peripheral nervous system nodes. J Comp Neurol 2004;479(4):424–34. PMID: 15514980. DOI: 10.1002/cne.20321.
26. Susuki K., Rasband M.N., Tohyama K. et al. Anti-GM1 antibodies cause complement-mediated disruption of sodium channel clusters in peripheral motor nerve fibers. J Neurosci 2007;27(15):3956–67. PMID: 17428969. DOI: 10.1523/JNEUROSCI.4401-06.2007.
27. Kiernan M.C., Guglielmi J.M., Kaji R. et al. Evidence for axonal membrane hyperpolarization in multifocal motor neuropathy with conduction block. Brain 2002;125:664–75. PMID: 11872621. DOI: 10.1093/brain/awf041.
28. Farrar M.A., Park S.B., Krishnan A.V. et al. Axonal dysfunction, dysmyelination, and conduction failure in hereditary neuropathy with liability to pressure palsies. Muscle Nerve 2014;49(6):858–65. PMID: 24752454. DOI: 10.1002/mus.24085.
29. Bai Y., Zhang X., Katona I. et al. Conduction block in PMP22 deficiency. J Neurosci 2010;30(2):600–8. PMID: 20071523. DOI: 10.1523/JNEUROSCI.4264-09.2010.
30. Jankelowitz S.K., Burke D. Pathophysiology of HNPP explored using axonal excitability. J Neurol Neurosurg Psychiatry 2013;84(7):806–12. PMID: 23418209. DOI: 10.1136/jnnp-2012-304576.
31. Van Asseldonk J.T.H., Van den Berg L.H., Wieneke G.H. et al. Criteria for conduction block based on computer simulation studies of nerve conduction with human data obtained in the forearm segment of the median nerve. Brain 2006;129(9):2447–60. PMID: 16923956. DOI: 10.1093/brain/awl197.
32. Oh S.J., Kim D.E., Kuruoglu H.R. What is the best diagnostic index of conduction block and temporal dispersion? Muscle Nerve 1994;17(5):489–93. PMID: 8159178. DOI: 10.1002/mus.880170504.
33. Rhee E.K., England J.D., Sumner A.J. A computer simulation of conduction block: effects produced by actual block versus interphase cancellation. Ann Neurol 1990;28(2):146–56. PMID: 2221844. DOI: 10.1002/ana.410280206.
34. Taylor P.K. CMAP dispersion, amplitude decay, and area decay in a normal population. Muscle Nerve 1993;16(11):1181–7. PMID: 8413370. DOI: 10.1002/mus.880161107.
35. Olney R.K., Albers J.W., Brown W.F. et al. Guidelines in electrodiagnostic medicine. Consensus criteria for the diagnosis of partial conduction block. Muscle Nerve Suppl 1999;8:S225–9. PMID: 16921636
36. Kimura J., Machida M., Ishida T. Relation between size of compound sensory or muscle action potentials, and length of nerve segment. Neurology 1986;36(5):647–52. PMID: 3703263. DOI: 10.1212/wnl.36.5.647.
37. Гришина Д.А., Супонева Н.А., Павлов Э.В., Савицкая Н.Г. Аномалии иннервации: варианты и типичные электронейромиографические признаки. Нервно-мышечные болезни 2016;2:10–9. DOI: 10.17650/2222-8721-2016-6-2-10-19.
38. Franssen H., Wieneke G.H. Nerve conduction and temperature: necessary warming time. Muscle Nerve 1994;17:336–44. PMID: 8107712. DOI: 10.1002/mus.880170313.
39. Franssen H., Wieneke G.H., Wokke J.H. The influence of temperature on conduction block. Muscle Nerve 1999;22:166–73. PMID: 10024129. DOI: 10.1002/(SICI)1097-4598(199902)22:2 3.0.CO;2-Q.
40. Rutkove S.B. Effects of temperature on neuromuscular electrophysiology. Muscle Nerve 2001;24(7):867–82. PMID: 11410914. DOI: 10.1002/mus.1084.abs.
41. Bostock H., Grafe P. Activity-dependent excitability changes in normal and demyelinated rat spinal root axons. J Physiol 1985;365:239–57. PMID: 4032313. DOI: 10.1113/jphysiol.1985.sp015769.
42. Kaji R., Bostock H., Kohara N. et al. Activity-dependent conduction block in multifocal motor neuropathy. Brain 2000;123(8):1602–11. PMID: 10908190. DOI: 10.1093/brain/123.8.1602.
43. Straver D.C., van den Berg L.H., van den Berg-Vos R.M., Franssen H. Activitydependent conduction block in multifocal motor neuropathy. Muscle Nerve 2011;43(1):31–6. PMID: 21171095. DOI: 10.1002/mus.21843.
44. Salameh J.S., Souayah N., Chong P.S. Role of activity-dependent conduction blockin the diagnosis of primary demyelinating polyneuropathy. J Clin Neuromuscul Dis 2012;14(1):40–4. PMID: 22922581. DOI: 10.1097/CND.0b013e3182596166.
45. Kuwabara S., Yuki N., Koga M. et al. IgG anti-GM1antibody is associated with reversible conduction failure and axonal degeneration in Guillain–Barré syndrome. Ann Neurol 1998;44:202–8. PMID: 9708542. DOI: 10.1002/ana.410440210.
46. Capasso M., Caporale C.M., Pomilio F. et al. Acute motor conduction block neuropathy – another Guillain–Barré syndrome variant. Neurology 2003;61(5):617–22. PMID: 12963751. DOI:10.1212/wnl.61.5.617.
47. Uncini A., Ippoliti L., Shahrizaila N. et al. Optimizing the electrodiagnostic accuracy in Guillain–Barré syndrome subtypes: criteria sets and sparse linear discriminant analysis. Clin Neurophysiol 2017;128(7):1176–83. PMID: 28521265. DOI: 10.1016/j.clinph.2017.03.048.
48. Ahdab R., Créange A., Saint-Val C. et al. Rapidly progressive amyotrophic lateral sclerosis initially masquerading as a demyelinating neuropathy. Neurophysiol Clin 2013;43(3):181–7. PMID: 23856174. DOI:10.1016/j.neucli.2013.05.001.
49. Супонева Н.А., Наумова Е.С., Гнедовская Е.В. Хроническая воспалительная демиелинизирующая полинейропатия у взрослых: принципы диагностики и терапия первой линии. Нервно-мышечные болезни 2016;6(1):44–53. DOI: 10.17650/2222-8721-2016-6-1-44-53.
50. Allen J.A., Lewis R.A. CIDP diagnostic pitfalls and perception of treatment benefit. Neurology 2015;85(6):498–504. PMID: 26180143. DOI: 10.1212/WNL.0000000000001833.
51. Dyck P.J.B., Tracy J.A. History, diagnosis, and management of chronic inflammatory demyelinating polyradiculoneuropathy. Mayo Clin Proc 2018;93(6):777–93. PMID: 29866282. DOI: 10.1016/j.mayocp.2018.03.026.
52. Daube J.R. Electrodiagnostic studies in amyotrophic lateral sclerosis and other motor neuron disorders. Muscle Nerve 2000;23(10):1488–502. PMID: 11003783. DOI: 10.1002/1097-4598(200010)23:10 3.0.co;2-e.
53. Echaniz-Laguna A., Degos B., Mohr M. et al. A study of three patients with amyotrophic lateral sclerosis and a polyneuropathy resembling CIDP. Muscle Nerve 2006;33(3):356–62. PMID: 16320313. DOI: 10.1002/mus.20475.
54. Rajabally Y.A., Jacob S. Chronic inflammatory demyelinating polyneuropathy-like disorder associated with amyotrophic lateral sclerosis. Muscle Nerve 2008;38(1):855–60. PMID: 18508343. DOI: 10.1002/mus.21010.
55. Bromberg M.B., Franssen H. Practical rules for electrodiagnosis in suspected multifocal motor neuropathy. J Clin Neuromuscul Dis 2015;16(3):141–52. PMID: 25695919. DOI: 10.1097/CND.0000000000000044.
56. Puma A., Benoit J., Sacconi S., Uncini A. Miller Fisher syndrome, Bickerstaff brainstem encephalitis and Guillain– Barré syndrome overlap with persistent non-demyelinating conduction blocks: a case report. BMC Neurol 2018;18(1):101–8. PMID: 30031375. DOI: 10.1186/s12883-018-1104-6.
57. Odaka M., Yuki N., Yamada M. et al. Bickerstaff’s brainstem encephalitis: clinical features of 62 cases and a subgroup associated with Guillain–Barré syndrome. Brain 2003;126(10):2279–90. PMID: 12847079. DOI: 10.1093/brain/awg233.
58. Муртазина А.Ф., Наумова Е.С., Никитин С.С. и др. Стволовой энцефалит Бикерстаффа, острый поперечный миелит и острая моторная аксональная нейропатия: сложности диагностики и лечения пациентов с перекрестными синдромами. Клиническое наблюдение. Нервно-мышечные болезни 2017;3(7):56–62. DOI: 10.17650/2222-8721-2017-7-3-56-62.
59. Deymeer F., Matur Z., Poyraz M. et al. Nerve conduction studies in CharcotMarie-Tooth disease in a cohort from Turkey. Muscle Nerve 2011;43(5):657–64. PMID: 21404297. DOI: 10.1002/mus.21932.
60. Mathis S., Corcia P., Tazir M. et al. Peripheral myelin protein 22 gene duplication with atypical presentations: a new example of the wide spectrum of Charcot-Marie-Tooth 1A disease. Neuromuscul Disord 2014;24(6):524–8. PMID: 24792522. DOI:10.1016/j.nmd.2014.03.014.
61. Vill K., Kuhn M., Gläser D., MüllerFelber W. Overlap phenotype between CMT1A and hereditary neuropathy with liability to pressure palsies caused by the novel small in-frame deletion c.407_418del12 in PMP22 gene. Neuropediatrics 2015;46(1):44–8. PMID: 25265422. DOI: 10.1055/s-0034-1389897.
62. Thibault M.W., Robinson L.R., Franklin G., Fulton-Kehoe D. Use of the AAEM guidelines in electrodiagnosis of ulnar neuropathy at the elbow. Am J Phys Med Rehabil 2005;84(4):267–73. PMID: 15785259. DOI: 10.1097/01.phm.0000156893.12433.c7.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Мультифокальная (множественная) двигательная (моторная) невропатия с блоками проведения - это редкое, заболевание периферической нервной системы, предположительно аутоиммунной природы, характеризующееся демиелинизацией двигательных волокон. Отказ от активной терапии в этом случае может привести к инвалидизации больного.
Этиология и патогенез. Этиология остается неизвестной. Однако эффективность иммуномодуляторов, наличие у значительной части больных антител к ганглиозиду GM1 указывают на аутоиммунную природу заболевания. Мультифокальная двигательная невропатия относится к числу демиелинизирующих невропатий. Патоморфологически при этом выявляют признаки демиелинизации и ремиелинизации с формированием "луковичных головок", иногда аксональную дегенерацию и регенерацию. Причина селективного поражения двигательных волокон остается неясной, возможно, она отражает разный антигенный состав двигательных и чувствительных волокон или их различную чувствительность к повреждающему фактору.
Клиника. Среди больных 80 % составляют молодые мужчины. Основное проявление - прогрессирующие асимметричные парезы в дистальных отделах конечностей, прежде всего рук. И лишь в 10 % случаев слабость более выражена в проксимальных отделах рук или нижних конечностях. Распределение пареза "укладывается" в зоны иннервации основных нервов конечностей. Атрофия мышц развивается сравнительно поздно, что объясняется их неполной денервацией. Почти у 2Д больных отмечаются фасцикуляции, крампи или миокимия, вследствие чего нередко возникают трудности в дифференциальной диагностике с БАС.
Сухожильные рефлексы неравномерно снижаются или выпадают, реже встречается диффузное снижение рефлексов. У отдельных больных сухожильные рефлексы производят впечатление оживленных, что еще более усиливает сходство с БАС. Нарушения чувствительности отсутствуют или выражены минимально, хотя многие больные жалуются на онемение или парестезии. Черепные нервы, а также нервы, иннервирующие дыхательные мышцы, в том числе диафрагмальный нерв, вовлекаются крайне редко. Характерно медленное прогрессирование. Возможны спонтанные ремиссии.
Диагноз. Ключевое значение в диагностике мультифокальной двигательной невропатии имеет ЭНМГ (электронейромиография), которая обнаруживает множественные парциальные блоки проведения по двигательным волокнам при нормальном проведении по чувствительным волокнам. Для диагностики мультифокальной двигательной невропатии необходимо выявить блок проведения не менее чем в двух нервах, причем вне зон частой компрессии нервов (например, запястного или локтевого каналов). Блок проведения чаще определяется в нервах рук на уровне предплечья, реже плеча или подмышечной области. Помимо блоков проведения, могут быть выявлены и другие признаки демиелинизации: увеличение дистальной латенции и латентного периода F-волны, патологическая временная дисперсия М-ответа. При игольчатой электромиографии часто выявляются признаки денервации: фибрилляции и фасцикуляции, увеличение амплитуды и продолжительности ПДДЕ, но в отличие от БАС, эти изменения выявляются только в тех мышцах, которые иннервируются пораженным нервом. Следует учитывать, что блок проведения - неспецифический признак. Он может, например, отмечаться и при других приобретенных демиелинизирующих полиневропатиях, туннельных невропатиях, ишемических невропатиях. В ЦСЖ при мультифокальной двигательной невропатии в большинстве случаев не обнаруживают каких-либо отклонений. Лишь у 10 % больных отмечается легкое увеличение уровня белка (обычно не выше 0,8 г/л). У 2/з больных повышен уровень КФК в 2-3 раза. Другие лабораторные показатели в пределах нормы. При биопсии можно выявить субклинические изменения в чувствительных волокнах.
Лечение. При мультифокальной двигательной невропатии установлена эффективность внутривенного введения иммуноглобулина и циклофосфамида. Но в отличие от ХВДП (хроническая воспалительная демиелинизирующая полинейропатия) ни кортикостероиды, ни плазмаферез не оказывают лечебного действия. Иммуноглобулин эффективен у 90 % больных. Обычно его вводят по 0,4 г/кг в течение 5 дней. Иногда ту же курсовую дозу вводят быстрее - в течение 3 дней (0,4 г/кг - 0,8 г/кг - 0,8 г/кг). Во время первой инфузии нужно внимательно следить за состоянием больного, учитывая опасность аллергической реакции. В дальнейшем необходим контроль уровня креатинина. Уменьшение слабости обычно становится заметным в первые 2-4 недели. Однако в дальнейшем введение иммуноглобулина приходится повторять каждые 8-12 недель, при этом доза постепенно снижается, а интервал между введениями растет. Следует отметить, что регрессу обычно подвергаются лишь относительно недавно сформировавшиеся парезы. Длительно существующий дефект остается стабильным. При недостаточной эффективности или необходимости частых инфузий иммуноглобулина дополнительно назначают малые дозы циклофосфамида (0,5-2 мг/кг в сутки). При недоступности или неэффективности иммуноглобулина возможно применение циклофосфамида как длительным курсом (2-3 мг/кг в сутки), так и путем пульс-терапии (3 г/м2 вводят внутривенно через день в 5 приемов).
Электрофизиологические исследования (ЭМГ и исследование нервной проводимости) используются для выявления, локализации, характеристики и прогнозирования нарушений, влияющих на моторную единицу.
Аномальные нейрогенные результаты ЭМГ не являются специфичными для конкретного заболевания, но полезны в диагностическом процессе. При электрофизиологическом обследовании определяются клинические показания для нейровизуализации.
Электрофизиологическое исследование предоставляет информацию о локализации поражения в моторной единице (нижний мотонейрон, нервно-мышечное соединение или мышечные волокна). Также устанавливается тип повреждения, либо демиелинизирующее или аксональное, либо оба.
а) Поражения нижнего мотонейрона. Острое очаговое поражение нижнего мотонейрона (включая передние рога, нервные корешки, нервные сплетения и периферические нервы) вызывает изменения при ЭМГ и при исследовании нервной проводимости и зависит от механизма (компрессия, растяжение, разрыв или ишемия).
Распределение электрофизиологических изменений зависит от места поражения, а также от того, какие мышцы и нервы были выбраны для исследования, что в свою очередь зависит от симптомов у пациента.
Поражение клеток передних рогов, нарушение непрерывности аксонов и демиелинизация (нейроапраксия) немедленно отражаются на ЭМГ и в исследовании нервной проводимости. Эти изменения являются неспецифическими, и их может быть трудно отличить, например, от поражения верхних мотонейронов или субмаксимальной контрактуры мышц.
При ЭМГ частота оставшихся моторных единиц увеличивается для получения исходной силы сокращения мышц с меньшим количеством моторных единиц, а картина интерференции максимального сокращения мышц может быть уменьшена при достаточно низком количестве выживших моторных единиц. В течение второй недели происходит увеличение спонтанной активности (потенциал фибрилляции, положительные острые волны и фасцикуляции), но она не присутствует в большинстве пораженных мышц до следующих 3-5 недель.
При проведении исследования при остром очаговом поражении периферических нервов появляются различные нарушения, если природа нарушений демиелинизирующая или связана с потерей аксонов.
При фокальной демиелинизации миелиновая оболочка нарушается и затруднено распространение нервных потенциалов действия на месте поражения. Соответственно выявляется электрофизиологическое снижение скорости проводимости или проводниковая анестезия. Проводниковая анестезия может быть полной или частичной.
В случае замедления проводимости амплитуда потенциалов действия мышцы нормальная после стимуляции и проксимального и дистального концов. Проведение полностью блокируется, если распространение потенциалов действия двигательных нервов не представляется возможным по всему периметру демиелинизации. При полном моторном блоке нормальные потенциалы действия мышц вызываются дистальнее места поражения но отсутствуют при стимуляции проксимальнее места поражения. При частичном блоке распространение потенциалов действия проходит только по аксонам.
Таким образом, амплитуда потенциала действия, записанная после стимуляции проксимально от поражения, снижается по сравнению с дистальной стимуляцией.
После острого аксонального повреждения часть аксона дистальнее поражения подвергается валлеровский дегенерации. Скорость проведения может быть несколько снижена в связи с потерей самых быстропроводящих нервных волокон.
Так как валлеровская дегенерация начинается только через два дня после прекращения аксонального проведения, часть аксонов дистальнее места повреждения остается возбудимой до полной дегенерации. Валлеровская дегенерация завершается к 10 дню после аксонального поражения. Чтобы записать или классифицировать поражение как демиелинизируещее или аксональное, электрофизиологическое исследование должно быть отложено, по крайней мере на 11 дней после поражения. После полной валлеровской дегенерации ЭМГ обследование позволяет локализовать поражение, так как нейрогенные нарушения выявляются только в мышцах с иннервацией ветвями, возникающими дистальнее места поражения.
ЭМГ также может быть использована для оценки прогресса реиннервации.
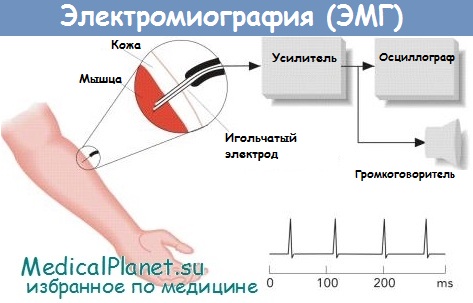
б) Поражения периферических нервов. Исследования нервной проводимости и ЭМГ играют важную роль в дифференциальной диагностике нервных нарушений.
Во время исследования нервной проводимости выявляются нормальные результаты при клинической картине ущемления нерва, вызванной наличием болезненных точек или других болезненных состояний опорно-двигательного аппарата. Это можно наблюдать, например, при болезненной точке подостной мышцы, когда часто возникает парестезия локтевой части кисти и предплечья или при латеральном эпикондилите, когда можно выявить парез мышц разгибателей запястья и кисти.
Электромиография при повреждении сплетений и корешков покажет нейропатические результаты вне зоны поражения. Например, при поражении нижнего ствола плечевого сплетения помимо нарушений в мышцах, иннервируемых локтевым нервом (ущемление нерва позади медиального надмыщелка), нарушения будут присутствовать в мышце, отводящей мизинец (иннервируется срединным нервом), в соответствии с ходом нервных волокон из корешков С8 и Т1 через нижний ствол срединного нерва.
в) Плексопатии. Плечевое и пояснично-крестцовое нервные сплетения являются сложными структурами. Для локализации повреждения необходимы детальные знания об их анатомии. Дифференциальная диагностика между поражениями корешка и повреждением сплетения важна после тракционной травмы. Исследование СВП показывает нормальное проведение потенциалов действия и скорость проведения в случае травмы корешка (см. ниже), в то время как потенциалы действия снижают амплитуду или отсутствуют при поражении сплетения при исследовании пациента после полной валлеровской дегенерации (более чем через 10 дней после травмы).
Выявление нейрогенного нарушения в мышцах, иннервируемых двумя или более периферическими нервами с общим ходом через сплетение, подтверждает диагноз поражения сплетения.
г) Радикулопатия. Поражения нервных корешков вызывают валлеровскую дегенерацию мотонейронов в периферических нервах, а затем нейрогенные нарушения обнаруживаются в мышцах, иннервируемых этими нервными волокнами. Напротив, сенсорные нервные волокна в периферических нервах не перерождаются, потому что их трофические центры находятся в задних корешках. Таким образом, при поражении корешков будут диагностироваться нормальные сенсорные потенциалы действия вместе с нейрогенными нарушениями в распределении сегментарных миотомов при ЭМГ.
При радикулопатиях (и поражениях, связанных с передними рогами), в отличие от более периферических поражений, страдают параспинальные мышцы и мышцы, иннервируемые ветвями, отходящими в непосредственной близости от межпозвонкового отверстия (например, зубчатая мышца), и при ЭМГ можно зарегистрировать нейрогенные нарушения в этих мышцах.
д) Поражение спинного мозга. Поражения, связанные с мотонейронами в передних рогах спинного мозга, дают такие же изменения на ЭМГ и нарушения моторной проводимости, как при радикулопатиях. Распределение патологических изменений и дополнительные находки предполагают повреждение верхнего мотонейрона, что подтверждает диагноз повреждения спинного мозга.
е) Поражение верхнего мотонейрона. При поражения спинного мозга ниже места поражения не выявляется никаких отклонений в сенсорном или моторном проведении нервов. При ЭМГ спонтанная активность не определяется, а МВП имеют нормальную конфигурацию. Единственным электрофизиологическим нарушением является снижение интерференционного паттерна при максимальном сокращении и снижении частоты моторной единицы. Эти нарушения также могут быть найдены при истерических парезах.
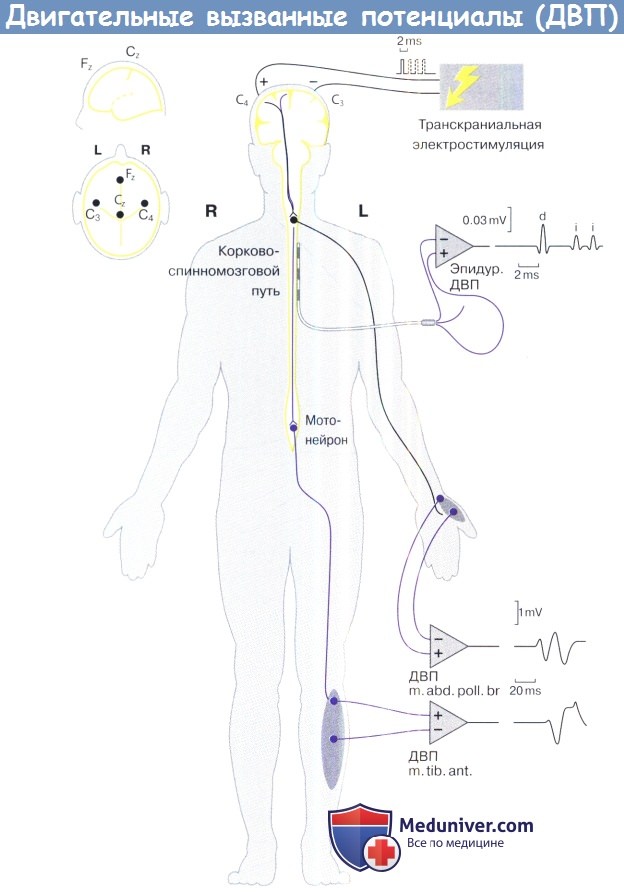
Настройка мониторинга двигательных вызванных потенциалов.
Транскраниальная электростимуляция (ТЭС) через кожу/игольчатые электроды в области С3 и С4, анод (+) является стимулом для аксонов кортикоспинального тракта.
Стимул должен состоять из последовательных 4-7 импульсов, с коротким межимпульсным интервалом.
Стимуляция в основном осуществляется с частотой 1-0,5 Гц, особенно в критические периоды операции.
Общие характеристики приведены в таблице ниже. Запись осуществляется с помощью иглы или поверхностных электродов в/на мышцах рук (например, m. abductor pollicis brevis, m.abd. poll.br) и ног (m. tibialis anterior, m.tib.ant.).
Во время открытой операции на позвоночнике могут быть размещены эпидуральные электроды ниже (и выше) зоны риска, например, в случае интрамедуллярных опухолей.
На рисунке показано, что в случае записи с мышц участвуют два синапса: один на двигательном нейроне, и один на мышце.
При эпидуральной записи (D-волны) синапсы не вовлечены, что делает контроль в такой ситуации нечувствительным к анестезии или релаксации.
Эпидуральная запись также показывает позднюю реакцию, называемую I-волной, которая является результатом стимуляции ассоциативных волокон в коре головного мозга, вместо аксонов кортикоспинального тракта.
- Все (14)
Вообще, безусловно, хорошо, если невролог может сам работать с электронейромиографом и знает не только биофизические аспекты процедуры, но и умеет оценивать полученные результаты. Однако, тема электронейромиографии достаточно обширна, по ней имеется ряд руководств, как отечественных, так и зарубежных, поэтому данная тема не претендует на полноту раскрытия материала. При рассмотрении отдельных заболеваний, где это необходимо, будут указываться наиболее типичные изменения по ЭНМГ.
В основе электронейромиографии (ЭНМГ) лежит применение электрической стимуляции нерва с последующим анализом параметров, регистрируемых с иннервируемой мышцы или с самого нерва. Это комплекс исследований для оценки работы мышц и качества передачи нервных импульсов по периферическим нервам и проводящим путям головного и спинного мозга. Метод применим для исследования любого доступного периферического нерва, но в практике чаще исследуют срединный, локтевой, большеберцовый, малоберцовый, седалищный, лицевой, межреберные нервы, поскольку топография других нервов затрудняет стимуляцию их в двух точках, что является неизменным условием для проведения процедуры. Достаточно эффективный и безопасный метод для установки места повреждения (сдавления, травмы и др.) периферического нерва.

Различают две разновидности электронейромиографии:
- спонтанная ЭНМГ – регистрируется активность мышц и нервных волокон в состоянии покоя или при возбуждении
- вызванная ЭНМГ – регистрируется потенциал, который возникает при воздействии на мышцу электрическим током.
Для регистрации используются различные электроды, которые могут быть накожными и инвазивными (игольчатыми). Для понимания сути процесса можно сравнить метод с работой электрика при выявления обрыва в электрической цепи - между парой электродов должен идти ток определённых характеристик. Если ток не идёт - цепь (нерв в нашем случае) оборвана. если сигнал искажен или замедлен - по оценке характеристик можно понять, что не так с цепью и даже получить ответ на вопрос "почему?". Оцениваются следующие показатели:
- параметры вызванных потенциалов (ВП) мышцы и нерва (латентный период, форма, амплитуда и длительность ВП);
- число функционирующих двигательных единиц (ДЕ);
- скорость проведения импульса (СПИ) по двигательным и чувствительным волокнам периферических нервов;
- производится подсчет мотосенсорного и краниокаудального коэффициентов, коэффициентов асимметрии и отклонения от нормы.
Исследование спонтанной активности мышц помогает нам оценить состояние самих мышц и состояние двигательных нервных клеток спинного мозга (миопатия, полимиозит, болезнь мотонейрона, миелопатия и др).
Исследование нервно-мышечной передачи с помощью электромиографии дает информацию о проблемах перехода нервного импульса с периферического нерва непосредственно к мышце-исполнителю (помогает в диагностике миастении и миастенических синдромов).
Исследование двигательных и чувствительных нервов выполняется с использованием электрической или магнитной стимуляции. Оценивается множество параметров, в том числе скорость проведения импульсов по нервам, наличие и местоположение блоков проведения и др. Исследование ценно для диагностики и оценки эффективности лечения полинейропатии, полиневрита, других болезней и травм нервов.
Вызванные зрительные, слуховые и соматосенсорные потенциалы – способ исследования проводящий путей, соединяющих органы чувств с нервной системой. Используются для диагностики рассеянного склероза, патологии слуховых, зрительных нервов и ряда других заболеваний с помощью электромиографии.
М-ответ — вызванный потенциал мышцы, являющийся суммарным синхронным разрядом двигательных единиц мышцы в ответ на электрическое раздражение нерва. Обычно М-ответ регистрируется с помощью накожных отводящих электродов, которые более объективно, чем игольчатые, отражают суммарную активность мышцы. Пластины электродов помещают поперечно расположению волокон. При изучении М-ответа обращают внимание на интенсивность порогового раздражения, форму вызванного потенциала, его амплитуду и длительность. Форма М-ответа зависит от ряда факторов. При биполярном отведении М-ответ имеет негативную и позитивную фазы соответственно прохождению волны возбуждения над обеими электродными пластинками.
Потенциал действия (ПД) нерва обусловлен электрической активностью волокон периферических нервов в ответ на электрическое раздражение нервного ствола. ПД нерва является суммарным потенциалом действия, складывающимся из потенциалов отдельных нервных волокон разного диаметра и степени миелинизации. ПД афферентных волокон регистрируется кольцевыми пальцевыми электродами при стимуляции ствола нерва или, наоборот, со ствола нерва при стимуляции концевых его ответвлений. ПД эфферентных волокон можно регистрировать при избирательной стимуляции двигательных волокон нерва, изолированно от чувствительных волокон. В клинической практике исследование ПД двигательных волокон обычно не проводится в связи с его малой амплитудой, поэтому, говоря о ПД нерва, имеют в виду ПД чувствительных волокон. При изучении ПД нерва обращают внимание на интенсивность порогового раздражения, форму и амплитуду вызванного потенциала.
Уменьшение числа функционирующих ДЕ наблюдается при поражении центрального и периферического двигательных нейронов. При миодистрофии уменьшение количества ДЕ менее значительно.
Изучение вызванных потенциалов мышц, полученных повторной стимуляцией нерва, направлено прежде всего на выявление нарушенийнервно-мышечной синаптической передачи и патологической нервно-мышечной утомляемости. О наличии нервно-мышечного утомления судят по снижению амплитуды М-ответа при повторной электрической стимуляции нерва.
Методика определения СПИ (скорости проведения импульса) по периферическим нервам основана на сопоставлении латентных периодов ВП при электрическом раздражении двух точек нерва, находящихся на некотором расстоянии друг от друга.
Поражение периферического нервного ствола сопровождается наиболее четкими ЭНМГ-изменениями:
- выраженным снижением скорости проведения импульсов по чувствительному и двигательному нервам,
- уменьшением амплитуды потенциала действия пораженного нерва и мышечного ответа (М-ответа) иннервируемых мышц.
При сегментарном поражении спинного мозга, в основном его передних рогов наблюдаются:
- относительно нормальные величины скорости проведения импульсов по чувствительному и двигательному нервам верхних и нижних конечностей,
- значительное повышение амплитуды потенциала действия нервов верхних и в меньшей степени нижних конечностей,
- резкое снижение амплитуды максимального мышечного ответа мышц кистей и стоп
- повышение амплитуды минимальных (пороговых) мышечных ответов,
- резкое падение числа функционирующих двигательных единиц в мышцах верхних и нижних конечностей.
Дифференциально-диагностическим отличием поражения передних рогов спинного мозга от поражения нерва являются диссоциированное снижение амплитуды максимальных мышечных ответов и падение числа функционирующих двигательных единиц при нормальных или повышенных величинах скорости проведения импульсов и амплитуд вызванных биопотенциалов нерва.
Электронейромиография находит все более широкое применение в клинике нервных болезней. Метод наиболее информативен в диагностике заболеваний, сопровождающихся поражением периферических нервов (мононевриты, полиневриты, невральная амиотрофия, полиневропатии при эндокринных и коллагеновых заболеваниях, при которых наблюдается снижение СПИ по двигательным и чувствительным волокнам периферических нервов, снижение амплитуд вызванных потенциалов мышцы и нерва). Электронейромиография нашла применение при изучении супрасегментарных пирамидных и экстрапирамидных поражений. Портативные электромиографы позволяют проводить лечебно-диагностические манипуляции в любом месте и в любое время, существенно облегчают поиск глубоких мышц, например - для топического введения ботулинического токсина с целью коррекции дистонии (в лечении писчего спазма, например).
Читайте также:


