Болезнь альцгеймера атрофия гиппокампа
Под деменцией понимают выраженное нарушение когнитивных функций на фоне полного сохранения сознания. Самая частая причина деменции — болезнь Альцгеймера (БА), которой страдают 5% людей в возрасте 70 лет и 20% в возрасте 80 лет. На пациентов с БА приходится 20% госпитализаций в психиатрические стационары.
При МРТ обычно обнаруживают выраженную атрофию коры больших полушарий с расширением борозд и увеличением желудочков. Как показано на рисунке ниже, поражение медиальной височной доли (гиппокампальный комплекс и энторинальная кора) происходит в большей степени, чем других отделов. Первичная чувствительная кора и двигательная кора, а также верхние участки префронтальной коры остаются относительно сохраненными.
При посмертном исследовании коры больших полушарий обнаруживают следующие изменения:
• Массивная гибель пирамидных нейронов.
• Амилоидные бляшки и нейрофибриллярные клубки, преимущественно в гиппокампе и миндалевидном теле. Бляшки начинают скапливаться в стенках мелких кровеносных сосудов. Их появление можно объяснить разрушением определенного фермента с последующей гиперпродукцией белка β-амилоида. Клубки состоят из скоплений микротрубочек, которые связаны с патологической формой белка, ассоциированного с микротрубочками (θ-белок). Клубки постепенно замещаются амилоидом.
• Гибель более 50% холинергических нейронов базального ядра Мейнерта и области перегородки мозга, а также их волокон, идущих через неокортекс и мезокортекс. Было также показано, что гибель АХ-нервных окончаний провоцирует образование нейрофибриллярных клубков в височной доле.
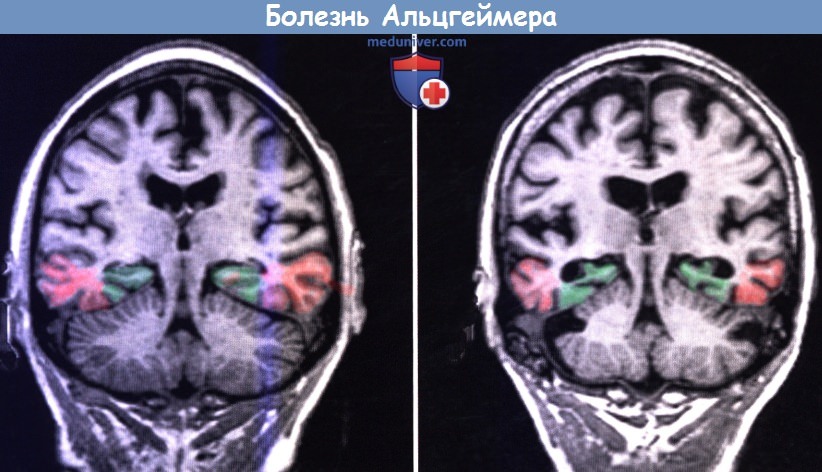
Коронарные срезы MPT.
(А) В норме. (Б) Пациент с болезнью Альцгеймера.
Добавлены цвета: зеленый — гиппокамп; красный — энторинальная кора.
При помощи ПЭТ-исследования, направленного на определение скорости метаболизма глюкозы, определяют признаки гипометаболизма. Снижение метаболизма связано с гибелью пирамидных нейронов и (частично) с нарушением холинергической иннервации оставшихся пирамидных клеток. На мембранах здоровых пирамидных нейронов расположены возбуждающие АХ-рецепторы.
Несмотря на то, что процесс гибели нейронов в каждом случае протекает по-разному, чаще всего он начинается в медиальной височной доле, а затем распространяется наверх и вперед. Это может объяснить следующую последовательность развития симптомов.
• Снижение функции гиппокампа. Возникают антероградная амнезия и забывчивость, пациент не может вспомнить о произошедшем с ним событии даже спустя несколько минут (нарушение текущей эпизодической памяти). Пациент перестает ориентироваться на знакомых улицах, совершает опасные ошибки при управлении автомобилем (работа гиппокампа необходима для поддержки чувства пространства, за которое отвечает теменная доля). Нарушается внимание, пациенту становится сложно переключиться с одной задачи на другую.
• Снижение функции затылочно-височной коры. Повреждение поля 37 приводит к неспособности читать и писать. Повреждение височного полюса приводит к развитию крайне неприятного симптома—пациент перестает узнавать лица родственников и друзей. При вовлечении в процесс надкраевой и угловой извилин пациент не может писать.
Существует также редкий вариант болезни Альцгеймера с ранним началом, который наследуют по аутосомно-доминантному типу. Заболевание обычно возникает в возрасте 30-40 лет. Хромосомный анализ позволил установить, что за развитие болезни отвечает мутация на длинном плече хромосомы 21, которая нарушает действие гена, кодирующего синтез белка-предшественника амилоида. Эту мутация часто также обнаруживают у лиц с синдромом Дауна. У большинства лиц с синдромом Дауна, доживающих до зрелого возраста, развивается болезнь Альцгеймера.
Редактор: Искандер Милевски. Дата публикации: 25.11.2018

Патология гиппокампа занимает центральное место в патогенезе и патологической анатомии болезни Альцгеймера (AD) и других форм деменции, например, таких, как лобно-височная деменция (FTLD). Исследования, проведенные с помощью аутопсии тканей мозга показали, , что некоторые отделы гиппокампа более уязвимы к патологическим процессам , наблюдающимся при AD и FTLD, в частности subiculum ( основание аммонова рога) и cornu ammonis 1 (CA1) (аммонов рог; cornu ammonis; по имени древнеегипетского бога Аммона, изображавшегося с бараньей головой).
Гиппокамп можно разделить анатомически по-разному. В грубых анатомических терминах можно выделить три области: головку гиппокампа (HH), которая является самой передней его частью, тело (HB) и хвост (HT), а на основании цитоархитектуры гиппокамп можно разделить на субрегионы cornu ammonis (CA1-4), зубчатую извилину (DG) и субикулум. Подразделение из трех частей также возможно с функциональной или молекулярно - генетической точки зрения, согласно которой структуру гиппокампа можно разделить на переднюю, промежуточную и заднюю его секции. Передний гиппокамп связан с регуляцией аффекта, стресса и эмоций, а задняя часть - с когнитивными функциями, такими как память и пространственное обучение. Была идентифицирована промежуточная часть гиппокампа , но ее конкретные функции менее понятны. Каждая часть гиппокампа также имеет свою уникальную "схему подключения". Передний гиппокамп связан с миндалиной и медиальной префронтальной корой, регионами, ответственными за генерацию и регуляцию эмоционального ответа. Задний гиппокамп имеет связи с подкорковыми ядрами, связанными с пространственным обучением. Однако, в отличие от грубого анатомического деления, это функциональное подразделение не имеет четких границ; вместо этого изменения связи постепенно перемещаются из передней к задней части гиппокампа.
Из-за своей центральной роли в консолидации памяти и эмоциональной обработки информации , ее уязвимости при различных деменциях части ( образования) гиппокампа широко изучались с помощью структурной магнитно-резонансной томографии (MRI). Поскольку патология гиппокампа рассматривается как центральное звено патогенеза болезни Альцгеймера (AD), он также используется в качестве диагностического биомаркера в клинической практике.
При болезни Альцгеймера ( AD) большинство исследований показали снижение объема гиппокампа в субикулуме и CA1. Лобно - височная лобарная деменция (FTLD) с неврологической точки зрения является "зонтичным термином", охватывающим несколько различных патологических процессов, которые приводят к общим клиническим фенотипам. Тем не менее, различные неврологические варианты могут разделяться и некоторыми сайтами патологии гиппокампа, а именно CA1, субикулум и DG ( дентальная извилина).
Объемные данные показывают атрофию гиппокампа при всех типах деменции с левой стороны, тогда как только два подтипа FTLD (SD и FTD) демоснтрируют атрофию с правой стороны.
С грубой анатомической точки зрения у пациентов с FTD наблюдается атрофия левой передней части головки гиппокампа (HH).
У пациентов с SD наблюдается выраженная атрофическая деформация во всем левом гиппокампе, а у больных с PNFA отмечается деформация в левой HH и HB ( тело гиппокампа). Ранние исследования, посвященные SD показали ограниченную атрофию, особенно в HT. Последние работы продемонстрировали более позднюю патологию гиппокампа при SD, включая левый HT, что могло быть следствием прогрессирования болезни.
Болезнь Альцгеймера (AD), наконец, проявляет более выраженную деформацию левого HB и некоторые небольшие пятна в HH.
Сходство в морфологии гиппокампа между клиническими подтипами FTLD и AD может потенциально быть обусловлено наличием AD-патологии в этих подтипах. PNFA подтип FTLD, который показал наибольшее сходство морфологии гиппокампа с AD. Как AD, так и PNFA показывают деформацию медиальной части HH и боковой части HB. В исследовании клинически диагностированных пациентов с FDLL около 44% случаев FTLD имели патологию, согласующуюся с патологией AD, тогда как это число было намного меньше при SD (10%) и FTD (7%) ( Alladi et al., 2007) . При AD левый гиппокамп проявляет более выраженную патологию, тогда как правый гиппокамп проявляет атрофию в медиальной части головы гиппокампа. Патологические исследования AD свидетельствуют о том, что атрофия начинается в регионе интраминальной области.

Несмотря на то, что научное общество до сих пор не может прийти к единому мнению относительно гипотезы возникновения болезни Альцгеймера, морфологические изменения, возникающие при данной патологии, изучены достаточно тщательно. Знание механизмов развития заболевания и отдельных его проявлений необходимо для своевременной диагностики сенильной деменции альцгеймеровского типа. Понимание патогенеза играет важную роль и в создании новых направлений терапии.

Молекулярный уровень
Что происходит с мозгом при болезни Альцгеймера на молекулярном уровне?
Все начинается с нарушения метаболизма. В нормальных условиях предшественник бета-амилоида расщепляется ферментом на одинаковые по размеру непатогенные пептиды. При дефекте ферментной системы или самого белка в результате указанной реакции получаются разные по длине фрагменты.
Нерастворимые длинные молекулы начинают откладываться в стенках сосудов и веществе головного мозга, затем объединяются между собой в бета-амилоидную структуру. Получившийся белок обладает токсичным воздействием на нейроны. Он способствует развитию оксидативного стресса, активирует медиаторы воспаления — вещества, поддерживающие воспалительную реакцию. Все эти процессы приводят к повреждению и смерти нервных клеток.
В свою очередь, из-за гибели нейронов базального ядра снижается концентрация ацетилтрансферазы, фермента, катализирующего образование ацетилхолина, одного из главных возбуждающих нейромедиаторов. Ацетилхолин отвечает за передачу нервного импульса: снижение его количества негативно отражается на когнитивных функциях и ведет к нарушению регуляции процессов памяти.

Клеточный уровень
Какие изменения характеризуют головной мозг при болезни Альцгеймера на клеточном уровне? Самыми главными являются появление сенильных бляшек и нейрофибриллярных сплетений, а также массовая гибель клеток вещества головного мозга.
- центральное ядро — очаговое скопление бета-амилоида;
- клеточное окружение из микроглии, в этой же зоне изредка встречаются астроциты;
- аксоны и дендриты, находящиеся в стадии дегенерации;
- отростки нейронов, которые уже наполнены плотными тельцами.
Мозг больного Альцгеймером содержит сенильные бляшки в гиппокампе, миндалевидном теле, во всех отделах коры головного мозга, кроме чувствительных и двигательных зон.
Это внутриклеточные включения, основной составляющей которых считается гиперфосфорилированнный белок под названием тау-протеин. Они выглядят как узелки, либо клубочки, и представлены спиралевидными скрученными попарно филаментами.
Тау-протеин предназначен для стабилизации микротрубочек, органелл, отвечающих за создание цитоскелета и транспортировку веществ внутри клетки. Гиперфосфорилирование белка тау приводит к нарушению его связей с микротрубочками, что в итоге вызывает гибель нейрона.
Пораженные клетки уменьшаются в объеме, их цитоплазма вакуолизируется. В ней часто обнаруживают агрофильные гранулы.

| Свойства/Патоморфологический элемент | Сенильные бляшки | Нейрофибриллярные сплетения |
|---|---|---|
| внешний вид | скопления разных размеров овальной формы | узелки или клубочки из филаментов |
| локализация по отношению к клетке | внеклеточное пространство | внутри клетки, на внутренней стороне мембраны нейрона |
| локализация в головном мозге | гиппокамп, амигдала, кора | гиппокамп, амигдала, кора, базальное ядро Мейнерта |
Нейрофибриллярные сплетения локализуются там же, где сенильные бляшки, а также в базальном крупноклеточном ядре переднего мозга. К патоморфологическим элементам, схожим с ними по происхождению, относятся скопления актиновыхфиламентов или тельца Хирано, которые располагаются в нейронах гиппокампа и проксимальных дендритах.

Выраженность когнитивных нарушений при данной патологии не коррелирует с концентрацией двух предыдущих элементов (бляшек и нейрофибриллярных сплетений), зато напрямую зависит от того, насколько поврежден мозг при болезни Альцгеймера, и количества связей между нервными клетками. Чем меньше синапсов, тем тяжелее выражены нарушения.
Головной мозг при Альцгеймере страдает неоднородно. Массовую гибель нейронов отмечают на следующих участках:
- гиппокампе, отвечающем за консолидацию памяти;
- медиобазальных участках лобных долей;
- глубинных отделах височных долей;
- кореатрофичных долей головного мозга.
Нейробиологи из Университета штата Аризона во время испытаний обнаружили, что изменения в мозге при болезни Альцгеймера на клеточном уровне включают в себя также некроптоз. При изучении посмертных образцов в тканях мозга были обнаружены белки, являющиеся маркерами этого программируемого процесса. Поэтому некроптоз можно отнести к одному из механизмов развития нейродегенерации.
Тканевой уровень
Гистологические исследования показывают, что вышеуказанные процессы приводят к постепенной атрофии ткани головного мозга, значительному уменьшению числа нейронов гиппокампа (особенно на уровне крючка), коры, подкорковых структур.
Отмечаются дегенеративные изменения дендритов, белого вещества, накопление бета-амилоида и нейрофибриллярных сплетений. Вместе с гибелью нейронов нарушаются синаптические связи. Сильнее всего эти изменения заметны в височной коре, базальных ядрах, гиппокампе, поясной извилине и в медиобазальных участках коры больших полушарий мозга.
Важно! У многих людей в пожилом возрасте в веществе мозга обнаруживаются сенильные бляшки и клубки из филаментов. Однако при Альцгеймере они распределяются неравномерно, преимущественно в определенных областях (например, в височных долях).
Скопления бета-амилоида выявляются не только во внеклеточном пространстве, но и в церебральных сосудах, а также в сосудистых сплетениях. Возможна дистрофия (иногда избыточная пролиферация) глии.

Органный уровень
Мозг человека с болезнью Альцгеймера характеризуется следующими признаками:
- диффузной атрофией вещества, преимущественно височных, теменных и затылочных долей;
- сужением извилин;
- углублением борозд;
- асимметрией гиппокампов;
- расширением желудочков;
- расширением субарахноидальных пространств;
- уменьшением общей массы и объема;
Из-за атрофии коры и уменьшения общего объема мозга развивается компенсаторная гидроцефалия — ликвор постепенно заполняет образующиеся в белом веществе полости. Истончается дно III желудочка. Результатом этого является поражение области гипоталамуса и нарушение метаболизма вплоть до серьезных эндокринных сдвигов (яркий пример — прогрессирующая кахексия).
Нейровизуализация мозга при Альцгеймере
Немалый вклад в изучение патогенеза и проявлений данного заболевания внесли методы нейровизуализации: КТ, МРТ, ПЭТ, ОФЭКТ и т.д. Большое значение в диагностике Альцгеймера придается методу магнитно-резонансной томографии. Изменения на МРТ при болезни Альцгеймера позволяют учитывать возрастную инволюцию и упрощают дифференциальный диагноз с другими, схожими по клиническим проявлениям патологиями.
Магнитно-резонансную томографию проводят минимум два раза. Интервал между исследованиями должен составлять не меньше месяца — для оценки наличия и динамики дегенеративного процесса. При анализе учитывают возрастные изменения, церебральную атрофию и компенсаторную гидроцефалию.
Уже для ранних стадий заболевания характерно уменьшение объема медиальных участков височных долей. Наиболее точно дифференцировать возрастную норму от Альцгеймера удается благодаря измерению гиппокампа и энториальной коры: степень дегенерации гиппокампа у больных сенильной деменцией больше примерно в два раза. То же самое можно сказать о размерах височного рога.
Мозг больного Альцгеймером на МРТ на более поздних стадиях имеет следующие признаки:
- наличие включений (крупных очагов-бляшек и нейрофибриллярных сплетений);
- уменьшение массы и объема церебрального вещества;
- расширение желудочков;
- нарушение метаболизма в мозговом веществе.
У пациентов с БА на МРТ чаще выявляется поражение белого вещества в форме лейкоареоза. Особое значение имеют перивентрикулярные гиперинтенсивные очаги, в то время как глубокие поражения не имеют особой корреляции с сенильной деменцией.
В 60% случаев обнаруживаются изменения в подкорковых структурах в виде лакунарных кист, не прозвучавших клинически корковых инсультов, изолированных очагов.

Помимо обычного МРТ, в диагностику иногда включают перфузионную МРТ, диффузионно-взвешенную и спектроскопию.
Перфузионная МРТ — методика получения изображения после внутривенного введения специального вещества. Благодаря ей можно измерить гемодинамические параметры мозга. Ряд исследований выявил снижение объема гемоперфузии у пациентов с Альцгеймером почти на 20% по сравнению с нормой.
Спектроскопия — позволяет получить информацию о химическом составе тканей.
Важно! Большинство назначаемых методик исследования, даже МРТ, не всегда позволяет однозначно вынести вердикт о наличии болезни Альцгеймера на ступени ранней деменции. Поэтому при изучении изменений в церебральном веществе следует принимать во внимание все виды диагностики, не отдавая приоритет какому-либо из них.
Болезнь Альцгеймера на МРТ головного мозга с участием спектроскопии демонстрирует подъем уровня холина, что отражает разрушение миелиновых оболочек нервных волокон, подъем уровня мио-инозитола, что показывает аномалию цитоскелета. У пациентов с БА регулярно выявляются оба признака. Уровень других метаболитов, таких как креатин, N-ацетиласпартат, коррелируют с тяжестью деменции при Альцгеймере.
Если МРТ покажет болезнь Альцгеймера точно, то с компьютерной томографией все сложнее. Чувствительность компьютерного томографа по сравнению с ЯМР намного ниже, на КТ видны лишь значительные поражения вещества мозга.
| Изменения/метод исследования | КТ | МРТ |
|---|---|---|
| атрофия вещества мозга | при выраженных изменениях | на ранних стадиях |
| расширение желудочков | да | да |
| гидроцефалия | да | да |
| бляшки в сосудах | с контрастированием | да |
| очаги лейкоареоза | да | да |
| изменения размеров гиппокампа | при выраженных изменениях | да |
| изучение оболочек мозга | нет | да |
| изучение мягкого вещества | средняя точность | высокая точность |
| исследование структуры нервных волокон | нет | да |
На срезах КТ хорошо заметна атрофия коркового вещества, расширение субарахноидальных пространств и желудочков мозга, а также компенсаторная гидроцефалия, характерные для Альцгеймера. Видны будут и небольшие зоны лейкоареоза, а КТ с внутривенным введением контраста помогает обнаружить и амилоидные отложения в церебральных сосудах и сосудистых сплетениях.
Хотя все эти признаки и повторяют МР-симптоматику для сенильной деменции альцгеймеровского типа, но они становятся заметны только на поздних стадиях и нужны лишь для подтверждения уже поставленного диагноза. Если болезнь Альцгеймера МРТ покажет в стадии ранней деменции, то разрешающая способность компьютерного томографа попросту не позволит этого сделать.

Видео
Нейродегенеративные заболевания – условно выделяемая, разнородная группа относительно медленно развивающихся болезней с преимущественным поражением серого вещества центральной нервной системы, и в большинстве случаев, характеризующихся образованием аномальных клеточных и/или внеклеточных включений (депозитов) с последующей гибелью нейронов по механизму апоптоза.
К сожалению, для большинства нейродегенеративных болезней отсутствуют радикальные методы лечения, которые позволили бы полностью остановить патологический процесс и тем более обеспечить полное восстановление. Поэтому ранняя диагностика заболевания и своевременно начатое лечение играет важнейшую роль в возможности повлиять на ход заболевания и улучшить качество жизни больного.
Среди большинства существующих в настоящее время методов исследования только МРТ способна помочь клиницисту поставить правильный диагноз.
В числе нейродегенеративных заболеваний наиболее часто в клинической практике встречаются болезнь Альцгеймера и болезнь Паркинсона.
Учитывая этот факт, для достоверной диагностики и дифференциальной диагностики данных патологических процессов в МРТ разработаны дополнительные программы, позволяющие прицельно оценить зону интереса.
Паркинсонизм представляет собой медленно прогрессирующий неврологический синдром, для которого характерны тремор покоя, мышечная ригидность и гипокинезия.
Причиной синдрома паркинсонизма могут быть церебральный атеросклероз, черепномозговые травмы, эпидемический энцефалит, токсические и метаболические нарушения, применение ряда лекарственных препаратов, опухоли (вторичный паркинсонизм).
Кроме того выделяют истинный (первичный) паркинсонизм, как следствие болезни Паркинсона.
Патогенетически при данном заболевании происходит дегенерация и гибель дофаминэргических пигментированных (меланинсодержащих) нейронов, глиоз этих ядерных групп, атрофия прилежащих частей покрышки среднего мозга, вторичная дегенерация дофаминэргических и норадреналинэргических путей. В черной субстанции определяется депонирование ионов железа в высоких концентрациях.
Именно поэтому в наших МРТ центрах для возможности точного дифференцирования истинной болезни Паркинсона и синдрома паркинсонизма, вызванного другими причинами, используются специальные программы, позволяющие прицельно изучить зону патологического процесса и оценить состояние ядер среднего мозга.

Норма (в норме определяется пониженный МРС от ретикулярной части черной субстанции (длинная тонкая стрелка) и красного ядра (толстая стрелка), слабогиперинтенсивный сигнал от компактной части ретикулярной формации, разделяющий их (тонкая короткая стрелка).
У большинства обследуемых пациентов с болезнью Паркинсона отмечается исчезновение нормального пониженного МР-сигнала от ретикулярной части черной субстанции и красных ядер.

Гибель меланинсодержащих нейронов ретикулярной части черной субстанции, повышение МРС и сглаживание границ между указанными в примере нормы 3 образованиями.
У части пациентов отмечается слияние в норме гипоинтенсивных зон в одну за счет депонирования железа в компактной и ретикулярной частях черной субстанции и красных ядрах в режиме Т2-ВИ, сопровождающееся слабым повышением МРС в Т1.

Накопление железа в среднем мозге с понижением сигнала от всех указанных образований со слиянием в одну зону гипоинтенсивного сигнала в режиме Т2-ВИ.
Данное заболевание является одной из ведущих причин деменции в современном обществе и, вследствие этого, представляет собой социально значимую проблему.
Клинически несколько чаще встречается у женщин. Проявляется прогрессирующим распадом когнитивных функций, среди которых первое место занимают нарушения памяти. Возможны острые психотические эпизоды – бред, галлюцинации, делирий. Реже встречаются гиперкинетические расстройства и синдром паркинсонизма, эписиндром.
При болезни Альцгеймера, в отличие от всех других нейродегенеративных заболеваний, максимальные изменения определяются в гиппокампах.
Именно поэтому в наших МРТ центрах используются специальные программы высокого разрешения с прицельным исследованием височных долей для максимально точного изучения состояния гиппокампов.
При этом на корональных томограммах при прицельном исследовании височных долей определяется асимметричная атрофия гиппокампов с истончением коры, расширением щелей Биша с двух сторон и височных рогов боковых желудочков. Эти изменения являются наиболее ранними. Также выявляется атрофия теменных и затылочных долей с расширением субарахноидальных пространств.

Выраженная атрофия на уровне крючка и тел гиппокампа справа с истончением коры и белого вещества и расширением височного рога и гиппокампальной щели.
Таким образом появление МРТ диагностики с применением специальных программ для прицельного исследования зон интереса значительно облегчило диагностику нейродегенеративных заболеваний и позволило клиницистам ставить правильный диагноз в более ранние стадии заболевания, своевременно назначать необходимые препараты, а значит улучшить прогноз заболевания и качество жизни пациента.
Синдром Альцгеймера, или болезнь Альцгеймера (БА), — очень распространенная патология. Как известно, это дегенеративное заболевание головного мозга с прогрессирующим слабоумием, которое развивается у пожилых людей.
Синдромом Альцгеймера болеют все — и обыкновенные люди, и всемирно известные. Например, бывший президент США Рональд Рейган, ирландская писательница Айрис Мёрдок, бывшая премьер-министр Великобритании Маргарет Тэтчер, актёр Питер Фальк, английский писатель Терри Пратчетт и ряд других знаменитостей имели или имеют сейчас диагноз болезни Альцгеймера.
Этиология заболевания до сих пор остается неясной, что особенно характерно в отношении ненаследственной (спорадической) формы БА. На фоне естественных процессов старения разворачиваются специфические для синдрома Альцгеймера события, центральные из которых — отложение -амилоида в коре и гиппокампе (Selkoe, 1994) и созревание сенильных бляшек. Это вызывает целый каскад молекулярных изменений, которые приводят к дисфункции и смерти нервных клеток по типу апоптоза или некроза, что клинически выражается прогрессирующей деменцией. В тканях мозга имеют место холинэргический дефицит, окислительный стресс, повышенный уровень провоспалительных цитокинов и глутамата (возбуждающего нейромедиатора).
Обнаружение причинных мутаций в генах белка-предшественника амилоида и пресенилина (b-АРР, PSEN-1 и) касаются очень редко встречающихся семей с аутосомно-доминантными формами заболевания, так называемой родословной семейной болезни Альцгеймера, которая поражает 50 % каждого поколения, независимо от пола, между 30 и 50 годами. Мутации в гене PSEN-2 характеризуются неполной пенетрантностью (т. е. не всегда приводят к развитию БА), они виновны в развитии более редких — как ранних, так и поздних — семейных форм болезни.
Изучение родословных несемейных форм БА дает такой результат: в среднем, риск развития БА для родственников первой степени родства составляет 3–14 %. При этом исследования близнецов показали значительную (но не 100 %) роль генетических факторов. Коэффициент конкордантности у монозиготных близнецов (85 %) значительно выше, чем у дизиготных (42 %).
Выделяют 2 формы БА — пресинильную (с началом до 65 лет), и сенильную (с началом после 65 лет). Крайне редко БА может дебютировать и в 30 лет (обычно это связано с мутацией гена пресенилина-1). Болезнь развивается некоторое время бессимптомно — мозгу удается компенсировать выпадение поврежденных нейронов. Клиника появляется, возможно, через годы после запуска патогенетического механизма. Ранним, хотя и недостаточно специфическим признаком болезни Альцгеймера, может служить выявляемая при магнитно-резонансной томографии атрофия медиальных отделов височных долей, прежде всего, гиппокампа. В диагностике БА может помочь нейропсихологическое скрининг-тестирование, при котором пациенты копируют фигуры, запоминают слова, читают, выполняют арифметические действия. Дифференциальную диагностику в первую очередь проводят с сосудистой деменцией.
К факторам риска БА в настоящее время относят:
- возраст
- женский пол (у женщин заболевание отмечается в два раза чаще, чем у мужчин)
- в анамнезе черепно-мозговая травма, инфаркт миокарда, гипотиреоз, депрессия, воздействие электромагнитных полей
- низкий уровень витамина В12 и фолатов в сыворотке крови
- курение
- отравление тяжелыми металлами
- длительный прием НПВС
- заместительная гормональная терапия (ЗГТ)
- возраст матери к моменту рождения индивидуума
- полный отказ от алкоголя или злоупотребление им
Защитными считаются следующие факторы:
- интеллектуальная работа, высокий уровень образования
- ежедневное употребление чая и кофе
- умеренное употребление алкоголя
Продолжительность жизни пациентов с момента постановки диагноза в среднем составляет 6–8 лет, но может варьироваться от 2 до 20 лет. Менее 3 % пациентов остаются в живых более четырнадцати лет. Первым симптом болезни Альцгеймера становится нарушение памяти. Сначала страдает запоминание нового материала, а профессиональная память нарушается в последнюю очередь. Снижается работоспособность, сужается круг интересов, появляется выраженная эмоциональная лабильность, тревожность, мнительность и некоторая расторможенность.
Позже присоединяются нарушения речи. Страдает в первую очередь понимание обращенной речи, способность же повторять слова и предложения сохраняется длительно. Кроме того, пациенты затрудняются называть предметы. Постепенно теряется навык осмысленного речевого общения, могут возникнуть эхолалии, палилалия или мутизм. Прогрессивно нарушаются праксис, гнозис и другие познавательных функции, изменяется личность, могут развиться аффективные расстройства и психозы (галлюцинации, бред).
Эхолалия — неконтролируемое автоматическое повторение слов, услышанных в чужой речи.
Паллилалия — болезненная потребность человека повторять некоторые слова или предложения.
Мутизм — отказ от речевого общения при отсутствии органических поражений речевого аппарата.
В финальной стадии больные утрачивают способность к самообслуживанию, дезориентированы в пространстве и времени — по сути, тотально слабоумны. Нередки неврологические симптомы: нарушение ходьбы, ригидность, брадикинезия, миоклонии, судорожные припадки, спастическая параплегия со сгибательной контрактурой ног. На терминальной стадии вследствие гипокинезии у пациентов возможно развитие сепсиса, урологических воспалительных заболеваний, аспирационной пневмонии, что может служить непосредственной причиной летального исхода. Неблагоприятные прогностические факторы, которые могут указывать на быстрое развитие болезни: экстрапирамидные нарушения (ригидность, брадикинезия, гипомимия, тремор покоя, а также нарушения ходьбы — шаркающая походка, ахейрокинезия, трудности поворотов).
У пациентов с пресенильным типом заболевания длительно сохраняются основные личностных особенностей, присутствует чувство собственной неполноценности или измененности и адекватное эмоциональное реагирование на болезнь. Типично медленное развитие болезни на инициальном и быстрое прогрессирование на этапе клинически выраженной деменции. Также для них характерно наличие богатой неврологической симптоматики.
В независимости от типа БА, в течение выделяют три стадии:
На стадии мягкой деменции пациент
Примерно у четверти пациентов на этой стадии имеются бредовые расстройства в виде эпизодических бредовых идей ущерба, воровства, реже — идей отношения, преследования или ревности.
На стадии умеренной деменции пациент
На стадии тяжелой деменции пациент
Увы, сегодня не существует лечения, которое могло бы предотвратить или существенно замедлить прогрессирование БА. Вот основные направления терапии и препараты.
2. Нейропротективная терапия помогает сохранять нейроны жизнеспособными, и должна применяться на начальных этапах болезни. Используют: а) антиоксиданты (витамин Е, экстракт гинкго билоба) — эффективнее на додементной стадии б) препараты с нейротрофическими свойствами (церебролизин) в) нейропротекторы (ницерголин)
Использование ноотропов (пирацетама, пиридитола) — препаратов, улучшающих церебральный метаболизм — не дало достоверных позитивных результатов при лечении больных БА. Применение больших доз нередко приводит к быстрому прогрессированию деменции (после кратковременного улучшения когнитивных функций). Этот эффект объясняется нейротрансмиттерным истощением холинергических структур после их чрезмерной стимуляции большими дозами ноотропов.
Гаврилова С. И., Жариков Г. А. Лечение болезни Альцгеймера // Психиатрия и психофармакотерапия Том 3/N 2/2001
4. Новые веяния в терапии БА Сегодня для лечения синдрома Альцгеймера начинают применять НПВС. Небольшое клиническое испытание индометацина показало, что у больных БА, получавших его в течение 6 месяцев, отмечалась стабилизация состояния, тогда как в группе больных, получавших плацебо, за этот период отмечено ухудшение по ряду параметров. Кроме того, опубликованные в 2004 году результаты клинических испытаний Национального института здоровья (National Institutes of Health (NIH)) селективных ингибиторов ЦОГ-2 (рофекоксиб, целекоксиб) показали, что они также обладают протективным действием и в то же время дают меньше нежелательных явлений, чем неселективные. Пока невозможно сказать, будут ли селективные НПВС столь же эффективны при БА, как неселективные.
Заместительная гормональная терапия — это доказанный фактор защиты от развития БА, однако она может иметь ряд серьезных осложнений (тромботические и онкологические). Сейчас только проверяется безопасность и эффективность ЗГТ при БА В стадии разработки находятся антиамилоидные стратегии терапии. Они развиваются по двум основным направлениям. Первое из них нацелено на нейтрализацию нейротоксических свойств b-амилоидных отложений посредством введения специальных лигандов или протеаз. Второе — на снижение продукции b-амилоида за счет ингибиторов ферментов синтеза амилоида.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Читайте также:


