Болезнь альцгеймера и глаукома

Ключевую роль в развитии обеих заболеваний играет один и тот же протеин
Британские ученые, сообщение об исследовании которых публикует журнал Proceedings of the National Academy of Sciences, пришли к выводу, что протеин, бета-амилоид, играющий ключевую роль в развитии заболевания, при котором ухудшаются умственные способности человека, также является причиной повреждения нервных клеток глаза при слепоте, вызванной глаукомой.
Глаукомой страдают около 65 млн человек по всему миру, но ученые не знают, что именно вызывает это заболевание. В большинстве случаев лечение глаукомы сводится к попыткам снизить глазное давление, однако 30% пациентов подобная терапия не помогает.
Кордейро надеется, что эксперименты, которые проводят сейчас ученые на лабораторных крысах, однажды помогут выработать альтернативную методику лечения людей. Она рассказала, что после обнаружения протеиновой связь между двумя заболеваниями, ученые составили комбинацию экспериментальных препаратов для лечения болезни Альцгеймера.
Использование этих препаратов позволило остановить смерть нервных клеток у крыс, больных глаукомой, и предполагается, что при сочетании нескольких методик лечения они покажут свою эффективность и при лечении болезни Альцгеймера, добавила Кордейро.
Одно из лекарств, Bapineuzumab, созданное ирландской фармацевтической компанией Elan Corp в партнерстве с американской фирмой Wyeth, уже проходит клинические испытания, и, по словам Кордейро, может выйти на рынок в ближайшие годы.
NAME] => URL исходной статьи [

Ключевую роль в развитии обеих заболеваний играет один и тот же протеин
Британские ученые, сообщение об исследовании которых публикует журнал Proceedings of the National Academy of Sciences, пришли к выводу, что протеин, бета-амилоид, играющий ключевую роль в развитии заболевания, при котором ухудшаются умственные способности человека, также является причиной повреждения нервных клеток глаза при слепоте, вызванной глаукомой.
Глаукомой страдают около 65 млн человек по всему миру, но ученые не знают, что именно вызывает это заболевание. В большинстве случаев лечение глаукомы сводится к попыткам снизить глазное давление, однако 30% пациентов подобная терапия не помогает.
Кордейро надеется, что эксперименты, которые проводят сейчас ученые на лабораторных крысах, однажды помогут выработать альтернативную методику лечения людей. Она рассказала, что после обнаружения протеиновой связь между двумя заболеваниями, ученые составили комбинацию экспериментальных препаратов для лечения болезни Альцгеймера.
Использование этих препаратов позволило остановить смерть нервных клеток у крыс, больных глаукомой, и предполагается, что при сочетании нескольких методик лечения они покажут свою эффективность и при лечении болезни Альцгеймера, добавила Кордейро.
Одно из лекарств, Bapineuzumab, созданное ирландской фармацевтической компанией Elan Corp в партнерстве с американской фирмой Wyeth, уже проходит клинические испытания, и, по словам Кордейро, может выйти на рынок в ближайшие годы.
Авторы
- Еричев В.П., д.м.н., профессор, зам. директора по научной работе;
- Панюшкина Л.А., аспирант.
Болезнь Альцгеймера — это прогрессирующее нейродегенеративное заболевание, характеризующееся расстройством памяти и когнитивной дисфункцией. Несмотря на большие успехи, достигнутые в понимании патофизиологии дегенеративного процесса при данной патологии, диагностика болезни Альцгеймера чрезвычайно сложна.
Основывается она на результатах нейропсихологического тестирования и данных дорогостоящих исследований, таких как магнитнорезонансная томография, однофотонная эмиссионная компьютерная томография или позитронноэмиссионная томография [1].
В патогенезе болезни Альцгеймера ведущую роль занимает потеря нейронов и синаптических связей в коре головного мозга и определенных субкортикальных областях. Результатом нейрональной гибели является атрофия височных и теменных долей, участков фронтальной коры и поясной извилины, приводящая к характерным расстройствам памяти и поведения [2].
Тем не менее уже на ранних стадиях заболевания у ряда пациентов наблюдаются расстройства, не связанные с деменцией. Обнаружение новых биомаркеров болезни Альцгеймера является актуальной задачей современных исследований. В настоящий момент пристальное внимание уделяется изучению зрительных расстройств, ассоциированных с болезнью Альцгеймера [3].
В литературе описаны случаи нарушения цветового зрения и контрастной чувствительности [4, 5], изменения показателей электрофизиологических исследований у пациентов с данным диагнозом [69]. Результаты морфологических исследований обнаруживают маркеры нейродегенеративного процесса на различных участках зрительного пути.
Так, в своей работе Rizzo [6] делает вывод о вовлечении в патологический процесс зрительной ассоциативной коры. R.A. Armstrong [10] доказал преимущественное расположение сенильных бляшек и нейрофибриллярных клубков, маркеров нейродегенерации, в специфических областях зрительной коры у пациентов с болезнью Альцгеймера, а именно в клиновидной и язычковой извилинах.
Впервые в 1986 г. в своей работе D.R. Hinton [11] обнаружил гистологическое подтверждение потери ганглиозных клеток сетчатки и дегенерации зрительного нерва у таких больных. Похожие результаты были получены и в других исследованиях [1214]. Эти работы послужили обоснованием природы зрительных расстройств у пациентов с болезнью Альцгеймера.
Исследование G.L. Trick [15] было посвящено изучению особенностей изменения полей зрения у пациентов с деменцией. В работе было проведено сравнение результатов автоматизированной компьютерной периметрии на аппарате Humphrey по программе 302 у 61 пациента с болезнью Альцгеймера и 61 добровольца из группы контроля.
Было показано снижение светочувствительности сетчатки в центральной зоне в 1й группе, которое коррелировало с тяжестью деменции. Интересно, что преимущественная локализация дефектов у этих пациентов наблюдалась в нижней части поля зрения. Для изолированной оценки функции магноцеллюлярных клеток зрительного пути D.A. Valenti [16] применил другой метод исследования поля зрения — периметрию с удвоенной пространственной частотой (FDTperimetry). В этой работе были также обнаружены нарушения светочувствительности сетчатки у пациентов с болезнью Альцгеймера по сравнению с группой контроля.
Особый интерес представляют исследования, посвященные изучению морфометрических параметров сетчатки и зрительного нерва. Результаты подавляющего большинства работ свидетельствуют об истончении сетчатки в макулярной зоне [17, 18] и истончении слоя перипапиллярных нервных волокон, обнаруживаемых при помощи оптической когерентной томографии и лазерной сканирующей поляриметрии [1926].
В нашем исследовании морфометрических параметров сетчатки и зрительного нерва методом оптической когерентной томографии, результаты которого были опубликованы ранее в 2013 г., нами не было обнаружено достоверной разницы в толщине перипапиллярных нервных волокон у пациентов с болезнью Альцгеймера и группой контроля [27]. Однако разница в толщине сетчатки в центральной зоне была статистически достоверной в этих двух группах.
Кроме того, была выявлена диффузная потеря ганглиозных клеток сетчатки, проявлением которой стало повышение параметра GLV (уровень глобальных потерь ГКС). Таким образом, до сих пор остается спорным вопрос о диагностической ценности обнаруживаемых маркеров нейродегенеративного процесса у пациентов с болезнью Альцгеймера при офтальмологическом обследовании.
Цель исследования — оценить диагностическую ценность морфофункциональных и морфометрических показателей, характеризующих состояние сетчатки и диска зрительного нерва (ДЗН) у пациентов с болезнью Альцгеймера (стадия мягкой деменции), с помощью компьютерной статической периметрии и оптической когерентной томографии.
Материалы и методы
Обследованы 17 пациентов (34 глаза) с болезнью Альцгеймера, в возрасте от 59 до 82 лет (средний возраст 71 год). Критериями исключения были выбраны: острота зрения ниже 0,6, наличие тяжелой офтальмологической патологии (зрелой катаракты, возрастной макулярной дистрофии, глаукомной оптической нейропатии и другой патологии, непосредственно влияющей на состояние сетчатки и зрительного нерва).
Каждому пациенту проводили стандартное комплексное офтальмологическое обследование, включавшее визометрию, компьютерную статическую периметрию на анализаторе поля зрения Humphrey Field Analiser II (HFA II) 750i (Германия) с использованием скрининговой и пороговой программ, биомикроскопию, офтальмоскопию, тонометрию по Гольдману. Морфометрические параметры диска зрительного нерва и сетчатки оценивали с помощью оптической когерентной томографии (ОКТ) сетчатки и зрительного нерва на аппарате RTVue100 (Optovue, США).
Результаты и обсуждение
Из 17 пациентов с диагнозом болезнь Альцгеймера лишь 13 удалось выполнить исследование поля зрения. Несмотря на обстоятельное объяснение, 4 пациента не поняли поставленную перед ними задачу. Для оценки достоверности исследования применяли стандартные критерии: оценивали процент потерь фиксации взора, ложноотрицательных и ложноположительных ответов.
Исходя из этих критериев, у 4 пациентов результаты исследования полей зрения были признаны недостоверными: во всех случаях были высокими процент потерь фиксации взора (>5/20) и показатель ложноотрицательных ответов, который достигал 3040%. Полученные наблюдения могут свидетельствовать о недостаточном понимании задачи исследования и быстрой потере внимания у пациентов с деменцией.
Таким образом, анализу были подвергнуты результаты компьютерной периметрии 9 пациентов (18 глаз). При исследовании поля зрения по пороговой программе 302 было обнаружено диффузное снижение светочувствительности центральной области у пациентов с болезнью Альцгеймера (медиана значений суммарной светочувствительности сетчатки в центральной зоне — 1807 дБ). Значения индексов MD и PSD незначительно отклонялись от нормальных значений (медианы 2,75 и 4,1 дБ соответственно).
Интересно, что в каждом результате исследования поля зрения выявлялась концентрическая депрессия светочувствительности как тотальная, так и локальная (очаговая), по периферии исследуемой области.
При исследовании поля зрения по пороговой программе 604 также наблюдалось дугообразное или кольцевидное сужение поля зрения до 5040°, чаще в верхне и нижненазальном секторах. Обращал на себя внимание факт наличия области с нормальной светочувствительностью в пределах 3040°, окруженный участками поля зрения со сниженной светочувствительностью, при сопоставлении результатов исследования периферического и центрального полей зрения.
При исследовании поля зрения по скрининговой программе (120 Three Zone) у 5 пациентов с болезнью Альцгеймера не было обнаружено существенных дефектов. У 4 пациентов наблюдалось незначительное число абсолютных и относительных скотом, локализующихся на крайней периферии поля зрения в верхне и нижненазальном секторах (рис. 1).
Во всех случаях результаты исследования поля зрения по скрининговой программе не совпадали с пороговым исследованием. Анализируя полученные результаты, можно сказать, что оценка светочувствительности центрального и периферического полей зрения с помощью пороговых программ 302 и 604 у пациентов с болезнью Альцгеймера затруднена.
Продолжительность исследования составляет около 30 минут, и большинству пациентов с трудом удается концентрировать внимание для выполнения задачи в течение этого времени. В результате мы наблюдаем большое количество потерь фиксации взора и высокий процент ложноотрицательных ошибок, что ставит под сомнение достоверность полученных результатов.


Рис. 1. Пациент Б., 73 года, с диагнозом болезнь Альцгеймера, мягкая деменция. Результаты исследования поля зрения с помощью статической компьютерной периметрии по пороговым программам: А — 302; Б — 604.
При исследовании поля зрения по скрининговой программе 120 Three Zone у этого пациента не было выявлено абсолютных или относительных скотом

Рис. 2. Протокол исследования комплекса ГКС у пациентки С., 71 год, с диагнозом болезнь Альцгеймера. Средняя толщина комплекса ГКС соответствует нормальным значениям. Параметр GLV — пограничный
Кроме того, противоречивость и несоответствие локализации скотом, определяемых при исследовании по пороговой и скрининговой программам, не позволяет выявить наиболее типичные дефекты поля зрения у пациентов с болезнью Альцгеймера, как было описано в некоторых статьях [15, 16]. Интересно, что при динамическом наблюдении через 36 месяцев у большинства пациентов наблюдали повторяемость результатов исследования поля зрения.
Для уточнения полученных результатов и оценки морфометрических параметров сетчатки и зри тельного нерва всем пациентам была выполнена оптическая когерентная томография сетчатки на аппарате RTVue100. Проводили оценку толщины сетчатки в центральной области по зональному стандарту ETDRS (фовеа, пара и перифовеа), оценку слоя перипапиллярных нервных волокон и параметров средней толщины комплекса ганглиозных клеток сетчатки (ГКС), включая показа телифокальных и глобальных потерь (FLV и GLV соответственно).


Рис. 3. Результаты исследования поля зрения по пороговой программе 30-2 и протокол исследования комплекса ГКС у пациентки К., 70 лет, с диагнозом болезнь Альцгеймера (мягкая деменция)
По полученным нами ранее данным [27], при сравнении с группой контроля была выявлена статистически достоверная разница толщины сетчатки в центральной области у пациентов с болезнью Альцгеймера. Уменьшение толщины сетчатки у этих пациентов было диффузным и наблюдалось во всех секторах. Однако следует отметить, что в абсолютном большинстве наблюдений параметры толщины сетчатки в центральной области находились в зеленом спектре и в сравнении с нормативной базой прибора не отличались от нормы. Аналогичные результаты были получены при сравнении средней толщины комплекса ганглиозных клеток сетчатки.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
1. Еричев В.П., Туманов В.П., Панюшкина Л.А. Глаукома и нейродегенеративные заболевания. Национальный журнал глаукома 2012; 1: 62-68
2. Еричев В.П., Туманов В.П., Панюшкина Л.А. и др. Сравнительный анализ морфологических изменений в зрительных центрах при первичной глаукоме и болезни Альцгеймера. Национальный журнал глаукома 2014;3: 5-13
3. Gupta N., Yucel Y.H. Glaucoma as a neurodegenerative disease. Curr Opin Opthalmol 2007; 18(2): 110-114. doi: 10.1097/icu.0b013e3280895aea.
4. McKinnon S.J. Glaucoma: ocular Alzheimer’s disease? Frontiers in Bioscience 2003; 8(1-3): 1140-1156. doi.org/10.2741/1172.
5. Аветисов С.Э., Киселева Т.Н., Лагутина Ю.М., Кравчук Е.А. Влияние вазоактивных препаратов на зрительные функции и глазной кровоток у больных с ранними проявлениями возрастной макулярной дегенерации. Вестник офтальмологии. 2007; 123(3): 26-28.
6. Еричев В.П. Дефицит глутатиона при открытоугольной глаукоме и подходы к его коррекции. Вестник офтальмологии 1992; 108(4-6): 13-15
7. Еричев В.П., Ганковская Л.В., Ковальчук Л.В., Ганковская О.А., Дугина А.Е. Интерлейкин-17 и его возможное участие в репа-ративных процессах при глаукоме. Глаукома 2009; 1: 23-25
8. Егорова И.В., Шамшинова А.М., Еричев В.П. Функциональные методы исследования в диагностике глаукомы. Вестник офтальмологии 2001; 117(6): 38-40
9. Борисова С.А., Никитин Ю.М., Еричев В.П. Ультразвуковое допплерографическое исследование кровотока в орбитальных сосудах у больных первичной глаукомой. Ультразвуковая и функциональная диагностика 1997; 2: 8-12
10. Куроедов А.В., Еричев В.П., Ходыкина Н.П., Городничий В.В. и др. О корреляционных взаимоотношениях между суточными колебаниями внутриглазного давления и морфометрической структурой диска зрительного нерва. Офтальмология 2006; 3(1): 43-49
11. Авдеев Р.В., Александров А.С., Бакунина Н.А., Басинский А.С. и др. Модель манифестирования и исходов первичной открытоугольной глаукомы. Клиническая медицина 2014; 92(12): 64-72
12. Еричев В.П., Козлова И.В., Макарова А.С., Цзинь Д. Особенности системной гемодинамики у больных первичной открытоугольной глаукомой, компенсированным внутриглазным давлением и нестабилизированным течением. Национальный журнал глаукома 2013; 3: 20-23
13. Еричев В.П., Петров С.Ю., Макарова А.С., Козлова И.В. и др. Современные методы функциональной диагностики и мониторинга глаукомы. Часть 2. Диагностика структурных повреждений сетчатки и зрительного нерва. Национальный журнал глаукома 2015; 14(3): 72-79
14. Астахов Ю.С., Рахманов В.В. Наследственность и глаукома. Офтальмологические ведомости 2012; 4: 51-57
15. Cronin-Golomb A., Corkin S., Rizzo J.F. et al. Visual dysfunction in Alzheimer's disease: relation to normal aging. Ann Neurol 1991; 29(1): 41-52. doi: 10.1002/ana.410290110.
16. Gilmore G.C., Whitehouse P.J. Contrast sensitivity in Alzheimer’s disease: a 1-year longitudinal analysis. Optometry Vis Sci 1995; 72(2): 83-91. doi: 10.1097/00006324-199502000-00007.
17. Pache M., Smeets C.H., Gasio P. et al. Colour vision deficiencies in Alzheimer's disease. Age Ageing 2003; 32(4): 422-426. doi: 10. 1093/ageing/32.4.422.
18. Granholm E., Morris S., Galasko D. et al. Tropicamide effects on pupil size and pupillary light reflexes in Alzheimer’s and Parkinson's disease. International J Psychophysiology 2003; 47(2): 95-115. doi: 10.1016/s0167-8760(02)00122-8.
19. Prettyman R., Bitsios P., Szabadi E. Altered papillary size and darkness and light reflexes in Alzheimer’s disease. J Neurology, Neurosurgery & Psychiatry 1997; 62(6): 665-668. doi: 10.1136/ jnnp.62.6.665.
20. Berisha F., Feke G.T., Trempe C.L. et al. Retinal abnormalities in early Alzheimer's disease. Invest Opthalmol Vis Sci 2007; 48(5): 2285-2289. doi: 10.1167/iovs.06-1029.
21. Blanks J.C., Torigoe Y., Hinton D.R. et al. Retinal pathology in Alzheimer’s disease. I. Ganglion cell loss in foveal/parafoveal retina. Neurobiol Aging 1996; 17(3): 377-384. doi: 10.1016/01974580(96)00010-3.
22. Danesh-Meyer H.V., Birch H., Ku J.Y. et al. Reduction of optic nerve fibers in patients with Alzheimer disease identified by laser imaging. Neurology 2006; 67(10): 1852-1854. doi: 10.1212/01.wnl.0000244490.07925.8b.
23. Iseri P.K., Altinas O., Tokay T. et al. Relationship between cognitive impairment and retinal morphological and visual functional abnormalities in Alzheimer’s disease. J Neuro-Ophthalmology 2006; 26(1): 18-24. doi: 10.1097/01.wno.0000204645.56873.26
24. Parisi V., Restuccia R., Fattapposta F. et al. Morphological and functional retinal impairment in Alzheimer's disease patients. Clin Neurophysiol 2001; 112(10): 1860-1867. doi: 10.1016/s1388-2457(01)00620-4.
25. Еричев В.П., Панюшкина Л.А., Фомин А.В. Оптическая когерентная томография сетчатки и зрительного нерва в диагностике болезни Альцгеймера. Национальный журнал глаукома 2013; 1: 5-10.
26. Quigley H.A., Addicks E.M., Green W.R. Optic nerve damage in human glaucoma. Quantitative correlation of nerve fiberloss and visual field defects in glaucoma, ischemic neuropathy, papilledema and toxic neuropathy. Arch Ophthalmol 1982; 100(1): 135-143. doi: 10.1001/archopht.1982.01030030137016
27. Trick G.L., Trick L.R., Morris P. et al. Visual field loss in senile dementia of the Alzheimer’s disease type. Neurology 1995; 45(1): 68-74. doi: 10.1212/wnl.45.1.68.
28. Valenti D.A. Alzheimer’s Disease: screening biomarkers using frequency doubling technology visual field. ISRN Neurology 2013; pp. 1-9. doi: 10.1155/2013/989583.
29. Шамшинова А.М., Волков В.В. Функциональные методы исследования в офтальмологии. М.: Медицина, 1998; 412 с.
30. Bach M., Speidel-Fiaux A. Pattern electroretinogram in glaucoma and ocular hypertension. Documenta Ophthalmologica 1989; 73(2): 173-181. doi: 10.1007/bf00155035.
31. Holder G.E. Significance of abnormal pattern electroretinography in anterior visual pathway dysfunction. Br J Ophthalmol 1987; 71(3): 166-171. doi: 10.1136/bjo.71.3.166.
32. Trick G.L. Visual dysfunction in normotensive glaucoma. Ophthalmologica 1993; 85(2): 125-133. doi: 10.1007/bf01371128.
33. Atkin A., Bodis-Wollner I., Podos S.M. et al. Flicker threshold and pattern VEP latency in ocular hypertension and glaucoma. Invest Ophthalmol Vis Sci 1983; 24: 1524-1528.
34. Parisi V. Impaired visual function in glaucoma. Clin Neurophysiol 2001; 112(2): 351-358. doi: 10.1016/s1388-2457(00)00525-3.
35. Шелудченко В.М., Ронзина И.А., Шеремет Н.Л. и др. Возможности современных методов электрофизиологического анализа при заболеваниях зрительного анализатора. Вестник офтальмологии 2013; 129(5): 43-52.
36. Шеремет Н.Л., Ронзина И.А., Галоян Н.С. и др. Современные методы исследования зрительного нерва при оптических нейропатиях различного генеза. Вестник офтальмологии 2011; 127(2): 15-18
37. Ruben S.T., Arden G.B., O’Sullivan F. et al. Pattern electroretinogram and peripheral color contrast thresholds in ocular hypertension and glaucoma: comparison and correlation of results. Br J Ophthalmol 1995; 79(4): 326-331. doi: 10.1136/bjo.79.4.326.
38. Ruben S.T., Hitchings R.A., Fitzke F. et al. Electrophysiology and psychophysics in ocular hypertension and glaucoma: evidence for different pathomechanisms in early glaucoma. Eye 1994; 8(5): 516-520. doi: 10.1038/eye.1994.128
39. Katz B., Rimmer S., Iragui V. et al. Abnormal pattern electroretinigram in Alzheimer’s disease: evidence for retinal ganglion cell degeneration? Ann Neurol 1989; 26(2): 221-225. doi: 10.1002/ ana.410260207.
40. Krasodomska K., Lubmski W., Potemkowski A. et al. electroretinogram (PERG) and pattern visual evoked potential (PVEP) in the early stages of Alzheimer’s disease. Documenta Ophthalmologica 2010; 121(2): 111-121. doi: 10.1007/s10633-010-9238-x.
41. Trick G.L., Barris M.C., Bicker M. Abnormal pattern electroretino-grams in patients with senile dementia of the Alzheimer type. Ann Neurol 1989; 26(2): 226-231. doi: 10.1002/ana.410260208.
42. Wright C.E., Harding G.F., Orwin A. The flash and pattern VEP as a diagnostic indicator of dementia. Documenta Ophthalmologica 1986; 62(1): 89-96. doi: 10.1007/bf00140551.
43. Parisi V., Restuccia R., Fattapposta F. et al. Morphological and functional retinal impairment in Alzheimer’s disease patients. Clin Neurophysiol 2001; 112(10): 1860-1867. doi: 10.1016/s13882457(01)00620-4.
44. Partanen J., Hartikainen P., Könönen M. et al. Prolonged latencies of pattern reversal visual evoked early potentials in Alzheimer’s disease. Alzheimer Disease & Associated Disorders 1994; 8(4): 250-258. doi: 10.1097/00002093-199408040-00004.
45. Pollock V.E., Schneider L.S., Chui H.C. et al. Visual evoked potentials in dementia: a meta-analysis and empirical study of Alzheimer’s disease patients. Biological Psychiatry 1989; 25(8): 1003-1013. doi: 10.1016/0006-3223(89)90288-6.
46. Kergoat H., Kergoat M.J., Justino L. et al. Visual retinocortical function in dementia of the Alzheimer type. Gerontology 2002; 48(4): 197-203. doi: 10.1159/000058350.
Еричев В.П., Панюшкина Л.А., Ронзина И.А. Диагностическое значение статической периметрии и электрофизиологических исследований при глаукоме и болезни Альцгеймера. Национальный журнал глаукома. 2016;15(2):11-18.
Erichev V.P., Panyushkina L.A., Ronzina I.A. Comparative analysis and diagnostic value of static perimetry and electrophysiological studies in glaucoma and Alzheimer’s disease. National Journal glaucoma. 2016;15(2):11-18. (In Russ.)

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
1. Thies W., Bleiler L. Alzheimer’s disease facts and figures. Alzheimers Dement. 2011;7(2):208-244. DOI:10.1016/j. jalz.2011.02.004
2. Гаврилова С.И., Калын Я.Б. Социально-средовые факторы и состояние психического здоровья пожилого населения (клинико-эпидемиологическое исследование). Вестник РАМН. 2002;(9):15-20
4. Scholl H.P.N., Massof R.W., West S., eds. Ophthalmology and the Ageing Society. Berlin, Heidelberg: Springer Berlin Hei- delberg; 2013. DOI:10.1007/978-3-642-36324-5
5. Bayer A.U., Ferrari F., Erb C. High occurrence rate of glau- coma among patients with Alzheimer’s disease. Eur. Neurol. 2002;47(3):165-168. DOI:47976
6. Ou Y., Grossman D., Lee P., Sloan F. Glaucoma, Alzheimer`s disease and other dimentia: longitudinal analysis. Ophtal- mic. Epidemiol. 2012;19(5):285-292. DOI:10.3109/09286 586.2011.649228.Glaucoma
7. Ghiso J.A. Alzheimer’s disease and glaucoma: mechanistic similarities and differences. J. Glaucoma. 2013;22 Suppl. 5(5):S36-S38. DOI:10.1097/IJG.0b013e3182934af6
9. Jack C.R., Albert M.S., Knopman D.S. et al. Introduction to the recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 2011;7(3):257-262. DOI:10.1016/j.jalz.2011.03.004
16. Mills R.P., Budenz D.L., Lee P.P. et al. Categorizing the stage of glaucoma from pre-diagnosis to end-stage disease. Am. J. Ophthalmol. 2006;141(1):24-30. DOI:10.1016/j. ajo.2005.07.044
17. Kesler A., Vakhapova V., Korczyn A.D., Naftaliev E., Neu- dorfer M. Retinal thickness in patients with mild cogni- tive impairment and Alzheimer’s disease. Clin. Neurol Neurosurg. 2011;113(7):523-526. DOI:10.1016/j.clineu- ro.2011.02.014
18. Paquet C., Boissonnot M., Roger F., Dighiero P., Gil R., Hu- gon J. Abnormal retinal thickness in patients with mild cog- nitive impairment and Alzheimer’s disease. Neurosci. Lett. 2007;420(2):97-99. DOI:10.1016/j.neulet.2007.02.090
19. Marziani E., Pomati S., Ramolfo P. Evaluation of retinal nerve fiber layer and ganglion cell layer thickness in Alzheimer ’ s disease using spectral- domain optical coherence tomog- raphy. IOVS. 2013
21. Garcia-Martin E., Bambo M.P., Marques M.L. et al. Ganglion cell layer measurements correlate with disease severity in patients with Alzheimer’s disease. Acta Ophthalmol. Febru- ary 2016. DOI:10.1111/aos.12977
23. Garcia Martin E., De Hoz R., Rojas B., Gil P., Yubero R., Ramirez J. Macular nerve-fiber-layer measurement in early stage Alzheimer’s disease using optical coherence tomogra- phy. Acta Ophthalmol. 2013;91(s252). DOI:10.1111/j.1755- 3768.2013.3771.x
24. Herrera L., Cuze N., Zabadani K. et al. Optical coherence tomography as a progression marker in mild cognitive impairment and Alzheimer´s disease. Acta Ophthalmol. 2013;91(s252). DOI:10.1111/j.1755-3768.2013.F078.x
26. Kanaan N.M., Pigino G.F., Brady S.T., Lazarov O., Binder L.I., Morfini G.A. Axonal degeneration in Alzheimer’s disease: when signaling abnormalities meet the axonal transport system. Exp. Neurol. 2013;246:44-53. DOI:10.1016/j.ex- pneurol.2012.06.003
27. Bertuzzi F., Benatti E., Esempio G., Rulli E., Miglior S. Evalu- ation of Retinal Nerve Fiber Layer Thickness Measurements for Glaucoma Detection: GDx ECC Versus Spectral-domain OCT (RTVue). J. Glaucoma. August 2013. DOI:10.1097/ IJG.0b013e3182741afc
28. Williams P.A., Thirgood R.A., Oliphant H. et al. Retinal gan- glion cell dendritic degeneration in a mouse model of Alz- heimer’s disease. Neurobiol. Aging. 2013;34(7):1799-1806. DOI:10.1016/j.neurobiolaging.2013.01.006
Акопян В.С., Гаврилова С.И., Семенова Н.С., Федорова Я.Б., Гурова Е.В. Нейродегенеративные изменения сетчатки при болезни Альцгеймера, синдроме мягкого когнитивного снижения и глаукоме. ПСИХИАТРИЯ. 2016;(72):33-40.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Глаукома — одна из наиболее важных медико-социальных проблем современной офтальмологии. Это заболевание занимает одно из ранговых мест среди причин необратимой слепоты и слабовидения. По данным H. Quigly, общее число больных глаукомой в мире к 2020 г. возрастет с 60 до 80 млн человек, а слепота вследствие этого заболевания увеличится с 8,4 до 11,2 млн человек. В России доля глаукомы в нозологической структуре слепоты и слабовидения возросла за 5 лет с 14 до 29% (Либман Е.С. с соавт.).
Столь угрожающая статистика свидетельствует о серьезных трудностях, связанных как с пониманием природы, так и с диагностикой и лечением этого заболевания.
Долгое время глаукому рассматривали лишь как глазное заболевание, основным фактором риска которого является повышенное внутриглазное давление. И действительно, в патогенезе глаукомы ведущую роль занимает гибель ганглиозных клеток сетчатки и их аксонов под воздействием высокого ВГД.
Однако, несмотря на эффективные терапевтические и хирургические методы, направленные в основном на нормализацию внутриглазного давления, у каждого пятого пациента с глаукомой продолжается распад зрительных функций, что является неопровержимым свидетельством глаукомы как многофакторного заболевания. На настоящий момент неоспоримым становится факт существования механизмов развития глаукомной оптической нейропатии (ГОН), независящих напрямую от уровня внутриглазного давления. Основные механизмы прогрессирования ГОН (механическая, сосудистая, метаболическая, аутоимунная) усматривают некоторые общие признаки с нейродегенеративными заболеваниями.
Магноцеллюлярный путь обеспечивает регистрацию движения объектов, восприятие пространственной глубины и определение пространственных отношений. Нейроны этого пути проецируются на 1 и 2 слои НКТ. Парвоцеллюлярный путь служит для анализа информации о контурах объекта и линейной ориентации его деталей, а также для формирования зрительного представления о цвете объекта, а именно отвечает за информацию об оттенках красного и зеленого цветов. Формируют этот проводящий путь нейроны 3-6 слоев НКТ. Кониоцеллюлярный путь отвечает за сине-желтый процессинг. Его нейроны располагаются между 1 и 2 , 2 и 3 слоями, а также в S-слое кпереди от 1 слоя.
Слои 1, 4 и 6 НКТ получают афферентные импульсы от контрлатерального глаза, а слои 2, 3 и 5 — от ипсилатерального глаза.
В наружном коленчатом теле выделяют две популяции нейронов — вставочные и проводящие. Аксоны первых оканчиваются в самом НКТ, а аксоны вторых идут к первичной зрительной коре.
В литературе появляются единичные сведения, рассматривающие глаукому как заболевание, занимающее некое промежуточное положение между неврологической и офтальмологической патологией. Современные исследования обнаруживают сходство между глаукомой и нейродегенеративными заболеваниями, в частности болезнью Альцгеймера.
Уже в общепринятых определениях болезни Альцгеймера и ПОУГ можно найти много общего.
ПОУГ — это хроническая прогрессирующая оптическая нейропатия, которая объединяет группу заболеваний с характерными морфологическими изменениями головки зрительного нерва (экскавация) и слоя нервных волокон сетчатки при отсутствии другой офтальмопатологии и врожденных аномалий. Для данного заболевания характерны прогрессирующая гибель нейронов сетчатки и возникновение дефектов поля зрения.
Болезнь Альцгеймера — это хроническое, прогрессирующее нейродегенеративное заболевание, характеризующееся расстройством памяти и когнитивной дисфункцией. В патогенезе заболевания ведущую роль занимает гибель нейронов и синаптических связей в коре головного мозга и определенных субкортикальных областях.
Интересны и другие факты. По данным A.U. Bayer (2002), частота встречаемости глаукомы у пациентов с болезнью Альцгеймера составляет 25,9%, в то время как в контрольной группе этот показатель равен 5,2%. Обнаружены дефекты полей зрения у пациентов с болезнью Альцгеймера, напоминающие картину глаукомного поражения зрительных функций (Trick G.L., 1995). В опубликованных исследованиях описаны и некоторые общие механизмы развития этих двух заболеваний.
Все нейродегенеративные заболевания объединяют несколько общих признаков: тенденция к прогрессированию с медленной потерей функций; селективная потеря определенных популяций нейронов в результате апоптоза; транссинаптическая дегенерация (первичная, вторичная); общие механизмы клеточной смерти — оксидативный стресс и глутаматная токсичность.
Болезнь Альцгеймера характеризуется гибелью нейронов в результате апоптоза и потерей синаптических связей в коре головного мозга и определенных субкортикальных областях, что в свою очередь приводит к выраженной атрофии и дегенерации височных и теменных долей.
Гибель ГКС при глаукоме, по данным H.A. Quigley, также происходит в результате апоптоза. Повышенное ВГД приводит к деформации перегородок решетчатой пластинки, что вызывает компрессию аксонов ганглиозных клеток.
В результате снижения аксоплазматического тока и ретроградного аксонального транспорта нарушается поступление нейротрофических факторов к телу ГКС. Их недостаток запускает механизм апоптоза. Апопотоз в этом случае идентифицирован по следующим специфическим признакам: конденсации хроматина, дроблению геномной ДНК, обнаружению апоптозных телец.
Современные методики позволяют наблюдать это процесс in vivo. Так профессором Cordeiro (2004) был разработан метод DARC (detection of apoptosing retinal cells) (рис. 1). С помощью лазерного офтальмоскопа и флуоресциновой метки можно прижизненно наблюдать свечение ГКС, находящихся в стадии апоптоза.
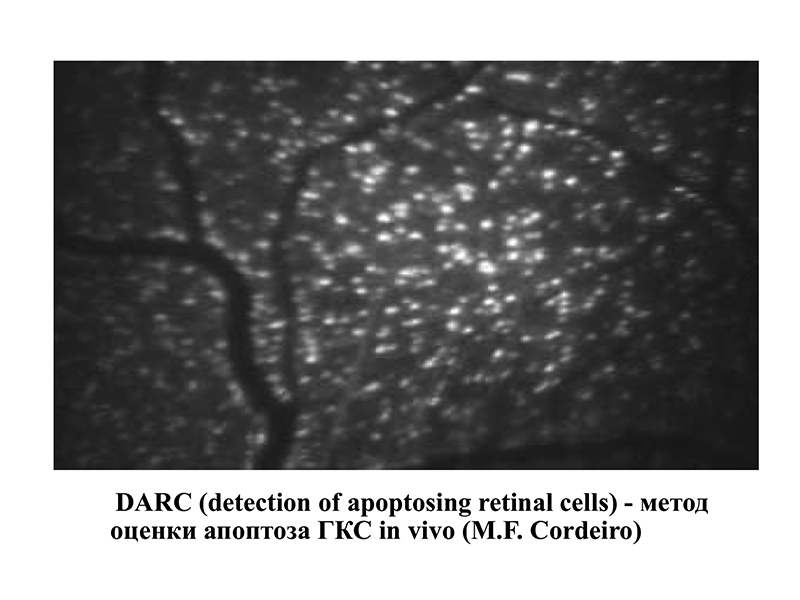
Апоптоз — запрограммированная гибель клетки, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении наружной и цитоплазматической мембран без выхода ее содержимого в окружающую среду. Ключевую роль в индукции апоптоза играет активация каспаз-ферментов, расщепляющих белки по остаткам аспартата. При взаимодействии инициирующих и эффекторных каспаз запускается каскад реакций, в результате которого происходит деструкция белков цитоскелета и регуляторных белков ядра, разрушаются структурные белки ядра — происходит фрагментация ДНК. При изучении образцов головного мозга больных, умерших от болезни Альцгеймера, обнаружен более высокий уровень активированных каспаз в клетках микроглии. В экспериментальной модели глаукомы у крыс также обнаружено повышение концентрации активированных каспаз: каспазы-3 и каспазы-8. Каспаза-3 — главный эффектор апоптического каскада — активируется в ГКС и расщепляет АРР (англ. Amyloid Precursor Protein) до нейротоксических фрагментов, включающих в себя -амилоид. Каспаза-8 принимает участие в апоптозе посредством активации рецепторов к фактору некроза опухоли (рис. 2).
Читайте также:


