Что такое рак симпатической нервной системы





- Здоровье
- Статьи
- Медицина
- Форум
- Rating
- Full Article
- Comments

Приведем данные, освещающие зависимость между состоянием вегетативной нервной системы, иммунологической реактивностью и раком. Стейн-Вербловский в экспериментах на крысах линии Вистар обнаружил, что клетки трансплантированной опухоли, которые ранее росли в любых участках тела, обработанные фосфорилхолином и привитые в те же участки, отторгались.
Такой паралич может способствовать развитию спонтанных, индуцированных или трансплантированных опухолей. Высокая заболеваемость раком легкого среди курящих сигареты может объясняться первичным действием никотина (не являющегося канцерогеном), который специфически блокирует симпатические ганглии и вызывает, по данным Холта, депрессию локального иммунитета в респираторном тракте. Вторичным, собственно канцерогенным фактором в этом процессе выступает бензпирен, содержащийся в табачной смоле.
Таким образом, роль вегетативной нервной системы проявляется в создании в организме условий, препятствующих или, напротив, способствующих развитию опухолевого процесса. Очевидно, что основной задачей исследований в указанной области должно явиться изучение конкретных механизмов влияния нервной системы на формирование противоопухолевой резистентности, а также возможности управления этими механизмами.
Важным звеном в изучении роли нервной системы в злокачественном процессе было установление характера иннервации опухолей. С помощью морфологических и электрофизиологических исследований функционального состояния периферических нервов при опухолевом процессе было установлено поражение преимущественно афферентной иннервации в опухолевой ткани.
Разработана методика регистрации токов действия периферических нервных проводников в хроническом опыте на кроликах, с помощью которой изучали афферентную импульсацию большого чревного нерва при внутривенной трансплантации опухоли Брауна-Пирс и большеберцового нерва — при росте и рассасывании этой опухоли, привитой внутримышечно. В первые дни после прививки опухоли наблюдалось повышение частоты импульсации в большом чревном нерве, по-видимому вследствие интенсивного раздражения рецепторов внутренних органов. В период прогрессивного роста опухоли частота импульсации значительно снижалась, что следует объяснить ухудшением функционального состояния нервных элементов в пораженных опухолью органах брюшной полости. Частота афферентной импульсации большеберцового нерва при внутримышечно привитой опухоли Брауна-Пирс существенно снижалась в период прогрессивного роста и восстанавливалась при рассасывании новообразования. Снижение частоты афферентной импульсации в исследованных нервах в период прогрессивного роста опухоли свидетельствует о существенном изменении информационного потока, поступающего в центральную нервную систему из области роста опухоли.
Говоря о влиянии опухоли на нервную систему, нельзя не остановиться на чрезвычайно интересном факте, обнаруженном при исследовании процесса новообразования нервных волокон, иннервирующих быстро растущую ткань. Имплантация мышиной саркомы 180 двухдневному куриному зародышу вызывала стимуляцию роста симпатических и чувствительных волокон. Исследованиями Леви-Монтальчини было установлено, что опухоль содержит фактор, который избирательно стимулирует рост симпатических и чувствительных нервных волокон. Этот фактор является нуклеопротеидом с молекулярным весом 44 000. Леви-Монтальчини и Ангелетти приготовили сыворотку, содержащую антитела против этого фактора, которая при введении новорожденным животным полностью подавляла рост симпатической цепочки. Производилась, таким образом, иммуносимпатэктомия. Как ни странно, этому феномену не уделено надлежащего внимания в исследованиях онкологов.
В процессе злокачественного роста происходят выраженные изменения в медиаторном звене нервной системы. В период прогрессивного роста новообразований наблюдается снижение концентрации в крови и тканях ацетилхолина, активности холинэстеразы, уменьшение содержания в крови норадреналина и дофамина, что свидетельствует о понижении тонуса симпато-адреналовой системы в организме-опухоленосителе. Последнее подтверждается исследованиями В. С. Шевелевой, в которых были использованы специальные тесты на функциональную активность симпато-адреналовой системы.
Автор приводит данные о том, что нарушение тонуса симпатической нервной системы при злокачественных опухолях сказывается и на фагоцитарной функции лейкоцитов крови. Ранее была установлена зависимость фагоцитарной активности лейкоцитов крови здоровых людей от влияния нервной системы. У здоровых людей адреналин усиливает фагоцитарную активность, а ацетилхолин снижает ее. У онкологических больных после введения адреналина наблюдается снижение фагоцитарной активности лейкоцитов крови. Приведенное указывает на глубокие нарушения регулирующих функций вегетативной нервной системы при злокачественном процессе, приводящие к качественно иным реакциям клеток иммунокомпетентной системы, а частности макрофагов.
Анализируя приведенные выше данные о влиянии различных отделов нервной системы на опухолевый процесс и иммунологическую реактивность организма, можно отметить достаточно четкую закономерность: в случаях, когда изменения деятельности центральной нервной системы (в результате стресса, эмоционального напряжения) или вегетативной (хирургическая, фармакологическая либо иммунологическая симпатэктомия) сопровождаются снижением иммунологической реактивности, наблюдается повышение выхода спонтанных или индуцированных злокачественных новообразований и стимуляция опухолевого роста. И напротив, когда воздействия на нервную систему приводят к активации функции иммунокомпетентной системы, происходит повышение противоопухолевой резистентности и торможение роста опухолей.
Опухоли адреналовой и симпатической нервной системы являются типичными для детей раннего возраста. Они встречаются чаще до 2 лет и в основном оказываются врожденными, эмбриональными по строению. Чаще они выявляются по одному очагу, но иногда оказываются множественными образованиями. Опухоли такого рода ведут себя разнообразно: они могут не давать роста, расти медленно или быстро прогрессировать и обусловливать генерализацию процесса. Для данного вида опухолей характерна быстрая реакция на лечение, т. е. очень быстрое уменьшение в размерах. У отдельных больных при этом возможен переход от злокачественной формы опухоли типа симпатогониомы к доброкачественной ганглионевроме. Это обстоятельство делает их перспективными для лечения и требует большого внимания и вдумчивого, настойчивого лечения с поисками различных методов воздействия.
Понимание особенностей строения и роста этих опухолей шло извилистым путем. Их часто ошибочно расценивают как саркому, хотя уже в начале XIX века некоторые авторы определяли их правильно как неврогенные опухоли. В 1858 г. Вирхов дал классификацию неврогенных опухолей, разделив их на истинно неврогенные опухоли, ложные невриномы и фибриллярные. Лишь истинные невриномы развиваются из нервной ткани, остальные опухоли имеют в основе соединительную ткань. Правда, точное разграничение данных опухолей гистологически не всегда удается.
Долгое время это заболевание отождествлялось с болезнью Реклингхаузена - нейрофиброматозом, который выражается развитием кожных узелков, образующихся в результате пролиферации соединительной ткани из периневрия и глиальной ткани вместе с мышечными элементами.
В 1910 г. Reit доказал происхождение глиом из клеток этого же ряда, связывая это явление с ранней стадией развития симпатической системы, но не топографически, а генетически.
Различают образование из этих клеток опухолей типа симпатогониомы, симпатобластомы и симпатической ганглионевромы, что зависит от того, на каком этапе эмбрионального созревания клеток возник их опухолевый рост. В опухолях симпатического вида возможно сочетание разных производных в силу большой плюрипотенции симпатогониев: невробластомы и феохромоцитомы, невробластомы и симпатогониомы и др.
По современным данным, принято считать, что эти опухоли формируются следующим образом: 1) из нервных волокон, имеющих шванновские клетки (невриномы, невролеммомы, шванномы), синонимами их являются следующие названия: шванноглиома, леммобластома, параневральная фибробластома; А. П. Авцын считает более правильным называть их невриномами или шванномами. Указанные доброкачественные опухоли в любом возрасте состоят из шванновского синтиция и имеют вид ретикулярной структуры; 2) из ткани нервных узлов, которые имеют в основе симпатические и ганглиозные клетки, происходят ганглионевромы, симпатикобластомы, симпатогониомы; 3) из параганглиозных структур, из хромаффиновых клеток происходят феохромоцитомы, феохромобластомы. Из всех этих опухолей 30% оказываются злокачественными, до 50% из них являются врожденными.
Эмбриональные клетки этой системы образуются у плода на 5-й неделе внутриутробной жизни. Нарушение правильного порядка созревания клеток и их слабая дифференциация приводят к разрастанию незрелых эмбриональных клеток, зачатков нервной системы и к переходу их в злокачественные опухоли.
Важно отметить, что если начало формирования симпатогониев относят к эмбриональному периоду, то конец их формирования, по данным гистологического исследования, относят к 10 годам. Считается, что до 10 лет имеет место активное состояние симпатогониев и возможность возникновения из них опухолевых образований; однако оно возможно и в более позднем возрасте. При наличии опухоли исследование различных узлов симпатической нервной системы позволяет выявить одновременно различные фазы развития одной и той же опухоли.
Гистологическая картина неврогенных опухолей разнообразна: клетки опухоли оказываются незрелыми, неоднородными, обнаруживаются малые, лимфоцитоподобные круглые клетки с четко очерченными ядрами, богатыми зернами хромаффина. Без дополнительной окраски нервных волокон серебром они могут быть приняты за клетки опухоли Юинга, первичную ретикулосаркому, остеогенную саркому и др. Между клетками имеются нежные нервные волокна. Васкуляризация опухолей может быть чрезвычайно выраженной, возможны кровоизлияния, некрозы и обызвествления. Такой характер опухоли обусловливает ошибки диагностики.
Помимо круглых клеток, характерны для этого вида опухолей нежные нервные волокна, но их не всегда удается легко выявить даже с помощью специальных красок, а между тем наличие их делает диагноз этого рода опухоли несомненным. Для облегчения их выявления Murray и Stout предлагают способ, помогающий нервным клеткам продуцировать невриты, что позволяет отличить их от саркомы. Для этого малые кусочки опухоли изолируют и помещают в коагулирующую плазму, где процесс продуцирования невритов заканчивается в 24-48 часов.
Разнообразие неврогенных врожденных опухолей у детей выявляется в основном патологоанатомически. Так, Wells, специально интересуясь злокачественными опухолями у плодов и новорожденных, на большом количестве вскрытий (3000) мог сообщить о генерализованных невробластомах у них. Две истории болезни из этой группы особенно типичны: 1) новорожденная девочка доставлена в клинику через 9 часов после рождения с резко увеличенным животом, нарастающей одышкой и цианозом, быстро наступила смерть, на вскрытии обнаружена нейробластома правого надпочечника с метастазами в печень, лимфатические узлы, область поджелудочной железы и левый надпочечник; 2) недоношенный ребенок был извлечен из родовых путей с помощью перфорации головки (из-за гидроцефалии). На вскрытии выявлены множественные опухолевые образования по ходу узлов симпатической нервной системы от шеи до крестцовой области. Узлы имели различную величину и вид, содержали кровоизлияния и обызвествления. Найдены метастазы опухоли в лимфатические узлы и ткань печени. Аналогичные опухоли обнаружены по ходу блуждающего нерва и в обоих надпочечниках. При гистологическом исследовании в узлах, исходящих из блуждающего нерва, найдены симпатогонии и ганглиозные клетки. Опухолевые узлы надпочечников содержали множество симпатобластомных клеток с некрозами и обызвествлениями на всем протяжении мозгового и коркового слоев. В остальных узлах также выявлены обычные клетки - симпатогонии. Оба ребенка погибли от неврогенных опухолей, у которых было типичное метастазирование опухоли прежде всего в печень, как это свойственно новорожденным с эмбриональным развитием кровообращения.
Патологоанатомические данные у новорожденных с нейробластомами подтверждают и то положение, что первичная опухоль, например в мозговом слое надпочечника, может быть очень малых размеров (2х1,5 см), а печень уже внутриутробно оказывается переполненной островками метастазов и увеличенной в 4 раза.
Частота опухолей этого рода, по данным статистик детских больниц, увеличивается, чему прежде всего способствует улучшение методов диагностики. Bulbring приводит на основании литературных данных сведения о 33 случаях невробластом; Plesch, Personj - о 450, из них 81 % у детей до 4 лет и т. д. На долю детей грудного возраста и плодов падает 34% неврогенных опухолей. В настоящее время в разных детских клиниках скапливается большой собственный материал. Отдельные авторы описывают 30-50 собственных наблюдений нейробластом у детей.
Локализация опухолей многообразна в силу большого распространения этой системы по органам и тканям. Элементы адреналовой системы сохраняются в брюшных и аортальных параганглиях вне- и внутриорганных узлов симпатической нервной системы в добавочных надпочечниках, семенном канатике, паховом канале, яичке, придатках яичка, широкой маточной связке и т. д. Добавочные адреналовые образования могут компенсировать недостаточность функции надпочечников, но могут являться и источником образования нейробластомы. Следовательно, нейробластомы, исходящие из клеток симпатической нервной системы, могут иметь самую разнообразную локализацию. Чаще всего они встречаются в адреналовой системе надпочечников, затем в паравертебральных узлах симпатической нервной системы, нервных сплетениях (в солнечном, шейном), близ тазовых артерий, в глазу, внутри черепа, по ходу периферических нервов, в интрамуральных узлах различных органов и т. д.
У ребенка как злокачественные, так и доброкачественные опухоли симпатической нервной системы, как правило, располагаются ретроплеврально, занимая реберное углубление сзади, близ позвоночного столба, по ходу нервных стволов - ретроперитонеально. Они могут проникать в экстрадуральное спинномозговое пространство, раздвигая позвонки, а также оттеснять ребра и деформировать их. Как исключение, нейринома может располагаться внутрилегочно и в междолевых щелях, a Harrington описывает нейрофиброму межреберного нерва как внутриторакальную опухоль по средней подмышечной линии.
У детей чаще всего узлы опухоли, по многим современным данным, локализуются в мозговом слое надпочечника (50-75%). У детей преобладают опухоли из симпатической нервной системы различной степени зрелости, и именно они встречаются чаще у детей, чем у взрослых. Современная рентгенодиагностика помогает выявлять неврогенные патологические образования и в средостении.
Страница 1 - 1 из 4
Начало | Пред. | 1 2 3 4 | След. | Конец
Нейробластома – эмбриональная опухоль, возникающая в процессе внутриутробного или раннего постнатального периода жизни из стволовых нервных клеток – нейробластов.
Эпидемиология
Нейробластома составляет около 7-8% от всех злокачественных новообразований в детском и подростковом возрасте. Это наиболее часто возникающий вид детских новообразований после опухолей кроветворной и центральной нервной системы. Примерно 40% случаев заболевания встречается на первом году жизни, с возрастом количество случаев уменьшается. Средний возраст на момент диагностирования составляет 19 месяцев.
Причины и риски
Причины появления опухоли до конца не изучены. Нейробластома возникает в том случае, когда нормальные нейробласты не созревают в нервные клетки. Вместо этого они продолжают бесконтрольно расти и делиться. Предполагают, что эти несозревшие (эмбриональные) нервные клетки начинают мутировать еще до рождения ребенка, когда начинают меняться хромосомы и/или происходит сбой в регулировании работы генов. Как подтверждают актуальные исследования, у большинства детей болезнь не является наследственной̆. Только около 1% случаев нейробластомы имеют наследственную основу, чаще всего, вследствие мутаций в гене, который̆ называется ALK (или ген киназы анапластической лимфомы), либо в гене PHOX2B. На сегодняшний̆ день нет клинических исследований, доказывающих, что внешние факторы (окружающая среда, вредные условия работы родителей ребенка, прием каких-либо медикаментов, курение и употребление алкоголя во время беременности) могут стать причиной болезни.
Клиническая картина при нейробластоме
Нейробластома может возникать в любой анатомической области, где располагается симпатическая нервная система: надпочечники, шейный, грудной и брюшной симпатический отделы, параганглии.
Самой частой локализацией нейробластомы является забрюшинное пространство (одинаково часто опухоль диагностируется в надпочечниках и паравертебральных забрюшинных ганглиях). У 15% детей нейробластома локализуется в заднем средостении. Реже опухоль возникает в области таза (6%) и шеи (2%) (рис. 1).
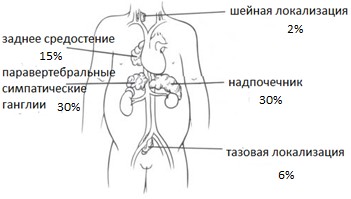
Рис. 1. Локализация нейробластомы
При ранних стадиях заболевания у многих детей может не быть никаких симптомов. Опухоль у них находят случайно, например, при плановом УЗИ обследовании младенцев при диспансеризации. Как правило, жалобы у детей появляются тогда, когда опухоль уже успела сильно вырасти и давит на соседние органы, нарушая их работу, или когда опухоль дала метастазы.
Среди общих симптомов заболевания можно выделить следующие: потеря веса, слабость, костные и суставные боли, некупируемая диарея.
Большинство проявлений болезни и их выраженность зависят от расположения опухоли и ее взаимосвязи с соседними органами и тканями. Так, для пациентов в возрасте до 2-х лет при забрюшинной локализации характерно увеличение размеров живота, лихорадка и потеря веса. Нейробластома забрюшинного пространства пальпируется через переднюю брюшную стенку в виде бугристого, несмещаемого опухолевого узла (рис. 2). У детей старшего возраста заболевание может манифестировать болевым синдромом, обусловленным метастатическим поражением костей, респираторными нарушениями, увеличением размеров живота, появлением запоров. У пациентов с большими забрюшинными опухолями можно обнаружить развитую сеть подкожных вен, развернутые края грудной клетки.
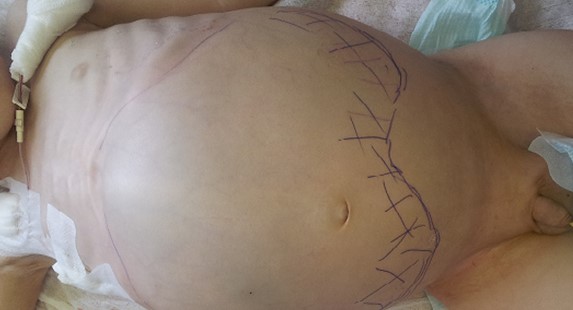
Рис. 2. Нейробластома забрюшинного пространства
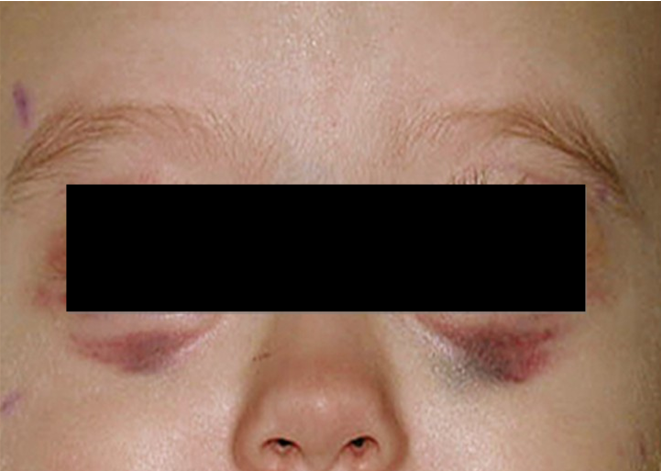
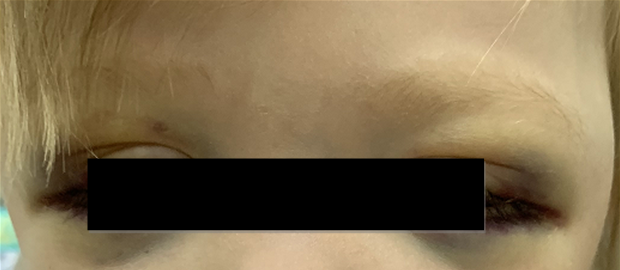
Поражение заднего средостения может стать причиной сухого кашля, дыхательных расстройств, деформации грудной клетки, частого срыгивания. При локализации опухоли в полости таза отмечают нарушение функции тазовых органов (периодическое недержание мочи, нарушение акта дефекации), отёки нижних конечностей.
При распространении опухоли в позвоночный канал и сдавлении ею спинного мозга могут развиваться слабость в ногах, неустойивость походки, параличи нижних конечностей, а также дисфункции органов малого таза (задержка мочеиспускания или непроизвольное мочеиспускание, запоры).
Нейробластома ‒ гормонопродуцирующая опухоль, способная к секреции физиологически активных веществ – катехоламинов ‒ адреналина, норадреналина и дофамина. В моче, как правило, повышено выведение их метаболитов ‒ ванилилминдальной и гомованилиновой кислот. В 95% случаев гормональная активность нейробластомы тем больше, чем выше степень её злокачественности. Эффекты секретируемых гормонов вызывают специфические клинические симптомы нейробластомы ‒ резкое повышение артериального давления, диарею (вызывается секрецией вазоактивного интестинального полипептида), потливость, эмоциональную лабильность, периодическое повышение температуры.
Нейробластома метастазирует чаще всего в костный мозг, кости, в отдаленные лимфатические узлы, печень или кожу, редко — в головной мозг или легкие. Признаки отдалённых метастазов можно обнаружить в виде экзофтальма, кровоизлияний в орбиты, опухолевых узлов на голове.
Среди особенностей течения нейробластомы можно выделить следующие:
- Регрессия – способность опухоли к спонтанному или индуцированному минимальной полихимиотерапией или лучевой терапией уменьшению (инволюции). Как правило, это происходит у детей до 1 года с IVS стадией заболевания.
- Реверсия – способность опухоли трансформироваться из более злокачественных форм в доброкачественные ганглионевромы (спонтанно или индуцированно).
- В некоторых случаях опухолевый процесс имеет обратную направленность: склонность к агрессивному течению и быстрому метастазированию.
Гистологическая классификация
Существующая гистологическая классификация нейробластомы INPC-Shimada основана на степени зрелости (дифференцировки) опухолевой ткани и выделяет 4 категории (от недифференцированных до зрелых форм):
1) нейробластома, бедная шванновской стромой: недифференцированная, низкодифференцированная, дифференцированная;
2) нодулярная ганглионейробластома;
Стадии заболевания
Существует несколько систем стадирования нейробластомы. Наиболее точной является модифицированная система, разработанная Международным противораковым союзом (INSS) (табл. 1).

Диагностика нейробластомы
В клиническом анализе крови при поражении костного мозга может наблюдаться снижение показателей крови: анемия, лейконейтропения, тромбоцитопения.
В сыворотке крови также можно определить специфические для нейробластомы маркеры: нейрон-специфическую енолазу (НСЕ), уровень метаболитов катехоламинов, лактатдегидрогеназу (ЛДГ) и ферритин.
Перед началом специфической терапии всегда проводится верификация диагноза; диагноз нейробластомы ставится при гистологическом исследовании биоптата первичной опухоли или метастазов, или при сочетании наличия опухолевых клеток в костном мозге и повышенного уровня суточной экскреции катехоламинов.
Для установления степени злокачественности нейробластомы выполняется ряд генетических исследований: мутация MYCN, делеция хромосом 1р или 11q . Наличие данных мутаций является неблагоприятным фактором прогноза заболевания.
Ультразвуковое исследование
Ультразвуковой метод исследования позволяет выявить наличие опухоли и ее расположение по отношению к внутренним органам. УЗИ позволяет оценить степень местного и отдаленного распространения злокачественного процесса и выявляет метастатическое поражение печени и лимфатических узлов (рис. 4).
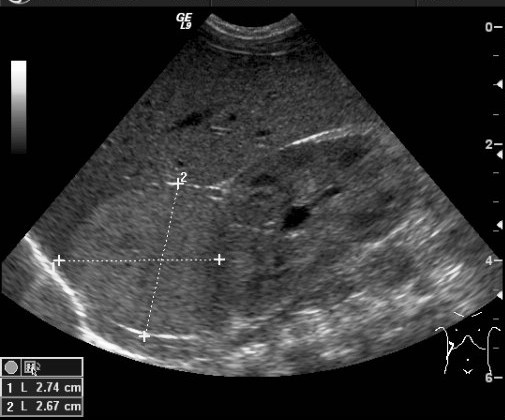
Рис. 4. УЗИ образования правого надпочечника
Компьютерная томография брюшной полости и забрюшинного пространства
Компьютерная томография более детально дает информацию об анатомическом отношении опухоли к окружающим тканям и органам, позволяет оценить структуру опухоли (рис. 5).
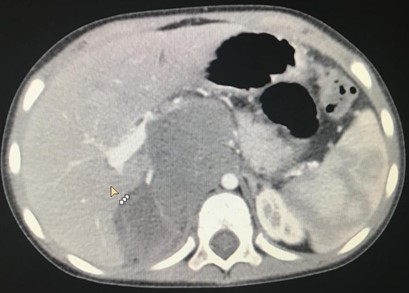
Рис. 5. КТ нейрогенного образования забрюшинного пространства справа
Магнитно-резонансная томография органов брюшной полости, забрюшинного пространства и позвоночника
МРТ органов брюшной полости и забрюшинного пространства ‒ это безопасный и высокоинформативный метод исследования, который позволяет не только уточнить локализацию опухоли, точные размеры новообразования и соотношение его с окружающими тканями, но и выявить метастатические очаги в печени и брюшной полости. Также МРТ дает возможность оценить состояние костных структур и мягких тканей позвоночного столба и позвоночного канала (рис. 6).
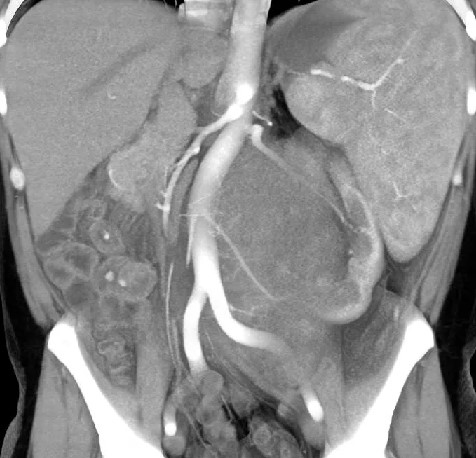
Рис. 6. МРТ нейрогенного образования забрюшинного пространства слева
Одним из наиболее информативных специфических методов топической диагностики нейробластом является сцинтиграфия с метайодбензилгуанидином (МЙБГ), меченным 123I. МЙБГ по своей химической структуре сходен с катехоламинами в организме. Это вещество концентрируется в тех опухолях, которые вырабатывают катехоламины. МЙБГ метят радиоактивным изотопом йода (например, 123I) в безопасной для жизни дозе, и готовый препарат внутривенно вводят в кровоток. Накапливаясь в клетках опухоли, он дает излучение. Эти сигналы регистрирует специальная камера и переводит их в изображение. Таким образом, метод позволяет выявить не только первичную опухоль, но и наличие регионарных и отдаленных метастазов (рис. 7).
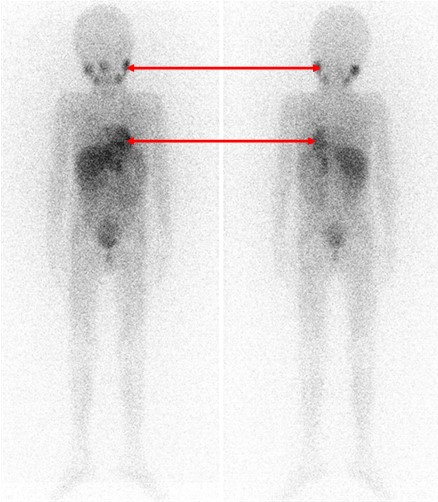
Рис. 7. Сцинтиграфия с метайодбензилгуанидином (визуализируется первичная паравертебральная опухоль с метастазами в кости черепа)
Остеосцинтиграфия – метод сканирования костей скелета с помощью внутривенного введения радиофармпрепарата. Радиофармпрепарат накапливается участками, пораженными опухолевыми клетками в костях, что видно на снимках, выполняемых гамма-камерой. Таким образом, данный метод исследования позволяет выявить возможные метастазы костей скелета.
Исследование костного мозга (миелограмма и трепанобиопсия) используется для уточнения наличия поражения опухолевыми клетками костного мозга.
Лечение нейробластомы
Учитывая разнообразные сценарии развития исхода заболевания (от спонтанной регрессии до летального исхода от прогрессирования), в терапии нейробластомы предлагаются риск-адаптированные принципы. Стратификация пациентов проводится согласно факторам риска до начала лечения (как правило, это клинические и молекулярно-генетические данные) и на основании ответа опухоли во время лечения (response-adapted). При выделении групп риска перед началом лечения используются следующие прогностические критерии: стадия заболевания, возраст на момент диагностики, результаты молекулярно-генетических данных — амплификация MYCN и делеция короткого плеча 1р (рис. 8).
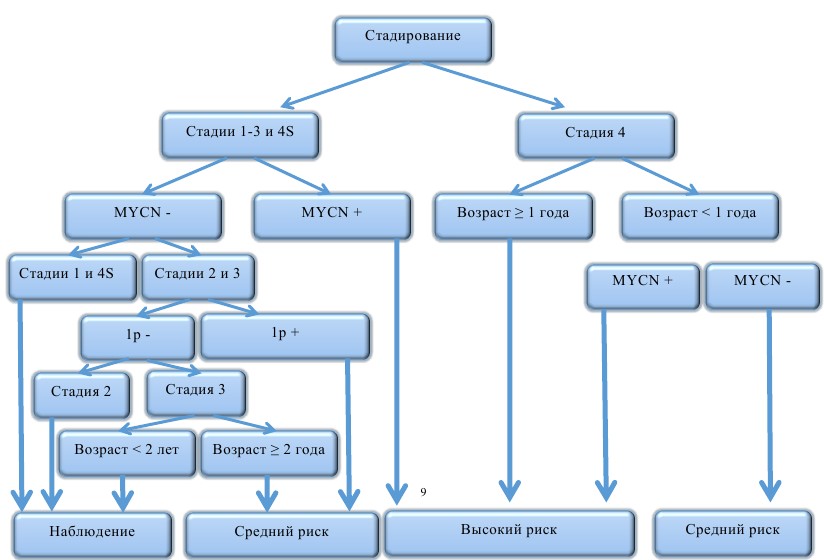
Рис. 8. Стратификация пациентов на группы риска согласно наличию факторов неблагоприятного прогноза
- Необходимость проведения полихимиотерапии определяется стадией заболевания и наличием или отсутствием неблагоприятных клинических и биологических факторов (n-myc амплификация, делеции короткого плеча 1р).
- Полихимиотерапия позволяет уменьшить размеры первичной опухоли, чтобы сделать хирургическое вмешательство более безопасным и радикальным.
- Базовыми препаратами для лечения нейробластомы являются винкристин, циклофосфамид, антрациклины, ифосфамид, препараты платины, этопозид.
Особенности хирургического лечения
- При локализованных стадиях заболевания лечение может ограничиться полным удалением опухоли.
- При III-IV стадиях заболевания оперативный этап проводится после проведения предоперационной (неоадъювантной) полихимиотерапии, которая направлена на сокращение размеров опухоли с целью последующего радикального удаления образования.
- В тех случаях, когда полное удаление опухоли невозможно, в послеоперационном периоде лечение дополняется лучевой терапией.
Лекарственное лечение необходимо начать через 5-7 дней после оперативного вмешательства. При отсутствии показаний для проведения 2-й линии полихимиотерапии в схемах лечения используются те же базовые препараты, как и при неоадъювантной терапии.
- Лучевая терапия используется для уничтожения любых опухолевых клеток, которые невозможно удалить хирургическим путем и/или которые не были разрушены посредством предыдущих терапий.
- При нерадикальном характере операции с наличием активной остаточной опухоли проводится облучение остаточной опухолевой ткани, вовлеченных в процесс лимфатических узлов и зон связи опухоли с окружающими органами и тканями.
- Облучение осуществляется ежедневно, начиная с 5-7-го дня после операции.
- По показаниям проводится облучение метастатических очагов (с лечебной, иногда с противоболевой целью).
В случае наличия неблагоприятных прогностических факторов, в частности выявления в опухоли мутации MYCN онкогена, рекомендовано проведение высокодозной полихимиотерапии с аутологичной трансплантацией гемопоэтических стволовых клеток.
Иммунотерапия – новый метод лечения нейробластомы, который используется для уничтожения раковых клеток. Дисиалоганглиозид GD2 – молекула- антиген, экспрессируемая клетками нейробластомы, это делает ее идеальной мишенью для иммунотерапии антителами: антитело действует против этой молекулы. Клетки иммунной системы могут способствовать гибели клеток нейробластомы.
В НМИЦ онкологии им. Н.Н. Петрова проводятся все этапы лечения, включая минимально-инвазивные операции (лапаро- и торакоскопические), тандемную трансплантацию и пассивную иммунотерапию.
Интенсифицируя терапию у детей с нейробластомой группы высокого риска (с включением тандемной высокодозной полихимиотерапии в консолидацию и пассивной иммунотерапии в постконсолидацию) удалось повысить результаты выживаемости на 20%.
Рекомендации после лечения
- После успешного лечения нейробластомы ребенку необходимо проходить врачебный контроль, который может включать осмотр и консультацию детского онколога, анализ крови на онкомаркеры (ЛДГ, НСЕ), анализ мочи на метаболиты катехоламинов, УЗИ и КТ/МРТ, сцинтиграфию с МЙБГ и другие исследования.
- Детский онколог проводит осмотр 1 раз в 1,5-2 мес в течение первого года после окончания лечения, 1 раз в 3 мес ‒ в течение 2-го года, 1 раз в 6 мес ‒ на протяжении следующих 2 лет, в дальнейшем ‒ 1 раз в год.
- С учета больных не снимают.
СПИСОК ЛИТЕРАТУРЫ
Авторы:

- Изможерова Рина Игоревна;
- Сенчуров Евгений Михайлович;
- Михайлова Елена Андреевна;
- Иванова Светлана Вячеславовна;
- Фасеева Наталья Дмитриевна;
- Борокшинова Ксения Михайловна;
- Жук Ирина Николаевна.

Под научной редакцией:
Кулева С.А.
Заведующий детским онкологическим отделением, врач-детский онколог, ведущий научный сотрудник, профессор, доктор медицинских наук, главный внештатный детский специалист-онколог Комитета по здравоохранению Санкт-Петербурга
Читайте также:


