Диспансерное наблюдение при болезни паркинсона
Для обеспечения медико-социальной реабилитации больных паркинсонизмом необходима организация многоуровневой системы на основе существующих структур как в здравоохранении, так и в сфере социальной защиты населения, а также создание региональных подразделений, непосредственно проводящих в жизнь программу диспансерного наблюдения, реабилитации и социальной помощи.
Организационную и координирующую роль в этой системе играют Министерство здравоохранения РФ с его отделом психоневрологической помощи, с главным неврологом Минздрава РФ, главным специалистом Управления организации медицинской помощи Минздрава
Научно-методическое обеспечение осуществляет Центр экстрапирамидных заболеваний нервной системы Минздрава РФ при кафедре неврологии Российской Медицинской Академии последипломного образования. Для непосредственного осуществления медико-социальной помощи больным с заболеваниями экстрапирамидной нервной системы и, в первую очередь, больным паркинсонизмом в регионах Российской Федерации предлагается организовать Региональные филиалы Центра экстрапирамидных заболеваний.
Работа регионального филиала осуществляется при участии и под контролем главного невролога республики, края или области, во взаимодействии с профильными кафедрами региональных ГИДУвов, ФУВов и медицинских институтов, а также территориальными органами здравоохранения. Ответственным за работу регионального филиала может быть главный невролог региона, сотрудник кафедры нервных болезней регионального ВУЗа или опытный клиницист-невролог. Основной клинической базой для осуществления работы филиала являются центральные региональные (республиканские, краевые, областные) больницы с их неврологическими стационарами и консультативными поликлиниками.
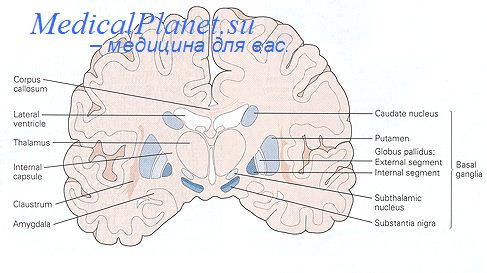
Программа диспансерного наблюдения осуществляется медико-социальной группой диспансерного наблюдения, а при малочисленности региональной неврологической службы — врачом-неврологом. Выявление больных паркинсонизмом должно носить активный характер: плановое освидетельствование лиц старше 50 лет, работников вредных производств. На выявленных больных заводится амбулаторная карта, в которую заносятся все данные первичного освидетельствования — развернутый диагноз с указанием этиологической формы, клинической формы, степени тяжести, продолжительности болезни, типа течения и темпа прогрессирования.
Если больной до взятия на учет получал лечение, то должен быть приведен подробный фармакологический анамнез: названия лекарственных препаратов, разовая доза, кратность приема, продолжительность лечения, эффект лечения (как долго при получении назначенного лечения был стабильный эффект); назначаются сроки наблюдения в ходе коррекции программы лечения, а по окончании коррекции делается заключение об эффективности новой программы фармакотерапии.
Выявленные и взятые на учет больные распределяются на три группы в соответствии с тремя степенями тяжести. Соответственно выделяются и три этапа диспансеризации. Такая дифференцировка облегчает разработку единого плана лечебных и иных мероприятий для больных с одинаковой степенью тяжести.
На первом этапе диспансеризации (I степень тяжести) проводят обследование, подтверждающее диагноз, и определяют тактику подбора индивидуальной эффективной монотерапии. Регистрируют результаты терапии. На втором этапе диспансеризации (вторая степень тяжести) осуществляется подбор индивидуальной комбинированной терапии, которая обычно включает три противопаркинсонических средства -холинолитики, амантадин, препараты леводопы или другие комбинации. Важной особенностью второго этапа является решение вопросов медико-социальной экспертизы. Возможность продолжить работу должна рассматриваться как благоприятный вариант, так как сохранение привычных двигательных стереотипов поддерживает двигательную активность больного.
Во всех случаях установления группы инвалидности удобно пользоваться трехстепенной оценкой тяжести паркинсонизма. Первая степень тяжести, когда двигательный дефицит не ведет к утрате профессиональной и бытовой активности, соответствует III группе инвалидности. Вторая степень тяжести, когда двигательный дефицит ведет за собой утрату профессиональной и(или) бытовой активности, соответствует II группе инвалидности. Третья степень тяжести приводит к утрате способности к самообслуживанию — устанавливается I группа инвалидности. Третий этап предусматривает наблюдение и лечение больных с третьей степенью тяжести, утративших в том или ином объеме способность к самообслуживанию.
Разрабатывается программа ежедневного ухода (кормление, туалет, гигиена), которая, кроме прочего, направлена на предупреждение возможных осложнений у неподвижно лежащего больного: профилактика пневмонии, пролежней, предупреждение и купирование декомпенсации соматических заболеваний.
Индивидуальная программа ЛФК на первом этапе достаточно разнообразна и может включать различные физические упражнения. На втором этапе основное содержание ЛФК составляют упражнения, поддерживающие профессиональные и бытовые двигательные стереотипы, упражнения на сохранение координации и равновесия. На третьем этапе в занятиях ЛФК увеличивается удельный вес пассивных упражнений, массажа, дыхательной гимнастики. Общее направление ЛФК на третьем этапе — максимальное облегчение ухода за больным, прикованным к креслу и кровати.
В заключение следует подчеркнуть, что успехи в деле реабилитации и социальной адаптации больных паркинсонизмом могут быть достигнуты при объединении усилий медицинской науки, органов здравоохранения и социальной защиты населения.
Прогрессирующее нейродегенеративное заболевание, преимущественно обусловленное гибелью нейронов в чёрной субстанции. Дефицит дофамина, выявляемый при болезни Паркинсона, приводит к нарушению передачи импульсов от мозга к скелетным мышцам и, тем самым, к расстройству плавности движений

Что такое болезнь Паркинсона?
Болезнь Паркинсона — это прогрессирующее нейродегенеративное заболевание, преимущественно обусловленное гибелью нейронов в чёрной субстанции. Значительный, прогрессирующий дефицит дофамина, выявляемый при болезни Паркинсона, приводит к нарушению передачи импульсов от мозга к скелетным мышцам и, тем самым, к расстройству плавности движений, появлению замедленности движений (брадикинезия), дрожания конечностей (тремор), повышения мышечного тонуса (ригидности) и чувству скованности, постуральной неустойчивости и немоторным нарушениям.
Чаще болезнью Паркинсона страдают мужчины. Средний возраст начала двигательных проявлений заболевания 60-70 лет.
К сожалению, наибольшее внимание пациентов и большинства врачей направлено на наблюдение и лечение двигательных расстройств, которые появляются при гибели 80% нейронов чёрной субстанции. Однако, первые признаки болезни начинаются исподволь за 10-20 лет до появления моторных расстройств, и именно в этот период терапевтическое влияние на болезнь наиболее эффективно. До появления двигательных симптомов у большинства пациентов могут развиться нарушения обоняния, запоры, депрессия, чувство дискомфорта в области шеи и плеча, часто расценивающиеся, как проявления заболевания позвоночника. Выявление БП на самых ранних стадиях и разработка методов замедляющих её прогрессирование является приоритетным направлением в современной медицине.
Клиника болезни Паркинсона
Выделяют доклиническую стадию болезни (пациент никак не ощущает начавшееся заболевание), премоторную стадию (есть немоторные симптомы, которые пациент уже замечает) и моторную стадии (собственно классическая клиническая картина БП).
Двигательные симптомы
Немоторные симптомы:
- Вегетативные нарушения (сальность кожных покровов, особенно лица, повышенное слюноотделение, избыточная потливость, частые запоры, колебания АД с тенденцией к снижению).
- психические расстройства: депрессии, расстройства сна, патологическая утомляемость, психоз (галлюцинации и бред с нарушением ориентировки страх, растерянность, бессонница), слабоумие выражено слабее, чем при старческой деменции.
Рекомендации по питанию
Не существует специальной диеты для пациентов с БП, однако существуют общие рекомендации по питанию:

Целью терапии при болезни Паркинсона являются:
- Сохранность работоспособности.
- Увеличение повседневной активности и уменьшение нагрузки на окружающих.
- Улучшение качества жизни.
В Фениксе разработан комплексный подход к лечению болезни Паркинсона
- Противопаркинсонические средства:
- Антихолинергические средства.
- Препараты амантадина.
- ДОФА-содержащие средства.
- Агонисты дофаминовых рецепторов.
- Ингибиторы МАО типа В.
- Ингибиторы КОМТ.
- Антагонисты 2А-аденозиновых рецепторов (проходят испытания).
- Фармакотерапия
- Нейропротекторная терапия.
- Симптоматическая терапия.
- Медико-социальная реабилитация
- Диспансерное наблюдение.
- ЛФК, физиотерапия.
- Психотерапевтические занятия.
- Группы поддержки.
- Школы для больных и их родственников.
- Обучающие программы.
- Нейрохирургическая терапия.
- Вспомогательная терапия (коррекция побочных эффектов, вегетативных, когнитивных и др. расстройств).
Любые лекарственные препараты должны назначаться только врачом!
Мы помогаем людям более 29 лет. Наша практика обширна, уникальна и проверена годами.

Болезнь Паркинсона (паркинсонизм) – это медленно развивающаяся патология, которая характеризуется замедленностью движений, мышечной ригидностью и появлением дрожания верхних конечностей в состоянии покоя. Согласно статистическим данным, патология чаще всего появляется у представителей мужского пола. По распространенности болезнь Паркинсона занимает вторую строчку среди нейродегенеративных болезней (на первой строчке болезнь Альцгеймера).
В специфике патогенеза заболевания наблюдаются некоторые факторы, которые негативно сказываются на пищеварительных функциях организма. Зачастую больные страдают потерей аппетита и вкусовых ощущений, отклонениями в работе желудочно-кишечного тракта (запорами). Как правило, это приводит к сильной потере веса.
В зависимости от клинической картины выделяют три формы болезни Паркинсона: акинетико-ригидную (характеризуется повышением тонуса мышц и обездвиженностью), дрожательную (характеризуется дрожанием верхних конечностей и челюсти), смешанную (характеризуется, как тремором, так и скованностью движений). Заболевание в зависимости от причины возникновения разделяют на две формы – первичную и вторичную. Первичную форму провоцирует наследственная (генетическая) предрасположенность, а вторичную форму – перенесенные патологии (к примеру, энцефалит или атеросклероз сосудов головного мозга). Всего различают пять стадий прогрессирования болезни:
нулевая стадия. Патология только зарождается, ярко-выраженная симптоматика отсутствует;
первая стадия. Признаки затрагивают только одну конечность;
полуторная стадия. Помимо одной конечности, признаки патологии затрагивают и само тело;
вторая стадия. У больных отмечаются двусторонние проявления, но при этом затруднения в удержании равновесия в конкретной позе (или при смене поз) отсутствуют;
промежуточная стадия. У больных отмечаются двусторонние проявления с появлением затруднений в удержании равновесия в конкретной позе (или при смене поз). При этом человек сам в состоянии преодолевать инерцию движения, которая была спровоцирована толчком;
третья стадия. На этой стадии прежние симптомы значительно прогрессируют;
пятая стадия. Человек не в состоянии ходить, он прикован кровати (тяжелая инвалидизация).
Начальные признаки болезни Паркинсона проявляются в виде утраты двигательной активности организма и появления тремора – колебательных движений верхних конечностей. Пациенты жалуются на сильную скованность движений, внезапное появление непроизвольных движений челюстью. Сильное дрожание может исчезать только в вечернее время суток (во сне, как правило, не беспокоит). Моторика рук сильно нарушается, почерк становится мелким, а походка шаркающей (движение происходит медленно, маленькими шажками). В большинстве случаев этих симптомов достаточно для постановки предварительного диагноза.
Болезнь Паркинсона: причины
Болезнь Паркинсона развивается в результате нарушения выработки дофамина. Это нейромедиатор, функция которого состоит в передачи импульсов в головном мозге. В последствие это приводит к проблемам функционирования клеток в тех отделах мозга, которые отвечают за двигательную активность человека. Этот недуг может спровоцировать ряд факторов. Наиболее часто встречаются следующие причины возникновения болезни Паркинсона:
пожилой возраст (70 лет и более);
злокачественные новообразования, локализирующиеся в головном мозге;
злоупотребление некоторыми лекарственными препаратами (чаще всего психотропными – нейролептиками);
перенесенные ранее патологии со стороны нервной системы;
повышение внутричерепного давления;
проживание в плохой экологической обстановке (к примеру, вблизи промышленных предприятий);
болезни вирусной этиологии (энцефалит);
употребление наркотических веществ (наиболее опасным признан амфетамин);
нарушение работы сосудов;
работа на вредном производстве (к примеру, на нефтехимической промышленности);
атеросклероз сосудов головного мозга;
злоупотребление табачной продукцией.
Группа риска
Значительно повышается риск развития патологии у людей, ближайшие родственники которых страдали паркинсонизмом. При этом появление болезни провоцирует малоподвижный образ жизни. Возраст и пол – важные составляющая группы риска. Чем старше человек, тем более вероятно у него развитие болезни Паркинсона. Согласно статистике, мужчины подвержены патологии намного чаще, чем женщины. Проживание вблизи вредных заводов и употребление никотина в 2-3 раза повышает вероятность развития паркинсонизма.
Прогноз и профилактика болезни
Согласно статистическим данным, болезнь Паркинсона способна существенно сократить продолжительность жизни, необратимо утратить трудоспособность у больных. Однако при своевременном лечении (устранении основных симптомов) болезнь Паркинсона имеет относительно положительный прогноз.
Как и любую патологию, ее проще предотвратить, чем вылечить. Она отличается медленным прогрессированием, поэтому при появлении первых симптомов не стоит ждать, когда они самостоятельно пройдут, важно незамедлительно обратиться к врачу. С помощью терапии удается замедлить развитие болезни, сохранить трудоспособность и повысить качество жизни.
Чтобы избежать появления паркинсонизма важно придерживаться здорового образа жизни. Для этого требуется заниматься умеренной физической активностью (во избежание развития гиподинамии), подвергать мозг умственным нагрузкам. Особенно полезны решения математических задач, разгадывание кроссвордом и другие подобные мероприятия. Любые психотропные вещества (в частности, нейролептики) следует употреблять с осторожностью и только по назначению лечащего врача.
Специальная диета при паркинсонизме отсутствует. В ежедневом рационе должны присутствовать свежие овощи и фрукты, зерновые и злаковые продукты. Здоровая пища – важная мера профилактики. Организму больного требуются продукты, богатые витаминами и минералами (в частности, кальцием, А, C, В1, В2, В6, В12 и фолиевой кислотой). Сам рацион при этом должен быть разнообразным и дробным (4-5 приемов пищи в день). При этом рекомендуется употреблять только те продукты, которые обладают легкой усвояемостью в организме. Нельзя злоупотреблять простыми углеводами, фастфудом. Среди наиболее полезных продуктов отмечают:
мясо нежирных сортов;
крупы (овсянку, гречку);
В сутки необходимо выпивать достаточное количество жидкости (1,5-2 л воды). Если болезнь сопровождается потерей веса, следует начать вести пищевой дневник (записывать количество и характер принятой за день еды). Рекомендуемая доза белков в день составляет 0,7-0,8 г на 1 кг массы тела. Суточная потребность в энергии – около 25 ккал на 1 кг массы тела. Стоит помнить, что крайне негативно на состоянии больного сказывается голодание и злоупотребление спиртосодержащими напитками, поэтому ими необходимо пренебречь.
Диагностика болезни Паркинсона
При обнаружении любого из выше представленных симптомов следует не затягивать с визитом к врачу-неврологу. На первичном осмотре он тщательно соберет анамнез пациента, задаст вопросы о перенесенных ранее заболеваниях, о том, когда и при каких обстоятельствах были замечены первые симптомы, была ли болезнь Паркинсона у кого-нибудь в роду (из ближайших родственников). Как правило, врачу-неврологу не сложно постановить верный диагноз. Это связано с насыщенной клинической картиной патологии, которая обладает специфическими признаками. Для того чтобы дифференцировать патологию, больному назначают лабораторную и инструментальную диагностику. В первую очередь следует определить уровень церулоплазмина. Это белок, который активно участвует в обмене меди в организме. В случае с дефицитом белка медь накапливается, что приводит к развитию болезни Вильсона – Коновалова. Ее признаки напоминают паркинсонизма.
Один из главных симптомов болезни Паркинсона – проблемы с мочеиспусканием (затрудненное, болезненное) может свидетельствовать о наличии воспалительных процессов в организме. Чтобы подтвердить это или опровергнуть требуется лабораторное исследование – общий анализ крови и мочи. Повышенное содержание лейкоцитов в крови подтверждает наличие воспалительного процесса. Повышенное содержание лейкоцитов в моче свидетельствует об инфекционном поражении органов мочеполовой системы.
1. Электроэнцефалография (ЭЭГ). Это высокоинформативный способ исследования головного мозга, который основан на регистрации электрических потенциалов, возникающих в процессе его жизнедеятельности. На голову пациенту надевают шапочку со специальными электродами. Специалист исследует электрическую активность мозга в состоянии покоя, затем просит моргнуть и дополнительно воздействует на пациента, чтобы подробно изучить его реакцию. Продолжительность процедуры – не более 20 минут. С помощью ЭЭГ удается обнаружить возможные органические нарушения в работе головного мозга.
2. Магнитно-резонансная томография (МРТ). МРТ головного мозг представляет собой неинвазивный метод диагностики, в ходе которого происходит воздействие магнитных полей и высокочастотных импульсов, что позволяет в результате получить качественное подробное изображение мозга. Эта методика полностью безопасна, поскольку отсутствует облучение. Благодаря МРТ удается обнаружить ряд проблем с мягкими тканями (к примеру, опухоли доброкачественного и злокачественного характера, нарушения функционирования гипофиза).
3. Рентгенографическое обследование. Это простая, неинвазивная методика, которая не требует особой подготовки. Больному часто назначают сделать рентген грудной клетки, чтобы обнаружить возможные воспалительные, застойные процессы в легких.
О.С. Левин 1,2 , А.В. Росинская 3
1 Российская медицинская академия последипломного образования;
2 Центр экстрапирамидных заболеваний (Москва);
3 Кабинет экстрапирамидных расстройств Приморской краевой клинической больницы №1 (Владивосток)
Болезнь Паркинсона (БП) – прогрессирующее нейродегенеративное заболевание, характеризующееся сочетанием гипокинезии с мышечной ригидностью и/или тремором покоя, а также с позднее развивающейся постуральной неустойчивостью и широким спектром немоторных нарушений, включая вегетативные, психические, диссомнические и сенсорные симптомы. В качестве основного звена патогенеза БП рассматривается формирование нейротоксических агрегатов небольшого пресинаптического белка альфа-синуклеина (основного компонента телец Леви) сопровождающееся гибелью пигментированных нейронов вентролатеральных отделов компактной части черной субстанции. Однако в последние годы установлено, что с поражением черной субстанции коррелируют лишь основные двигательные симптомы паркинсонизма, в то же время дегенеративный процесс при БП вовлекает и другие группы нейронов в различных зонах головного мозга, а также и в периферической нервной системе, что лежит в основе многочисленных немоторных проявлений болезни [1, 3].
Эпидемиология
По данным сплошного популяционного исследования, распространенность БП в России составляет 139 случаев на 100 000 населения, заболеваемость БП – 16 случаев на 100 000 населения в год. С увеличением возраста риск БП увеличивается, и выявляемость БП среди лиц старше 65 лет составляет уже около 1%. Большинство случаев заболевания возникают в возрасте 60–70 лет. Однако в 15% случаев БП дебютирует в возрасте до 45 лет.
Исходя из имеющихся данных и половозрастной структуры населения России, можно примерно оценить общую численность больных с БП в нашей стране в 210 тысяч, при этом ежегодно заболевание возникает примерно у 20 тысяч пациентов. Ориентировочные расчеты показывают, что, как минимум, четверть пациентов (то есть более 50 тысяч) оказываются вне сферы медицинской помощи, причем в большинстве своем это пациенты с ранней стадией заболевания [3].
Диагностика
Диагноз БП проводится в 2 этапа. На первом (синдромальном) этапе синдром паркинсонизма требуется отличить от других состояний, имитирующих его (таблица 1).
Таблица 1. Состояния, требующие дифференциальной диагностики с паркинсонизмом.
Начальным проявлением БП, особенно у лиц молодого возраста, может быть дистония стопы, появляющаяся или усиливающаяся при ходьбе, значительно реже – дистония иной локализации.
Дебютными проявлениями БП бывают также хронические болевые синдромы, чаще всего в спине и плечелопаточной области, связанные с повышенным мышечным тонусом, ограничением мобильности и постуральными нарушениями.
При неврологическом осмотре могут выявляться симптомы, атипичные для БП, требующие исключения иных заболеваний, вызывающих синдром паркинсонизма. Среди них можно выделить: симметричность, быстрое прогрессирование симптоматики с ранней утратой способности к передвижению в течние 5 лет, раннее развитие постуральной неустойчивости с падениями, отсутствие стойкого положительного эффекта адекватных доз препаратов леводопы, раннее развитие вегетативной недостаточности, быстрое присоединение деменции (в течении 1-го года), ограничение подвижности глазных яблок (особенно парез взора вниз), раннее развитие тяжелых псевдобульбарных синдромов, аксиальная дистония, пирамидные и мозжечковые знаки, наличие очаговых нарушений корковых функций.
Дополнительные методы исследования
В настоящий момент нет методов лабораторного или инструментального исследования, которые были бы обязательны у каждого пациента с подозрением на БП. В последние годы больным с БП часто проводят КТ или МРТ головного мозга, однако чаще всего в этом нет необходимости, и в большинстве случаев диагноз может быть установлен на основе клинических данных. Тем не менее, если клиническая картина у больного с синдромом паркинсонизма отклоняется от классического варианта, свойственного БП, в частности, отсутствует типичная реакция на дофаминергические средства, – необходимо проведение нейровизуализации.
При начале заболевания до 50 лет важно исключить гепатолентикулярную дегенерацию, о которой могут свидетельствовать роговичное кольцо Кайзера–Флейшера, низкий уровень церулоплазмина, повышение интенсивности сигнала от базальных ганглиев и мозжечка на Т2-взвешенных МРТ изображениях, повышенная экскреция меди с мочой.
Диагностическую значимость может иметь и транскраниальная сонография глубинных структур мозга, выявляющее при БП гиперэхогенные изменения в проекции черной субстанции, связанные с накоплением железа и установленные в 92% случаев клинически вероятной БП, однако его результаты можно интерпретировать лишь в клиническом контексте.
Общие принципы начала лечения
Поскольку на данный момент способность замедлять процесс дегенерации за счет нейропротективного эффекта (возможность защищать интактные клетки от повреждения) или нейрорепаративного эффекта (возможность восстанавливать активность частично поврежденных клеток) ни у одного из применяющихся средств убедительно не доказана, лечение основывается пока на симптоматическом действии. Тем не менее потенциальная возможность нейропротективного эффекта, подтверждаемая экспериментальными или клиническими данными, должна учитываться при назначении лечения.
В настоящее время широкое распространение получила концепция, подчеркивающая важность раннего назначения дофаминергической терапии – немедленно после установления диагноза – с тем, чтобы быстрее скорректировать нейрохимический дисбаланс в мозге и поддержать процессы компенсации.
Если ранее подчеркивалась необходимость возможно более длительного сохранения монотерапии, то в настоящее время преимущества такого подхода не представляются очевидными – по сравнению с ранним переходом к комбинации средств с разным механизмом действия. Вопрос о необходимости монотерапии или комбинированной терапии должен решаться индивидуально. В любом случае при выборе препаратов и их дозы следует стремиться не к полному устранению симптомов, а к существенному улучшению функций, позволяющему поддерживать бытовую и профессиональную активность. В то же время следует избегать внесения в схему лечения сразу нескольких изменений (например, повышения дозы сразу нескольких средств или добавления сразу нескольких препаратов), это позволяет оценить отдельно эффективность и безопасность каждого из назначаемых средств.
Принципы выбора противопаркинсонического препарата
Выбор препарата на начальном этапе лечения проводят с учетом возраста, выраженности двигательного дефекта, трудового статуса, состояния нейропсихологических функций, наличия сопутствующих соматических заболеваний, индивидуальной чувствительности пациента. Помимо достижения оптимального симптоматического контроля, выбор препарата определяется необходимостью отсрочить момент развития моторных флуктуаций и дискинезий (таблица 2).
Таблица 2. Выбор препарата для начального лечения болезни Паркинсона.
| Препараты | Возможность использования в качестве средства первого выбора | Степень симптоматического улучшения | Нейро-протективный потенциал | Риск побочного действия | |
| Флуктуации и дискинезии | Другие побочные эффекты | ||||
| Леводопа | + | +++ | +? | ↑ | ↑ |
| Агонисты дофаминовых рецепторов | + | ++ | +? | ↓ | ↑ |
| Ингибитор МАО В | + | + | +? | ↓ | ↑ |
| Амантадин | + | + | +? | ↓ | ↑ |
| Холинолитики | — | + | — | ? | ↑ |
У лиц моложе 50 лет при легкой или умеренной выраженности двигательных нарушений в отсутствие выраженных когнитивных нарушений назначают один из следующих препаратов: агонист дофаминовых рецепторов, ингибитор моноаминооксидазы типа В, амантадин. При более легком двигательном дефекте может быть назначен ингибитор МАО В, при более выраженном дефекте предпочтительнее начинать с лечения с одного из агонистов дофаминовых рецепторов. Неэрголиновые агонисты (например, прамипексол, ропинирол, ротиготин или проноран) ввиду более благоприятного профиля побочных эффектов предпочтительнее, чем эрголиновые (бромокриптин, каберголин). При недостаточной эффективности или плохой переносимости одного из агонистов дофаминовых рецепторов может быть испробован другой агонист дофаминовых рецепторов или препарат другой фармакологической группы. Рациональна комбинация агониста дофаминовых рецепторов, ингибитора МАО типа В и амантадина, к которой следует переходить постепенно, добавляя препарат новой группы, если ранее назначенное средство не обеспечило ожидаемого эффекта.
Антихолинергические средства (например, бипериден) показаны при наличии выраженного тремора покоя либо болезненной дистонии при условии сохранности нейропсихологических функций. Их целесообразно добавлять к комбинации агониста дофаминовых рецепторов с ингибитором МАО В и/или амантадином, если она у пациента относительно молодого возраста не обеспечила подавления тремора в той степени, в которой это необходимо для поддержания его трудоспособности.
Если указанные препараты в максимально переносимых дозах и их комбинация не обеспечивают адекватного состояния двигательных функций и социальной адаптации больных, назначают препарат леводопы в минимальной эффективной дозе [4].
У лиц в возрасте 50–70 лет при умеренном двигательном дефекте и относительной сохранности когнитивных функций лечение начинают с ингибитора МАО типа В (при легких симптомах паркинсонизма) или одного из агонистов дофаминовых рецепторов. В дальнейшем целесообразен постепенный переход к комбинации агониста дофаминовых рецепторов, ингибитора МАО типа В и амантадина (при условии хорошей переносимости). Больным после 60 лет антихолинергические средства, как правило, не следует назначать из-за риска ухудшения познавательных функций и других побочных эффектов. При недостаточной эффективности комбинации указанных выше препаратов добавляют препарат леводопы в минимальной эффективной дозе (200–400 мг в сутки).
У лиц в возрасте 50–70 лет при выраженном двигательном дефекте, ограничивающем трудоспособность и(или) возможность самообслуживания, а также при наличии выраженных когнитивных нарушений и необходимости получения быстрого эффекта лечение начинают с препаратов, содержащих леводопу. Если небольшие или средние дозы леводопы (300–500 мг леводопы в сутки) не обеспечивают необходимого улучшения, к ним последовательно могут быть добавлены агонист дофаминовых рецепторов, амантадин и ингибитор МАО В.
У пожилых лиц (старше 70 лет), особенно при наличии выраженного когнитивного снижения и соматической отягощенности, лечение следует начинать с препаратов леводопы. Указанные возрастные границы относительны, и общий принцип скорее заключается в том, что чем моложе больной, тем позже следует вводить препараты леводопы. Кроме того, решающее значение играет не столько хронологический, сколько биологический возраст больных.
Применение препарата прамипексола с длительным высвобождением на ранней стадии БП
Разработка новых лекарственных форм противопаркинсонических препаратов, обеспечивающих их длительное высвобождение и допускающих однократный прием в течение дня, не просто делает лечение более удобным, но и, улучшая приверженность пациентов лечению, повышает долгосрочную эффективность терапии. Кроме того, при медленном высвобождении препарата в течение суток достигается более стабильная его концентрация в крови, что может обеспечить его лучшую переносимость и эффективный контроль симптомов заболевания в течение всего дня (как в дневное, так и в ночное время).
Новая лекарственная форма прамипексола с длительным (контролируемым) высвобождением, предполагающая однократный прием в течение дня, применяется в европейских странах и США с 2009 года, а в нашей стране – с 2012 года. Она представляет собой матриксную таблетку, в которой активное вещество равномерно распределено в полимерном матриксе. В желудочно-кишечном тракте матрикс впитывает жидкость и превращается в гель, который равномерно высвобождает прамипексол в течение 24 ч. Поскольку прамипексол хорошо растворяется в жидкой среде, независимо от ее pH, активное вещество высвобождается из матрикса и всасывается на протяжении всего кишечника. Скорость опорожнения желудка и моторика кишечника не оказывают существенного влияния на действие препарата. Параметры всасывания не зависят также от того, принимается препарат натощак или после еды [2].
При разработке новой лекарственной формы была учтена возможность простого, одномоментного перехода от традиционной формы препарата к новой. Условием этого является то, что равные суточные дозы препарата с немедленным высвобождением (принимаемым 3 раза в день) и длительным высвобождение (принимаемым 1 раз в день) оказывают одинаковое противопаркинсоническое действие. Различие между новой и традиционной лекарственными формами прамипексола заключается лишь в скорости высвобождения активного вещества. Период полужизни прамипексола при применении обеих форм один и тот же, но благодаря контролируемому высвобождению обеспечивается более длительное поддержание терапевтической концентрации препарата в крови [5].
Эквивалентность действия равных суточных доз препаратов прамипексола с немедленным и длительным высвобождением была подтверждена в целом ряде клинических испытаний.
Следует подчеркнуть особое удобство новой лекарственной формы прамипексола, которую достаточно принимать один раз в день, для пациентов с ранней стадией БП, продолжающих работать. Во избежание побочного действия препарат назначается путем медленного титрования – по той же схеме, что и препарат с немедленным высвобождением. Для этого таблетки прамипексола с длительным высвобождением выпускаются в нескольких дозировках: 0,375, 0,75, 1,5, 3 и 4,5 мг. Лечение начинают с дозы 0,375 мг 1 раз в день, далее при условии хорошей переносимости каждые 7 дней переходят на следующий уровень дозы до достижения оптимального эффекта, максимально до 4,5 мг/сут (таблица 3). После достижения дозы 1,5 мг/сут титрование иногда целесообразно проводить медленнее, так как развитие полного лечебного эффекта может требовать нескольких недель. Рекомендуемая доза для поддерживающей терапии (как на ранней, так и на развернутой или поздней стадиях заболевания) может колебаться от 0,375 до 4,5 мг/сут. Наиболее часто применяемая доза – 3 мг/сут.
Таблица 3. Схема титрования прамипексола с длительным высвобождением.
| Неделя | Доза |
| 1-я | 0,375 мг 1 раз в день |
| 2-я | 0,75 мг 1 раз в день |
| 3-я | 1,5 мг 1 раз в день |
| 4-я | 2,25 мг 1 раз в день |
| 5-я | 3 мг 1 раз в день |
| 6-я | 3,75 мг 1 раз в день |
| 7-я | 4,5 мг 1 раз в день |
Лекарственные средства, эффективность которых при БП не доказана
В клинической практике широко применяют лекарственные средства, эффективность которых при БП не доказана и которые, следовательно, не могут быть рекомендованы к применению при этом заболевании. Прежде всего, к ним относятся так называемые ноотропные, нейрометаболические и вазоактивные препараты. Возможно, некоторые из этих средств оказывают определенное лечебное действие, но прежде, чем рекомендовать конкретный препарат, следует провести адекватную оценку его эффективности. Специалисты, занимающиеся лечением БП, прекрасно знают, что определенная часть больных хорошо реагирует на плацебо, причем этот эффект оказывается нестойким. Соответственно, затраты на подобное лечение оказываются бессмысленными.
Читайте также:


