Энцефалопатия с лакунарными очагами

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Причины дисциркуляторной энцефалопатии
Причины как острых, так и хронических нарушений мозгового кровообращения едины. Среди основных этиологических факторов рассматривают атеросклероз и артериальную гипертензию, нередко выявляют сочетание этих 2 состояний. К хронической недостаточности мозгового кровообращения могут привести и другие заболевания сердечно-сосудистой системы, особенно сопровождающиеся признаками хронической сердечной недостаточности, нарушения сердечного ритма (как постоянные, так и пароксизмальные формы аритмии), нередко приводящие к падению системной гемодинамики. Имеет значение и аномалия сосудов головного мозга, шеи, плечевого пояса, аорты, особенно её дуги, которые могут не проявляться до развития в этих сосудах атеросклеротического. гипертонического или иного приобретённого процесса. Большую роль в развитии дисциркуляторной энцефалопатии в последнее время отводят венозной патологии, не только интра-, но и экстракраниальной. Определённую роль в формировании хронической ишемии мозга могут играть компрессии сосудов, как артериальных, так и венозных. Учитывать следует не только спондилогенное влияние, но и сдавление изменёнными соседними структурами (мышцами, фасциями, опухолями, аневризмами). Неблагоприятно на мозговой кровоток влияет низкое артериальное давление, особенно у пожилых людей. У этой группы больных может развиваться поражение мелких артерий головы, связанное с сенильным артериосклерозом. Ещё одной причиной хронической недостаточности мозгового кровообращения у пожилых пациентов бывает церебральный амилоидоз - отложение амилоида в сосудах мозга, приводящее к дегенеративным изменениям стенки сосудов с возможным их разрывом.
Весьма часто дисциркуляторную энцефалопатию выявляют у больных сахарным диабетом, у них развиваются не только микро-, но макроангиопатии различной локализации. К хронической сосудистой мозговой недостаточности могут приводить и другие патологические процессы: ревматизм и иные заболевания из группы коллагенозов, специфические и неспецифические васкулиты, заболевания крови и т.д. Однако в МКБ-10 эти состояния совершенно справедливо классифицируют в рубриках указанных нозологических форм, что определяет правильную тактику лечения.
Как правило, клинически выявляемая энцефалопатия бывает смешанной этиологии. При наличии основных факторов развития хронической недостаточности мозгового кровообращения всё остальное многообразие причин данной патологии можно трактовать как дополнительные причины. Выделение дополнительных факторов, значительно отягощающих течение хронической ишемии головного мозга, необходимо для разработки правильной концепции этиопатогенетического и симптоматического лечения.
Причины дисциркуляторной энцефалопатии
- атеросклероз;
- артериальная гипертензия.
- болезни сердца с признаками хронической недостаточности кровообращения;
- нарушения сердечного ритма;
- аномалии сосудов, наследственные ангиопатии;
- венозная патология;
- компрессия сосудов;
- артериальная гипотензия;
- церебральный амилоидоз;
- сахарный диабет;
- васкулиты;
- заболевания крови.
Патогенез дисциркуляторной энцефалопатии
Указанные выше заболевания и патологические состояния приводят к развитию хронической гипоперфузии мозга, то есть к длительному недополучению мозгом основных метаболических субстратов (кислорода и глюкозы), доставляемых током крови. При медленном прогрессировании дисфункции мозга, развивающейся у больных с хронической недостаточностью мозгового кровообращения, патологические процессы разворачиваются прежде всего на уровне мелких мозговых артерий (церебральная микроангиопатия). Распространённое поражение мелких артерий вызывает диффузное двустороннее ишемическое поражение, в основном белого вещества, и множественные лакунарные инфаркты в глубинных отделах мозга. Это приводит к нарушению нормальной работы мозга и развитию неспецифических клинических проявлений - энцефалопатии.
Для адекватной работы мозга необходим высокий уровень кровоснабжения. Головной мозг, масса которого составляет 2,0-2,5% массы тела, потребляет 20% циркулирующей в организме крови. Величина мозгового кровотока в полушариях в среднем составляет 50 мл на 100 г/мин, но в сером веществе она в 3-4 раза выше, чем в белом, а также существует относительная физиологическая гиперперфузия в передних отделах мозга. С возрастом величина мозгового кровотока снижается, исчезает и фронтальная гиперперфузия, что играет свою роль в развитии и нарастании хронической недостаточности мозгового кровообращения. В условиях покоя потребление мозгом кислорода составляет 4 мл на L00 г/мин, что соответствует 20% всего кислорода, поступающего в организм. Потребление глюкозы составляет 30 мкмоль на 100 г/мин.
В сосудистой системе мозга выделяют 3 структурно-функциональных уровня:
- магистральные артерии головы - сонные и позвоночные, несущие кровь к мозгу и регулирующие объём мозгового кровотока;
- поверхностные и перфорирующие артерии мозга, распределяющие кровь по различным регионам мозга;
- сосуды микроциркуляторного русла, обеспечивающие метаболические процессы.
При атеросклерозе изменения первоначально развиваются преимущественно в магистральных артериях головы и артериях поверхности мозга. При артериальной гипертензии страдают прежде всего перфорирующие интрацеребральные артерии, питающие глубинные отделы мозга. Со временем при обоих заболеваниях процесс распространяется на дистальные отделы артериальной системы и происходит вторичная перестройка сосудов микроциркуляторного русла. Клинические проявления хронической недостаточности мозгового кровообращения, отражающие ангиоэнцефалопатию, развиваются, когда процесс локализуется преимущественно на уровне микроциркуляторного русла и в мелких перфорирующих артериях. В связи с этим мера профилактики развития хронической недостаточности мозгового кровообращения и её прогрессирования - адекватное лечение основного фонового заболевания или заболеваний.
Мозговой кровоток зависит от перфузионного давления (разницы между системным артериальным давлением и венозным давлением на уровне субарахноидального пространства) и сопротивления мозговых сосудов. В норме благодаря механизму ауторегуляции мозговой кровоток остаётся стабильным, несмотря на колебания артериального давления от 60 до 160 мм рт.ст. При поражении церебральных сосудов (липогиалиноз с развитием ареактивности сосудистой стенки) мозговой кровоток становится в большей степени зависимым от системной гемодинамики.
Известна определённая последовательность атеросклеротического поражения сосудов: сначала процесс локализуется в аорте, затем в коронарных сосудах сердца, далее в сосудах мозга и позже - в конечностях. Атеросклеротическое поражение сосудов мозга бывает, как правило, множественным, локализуясь в экстра- и интракраниальных отделах сонных и позвоночных артерий, а также в артериях, формирующих виллизиев круг, и его ветвях.
Многочисленными исследованиями показано, что гемодинамически значимые стенозы развиваются при сужении просвета магистральных артерий головы на 70-75%. Но мозговой кровоток зависит не только от выраженности стеноза, но и от состояния коллатерального кровообращения, способности мозговых сосудов изменять свой диаметр. Указанные гемодинамические резервы мозга позволяют существовать бессимптомным стенозам без клинических проявлений. Однако даже при гемодинамически незначимом стенозе будет практически обязательно развиваться хроническая недостаточность мозгового кровообращения. Для атеросклеротического процесса в сосудах головного мозга характерны не только локальные изменения в виде бляшек, но и гемодинамическая перестройка артерий на участке, локализованном дистальнее стеноза или окклюзии.
Большое значение имеет и структура бляшек. Так называемые нестабильные бляшки приводят к развитию артерио-артериальных эмболии и острых нарушений мозгового кровообращения, чаще по типу транзиторных ишемических атак. Кровоизлияние в такую бляшку сопровождается быстрым увеличением её объёма с нарастанием степени стеноза и усугублением признаков хронической недостаточности мозгового кровообращения.
При поражении магистральных артерий головы мозговой кровоток становится очень зависимым от системных гемодинамических процессов. Особенно чувствительны такие пациенты к артериальной гипотензии, способной привести к падению перфузионного давления и нарастанию ишемических расстройств в головном мозге.
В последние годы рассматривают 2 основных патогенетических варианта хронической недостаточности мозгового кровообращения. В их основу положены морфологические признаки - характер повреждения и преимущественная локализация. При диффузном двустороннем поражении белого вещества выделяют лейкоэнцефалопатический, или субкортикальный бисвангеровский, вариант дисциркуляторной энцефалопатии. Второй - лакунарный вариант с наличием множественных лакунарных очагов. Однако на практике нередко встречают смешанные варианты. На фоне диффузного поражения белого вещества обнаруживают множественные мелкие инфаркты и кисты, в развитии которых, помимо ишемии, важную роль могут играть повторные эпизоды церебральных гипертонических кризов. При гипертонической ангиоэнцефалопатии лакуны бывают расположены в белом веществе лобной и теменной долей, скорлупе, мосту, таламусе, хвостатом ядре.
В условиях хронической гипоперфузии - основного патогенетического звена хронической недостаточности мозгового кровообращения - механизмы компенсации могут истощаться, энергетическое обеспечение мозга становится недостаточным, в результате сначала развиваются функциональные расстройства, а затем и необратимое морфологическое повреждение. При хронической гипоперфузии мозга выявляют замедление мозгового кровотока, уменьшение содержания кислорода и глюкозы в крови (энергетический голод), оксидантный стресс, сдвиг метаболизма глюкозы в сторону анаэробного гликолиза, лактат-ацидоз, гиперосмолярность, капиллярный стаз, склонность к тромбообразованию, деполяризацию клеточных мембран, активацию микроглии, начинающей синтезировать нейротоксины, что наряду с другими патофизиологическими процессами приводит к гибели клеток. У больных с церебральной микроангиопатией нередко выявляют и гранулярную атрофию корковых отделов.
Мультифокальное патологическое состояние мозга с преимущественным поражением глубинных отделов приводит к нарушению связей между корковыми и подкорковыми структурами и формированию так называемых синдромов разобщения.
Снижение мозгового кровотока облигатно сочетается с гипоксией и приводит к развитию энергетического дефицита и оксидантного стресса - универсального патологического процесса, одного из основных механизмов повреждения клеток при ишемии мозга. Развитие оксидантного стресса возможно в условиях как недостаточности, так и избыточности кислорода. Ишемия оказывает повреждающее воздействие на антиоксидантную систему, приводя к патологическому пути утилизации кислорода - образованию его активных форм в результате развития цитотоксической (биоэнергетической) гипоксии. Высвободившиеся свободные радикалы опосредуют повреждение клеточных мембран и митохондриальную дисфункцию.
Острые и хронические формы ишемического нарушения мозгового кровообращения могут переходить одна в другую. Ишемический инсульт, как правило, развивается на уже изменённом фоне. У больных выявляют морфофункциональные, гистохимические, иммунологические изменения, обусловленные предшествующим дисциркуляторным процессом (в основном атеросклеротической или гипертонической ангиоэнцефалопатией), признаки которого значительно нарастают в постинсультном периоде. Острый ишемический процесс в свою очередь запускает каскад реакций, часть из которых завершается в остром периоде, а часть сохраняется на неопределённый срок и способствует возникновению новых патологических состояний, приводящих к нарастанию признаков хронической недостаточности мозгового кровообращения.
Патофизиологические процессы в постинсультном периоде проявляются дальнейшим повреждением гематоэнцефалического барьера, микроциркуляторными нарушениями, изменением иммунореактивности, истощением системы антиокси-дантной защиты, прогрессированием эндотелиальной дисфункции, истощением антикоагулянтных резервов сосудистой стенки, вторичными метаболическими расстройствами, нарушением компенсаторных механизмов. Происходит кистозная и кистозно-глиозная трансформация повреждённых участков мозга, отграничивающая их от морфологически не повреждённых тканей. Однако на ультраструктурном уровне вокруг некротизированных клеток могут сохраняться клетки с апоптозоподобными реакциями, запущенными в остром периоде инсульта. Всё это приводит к усугублению хронической ишемии мозга, возникающей до инсульта. Прогрессирование же цереброваскулярной недостаточности становится фактором риска развития повторного инсульта и сосудистых когнитивных расстройств вплоть до деменции.
Постинсультный период характеризуется нарастанием патологии сердечнососудистой системы и нарушениями не только церебральной, но и общей гемодинамики.
В резидуальном периоде ишемического инсульта отмечают истощение антиагрегационного потенциала сосудистой стенки, приводящее к тромбообразованию, нарастанию степени выраженности атеросклероза и прогрессированию недостаточности кровоснабжения мозга. Особое значение этот процесс имеет у пожилых больных. В этой возрастной группе, независимо от предшествующего инсульта, отмечают активизацию системы свёртывания крови, функциональную недостаточность противосвёртывающих механизмов, ухудшение реологических свойств крови, расстройства системной и локальной гемодинамики. Процесс старения нервной, дыхательной, сердечно-сосудистой системы приводит к нарушению ауторегуляции мозгового кровообращения, а также к развитию или нарастанию гипоксии мозга, в свою очередь способствующей дальнейшему повреждению механизмов ауторегуляции.
Однако улучшение мозгового кровотока, ликвидация гипоксии, оптимизация метаболизма могут уменьшить выраженность нарушения функций и способствовать сохранению мозговой ткани. В связи с этим весьма актуальны своевременная диагностика хронической недостаточности мозгового кровообращения и адекватное лечение.

[1], [2], [3], [4], [5], [6], [7], [8], [9]
Лакунарный инсульт – вариант ОНМК ишемического типа. В мире ежегодно диагностируется более 15 млн. случаев инсульта, который становится причиной инвалидизации и социальной дезадаптации. До 40% пациентов, перенесших инсульт, умирают на протяжении следующего года. Доля инсультов ишемического типа в общей массе ОНМК составляет 70-85%. Лакунарная форма является подтипом ишемического инсульта и в его структуре занимает 15-30%.
Характеристика
Лакунарный инсульт – это такая форма нарушения кровотока в системе головного мозга, которая относится к ОНМК ишемического типа, что предполагает схожие механизмы развития. Патология характеризуется появлением множественных мелких (диаметр преимущественно не превышает 15 мм) очагов, сосредоточенных в нескольких или одном артериальном бассейне.
Лакунарный инсульт – это прекращение кровотока на ограниченном участке мозга, который снабжается 1 небольшой (диаметр просвета около 40–80 мкм) артерией, что приводит к патологическим процессам, протекающим по ишемическому типу. Лакунарный инсульт развивается как следствие болезней сосудов, питающих головной мозг.
Слабо развитая система коллатерального кровообращения в бассейнах мелкокалиберных перфорирующих (соединяющих поверхностные и глубокие сосуды в церебральной кровеносной сети) артерий обуславливает острую недостаточность кровоснабжения ограниченного участка ткани при сужении или закупорке сосудистого русла. Стеноз (сужение) или закупорка русла происходят вследствие причин:
- Липогиалиноз (утолщение сосудистых стенок фракциями гиалиновой природы с последующим сужением просвета).
- Фибриноидный некроз (отмирание тканей стенок сосуда и соединительных волокон).
- Микроатерома (мелкие кистозные образования на артериальных стенках).
- Тромбоз (закупорка сосудистого просвета кровяным сгустком).
Перечисленные факторы способствуют образованию локального очага ишемии, где при ее хроническом течении происходит инфаркт мозга. Локализация патологического очага – чаще глубинные слои полушарий или мозговой ствол. По данным нейровизуализации, 80% очагов обнаруживается в перивентрикулярной (рядом с желудочковой системой) зоне, таламусе и в области базальных ганглиев. Остальные 20% очагов выявляются в зоне мозгового ствола и мозжечка.
Корковые отделы не вовлекаются в патологический процесс, что обусловлено наличием разветвленной капиллярной сети, которая обеспечивает коллатеральный (обходной, параллельный основному руслу) кровоток. Лакуна – то же самое, что патологический очаг, полость в мозговом веществе, которая образуется в процессе развития лакунарного инфаркта (повреждение нервной ткани, спровоцированное недостаточностью кровоснабжения с последующими некротическими изменениями в ней). Особенности ЛИ:
- Клиническая картина представлена одним из вариантов лакунарного синдрома.
- Нейровизуализация (КТ, МРТ) показывает удовлетворительное состояние мозговых структур или наличие небольших очагов ишемии и некроза, не превышающих в диаметре 15 мм, субкортикальной (подкорковой) или стволовой локализации.
- Хроническое течение с эпизодами обострения.
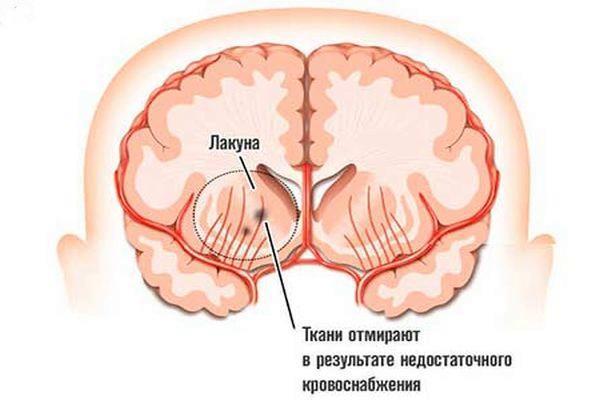
Причины возникновения и патогенез
Основная причина лакунарного инсульта – ишемические процессы на локальном участке мозга. В патогенезе лакунарного инсульта, который является вариантом ОНМК ишемического типа, участвуют заболевания сосудов, питающих головной мозг. Церебральная микроангиопатия (масштабное поражение капилляров), провоцирующая развитие ОНМК лакунарного типа, обусловлена факторами: атеросклерозом стенозирующего типа (проявляется сужением сосудистого просвета), устойчивой артериальной гипертензией.
В стенках перфорантных сосудов происходят патологические изменения – липогиалиноз и микроатерома. Формирование атеромы с последующим разрастанием соединительной ткани приводит к устойчивому сокращению сосудистого просвета. Нарушение архитектоники (нормальное строение) сосудистой стенки сопровождается отложением гиалина (стекловидное вещество белкового происхождения) под слоем интимы и инфильтрацией (пропитывание) макрофагами (клетки, взаимодействующие с бактериями, отмершими клетками, чужеродными для организма частицами, и устраняющие их).
Реже недостаточность кровоснабжения участка мозга связана с церебральной эмболией, когда эмбол (частица, присутствующая в кровотоке, но не типичная для крови) закупоривает не перфорантный сосуд, а питающую его артерию. Очаги лакунарного инфаркта выявляются у 50% пациентов с диагностированным эндокардитом (воспаление внутренней оболочки сердца) инфекционного генеза, что обусловлено закупоркой эмболами мелких церебральных сосудов.
В этом случае очаги поражения нервной ткани чаще обнаруживаются в бассейне концевых ответвлений средних церебральных артерий или в глубинных слоях полушарий. Данные нейровизуализации, свидетельствующие о наличии лакун у пациентов, которые не страдают сахарным диабетом или артериальной гипертензией, подтверждают эмболическую природу некоторых лакунарных инфарктов. Микроангиопатия может развиваться без участия артериальной гипертензии под воздействием других провоцирующих факторов:
- Почечная недостаточность.
- Заболевания печени.
- Дисфункция поджелудочной железы.
- Алкоголизм.

Перечисленные заболевания сопровождаются повреждением мелкокалиберных церебральных сосудов, что проявляется повышением проницаемости тканей сосудистой стенки. В данном случае ведущая роль в патогенезе отводится периваскулярному (в мозговой ткани, прилегающей к церебральному сосуду) отеку, а не ишемии.
Инфаркт лакунарного типа обуславливает и является предвестником развития обширного инсульта. Очаги ишемии отличаются малыми размерами, возникают как следствие непроходимости небольшой артерии, снабжающей кровью локальный участок. Патологические процессы, участвующие в патогенезе:
- Дисфункция эндотелия стенок капилляров.
- Микроэмболия (присутствие в крови частиц, не свойственных физиологической жидкости, что часто приводит к закупорке сосудистого просвета).
- Окклюзия (непроходимость) сосудистого русла.
- Олигемия (уменьшение общего количества крови в кровеносной сети), которая чаще развивается на фоне микроангиопатии, мерцательной аритмии, протекающей в хронической форме, сердечной недостаточности.
Лакунарный инсульт – это такая патология, которая может привести к развитию деменции даже при наличии единичных лакун в стратегически важных зонах мозга (белое вещество в области лобных долей, угловая извилина, медиобазальный, расположенный ближе к срединной плоскости корковый слой височного отдела), ответственных за интеллектуальную деятельность, что объясняет важность своевременной диагностики и лечения.
Симптоматика
Инфаркты лакунарного типа в 80% случаев протекают бессимптомно, что препятствует своевременной диагностике. Бессимптомные инфаркты, сочетающиеся с диффузным поражением белого вещества, приводят к когнитивным нарушениям, которые ассоциируются с сосудистой деменцией и являются предикторами (прогностический критерий) инсульта ишемического или геморрагического типа.
Уровень снижения когнитивных функций коррелирует с количеством перенесенных эпизодов ОНМК. Другие факторы, влияющие на ухудшение высших корковых функций: артериальная гипертензия, сахарный диабет в анамнезе. Лакунарный инсульт – это нарушение кровообращения на локальном участке мозговой ткани. Симптомы выражены в острый период. Проявления при хроническом течении чаще незначительны и связаны преимущественно с нарушением когнитивных функций:
- Ухудшение памяти и мыслительной деятельности.
- Снижение работоспособности.
- Быстрая утомляемость.
- Раздражительность, эмоциональная лабильность.

Большинство лакунарных инсультов, которые затрагивают локальные участки головного мозга, остаются не диагностированными даже в острой стадии течения из-за отсутствия выраженных симптомов. В стадии хронического течения чаще наблюдаются моторные расстройства, в том числе нарушение двигательной координации. Выделяют 5 типичных лакунарных синдромов (комплекс симптомов):
- Двигательный. Проявляется изолированной гемиплегией (паралич, невозможность совершения произвольных движений в одной половине туловища).
- Сенсорный. Проявляется изолированной гемигипестезией (ухудшение чувствительности в одной половине туловища).
- Смешанный (сенсомоторный).
- Дизартрии (расстройство речи, связанное с нарушением иннервации мышц речевого аппарата) и неловкой кисти (мышечная слабость, парез руки).
- Атактический гемипарез (нарушение равновесия с отклонением туловища в одну сторону, сопровождающееся головокружением и затруднениями при совершении произвольных точных движений).
У 60% пациентов обнаруживаются сочетанные неврологические симптомы. При лакунарном инфаркте пациенты обращаются за медицинской помощью по поводу патологических состояний и заболеваний, затрагивающих головной мозг, таких как дисциркуляторная энцефалопатия и неврологическая симптоматика (моторная дисфункция, нарушение двигательной координации, расстройство чувствительности). У многих пациентов в анамнезе выявляются повторные ТИА (ишемическая атака преходящего типа).
Диагностика
Клиническая картина при лакунарном инсульте не дает представления о точных причинах патологии. При эмболическом генезе в ходе исследования в формате МРТ выявляется диффузное очаговое поражение мозговой ткани в сочетании с эмболией кардиального или артерио-артериального типа. Микроэмболические сигналы наблюдаются в ходе допплеровского сканирования в области церебральных артерий. Общие диагностические мероприятия:
- Анализ факторов риска, провоцирующих инсульт.
- Определение неврологического статуса.
- Нейровизуализация (МРТ, КТ) мозговых структур.
- Эхокардиография.
- Дуплексное сканирование церебральных артерий.
- Допплерография церебральных артерий.
Анализ крови проводится, чтобы определить биохимические характеристики крови и показатели свертываемости. В ходе нейровизуализации выявляются множественные мелкие очаги поражения мозговой ткани, лейкоареоз (некротизированные участки белого вещества), тканевую атрофию (истощение). МРТ считается более информативным методом для обнаружения диффузных очаговых поражений мозгового вещества. Показаны консультации невролога, кардиолога.

Лечение
Лакунарный инсульт преимущественно является осложнением артериальной гипертензии, по этой причине лечение направлено на коррекцию показателей артериального давления и нормализацию кровоснабжения головного мозга. Чтобы предотвратить прогрессирование ухудшения когнитивных функций, обусловленное нарушением церебрального кровотока хронического течения, применяют препараты групп:
- Корректоры церебрального кровообращения.
- Антиагреганты.
- Нейропротекторы.
Адекватное лечение артериальной гипертензии на 30% сокращает количество эпизодов ОНМК. Пациентам с инфекционным эндокардитом показано оперативное вмешательство с целью санации патологического очага с последующим назначением антибактериальных препаратов.
При стенозе, который сопровождается сужением сонной артерии на 50-70%, проводится каротидная эндартерэктомия (удаление эмбола, посторонних тканей, перекрывающих русло) или баллонная ангиопластика (очистка сосудистого русла и установка в полость суженной артерии стента для восстановления нормального кровотока).
Последствия и прогноз
Последствия лакунарного инсульта связаны с нарушением функций головного мозга, что проявляется двигательными, сенсорными и когнитивными расстройствами. ЛИ – прогностический критерий, указывающий на высокий риск развития в ближайшем будущем обширного инсульта ишемического или геморрагического типа. По данным статистики, в России насчитывается более 1 млн. пациентов, у которых наблюдаются постинсультные осложнения.
Для лакунарного подтипа ишемического инсульта характерен меньший риск смертельного исхода, поэтому прогноз жизни относительно благоприятный, однако восстановление функций головного мозга у пациентов, перенесших ЛИ, проходит медленно и в меньшем объеме. Статистика показывает, ЛИ в 37% случаев вызывает устойчивые когнитивные расстройства умеренной и тяжелой степени, в том числе деменцию.
Лакунарный инсульт – предвестник ОНМК ишемического или геморрагического типа. Хроническое течение ишемии ограниченных, стратегически важных участков мозга может привести к развитию деменции и неврологических нарушений.
Разрушение структур ЦНС бывает очаговым и диссеминированным, то есть имеющим множественные зоны повреждения. Определить, как идет процесс, позволяет МРТ (магнитно-резонансная томография). С помощью нее врач-диагност визуально (по снимкам) оценивает состояние нервной ткани.
Очаговое поражение головного мозга – что это такое и как оно проявляет себя? В первую очередь – это симптом патологии, из-за которой на одном из участков органа происходит нарушение работоспособности соответствующих структур, о чем сигнализирует появление неврологических отклонений.

Снимки МРТ позволяют выявить все патологии, которые затрагивают ткани головного мозга. Зоны поражения определяю по изменению окраски, эхогенности отдельных участков коры или других структур органа. С помощью полученных данных специалисты измеряют площадь разрушенного участка, а также прогнозируют процесс развития патологии.
Очаговое поражение головного мозга может быть следствием:
- Демиелинизации;
- Наличия новообразований;
- Отека тканей;
- Нарушения кровообращения;
- Глиоза (замещение функциональных клеток глиальной тканью).
Проявления патологии зависят от места расположения очага поражения. Поэтому МРТ-диагностика считается самым информативным методом выявления заболеваний ЦНС.
По характеру расположения очаги поражения головного мозга бывают:
- Юкстакортикальные;
- Перивентрикулярные;
- Лакунарные.

Перивентрикулярное расположение очагов разрушения диагностируется при гипоксически-ишемическом поражении вещества мозга. В этом случае они располагаются вблизи желудочков.
Лакунарные очаги поражения являются следствием повреждения глубинных артерий. Они располагаются в толще белого вещества вдоль кровеносных сосудов. Обычно их диаметр варьируется в пределах 1–20 мм.
Характеризуется наличием областей разрушения миелиновой оболочки нервных волокон. Из-за этого на участке головного мозга нарушается передача нервных импульсов между нейронами, что негативно сказывается на работоспособности ЦНС.

Разрушение тканей по этому типу наблюдаются при рассеянном склерозе, мультифокальной лейкоэнцефалопатии, болезни Марбурга, остром диссимулирующем энцефаломиелите, болезни Девика.
При этих заболеваниях Мрт-картина идентична: на снимках хорошо визуализируются единичные или множественные белые пятна, которые располагаются в одном или нескольких отделах мозга. Размер областей зависит от степени заболевания, что подтверждается наличием и силой неврологических отклонений.
На данный момент единого представления о периваскулярных пространствах нет. Некоторые ученые считают, что они окружают только артерии, а другие – все крупные кровеносные сосуды, пронизывающие головной мозг. Одни описывают их, как пространство, которое располагается между стенкой сосуда и нервной тканью, другие – как естественное продолжение подпаутинной и мягкой мозговой оболочки.

Первикулярные пространства выполняют сразу несколько функций:
- Участвуют в циркуляции ликвора;
- В них происходит обмен веществ между ликвором и тканями мозга;
- Являются частью гематоэнцефалического барьера;
- Содержат иммунокомпетентные клетки, то есть с помощью них происходит иммунорегуляция в тканях органа.
Периваскулярные пространства занимают небольшой объем, поэтому у здорового человека на МРТ-снимке их не видно.
При опасных состояниях, например, перед инсультом, у заболевшего повышается ВЧД за счет увеличения объема спинномозговой жидкости. Это ведет к расширению полости между сосудами мозга и нервной тканью. Вместе с этим процессом повышается эхогенность участка, что на Мрт-снимке проявляется в виде возникновения белого пятна.
Заболевание характеризуется потерей нейронов и снижением числа синаптических связей между ними. Это ведет к уменьшению толщины серого вещества и выраженной атрофии пораженных участков.

На МРТ-снимках появляются темные пятна, которые свидетельствуют о некрозе клеток головного мозга. Точный диагноз ставится по итогу нескольких обследований, то есть в динамике.
Характеризуется накоплением жидкости в клетках головного и межклеточном пространстве. За счет этого увеличивается объема органа и повышается внутричерепное давление.

В зоне поражения на МРТ-снимке присутствует светлое пятно, которое по мере усугубления процесса увеличивается и постепенно охватывает весь орган.
Появляются в результате замещения функциональных структур головного мозга на соединительную ткань. Являются следствием дегенеративных процессов в ЦНС – недостатка кислорода, энцефалопатии, рассеянного склероза, энцефалита.
Причины
О том, какие очаги в головном мозге на МРТ при каких заболеваниях выявлены может рассказать только врач. И поэтому, необходимо проведение диагностики и получения данных после исследования.
Очаги поражения нервной ткани в головном мозге присутствуют на МРТ-снимках при следующих заболеваниях:
- Атеросклероз;
- Ангиопатия;
- Гипертония;
- Рассеянный склероз;
- Васкулит;
- Болезнь Бенье;
- Нейросифилис, клещевой боррелиоз;
- Прогрессирующая мультифокальная лейконцефалопатия;
- Рассеянный энцефаломиелит.
Их наличие может быть следствием отравления угарным газом, ЧМТ, ее осложнений, контузии.
У маленьких детей хромосомный сбой, гипоксия, неправильный образ жизни беременной также могут спровоцировать появление множественных очагов поражения головного мозга.
Симптомы
Патологии ЦНС, которые характеризуются наличием очагов поражения, проявляют комплекс схожих симптомов:
В зависимости от места расположения патологического участка у пациента могут наблюдаться:
- Отсутствие самоконтроля и самокритики (при разрушении лобной части больших полушарий);
- Нарушение социальных норм (очаги располагаются в толще органа);
- Появляется раздражительность, злость, поведение выходит за рамки нормального: больной ведет себя вызывающе, странно, импульсивно.
По мере усугубления заболевания проявления поражения структур ЦНС усиливаются.
Диагностика
Обнаружить очаги поражения вещества головного мозга позволяет МРТ-диагностика. В процессе ее проведения врач-диагност получает серию снимков послойного изображения структур органа, по которым впоследствии ставится диагноз.
Также с ее помощью можно выявить причину произошедших изменений:
- Если единичный очаг поражения располагается в правой лобной доле, то это указывает на хроническое повышение артериального давления или на перенесенный ранее гипертонический криз.
- Наличие мелких диффузных изменений в коре свидетельствует о развитии заболеваний сосудистого генеза.
- Если очаги демиелинизации находятся в теменной зоне полушарий, то это означает, что у заболевшего нарушено кровообращение в позвоночных артериях.
- При болезни Альцгеймера или болезни Пика на снимках отмечается наличие множества черных точек. Они свидетельствуют о некрозе нервной ткани.
- Ярко-белые точки сигнализируют об остром нарушении кровоснабжения органа.
- Одиночные очаги глиоза свидетельствуют об эпилепсии, гипоксии, хронической гипертонии, родовой травме.
- Единичные субкортикальные гиподенсные очаги регистрируются после инфаркта и ишемии головного мозга.
Подтверждается диагноз во время приема невролога. Он, проводя специальные тесты, оценивает работу ЦНС: реакцию, рефлексы, координацию движений, синхронность мышц-сгибателей и разгибателей. Психиатр изучает психическое состояние заболевшего: восприятие окружающего мира, когнитивные способности.
Лечение
Терапия при очаговом поражении головного мозга направлена на устранение причины возникновения изменений и восстановление функций органа.
Например, если патологию вызвало заболевание, характеризующееся повышением артериального давления, то пациенту предписывается прием препаратов, снижающих АД. Это могут быть мочегонные, блокаторы кальциевых каналов, или бета-адреноблокаторы.

Восстановление мозговой активности и устранение патологических явлений осуществляется с помощью препаратов, повышающих метаболизм в нервных тканях: ноотропов. Также применяются средства улучшающие кровоснабжение, реологические свойства крови, понижающие потребность к кислороду.
Симптоматическое лечение направлено на снижение проявлений патологии: прием противосудорожных, противоэпилептических препаратов, антидепрессанты, при чувстве тревоги – транквилизаторов.
Читайте также:


