Инсулин в центральной нервной системе
Глюкоза и нейроны
Одни нейроны являются глюкозовозбудимыми, в то время как другие - глюкозоингибируемыми. Их согласованная работа позволяет оценивать концентрацию глюкозы в мозге и, в зависимости от ее изменений, регулировать пищевое поведение, энергетический обмен и глюкозный гомеостаз в мозге и в периферических органах и тканях.
Транспорт глюкозы в нейронах в большинстве случаев не зависит от инсулина, что крайне важно, поскольку в противном случае при развитии инсулиновой резистентности или в условиях дефицита центрального инсулина глюкозный гомеостаз был бы полностью нарушен, что неизбежно должно было бы привести к нарушению центральной регуляции жизненно важных функций и, как следствие, к гибели организма. Большая часть глюкозных транспортеров в ЦНС представлена нечувствительными к инсулину глюкозного транспортера 1 (GLUT1-транспортерами), которых известно две изоформы.
Одна изоформа, с молекулярным весом 45 кДа, экспрессируется в астроцитах и не чувствительна к изменениям уровня глюкозы в мозге. Другая изоформа, с молекулярным весом 55 кДа, локализована в клетках эндотелия микрососудов мозга. В условиях гипогликемии экспрессия и функциональная активность 55 кДа изоформы GLUT1 повышаются, чтобы компенсировать недостаток глюкозы усилением ее закачки в клетки, в то время как в условиях гипергликемии ее экспрессия и активность не меняются.
Другой независимый от инсулина глюкозный транспортер GLUT2 экспрессируется в основном в аркуатных и паравентрикулярных ядрах и в латеральной области гипоталамуса, где он ко-локализован с глюкокиназой и рецептором 1-го типа сульфонилмочевины SUR1 (sulfonylurea receptor-1, SUR1), которые выполняют функции сенсоров глюкозы. В стриатуме, мозжечке, коре и гиппокампе центральную роль в обеспечении транспорта глюкозы играет GLUT3-транспортер, который активируется в условиях низкого содержания глюкозы в центральной нервной системе.
Инсулинозависимый транспортер GLUT4, который играет ключевую роль в транспорте глюкозы в периферических тканях, в ЦНС в незначительной степени представлен лишь в некоторых отделах мозга - в обонятельной луковице, зубчатой извилине гиппокампа, гипоталамусе, мозжечке, и регулируется инсулином менее эффективно, чем на периферии.
В то же время локализация и цикл активации GLUT4 в мозге почти не отличаются от таковых на периферии, а механизмы усиления транслокации GLUT4 к плазматической мембране в нейронах мозжечка, коры и гиппокампа в ответ на повышение уровня инсулина сходны с механизмами инсулин-индуцируемой транслокации GLUT4 в клетках периферических органов и тканей. В нейронах гиппокампа выявлены транспортеры GLUT8, которые также чувствительны к инсулину. Они активируются в условиях нарушенного метаболизма глюкозы, при гипергликемии и инсулиновом дефиците, что характерно для СД 1-го типа.
Наибольшую роль GLUT8-транспортеры играют в контроле глюкозного гомеостаза в гиппокампальных нейронах, осуществляя внутриклеточный транспорт глюкозы - из цистерн эндоплазматического ретилкулума в цитозоль, причем повышение уровня внеклеточной глюкозы приводит к быстрому и значительному повышению их активности. В отличие от GLUT4, транспортеры GLUT8 не транслоцируются к плазматической мембране.
Несмотря на то, что инсулин мозга сравнительно слабо влияет на гомеостаз глюкозы в ЦНС, действие инсулина на гипоталамические нейроны играет важную роль в контроле периферического гомеостаза глюкозы и ее синтеза печенью (рис. 3). Свой эффект инсулин реализует через повышение проводимости АТФ-зависимых K-каналов в чувствительных к глюкозе гипоталамических нейронах, что вызывает гиперполяризацию их плазматической мембраны.
Это вызывает усиление ответа гипоталамических нейронов на изменение уровня глюкозы в крови и индуцирует сигнал, передаваемый от них на двигательное ядро блуждающего нерва, с которого, в свою очередь, информация передается к печени. Другой механизм действия центрального инсулина на энергетический обмен на периферии состоит в регуляции сигнального каскада ИР/IRS/PI3K/AKT-киназа в гипоталамических нейронах.
Этот каскад является мишенью не только для инсулина, но и для различных орексигенных и анорексигенных сигнальных молекул, и отвечает за контроль пищевого поведения и периферического энергетического метаболизма, в том числе липолиза и липогенеза в жировой ткани (рис. 3). В отличие от периферии, где инсулин проявляет в основном анаболические свойства, в мозге он функционирует как катаболический гормон, обладая сильно выраженным анорексигенным действием.
Имеется много свидетельств в пользу того, что инсулин оказывает на нейрональные клетки выраженное нейротрофическое, нейропротекторное и нейромодуляторное действие, что указывает на его ключевую роль в функционировании центральной нервной системы.
Статистика
В экспериментах in vitro было показано, что инсулин стимулирует пролиферацию первичных культур астроцитов человека и крысы, и этот процесс сопровождается повышением экспрессии в них ряда компонентов инсулиновой сигнальной системы.

Рисунок 3. Взаимосвязь между центральной инсулиновой резистентностью и болезнью Альцгеймера: AВ - В-амилоидный пептид; GSK3В - киназа-3 гликогенсинтетазы; PI3K/AKT - фосфатидилинозитол-3-киназа и AKT-киназа
В первичных культурах нейронов инсулин повышал активность PI3K и нижележащших сигнальных белков, что вызывало усиление роста нейритов. Активируя сигнальный каскад ИР/IRS/PBK/mTOR в нейронах CA1-области гиппокампа, инсулин повышал экспрессию белка PSD-95 (dendritic scaffolding protein post-synaptic density-95, PSD-95), ответственного за синаптогенез и структурную реорганизацию нейрональных клеток. Стимуляция экспрессии белка PSD-95 может быть одним из молекулярных механизмов, опосредующих регуляторное влияние инсулина на синаптическую пластичность гиппокампальных нейронов.
Другим механизмом, через который инсулин реализует свое влияние на рост нейритов и формирование синапсов, является стимуляция экспрессии Tau-белка, также опосредуемая через сигнальный каскад ИР/IRS/PBK/mTOR. Как известно, Tau-белок тесно ассоциирован с микротрубочками нейрональных клеток и непосредственно вовлечен в процессы роста нейритов.
Для манифестации нейротрофических эффектов инсулина необходимо учитывать, что они в значительной степени зависят от концентрации гормона, что хорошо демонстрируют эксперименты с культурами стволовых нейрональных клеток человека. Следует отметить, что инсулин является обязательным компонентом культуральной жидкости, и в его отсутствие нейрональные клетки прекращают расти и быстро гибнут вследствие неапоптотической аутофагии.
Однако культивирование стволовых нейрональных клеток человека в среде со сравнительно высокими концентрациями инсулина также негативно сказывается на их выживаемости - в них усиливаются апоптотические процессы, что, в конечном итоге, приводит к их массовой гибели. Сравнительно низкие концентрации инсулина, напротив, подавляют апоптоз нейрональных клеток и способствуют их росту. Сходная картина наблюдается и в случае действия инсулина на дифференцированные нейроны.
В этой связи необходимо отметить, что в культурах стволовых нейрональных клеток грызунов негативное влияние высоких концентраций инсулина на выживаемость клеток не выявлялось, что свидетельствует о различиях в чувствительности к гормону нейронов, полученных из разных организмов. Причина гибели нейрональных клеток человека при их экспозиции с высокими концентрациями инсулина состоит в быстром развитии инсулиновой резистентности, в частности в значительном снижении ответа PI3K и AKT-киназы на обработку нейронов инсулином.
В основе нейропротекторного эффекта инсулина лежит его способность ингибировать апоптоз в нейрональных клетках, подавлять В-амилоидную токсичность, снижать окислительный стресс и стресс эндоплазматического ретикулума и предотвращать, таким образом, развитие ишемии. Нейропротекторный эффект инсулина реализуется через каскад PI3K/AKT-киназа/mTOR/p70-S6K-киназа.
Ингибирование mTOR с помощью рапамицина полностью блокирует антиапоптотическое действие инсулина и его нейропротекторный эффект, что свидетельствует об участии в его реализации протеинкиназы mTOR и нижележащей рибосомальной киназы p70-S6K. Показано также, что инсулин подавляет накопление в мозге фибрилл В-амилоидного полипептида. Это обеспечивает защиту нейрональных клеток и препятствует развитию нейродегенеративных процессов, ассоциированных с образованием В-амилоидных бляшек.
Центральный инсулин снижает негативное влияние окислительного стресса на нейроны, предотвращая в них митохондриальные дисфункции и восстанавливая окислительно-восстановительный баланс. Следует отметить, что в условиях повышения содержания активных форм кислорода в нейронах нарушается процессинг белков, ослабляются функции сигнальных каскадов и систем транспорта нейромедиаторов и нутриентов, в том числе глюкозы. Стимулируя захват глюкозы и синтез пирувата, инсулин восстанавливает образование внутриклеточного пула АТФ и снижает негативные последствия окислительного стресса в ЦНС.
Инсулин также снижает концентрации внесинаптосомального глютамата и у-аминомасляной кислоты, которые повышаются в условиях окислительного стресса, и тем самым предотвращает вызываемую этими нейромедиаторами токсичность, которая является пусковым механизмом для развития нейродегенерации. Следует отметить, что инсулин повышает уровень мочевой кислоты в центральной нервной системе, которая обладает выраженным антиоксидантным действием, и вместе с глутатионом, витаминами С и Е является важным компонентом нейрональной системы антиоксидантной защиты.
Одним из механизмов противоишемического эффекта инсулина мозга является индуцируемое им снижение уровня глюкозы в периферическом кровотоке, в основе чего лежит повышение чувствительности периферических тканей к инсулину, ведущее к усилению захвата глюкозы клетками, а также подавление глюконеогенеза в печени. Среди других механизмов необходимо отметить воздействие инсулина мозга на сигнальные и эффекторные белки, чья экспрессия и функциональная активность существенно меняются в условиях ишемии мозга.
Так инсулин предотвращает изменение активности JNК1/2-киназ, транскрипционного фактора Bcl-2 и каспазы-3 в гиппокампальных нейронах, которые вызываются ишемией/реперфузией мозга. Центральный инсулин в значительной степени восстанавливает активность других нейромедиаторных систем мозга, в том числе регулируемых у-аминомасляной кислотой, нарушенную в условиях ишемии.
Способность инсулина взаимодействовать с большим числом нейромедиаторных систем мозга и влиять на их активность лежит в основе его нейромодуляторного действия. Инсулин контролирует высвобождение нейропептидов и моноаминов, влияет на их транспорт и обратный захват в синаптической щели, регулирует функциональную активность рецепторов, специфичных для различных классов нейромедиаторов, контролирует активность ионных каналов.
Все вышесказанное свидетельствует о том, что инсулиновая сигнальная система занимает одно из центральных мест в интегративной сети мозга и играет исключительно важную роль в контроле нейрогенеза, синаптической пластичности, выживаемости нейрональных клеток. Вследствие этого нарушения в инсулиновой системе мозга самым неблагоприятным образом сказываются на функционировании всей ЦНС и нарушают центральную регуляцию биохимических и физиологических процессов на периферии.
Гипогликемия — это состояние, при котором уровень глюкозы в крови гораздо ниже нормы. Она может наблюдаться как у людей с диабетом, так и у людей без этого заболевания. У людей без диабета гипогликемия обычно связана с плохим и нерегулярным питанием, а также избыточными нагрузками, например в тренажерном зале, на соревнованиях, во время марафона и при других нагрузках. Также недиабетическая гипогликемия может быть вызвана приемом лекарственных препаратов.
Для людей, не больных диабетом, гипогликемия — состояние редкое, которое происходит нечасто, а гипогликемическая кома у них случается еще более редко. При понижении уровня сахара до критически низкого наступает кома, которая вызывает негативные последствия для всего организма, в особенности для нервной системы. В фатальной реакции задействованы такие мозговые структуры, как мозжечок, большие полушария, а также продолговатый мозг и его составляющие структуры. Кстати, кома может возникнуть не только при критически низком количестве углеводов в крови, но и при резком скачке показателей. Иногда промежуток между нормальным состоянием и наступлением комы настолько мал, что больной за несколько секунд переходит в коматозное состояние. В особо тяжелых случаях продолговатый мозг приходит в состояние паралича.
Такие изменения в состоянии человека грозят непредсказуемыми последствиями. Следует отметить, что подобные перепады уровня глюкозы гораздо чаще связаны с превышением дозы инсулина, которую получает человек, и намного реже зависят от принятой пищи или лекарственных препаратов, например, сульфаниламидов.
Стадии недиабетической гипогликемии
Гипогликемическая кома зависит от двух предшествующих процессов, в частности, нейрогликопении и возбужденным состоянием симпатической и адреналиновой системы. Нейрогликопения — это процесс, при котором в головном мозге критически не хватает глюкозы для обеспечения самых необходимых процессов. Перед тем, как впасть в гипогликемическую кому, больной испытывает различные изменения поведения, могут наблюдаться судороги, периодические потери сознания и только потом, без оказания помощи, наступает кома.
Глюкоза — важный компонент пищи и составляющая многих процессов в теле человека. Важен этот компонент и для мозга. Гормон инсулин в норме должен помогать сохранять нормальный уровень глюкозы и организм при этом будет работать без сбоев. Инсулин помогает глюкозе проникать в клетки, где она используется как топливо, обеспечивая основные функции
Основные причины недиабетической гипогликемии, факторы риска
Основные причины гипогликемии у недиабетиков заключаются в следующем:
- преддиабетическое состояние, которое вызывает дисбаланс инсулина;
- перенесенная операция на желудке, при которой пищевод слишком быстро переходит в тонкую кишку;
- редкие дефициты ферментов, которые не позволяют организму полноценно усваивать пищу.
Три типа этих нарушений объединяют так называемую реактивную гипогликемию. Но существует еще одна причина такого состояния — прием лекарственных препаратов.
- салицилаты (обезболивающие препараты);
- сульфаниламидные препараты (антибиотики);
- пентамидин (для лечения серьезных видов пневмонии);
- хинин (для лечения малярии).
Неблагоприятные факторы: алкоголизм или периодическое пьянство, серьезные заболевания печени, почек, сердца, низкий уровень кортизола, гормона роста, глюкагона, адреналина. Еще один фактор — опухоли поджелудочной железы, производящей инсулин и инсулиноподобный гормон (ИФР).
Симптомы гипогликемии
- чувство голода, ощущение пустоты в желудке;
- неустойчивость на ногах;
- сонливость, тревожность;
- потливость, раздражительность;
- нарушения речи (заплетающийся язык);
- тахикардия;
- избыточная бледность или покраснение лица;
- ощущение жара.
Гипогликемической коме предшествует онемение конечностей, языка, физическая слабость, мурашки на коже, вялость, звон в ушах, краткосрочная потеря сознания (с повторениями через равные промежутки времени в сторону уменьшения). Если подобное состояние было замечено у пациента, необходимо принять срочные меры профилактики, чтобы избежать комы. Для этого выполняется проверка уровня глюкозы в крови (низкий показатель — около 55 мг/дл или менее).
У больных нередко наблюдаются судороги. Если они начались, это прямой сигнал к тому, что вскоре может наступить инсулиновая кома. Для недиабетиков важен контроль количества препаратов, повышающих риск критической отметки глюкозы. Со стороны центральной нервной системы гипогликемия может быть более выражена при анализе спинномозговой жидкости, чем крови. Проявление симптомов не всегда зависит от степени гипогликемии. Если у больного наблюдается шумное дыхание, учащается пульс и дыхание имеет запах ацетона, это верные признаки предкоматозного состояния. Коварство состояния заключается еще и в том, что переходный период между критическими признаками и самой комой может пройти мгновенно. Отличительной особенностью являются судороги и потливость.
Лечение гипогликемии
Полностью зависит от причины, вызвавшей гипогликемию и кому. Основное лечение заключается в скорейшем устранении причин комы и непосредственно гипогликемии. Для профилактики низкого уровня глюкозы ежедневно необходимо съедать или выпивать 15 граммов углеводов. Разнообразная диета, частые и небольшие приемы пищи, а также ограничение продуктов, содержащих сахар, может помочь избежать критической степени гипогликемии.
Симптомы со стороны центральной нервной системы в большей степени соответствуют уровню глюкозы в спинномозговой жидкости, чем в крови, поэтому тяжесть этих симптомов не обязательно совпадает со степенью гипогликемии. Возможность медикаментозного отравления в основном зависит от затрудняющих дозировку значительных колебаний в реактивности к инсулину. Такие колебания имеют место не только у разных лиц, но и у одного и того же больного диабетом.
Что такое гиперинсулинизм, симптомы и лечение гиперинсулинизма
Гиперинсулинизм характеризуется неправильной и нерегулируемой секрецией инсулина из бета-клеток поджелудочной железы. При этом заболевании бета-клетки выделяют инсулин постоянно и секреция не регулируется уровнем глюкозы в крови (как это происходит у здоровых людей).
Действие инсулина вызывает гипогликемию. Это означает, что мозг не только лишен его самого важного топлива (глюкозы), но также и кетоновых тел, которые используются в качестве альтернативного топлива.
Как правило, бета-клетки высвобождают инсулин в ответ на уровень глюкозы в крови, то есть при употреблении углеводной пищи. Инсулин преобразует глюкозу в форму, в которой она может быть использована организмом.
Если преобразуется слишком много глюкозы, она хранится в печени и мышцах в виде гликогена. Гликоген может быть преобразован обратно в глюкозу, чтобы использоваться, когда глюкозы не будет.
При высоком кровяном уровне глюкозы, бета-клетки высвобождают больше инсулина, чтобы позволить глюкозе быть поглощенной из крови. Если уровень сахара низкий, бета-клетки высвобождают значительно меньшее количество инсулина или даже отключают выработку инсулина.
Это сохраняет уровень глюкозы в крови сбалансированным для всего тела и позволяет ему нормально функционировать.
При гиперинсулинизме люди находятся в зависимости от количества глюкозы, циркулирующей в крови, поэтому ее уровень должен поддерживаться на уровне выше 3,5 ммол /л.
Известно, что гиперинсулинизм передается по наследству по аутосомно-рецессивному или доминантному типу. Вторичные причины гиперинсулинизма: задержка внутриутробного развития, наличие у матери сахарного диабета, перинатальная асфиксия.
Существует два подтипа заболевания: диффузный и очаговый. Диффузный тип влияет на всю поджелудочную железу, тогда как очаговая форма — лишь на отдельные участки поджелудочной железы. Остальная ее часть анатомически и функционально остается нормальной.
Симптомы гиперинсулинизма: вялость, плохой аппетит и сонливость, судороги, потеря сознания.
Дети с подозрением на гиперинсулинизм должны пройти обследование, а уровень глюкозы в их крови должен поддерживаться в норме искусственно.
Лечение заключается в удалении пораженных участков поджелудочной железы (при диффузной форме) или полном удалении с пожизненным приемом лекарственных препаратов. Больной с этим диагнозом может находиться под наблюдением в дневном стационаре, а позже посещать врача раз в неделю для контроля самочувствия. Ребенок с гиперинсулинизмом после лечения должен правильно питаться, не подвергаться стрессам и по возможности вести умеренно-активный образ жизни.
Инсулинома – активная гормональная опухоль, причиной которой становятся в-клетки, островки Лангерганса, поджелудочной железы, выделяющая излишний инсулин, что неизбежно ведет к развитию гипогликемии.
Существуют доброкачественная (в 85-90% случаев) или злокачественная инсулинома (в 10-15% случаев). Болезнь чаще бывает у людей от 25 до 55 лет. Для тех, кто моложе болезнь не опасна.
Женщины подвержены заболеванию инсулиномой гораздо чаще, чем мужчины.
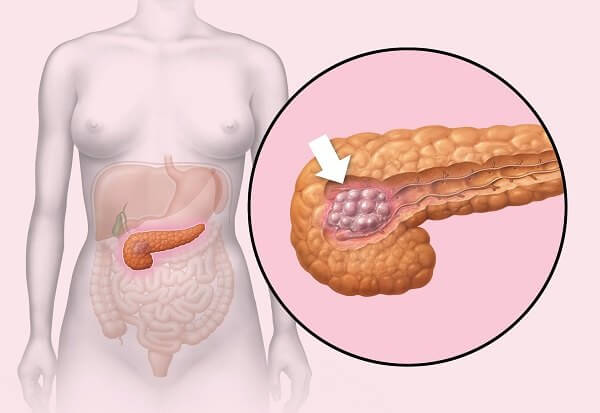
Инсулиномы могут появится в любой части поджелудочной железы, в некоторых вариантах она появляется в стенке желудка. Ее размеры 1,5 – 2 см.
- Особенности заболевания
- Причины инсулиномы
- Симптомы инсулиномы
- Диагностика
- Лечение инсулиномы
- Химиотерапия
- Профилактика
- Прогноз
- Видеозаписи по теме
Особенности заболевания
Инсулинома имеет следующие особенности:
- рост инсулиномы ведет к еще большему увеличению инсулина и понижению сахара в крови. Инсулинома синтезирует его постоянно, даже когда организму он не нужен;
- более восприимчивыми к гипогликемии считаются клетки мозга, для них глюкоза является главным энергетическим веществом;
- при инсулиноме происходит действие нейрогликопении, а при долговременной гипогликемии проявляются конфигурации ЦНС, с большими нарушениями.
- глюкоза в крови при норме снижается, но и синтезирование инсулина тоже уменьшается. Это является следствием нормального регулирования обмена веществ. В опухоли при уменьшении сахара синтез инсулина не снижается;
- при гипогликемии в кровь поступают гормоны норадреналинаа, появляются адренергические признаки;
- инсулинома по-разному синтезирует, бережет и отделяет инсулин. Она подпитывает и остальные клетки железы;
- форма опухоли похожа на форму пораженной ею клетки;
- инсулинома одна из видов инсуломы поджелудочной железы и занесена в МКБ;
- данной опухолью заражается 1 человек из 1,25 млн.чел.
Причины инсулиномы
Причины появления инсулиномы полностью неизвестны. Нашли лишь схожесть инсулиномы с эндокринным аденоматозом, способствующим возникновению опухолей, синтезирующих гормоны. У 80% заболевших болезнь появляется в поджелудочной железе.
Инсулинома не передается по наследству, и появляется довольно редко, но гораздо чаще остальных видов инсулом поджелудочной железы.
В организме связано все между собой и при обновление организма, мгновенно включаются связи за счет обработки, секретирования, и обмена веществ. Когда присутствует очевидная нехватка одних компонентов, то происходит их регуляция, также все делается, если обнаружен избыток каких-нибудь веществ.
Теоретически допускают, причины образования инсулином скрывается в неправильном функционировании пищеварительного тракта при заболеваниях. Тогда происходит нарушение деятельности всех органов в организме человека, потому что он является тем базовым органом, от которого зависит переработка всех веществ употребляемых человеком вместе с едой.
Предполагаемые причины заболевания:
- бессилие;
- долгое голодание;
- повреждение поступления углеводов через стены ЖКТ;
- острое либо хроническое действие энтероколитов;
- артротомия желудка;
- действие токсинов на печень;
- почечная глюкозурия;
- анорексия, вместе с неврозом;
- недостаток в крови тиреоидных гормонов;
- почечная недостаточность с понижением значения сахара в крови;
- понижение функций части гипофиза, угнетающе воздействующее на рост.
Исследования причин данного заболевания для его успешного лечения в настоящее время является одной из самых трудных задач медицины.
Симптомы инсулиномы

При инсулиноме симптомы следующие:
- у больного появляются беспорядочные и суетливые движения;
- возникает агрессия по отношению к окружающим;
- при разговоре возникает речевое возбуждение, часто бессмысленные фразы или звуки;
- усиливается слюноотделение и слюнотечение;
- приступы необоснованного веселья и эмоционального возбуждения;
- появляется спутанность сознания;
- возникают галлюцинации;
- неожиданно приподнятое настроение;
- проявляется отсутствие адекватности при оценке собственного состояния;
- мышечная слабость или иные нарушения движения мышц (атаксия);
- нарушения рефлексов конечностей при их сгибании и разгибании;
- снижается острота зрения;
- возникает учащенное сердцебиение;
- появляется состояние тревожности, страха;
- резкая сильная головная боль;
- преходящий паралич;
- боль, дискомфорт в момент перемещения глазных яблок;
- асимметрия лица, утрата мимики, отсутствие вкусовых ощущений.
Доктор нередко обнаруживает возникновение патологий, которых нет у здоровых людей. Больные подмечают смещение в худшую сторону памяти и интереса, они не могут делать обычную работу, возникает равнодушие к происходящему. Это проявляется и при маленьких опухолях.
Претензии и анамнез:
- утрата сознания утром на голодный желудок;
- рост веса с момента, как стали возникать приступы.
Показатели перед приступом:
- бессилие;
- потливость;
- покалывание губ, языка;
- головокружение;
- безразличие;
- сонливость и др.
Основные признаки приступа устраняются внутривенным введением 40% глюкозы.
Диагностика
Из-за ясных показателей по психическим отклонениям, инсулиному часто принимают за др. болезни. Неверно диагностируется эпилепсия, кровоизлияния, психозы. Знающий доктор при подозрении на инсулиному делает некоторое количество лабораторных исследований, а потом делает диагностику инсулиномы зрительным способом.
Нередко докторам, применяя обычные способы обследования никак не получается обнаружить инсулиному. Потому бывают ошибочные диагностики инсулиномы и лечатся совсем другие болезни.
Применяют следующие методы диагностирования:
- Ангиография — самый продуктивный способ диагностики инсулиномы. Она способствует нахождению сосудов, которые снабжают кровью опухоль. По объемам больших и маленьких сосудов получают представление о месте и поперечнике опухоли.
- Радиоиммунологический анализ для выявления количества инсулина.
- Компьютерная томография помогает найти инсулиномы больших размеров. Эффективность её находится в пределах 50-60%.
- Провокация гипогликемии. В течение 3 дней клиенты не принимают пищу в стационаре, используя только воду. Через 6 часов совершают тест, и потом снова через это же время его повторяют. Когда уровень сахара спускается до 3 ммоль/л, интервалы уменьшают. При уменьшении сахара до 2,7, и возникновении признаков гипогликемии, его прекращают. Их блокируют инъекцией глюкозы. Тест заканчивается обычно через 14 часов. Когда клиент в отсутствии результатов выдерживает 3 дня и ночи, диагноз инсулинома не диагностируется.
- Оценка уровня проинсулина. Проинсулин является предшественником инсулина. В норме порция проинсулина во всем инсулине 22%. При спокойном состоянии его более 24%, в опасной фазе – более 40%. Это позволяет довольно быстро диагностировать обострение заболевания и принять надлежащие меры.
- Анализ С-пептида. Вычисляют случаи приема инсулина инъекциями в отсутствии разрешения доктора. При хроническом использовании этот тест не дает правильного результата.
Про необходимость данных инструментальных исследований принимает решение доктор.
В основной массе случаев кратковременные инсулиновые отеки не сопровождаются нарушением функции внутренних органов. Инсулиновые отеки через некоторое количество дней проходят сами, не требуя особого излечения, не считая временной остановки в приеме дополнительной дозы инсулина. В некоторых вариантах назначаются диуретики.
Лечение инсулиномы
В основном инсулиному поджелудочной железы лечат хирургическим путем. Путем удаления из поджелудочной железы доброкачественной (реже злокачественное) опухоли у больного.
Оперативное лечение болезни имеет следующие особенности:
- у инсулиномы есть отчетливые края и отличительный бурый цвет, потому ее просто оперировать без причинения вреда органам;
- если опухоль по разным причинам не удалось найти, операцию больше не делают и ждут, когда она при росте станет заметнее и ее, возможно, будет удалить;
- успех проделанной операции расценивают определенным значением глюкозы в крови. Чем ближе к норме, тем успешнее прошло оперативное вмешательство;
- важно не допустить осложнений после операции и дать правильные методики пациентам для успешного восстановления ими своих сил и последующей нормальной жизни.
Трудности своевременной операции:
- неудовлетворительные характеристики пакреатических ферментов,
- состоятельная иннервация и кровоснабжение пораженной зоны;
- проблемы в доступе к больному органу;
- размещение вблизи жизненных принципиальных частей тела.
Все данные трудности настоятельно требуют кропотливой работы, верного выбора средства обезболивания и высочайшей техники выполнения операции.
Когда из-за самочувствия больного операция приостанавливается, применяют фенитоин и диазоксид.
1-ый продукт считается противоэпилептическим средством, 2-ой используется как сосудорасширяющее. Соединяет данные медикаменты одинаковое побочное действие – гипергликемия.
Таким образом, возможно годами удерживать сахар в крови почти на уровне стандартном. Вместе с ними применяют мочегонные. Их применяют, чтобы предотвратить вредное воздействие лекарства на почки и печень.
После оперативного вмешательства возможны следующие серьезные осложнения:
- панкреатит;
- свищи железы;
- панкреонекроз;
- перитонит;
- абсцесс брюшины.
Она нужна, когда заболевание перешло в опасную стадию и угрожает жизни. Используют стрептозоцин в композиции с фторурацилом, по статистике химиотерапия действуют на 60% больных.
Курс лечения продолжается 5 дней, повторение через 6 недель . Эти средства оказывают вредное воздействие на почки и печень, поэтому в дальнейшим для их нормального функционирования врачи применяют необходимые медикаменты.
Профилактика
Для предотвращения болезни можно порекомендовать следующее:
- не употреблять горячительные напитки;
- употреблять только здоровую пищу;
- не волноваться и быть спокойным;
- вовремя обнаруживать и лечить все эндокринные заболевания;
- измерять сахар в крови;
- постоянные осмотры у доктора, выполнять его рекомендации.
Люди, следящие за своим здоровьем, должны, прежде всего, обратить внимание на питание, потому что именно от него во многом зависит появление и развитие данного заболевания. Надо избегать тяжелой пищи и учреждений общественного питания. Стремиться постоянно, делать ежедневные физические упражнения.
Важно научиться правильно, очищать свой организм и все его органы, что многие забывают делать.
Прогноз
65-80% заболевших после операции идут на поправку. Своевременная диагностика и оперативное вмешательство способствует восстановлению центральной нервной системы.
Прогноз состояния больных после операции по факту таковой:
- смертность после операции – 5-10%;
- рецидив (повторение болезни) – 3%;
- при заболевании в последней стадии выживают не более 60% людей;
- в 10% клинических случаев имеется видоизменение, которое характеризуется опасным ростом опухоли и появлением метастазов в органах и системах. При такой форме заболевания мониторинг только негативный. Лечение в таких случаях ориентировано на уничтожения отдельных признаков болезни;
- при своевременной операции 96% пациентов восстанавливают свое здоровье.
После терапии, с переменами в центральной нервной системе организм справляется сам, они исчезают через пару месяцев.
Позитивных итогов, получается, добиться практически у 80% больных. Приблизительно в 3% случаев возможен рецидив. При развитии медицины данное соотношение улучшится не только количественно, но и качественно, с уменьшением осложнений после операции.
Видеозаписи по теме
Читайте также:


