Кальций и проведение нервного импульса
Наиболее совершенный способ связи рецептора и двигательного аппарата, которые обязательно должны быть пространственно разделены, состоит в передаче сигналов по нервному волокну. Скорость передачи сигналов по нерву (нервных импульсов), осуществляемых по принципу структурных перестроек, не может превысить скорость звука и фактически лимитируется подвижностью ионов в электрическом поле. Возможность передачи световых сигналов по нервному волокну не исследована.
Нервы возникли в эволюции вследствие необходимости преодоления пространственной разобщенности механизма, воспринимающего сигналы из внешней среды, и механизма перемещения в пространстве; они необходимы, кроме того, из-за медленности и беспорядочности направлений диффузий химического регулятора. Однако непосредственным способом управления биохимическим механизмом перемещения в пространстве может стать только образование в мышечной клетке специфических веществ. Только такие вещества способны изменить скорость ферментативного процесса расщепления АТФ, инициировать процесс конформационных изменений макромолекул, приводящих к преобразованию свободной энергии химического процесса, в механическую работу.
Следовательно, нервный импульс, дойдя до цели, до конца нервного волокна, должен вызвать образование специфического химического регулятора сокращения мышцы (что и происходит на самом деле). Сейчас мы знаем, что роль такого медиатора играют ионы кальция. Освобождение ионов из связанного состояния (в структурах саркоплазматического ретикулума) и соединение его с белками комплекса актомиозин — тропомиозин — тропонин — условие начала сокращения миофибриллы, начала движения нитей актина и миозина навстречу друг другу. Связывание кальция служит причиной прекращения ферментативного расщепления АТФ, прекращения энергетического обеспечения сокращения миофибрилл, т. е. условием расслабления, сопровождающегося при нагрузке растяжения миофибриллы, например, при действии эластических сил коллагеновых волокон или груза, или же под действием реципрокных (тянущих в противоположную сторону) мышц. Однако количество ионов кальция, непосредственно поступающих в протоплазму в результате прихода нервного импульса, очень невелико, и поэтому на нервных окончаниях действует механизм химического усиления, т. е. увеличения количества кальция, происходящего посредством медиаторов. Под влиянием нервного импульса выделяется химический медиатор — ацетилхолин (обеспечивающий регуляцию быстрых мышц) или адреналин (регулирующий относительно длительный тонус специализированных мышц в стенках кровеносных сосудов). Эти медиаторы запускают процессы, приводящие к появлению больших количеств кальция в иннервируемом органе.
Эволюционное совершенствование связей двигательных аппаратов (мышц) с рецепторами посредством нервов является залогом дальнейшего прогресса в решении основной проблемы эволюции на данном этапе — проблемы совершенного управления перемещением организма. Мы уже видели, что управление движением становится предельно совершенным лишь при достижении совершенного анализа траектории произвольного движущегося тела (жертвы или хищника). Анализ произвольной траектории и управление движением собственного организма основаны на функциях восприятия, запоминания, обобщения, сопоставления образов, в частности абстрактного образа — модели траектории с реально осуществляющейся траекторией.
Все это должно завершиться возникновением управляющей сигнальной системы, определяющей движение организма в нужном направлении по соответственно построенной траектории. Выполнение таких сложных задач не обеспечивается элементарной связью рецептора и двигательного аппарата — простейшей рефлекторной дугой. Непосредственная связь рецепторов с двигательным аппаратом становится принципиально недостаточной для управления движением в случае взаимодействия двух движущихся организмов. Это объясняется тем, что абсолютные скорости двух взаимодействующих организмов в принципе могут быть одинаковыми. И тогда хищник никогда не догонит жертву: они будут двигаться с равными скоростями, сохраняя постоянный интервал. И, наоборот, даже небольшое преимущество в скорости у хищника лишит жертву всех надежд на спасение. При близости скоростей перемещения в пространстве взаимодействие в системе жертва — хищник возможно лишь при произвольных траекториях движений. Это значит, что управление перемещением посредством простых рефлекторных механизмов не пригодно. Хищник не должен бежать непосредственно к тому месту, где он увидел жертву. Пока он добежит, жертвы там уже не будет. (Зенитчики стреляют, целясь не в летящий самолет, а вынося прицел далеко вперед, т. е. целясь в то место, куда при правильной экстраполяции самолет должен прилететь в момент долета туда снаряда). Итак, нужен анализ воспринятых рецепторами сигналов, необходима предварительная переработка информации и лишь затем должны возникать сигналы управления движением.
На рисунке в обобщенной форме показаны последовательные события, возникающие во время и вскоре после потенциала действия. В нижней части рисунка показаны изменения проводимости мембраны для ионов натрия и калия.
В покое до начала потенциала действия проводимость мембраны для ионов калия в 50-100 раз выше, чем для ионов натрия. Это связано со значительно более высокой проницаемостью каналов утечки для ионов калия по сравнению с ионами натрия. Однако при возникновении потенциала действия натриевые каналы мгновенно активируются, и проводимость мембраны для ионов натрия возрастает до 5000 раз. Затем в течение долей миллисекунды процесс инактивации закрывает натриевые каналы. Начало развития потенциала действия также влияет на электроуправляемые калиевые каналы, при этом их более медленное открытие начинается через долю миллисекунды после открытия натриевых каналов. В конце потенциала действия возврат мембранного потенциала к отрицательному уровню заставляет калиевые каналы опять вернуться к своему исходному закрытому состоянию, но лишь после задержки длительностью в миллисекунду или более.
В средней части рисунка показано соотношение проводимости для ионов натрия и калия в каждый момент потенциала действия; выше представлен сам потенциал действия. Во время его начальной части соотношение натрий-калиевой проводимости повышается более чем в 1000 раз. Следовательно, внутрь волокна входят гораздо больше ионов натрия, чем ионов калия выходит наружу. Именно поэтому в начале генерации потенциала действия мембранный потенциал становится положительным.
Затем натриевые каналы начинают закрываться, а калиевые каналы открываются, и отношение проводимости смещается в пользу высокой калиевой проводимости и низкой натриевой проводимости. Это обеспечивает очень быстрый выход ионов калия наружу при фактически нулевом токе ионов натрия внутрь. В результате потенциал действия быстро возвращается к исходному уровню.

До сих пор мы рассматривали значение лишь ионов натрия и калия в генерации потенциала действия. Следует обсудить, по крайней мере, два других типа ионов: отрицательно заряженные анионы и ионы кальция.
Непроникающие через мембрану отрицательно заряженные ионы (анионы) внутри аксона. Внутри аксона много отрицательно заряженных ионов, которые не могут проходить через мембранные каналы: анионы белковых молекул и многих органических фосфатных, а также сульфатных соединений и др. Поскольку эти ионы не могут покинуть аксон, любой недостаток положительных ионов внутри клетки приводит к избытку непроникающих через мембрану отрицательных ионов. Следовательно, анионы ответственны за отрицательный заряд внутри волокна при наличии общего дефицита положительно заряженных ионов калия и других положительных ионов.
Ионы кальция. Мембраны почти всех клеток организма имеют кальциевый насос, подобный натриевому насосу, а в некоторых клетках ионы кальция совместно с ионами натрия (или вместо них) участвуют в развитии потенциала действия. Кальциевый насос, как и натриевый, перекачивает ионы кальция изнутри клеточной мембраны наружу (или внутрь эндоплазматического ретикулума клетки), создавая градиент концентрации ионов кальция, равным примерно 10000 раз. При этом внутри клетки концентрация кальция составляет около 10-7 М по сравнению с внешней концентрацией, равной примерно 10-3 М.
Кроме того, имеются электроуправляемые кальциевые каналы. Эти каналы несколько проницаемы как для ионов натрия, так и для ионов кальция. Когда они открыты, оба иона поступают внутрь волокна, поэтому эти каналы также называют Ca2+/Na+ -каналами. Кальциевые каналы активируются медленно, на их активацию требуется примерно в 10-20 раз больше времени, чем для натриевых каналов. В связи с этим их называют медленными каналами (в противоположность натриевым каналам, называемым быстрыми каналами).
Множество кальциевых каналов представлено в сердечной и гладких мышцах. По существу, в некоторых типах гладких мышц быстрых натриевых каналов почти нет, поэтому потенциалы действия связаны практически полностью с активацией медленных кальциевых каналов.
Повышенная проницаемость натриевых каналов при недостатке ионов кальция. Концентрация ионов кальция во внеклеточной жидкости также оказывает существенное влияние на уровень потенциала, при котором происходит активация натриевых каналов. В условиях недостатка ионов кальция натриевые каналы активируются при очень небольшом повышении мембранного потенциала от нормы (сильно отрицательного уровня). Следовательно, нервное волокно становится высоковозбудимым, временами спонтанно разряжаясь повторными импульсами без раздражения. В действительности, лишь при падении концентрации ионов кальция на 50% ниже нормы в некоторых периферических нервах появляются спонтанные разряды, часто приводящие к мышечной тетании. Иногда это приводит к летальному исходу из-за тетанического сокращения дыхательных мышц.
Влияние ионов кальция на натриевые каналы, возможно, объясняется тем, что эти ионы связываются с внешней частью белковой молекулы натриевого канала. Положительные заряды ионов кальция могут менять электрическое состояние канального белка, в результате уменьшается уровень потенциала, необходимый для открытия ворот для натрия.
Нервная система человека выступает своеобразным координатором в нашем организме. Она передаёт команды от мозга мускулатуре, органам, тканям и обрабатывает сигналы, идущие от них. В качестве своеобразного носителя данных используется нервный импульс. Что он собой представляет? С какой скоростью работает? На эти, а также на ряд других вопросов можно будет найти ответ в этой статье.
Чем является нервный импульс?
Исследование строения и работы
Впервые прохождение нервного импульса было продемонстрировано немецкими учеными Э. Герингом и Г. Гельмгольцем на примере лягушки. Тогда же и было установлено, что биоэлектрический сигнал распространяется с указанной ранее скоростью. Вообще, такое является возможным благодаря особенному построению нервных волокон. В некотором роде они напоминают электрический кабель. Так, если проводить параллели с ним, то проводниками являются аксоны, а изоляторами – их миелиновые оболочки (они являют собой мембрану шванновской клетки, которая намотана в несколько слоев). Причем скорость нервного импульса зависит в первую очередь от диаметра волокон. Вторым по важности считается качество электрической изоляции. Кстати, в качестве материала организмом используется липопротеид миелин, который обладает свойствами диэлектрика. При прочих равных условиях, чем больше будет его слой, тем быстрее будут проходить нервные импульсы. Даже на данный момент нельзя сказать, что эта система полноценно исследована. Многое, что относится к нервам и импульсам, ещё остаётся загадкой и предметом исследования.
Особенности строения и функционирования
Где они создаются?
Типы клеток
- Рецепторные (чувствительные). Ими кодируются и превращаются в нервные импульсы все температурные, химические, звуковые, механические и световые раздражители.
- Вставочные (также называются кондукторными или замыкательными). Они служат для того, чтобы перерабатывать и переключать импульсы. Наибольшее их число находится в головном и спинном мозге человека.
- Эффекторные (двигательные). Они получают команды от центральной нервной системы на то, чтобы были совершены определённые действия (при ярком солнце закрыть рукой глаза и так далее).
Каждый нейрон имеет тело клетки и отросток. Путь нервного импульса по телу начинается именно с последнего. Отростки бывают двух типов:
- Дендриты. На них возложена функция восприятия раздражения расположенных на них рецепторов.
- Аксоны. Благодаря им нервные импульсы передаются от клеток к рабочему органу.
Интересный аспект деятельности
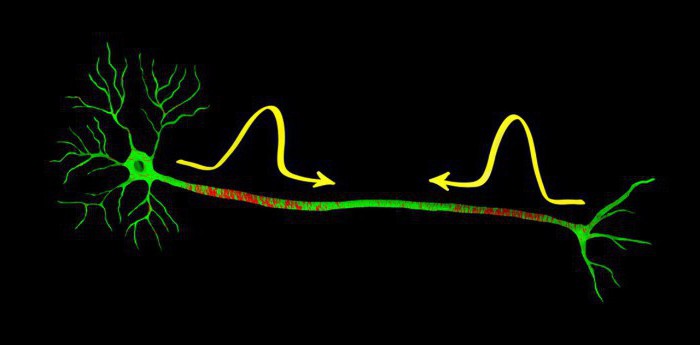
О потенциале действия
Как всё работает в мозгу?
Работа нейромедиаторов
Когда они передают нервные импульсы, то существует несколько вариантов, что произойдёт с ними:
- Они будут диффундированы.
- Подвергнутся химическому расщеплению.
- Вернутся назад в свои пузырьки (это называется обратным захватом).
В конце 20-го века сделали поразительное открытие. Ученые узнали, что лекарства, что влияют на нейромедиаторы (а также их выброс и обратный захват), могут изменять психическое состояние человека коренным образом. Так, к примеру, ряд антидепрессантов вроде "Прозака" блокируют обратный захват серотонина. Есть определённые причины считать, что в болезни Паркинсона виноват дефицит в головном мозге нейромедиатора дофамина.
Если кратко, то они могут работать с тысячами нейромедиаторов, которые посылаются их соседями. Детали относительно обработки и интеграции данного типа импульсов нам почти не известны. Хотя над этим работает много исследовательских групп. На данный момент получилось узнать, что все полученные импульсы интегрируются, а нейрон выносит решение – необходимо ли поддерживать потенциал действия и передавать их дальше. На этом фундаментальном процессе базируется функционирование головного мозга человека. Ну что ж, тогда это неудивительно, что мы не знаем ответа на эту загадку.
Некоторые теоретические особенности
Где же создаются нервные импульсы?
Откуда они начинают свой путь? Ответ на этот вопрос может дать любой студент, который прилежно изучал физиологию возбуждения. Есть четыре варианта:
- Рецепторное окончание дендрита. Если оно есть (что не факт), то возможным является наличие адекватного раздражителя, что создаст сначала генераторный потенциал, а потом уже и нервный импульс. Подобным образом работают болевые рецепторы.
- Мембрана возбуждающего синапса. Как правило, такое возможно только при наличии сильного раздражения или их суммирования.
- Триггерная зона дентрида. В этом случае локальные возбуждающие постсинаптические потенциалы формируются как ответ на раздражитель. Если первый перехват Ранвье миелинизирован, то они на нём суммируются. Благодаря наличию там участка мембраны, которая обладает повышенной чувствительностью, здесь возникает нервный импульс.
- Аксонный холмик. Так называют место, где начинается аксон. Холмик – это наиболее частый создать импульсов на нейроне. Во всех остальных местах, которые рассматривались ранее, их возникновение гораздо менее вероятное. Это происходит из-за того, что здесь мембрана имеет повышенную чувствительность, а также пониженный критический уровень деполяризации. Поэтому, когда начинается суммирование многочисленных возбуждающих постсинаптических потенциалов, то раньше всего на них реагирует холмик.
Пример распространяющегося возбуждения
Вспомните сводки из новостей прошлого лета (также это скоро можно будет услышать опять). Пожар распространяется! При этом деревья и кустарники, которые горят, остаются на своих местах. А вот фронт огня идёт всё дальше от места, где был очаг возгорания. Аналогичным образом работает нервная система.
Часто бывает необходимо успокоить начавшееся возбуждение нервной системы. Но это не так легко сделать, как и в случае с огнем. Для этого совершают искусственное вмешательство в работу нейрона (в лечебных целях) или используют различные физиологические средства. Это можно сравнить с заливанием пожара водой.
Сигналы,передаваемые нерв.клетками-это изм-е электрич.потенциала плазматич.мем-ны нейронов(нерв.импульс-НИ).Осн.инструментами мем-ны аксона, создающими нерв.импульс,явл-ся натриевый насос(Na,K-АТФаза) и два типа ионопроводящих каналов, построенные из спец.белков. Натриевый насос перекачивает ионы Na наружу,а К внутрь,создавая трансмембранный градиент концентраций этих ионов за счет энергии АТФ. Натриевые и калиевые каналы могут откр-ся и закр-ся; они пропускают ионы Na и К по градиентам концентрации этих ионов. Потенциал покоя. В состоянии покоя натриевые и калиевые каналы закрыты. Натриевый насос работает непрерывно,компенсируя утечку ионов по градиентам их концентраций. В рез-те уст-ся динамич.равновесие,при кот.электрохимич.трансмембранный градиент равен нулю,а распред-ие зарядов:внутри аксона отриц.,снаружи-положит.,т.е. воз-ет трансмембранная разность электрич.потенциалов-потенциал покоя(60-70мВ).Он одинаков на всем протяжении волокна. Потенциал действия. Раздражение нерва открывает натриевые и калиевые каналы в мем-не аксона.Это происходит в рез-те изм-я конформации и ионизации белков,из кот.построены каналы. натриевые каналы отк-ся неск.раньше чем калиевые.В рез-те потоков ионов Na внутрь аксона быстро изм-ся вел-на трансмем.электрич.пот-ла: сначала он становится равным нулю(деполяризация мем-ны),а затем вновь происходит поляризация,но теперь внутри +, снаружи -. Разность пот-ов достигает 40мВ.Затем натриевые каналы закр-ся,а калиевые откр-ся,нач-ся выход ионов К из клетки и потенциал изменяется до уровня потенциала покоя. Эта послед-ть действий наз-ся потенциалом действия и прод-ся менее 1 мс. ПД,возникнув в одном участкеаксона,вследствии диффузии ионов из этого участка вдоль волокна снижает потенциал покоя в сосед.участке и вызывает здесь тоже развитие ПД. Т.о. ПД,возникнув в одном месте,проходит весь аксон и достигает воспринимающей клетки.Пороговая вел-на поляризации, вызывающая НИ,зависит от концентрации ионов Са. Внутриклеточная концентрация Са в норме равна 0,3мкмоль/л; при гипокальциемии она↓,вслед-е чего ↓порог.вел-на возб-ия нервов и могут возникнуть судороги. Синаптич.передача нерв.импульса. В синапсе аксон прерывается и передача импульса на другую клетку происходит путем диффузии опред.в-ва-медиатора. В кач-ве медиатора: АХ(холинэргич.нейроны), норадреналин(адренэргические). В процессе синап.передачи импульса выд-ют след.этапы: а) НИ,дошедший до окончания аксона,вызывает освобождение медиатора из нерв.окончания в синап.щель; б) медиатор диффундирует к мем-не др.клетки(постсинап.мем-не); в) в постсинап.м-не медиатор присоед-ся к рецептору медиатора-белку,и в рез-те изм-я конформации рецептора генерируется возбуждающий постсинап.потенциал,кот.при достижении порог.уровня может вызвать ПД. г) медиатор в синап.щели инактив-ся или удаляется из нее, после чего синапс готов к передаче след.импульса. Холинэргические синапсы(нервно-мыш.соед-я,синапсы прегангл.нейронов автоном.н.с. и постгангл.нейронов парасим.н.с.). В окончаниях холинэргич.нервов сод-ся фер-т холинацетилтрансфераза,катализирующий синтез АХ из ацетил-КоА и холина. АХ накапл-ся в синап.пузырьках,окруженных мем-ой. При поступлении ПД в нерв.окончание некот.часть пузырьков сливается с пресинап.мем-ой и сод-мое пузырьков освоб-ся в синап.щель(экзоцитоз). В экзоцитозе уч-ют сократимые волокна цитоплазмы нерв.окон-ия:ПД вызывает ↑концентрации Са в нерв.окончании,а Са вкл-ет мех-м сокр-я этих волокон. АХ диффундирует к постсинап.мем-не, где соед-ся с рецептором АХ. Рецептор представляет собой интегральный белок постсинап.мем-ны. Присоед-е АХ к рецептору процесс обратимый; чем больше концентрация АХ в синап.щели,тем больше число молекул рецептора соединено с ним. АХ индуцирует конформационные изм-ия рецептора,кот.передаются на белки натриевых и калиевых каналов в постсинап.мем-не; в рез-те каналы отк-ся. В постсинап.мем-не имеется фер-т ацетилхолинэстераза(АХЭ),гидролизующий АХ.По мере гидролиза и ↓конц-ии АХ происходит диссоциация комплекса АХ-рецептор→все молекулы рецептора освоб-ся от АХ,конформации рецепторов и ионных каналов возвр-ся в исход.сост-е, а Na,К-АТФаза постсинап.м-ны вос-ет потенциал покоя. Адренергические синапсы.Скоростьсинтеза катехоламинов рег-ся по мех-му отриц.обр.связи концентрацией медиатора в нерв.окончании:дофамин и норадреналин ингибируют первый фер-т цепи реакций-тирозингидроксилазу. Вел-на высвоб-ся медиатора рег-ся также: в пресинап.мем-не имеется регуляторный белок,кот связывает медиатор при ↑его концентрации в синап.щели м выкл-ет дальнейший экзоцитоз медиатора. Адренергич.синапсы не сод-ат фермента, разрушающего медиатор в синап.щели. Вместо этого передача импульса завер-ся перекачкой медиатора обратно ч/з пресинап.м-ну, в кот. имеется спец.транспортная с-ма. Здесь медиатор вкл-ся в синап. пузырьки или инактивируется путем дезаминирования МАО, а также путем метилирования катехол-О-метилтрансферазой.
- 1100
- 0,9
- 0
- 8
Они знают, что такое боль.
![]()
Александр Русинов
![]()
Антон Чугунов![]()
Андрей Панов



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Какая бывает боль?
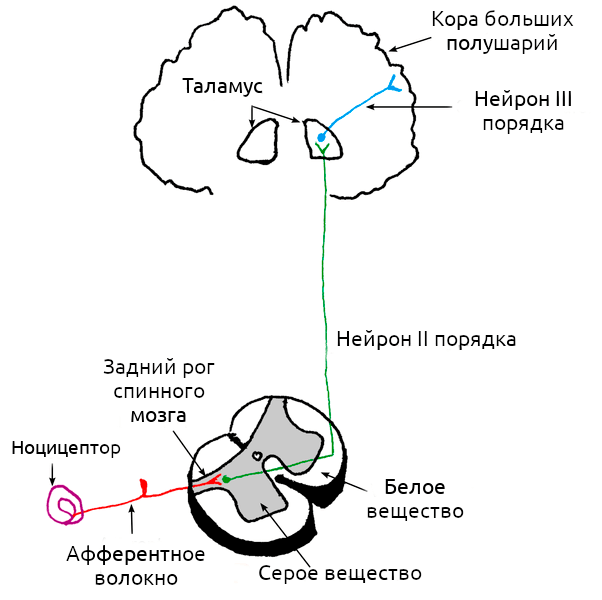
Классификация боли, предложенная Клиффордом Вульфом [1], включает в себя четыре типа: ноцицептивная, воспалительная, невропатическая и функциональная. Кроме того, стоит отметить и психогенную боль.
Эпизод I: Пойманная угроза
Чтобы определить любой сигнал, наш организм использует внушительный арсенал белков-рецепторов. Их задача заключается в том, что они реагируют на строго определенный внешний фактор и передают сигнал об этом связывании при помощи конформационных изменений [2], влекущих за собой и изменение биохимических свойств этого рецептора. Переданные от рецептора сигналы усиливаются каскадом белковых взаимодействий в клетке, могут передаваться с помощью нервной или эндокринной систем и, в конечном итоге, приводят к физиологическому ответу.
Нейроны, работающие в ноцицептивной системе, различаются по набору рецепторов. Среди этих нейронов выделяются четыре группы: несущие рецепторы температуры, химического воздействия, механического воздействия и полимодальные (с рецепторами всех раздражителей).
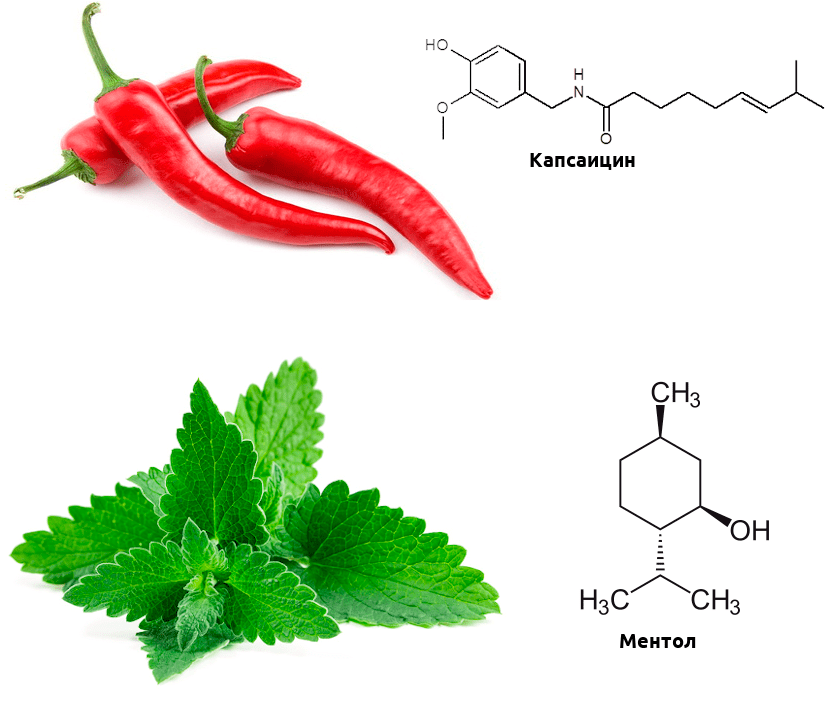
Одни из важнейших рецепторов, реагирующих на тепло, — белки группы TRP. Это ионные каналы, неспецифичные к катиону, — при открытии они пропускают в клетку натрий, магний и кальций, в результате чего в клетке возникает потенциал действия, необходимый для передачи нервного импульса. Этих доблестных воинов термочувствительности несколько: TRPV1–TRPV4 и TRPM8. Первые активируются при повышенной температуре, второй же реагирует на холод. Эти каналы обладают интересной особенностью — помимо температуры, они могут активироваться химическими стимулами.
Биохимические механизмы этой активации отличаются от температурной, но в мозге возникают в ответ на эти химические стимулы практически те же ощущения, что и на изменение температуры. А теперь вспомните, какие продукты питания вызывают ощущение обжигания, а какие — холода? Думаю, почти каждый читатель сталкивался с этими продуктами. Острота перца чили обусловлена тем, что содержащийся в нем капсаицин активирует рецептор TRPV1 (такие вещества называются агонистами) [3]. А ментол, содержащийся в мяте, — агонист TRPM8, и вызывает чувство прохлады (рис. 2) [4].
Но если можно с помощью небольших молекул заставить нас чувствовать эффект ноцицепции, то, может, с помощью других молекул можно этот рецептор заблокировать? Да! Разработка антагонистов TRPV1 [3], которые, блокируя рецептор, могут снижать болевые ощущения, например, от капсаицина, ведется с 1990-х годов, однако большинство препаратов пока не достигли рынка (рис. 3). Интересно, что эти препараты предлагается применять для лечения невропатической боли, то есть той, когда рецепторы активируются без внешней причины. Достигнут ли фармкомпании успеха — покажет время.
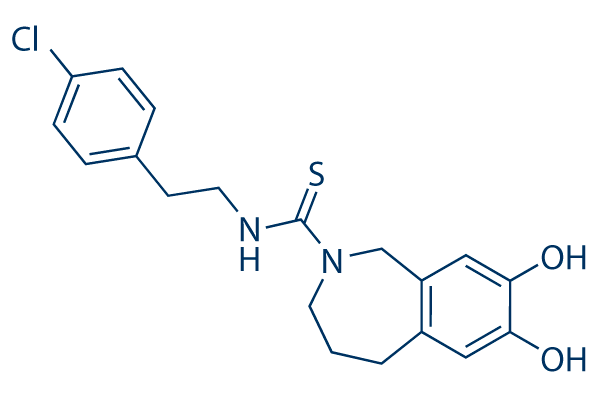
Рисунок 3. Один из первых разработанных антагонистов TPRV1 — капсазепин. Этот препарат находится сейчас на стадии клинических испытаний. Вообще, успех подобного рода лекарств может стать новой вехой в истории фармакологии анальгетиков — блокирование ноцицепторов вместо ослабления болевого импульса на более поздних стадиях.
Механоноцицепторы — куда более разнородная и многообразная группа рецепторов, чем терморецепторы. Среди них стоит отдельно выделить рецепторы, активируемые, помимо давления, сигнальным олигопептидом брадикинином. Его рецептор В-1 синтезируется в поврежденных клетках — например, при получении травмы. Связывая брадикинин, он активирует сигнальный каскад, приводящий к возникновению боли. Интересно, что в число прямых эффектов от связывания рецептора входит усиление воспаления — то есть поддержание стимула для дальнейшей активации болевых рецепторов: чем больше боли, тем больше боли. Поэтому частая активация В-1 (например, постоянным воспалением при аутоиммунных заболеваниях) может стать причиной развития хронической боли [5].
Рецепторы, воспринимающие различные химические раздражители (ирританты), тоже разнообразная, а местами малоизученная группа. Среди них особо примечателен член уже знакомого нам семейства TRP — TRPA1. Этот рецептор активируется совершенно разными молекулами, зачастую, вступая с ними в реакцию, что приводит к необратимости эффекта. В числе широко известных ирринантов, активирующих TRPA1, — аллилизоцианат, содержащийся в знаменитой японской приправе васаби, и аллицин, содержащийся в чесноке (рис. 4).
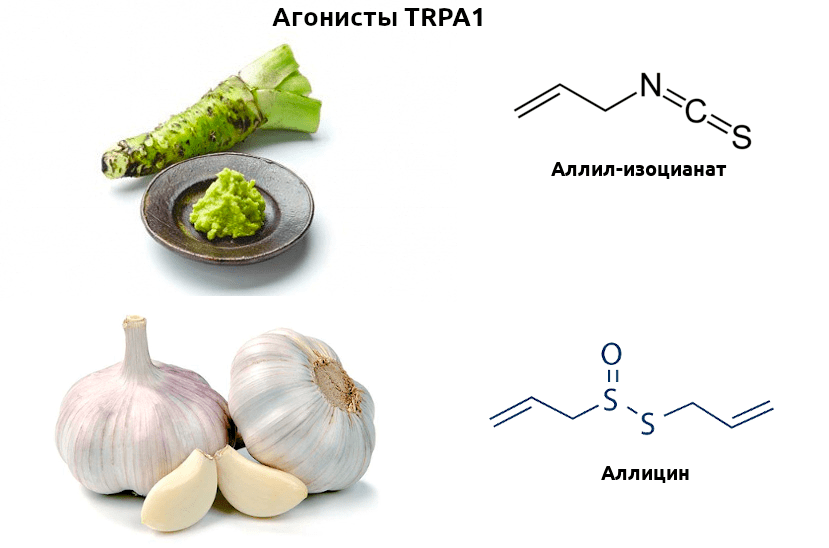
Рисунок 4. Вкус васаби сильно отличается от чесночного, однако за восприятие остроты этих приправ отвечает один рецептор — TRPA1. Серосодержащие летучие вещества этих растений способны активировать рецептор и дальнейшую ноцицептивную передачу. Эти агенты пригождаются ученым при изучении химических основ работы рецепторов.
Как уже говорилось, рецепторы TRP — ионные каналы. Открывшись, они пропускают внутрь клетки важнейшие катионы — Na + и Ca 2+ . Вход положительно заряженных ионов изменяет электрический потенциал мембраны [6], а также активирует работу ряда сигнальных белков. Всё это приводит к появлению нервного импульса, который начинает распространяться по нейрону в определенном направлении.
Отдельно стоит упомянуть боль, возникающую при воспалении. Ключевое вещество, на которое реагируют ноцицепторы, — гистамин, который некоторые клетки нашей иммунной системы (например тучные) выбрасывают в кровь в ответ на стимулы к воспалению. Гистамин связывается со своими рецепторами (из семейства GPCR). Активация гистаминового рецептора 1 типа (H1) приводит к активации фосфолипазы С (PLC) и гидролизу фосфатидилинозитолбисфосфата (PIP2) с образованием инозитолтрифосфата (IP3), который затем запускает высвобождение Ca 2+ из эндоплазматической сети. Кальций, связавшись с кальмодулином, активирует протеинкиназу С, которая, при помощи дальнейшего фосфорилирования регуляторных киназ, подавляет экспрессию потенциал-зависимых калиевых каналов 7 типа (Kv1.7), что приводит к деполяризации мембраны и проведению болевого импульса [7]. Интересно, что гистаминовые рецепторы 3 типа, которые локализованы в ЦНС, могут ингибировать проведение определенных ноцицептивных импульсов [8].
Стоит отметить, что другие активные игроки воспалительного процесса — простагландины — действуют похоже: в результате связывания простагландина Е2 с рецептором PTGER2 активируется протеинкиназа А, которая, в свою очередь, увеличивает экспрессию уже знакомого нам TRPV1 [9].
Эпизод II: Атака нервных волокон | Кондукция
Aβ-волокна работают еще быстрее (30–100 м/с) и сильно миелинизированы. Механорецепторы, расположенные в этих волокнах, крайне чувствительны, поэтому функция этих волокон — проведение сигналов о слабых раздражителях. Избыточная активация волокон Aβ вызывает аллодинию — боль, возникающую от причин, обычно ее не вызывающих, — например, от сидения на стуле.
Волокна типа C проводят нервный импульс медленно (0,5–2 м/с); в основном это сигналы от высокочувствительных механорецепторов и хеморецепторов.
Волокна C и Aδ работают синергично, обеспечивая основную массу болевых ощущений.
Эпизод III: Месть эндорфинов
Сигнал о боли достиг нейронов задних рогов спинного мозга, и уже очень скоро будет жарко. Хотя постойте, может, можно что-нибудь сделать? Может, сигнал несет организму чрезмерные страдания, превышающие пользу? А может, наоборот, сигнал недостаточен для осознания всей беды? В спинном мозге происходит модуляция ноцицептивного сигнала. Это поле для нейрохимической битвы двух сил — тормозящей и усиливающей.
По своей природе опиоидные рецепторы тоже являются GPCR, однако — ингибиторными. Будучи активированными, они подавляют работу аденилатциклазы, снижают уровень внутриклеточного цАМФ и, через киназных посредников активируют работу калиевых каналов, которая приводит к реполяризации клеточной мембраны. В конечном итоге эти меры замедляют проведение нервного импульса.
Кроме описанной системы, в ослаблении боли принимают участие всем известные тормозные нейромедиаторы — гамма-аминомаслянная кислота (ГАМК) [11] и глицин [12]; а опосредованно — многие другие сигнальные молекулы.
Одним из очень интересных модуляторов боли является субстанция Р. Это олигопептидный нейромедиатор, связывающийся с метаботропными рецепторами нейрокинина (NKR). NK1R, являясь уже знакомым нам GPCR, вызывает каскад реакций фосфорилирования через протеинкиназу С. В результате в клетке возрастает экспрессия генов натриевого канала Nav1.8, а в нейроне-ноцицепторе увеличивается синтез и наших старых знакомых — NMDA и TRPV1. Кроме того, субстанция Р снижает активность низкопорогового калиевого канала (Kv1.4) в чувствительных к капсаицину нейронах спинального ганглия и, таким образом, сенсибилизирует ноцицепторы. Интересно, что знаменитые грызуны-долгожители — голые землекопы [14] — практически не имеют в ЦНС субстанции Р, благодаря чему становятся нечувствительными ко многим видам боли [15].
То, в каком виде сигнал дойдет до головного мозга, определяется балансом между противоборствующими сторонами и силой изначального сигнала.
Часть IV: Новая проекция
В сером веществе спинного мозга различают 10 слоев (пластин Рекседа), каждый из которых отличается от других функционалом входящих в его состав нейронов, и, как следствие, — выполняемыми функциями. Чтобы нервный импульс попал на кору больших полушарий, сначала он должен пройти по восходящим путям этих пластин.
Синапс волокон Aδ и C со вторичными афферентными нейронами находится в дорсальном роге спинного мозга. Волокна Aδ и C передают информацию ноцицептивно-специфическим нейронам в I и II пластинах. Кроме того, импульс проецируется и на нейроны других пластин. Это нужно для того, чтобы впоследствии задействовать вторичные системы реакции мозга на боль (благодаря этому боль запоминается).
После того, как импульс проходит модуляцию в задних рогах, он передается нейронам восходящих трактов спинного мозга, каждый из которых имеет определенную функцию в распознавании боли.
Наиболее важны среди них спиноталамический тракт, участвующий в узнавании боли, спинопарабрахиальный тракт, участвующий в вегетативной и мотивационной регуляции реакции на боль, и спиномезенцефалический тракт, участвующий в активации нисходящих анальгетических путей, о действии которых мы говорили раньше.
Часть V: Головной мозг наносит ответный удар
Обработка информации о боли в головном мозге — самая разнообразная и индивидуальная для каждого человека часть работы ноцицепторной системы.
Стоит отметить, что у боли есть два разных компонента, за восприятие которых отвечают разные области мозга. Сенсорно-дискриминационные аспекты включают силу боли и ее локализацию, в то время как аффективно-эмоциональный компонент боли включает неприятный характер восприятия.
Для того чтобы мозг правильно локализовал источник боли, нервный импульс затем обрабатывается соматосенсорной корой.
Аффективно-мотивационный аспект боли опосредуется медиальным болевым путем, включающим внутриламинарные ядра таламуса, которые проецируются на соматосенсорные структуры коры и лимбической системы. Пластина V же передает ноцицептивные сообщения парабрахиальному внутреннему латеральному ядру. Нервные волокна этого ядра связаны с областями коры, отвечающими за когнитивные функции (например, поведенческую реакцию на боль) и агрессивное поведение [16].
Часть VI: Возвращение к наболевшему
Читайте также:





