Культивирование клеток нервной системы
Аннотация (русский):
В данной статье проанализированы различные аспекты культивирования и криоконсервации нервной ткани человека, крыс и моллюсков. Разобраны достоинства и недостатки применения методов низкотемпературного хранения клеток в клинической практике и в научных исследованиях. Кроме того, рассмотрены известные на данный момент источники нейральных стволовых клеток. Представлены обзорные сведения об известных методах культивирования, криоконсервации нервной ткани и их эмпирических модификациях на сегодняшний день. Также в данном обзоре сопоставлены различные условия реализации низкотемпературного хранения и жизнеспособность клеток после оттаивания. Показано селективное влияние определенных методик криоконсервации на сохранность нейральных и нервных клеток.
В настоящее время активно развивается такая область медицины как клеточная и тканевая терапия. Данные методы получили широкое распространение в последнее десятилетие, благодаря активному развитию и усовершенствованию биотехнологических процессов. Успешность применения клеточных технологий в клинической практике обусловлена наличием в трансплантате стволовых клеток, способных к дифференцировке, а также продукцией ими биологически активных веществ, способных влиять на метаболические процессы на молекулярном уровне.
Данные методы экспериментально применяются при лечении нейродегенеративных заболеваний. В качестве вводимого материала (трансплантата) используются нейральные стволовые и нервные клетки.
Один из важнейших этапов клеточной трансплантологии это культивирование (процесс выращивания клеток in vitro). Для каждого типа тканевой культуры или целых органов разрабатываются собственные протоколы культивирования, подобранные эмпирически. Нервная ткань из-за гетерогенного состава менее успешно поддается культивированию, однако результативные методики созданы и для нее.
Еще одним из этапов биотехнологического процесса применения клеточной терапии может являться метод низкотемпературного хранения биообъектов – криоконсервация. Криоконсервация позволяет уменьшить расходы клеток, расширяет возможности для использования донорского материала, а также применяется для научных целей. Существенный недостаток данного метода – влияние на жизнеспособность клеток (их механическая травматизация, токсический эффект, изменение метаболической активности). Из-за того, что криоконсервация оказывает многосторонний эффект на клетки важно установление наиболее оптимальных условий процедуры для обеспечения сохранности клеток.
Нейральные стволовые клетки и их источники
В двадцатом столетии считалось, что нервные клетки не способны делиться в постнатальном периоде. Впервые описал пролиферацию нейронов в зрелом мозге Джохева Альтман в 1962 [1]. Это было воспринято скептически. Позже Р. Eriksson и соавторы продемонстрировали образование новых нейронов в гиппокампе взрослого человека [2]. В дальнейшем сведения о пролиферации нейронов в постнатальном периоде только накапливались.
Число новых нейронов, образующихся ежемесячно, составляет 6% от общей популяции гранулярных клеток. Эти расчеты были проведены на основании экспериментов Н. Cameron и соавторов, которые впервые использовали высокие дозы BrdU [4].
Культивирование нейральных клеток
Для культивирования нервных клеток разработаны различные протоколы. Нервные клетки являются требовательными в выборе субстрата при культивировании.
Одна из схем культивирования, предложенная для монослойной культуры нейронов мозжечка Bernt Engelsten и Rolf Bjerkvig, Departament of Cell Biology and Anatomy, University of Bergen, Zrstadveien 19, N-5009 Bergen, Norway, будет рассмотрена ниже.
Кусочки ткани, полученные из мозжечка 7-8 дневных крыс, трипсинизируют. В дальнейшем для ингибирования действия трипсина используют ростовую среду. Центрифугируют для получения суспензии клеток, сеют клетки на ростовой среде. Через 2-4 дня инкубируют культуру с добавлением арабинозида цитозина, чтобы предупредить рост не-нейрональных клеток. В качестве культуральной среды взята среда DMEM с добавками (глюкоза, L-глутамин, KCl, инсулин, р-аминиобензоевая кислота, гентамицин, термоинактивированная фетальная сыворотка теленка). Суспензия единичных клеток может быть получена механическим продавливанием через нейлоновые сита или последовательной трипсинизацией. Для идентификации нейронов могут быть использованы нейронспецифические антитела к энолазе или тетанус-токсин [5].
В 2002 г. Репиным В.С. и соавторами былапредложена схема культивирования для приготовления биотрансплантата с целью аллопересадки. Использовали фетальный абортивный материал, полученный при искусственном прерывании беременности у женщин. Ткань головного мозга эмбрионов человека суспендировали, культивировали 12–16 дней при 37 ° С в атмосфере 5% СО2 в бессывороточной среде. Культивирование проводили на среде DMEM/F12 (1:1)+N2 (Gibco BRL, USA) в присутствии ростовых факторов [ 6 ].
Также были получены успешные результаты при добавлении в бессывороточную среду DMEM фетальной бычьей сыворотки при культивировании нервной ткани больных эпилепсией [7]. Кроме того, при добавлении к культивируемым нейронам человека ретинола ацетата происходит стимуляция пролиферации клеток-предшественниц [8].
Методы криоконсервации нервных тканей и нейральных клеток
В настоящее время в медицине успешно применяется низкотемпературное хранение однородных суспензий клеток с возможностью восстановления их биологических функций после оттаивания. Однако ткани, в том числе нервная, плохо переносят криоконсервацию, а для целых органов методы криоконсервации пока не разработаны [9].
Криоконсервирование – способ сохранения жизнеспособного состояния биообъектов при температуре ниже 120 ° С. Криоконсервирование включает в себя ряд циклов, которые направлены на сохранение свойств и жизнеспособности биоструктур после размораживания – отогрева. К ним относятся: отбор клеток, подготовка к замораживанию (охлаждение и эквилибрация в защитных средах), замораживание, хранение, отогрев и восстановление [10].
На сегодняшний день существует две основные стратегии криоконсервации: медленная заморозка и витрификация. Одним из условий успешной криоконсервации является добавление криопротектора. Витрификация – форма быстрой заморозки, применяющая очень высокие концентрации криопротектора, в результате чего происходит отвердевание без формирования кристаллов льда.
Многочисленные протоколызамораживания различаются применением проникающих (интрацеллюлярных) и непроникающих (экстрацеллюлярных) криопротекторов, а также скоростью заморозки и разморозки.
Подготовка к замораживанию. Биоматериалы могут быть эквилибрированы в различных и сложных криоконсервантах, содержащих несколько видов криопротекторов и различные мембранные стабилизаторы, ингибиторы метаболизма и т.д. [10]. Применение сильных, проникающих в клетку криопротекторов ограничено их токсичностью. Поэтому обычно используют смеси криозащитных растворов, так как в них токсичность одного из веществ снижается за счет присутствия другого [11]. Кроме того, сам процесс добавления криопротектора может вызывать повреждения в клетках из-за осмотического шока, поэтому данный этап требует постепенного прибавления криозащитного раствора.
Перед замораживанием чаще всего биоматериалы предварительно охлаждают. Затем производится сам процесс замораживния по определенной программе (медленные, быстрые или многоступенчатые режимы). Когда скорость охлаждения изменяется в различных температурных зонах, осуществляются температурные остановки, при необходимости – искусственная инициация кристаллизации [10].
Хранение . Наиболее надежно замороженные биоматериалы могут храниться при температуре, близкой к –196 ° С (жидкий азот), при которой подавляются метаболические и биофизические процессы. Сухой лед (-80°C) или механические морозильные камеры (-80° C) пригодны для хранения в масштабах месяцев, но при этих температурах могут происходить некоторые биохимические изменения [ 12 ].
Размораживание проводится с привлечением в основном метода теплопроводности (нагрев в водяной бане) и реже – метода СВЧ [10]. Размораживание следует проводить как можно быстрее. Микроволновое нагревание, как правило, не используется, поскольку теплая вода имеет тенденцию поглощать больше микроволнового излучения и, следовательно, становится еще теплее, что приводит к локальному появлению горячих точек. Лучший способ оттаивания – это погружение в водяную баню при 37°C [ 12 ].
Если мембраны клеток после размораживания оказываются сильно поврежденными, то часто применяют восстанавливающие среды, которые содержат биологически активные соединения, активирующие биоэнергетический цикл клеток. Это стабилизаторы мембран и соединения, подавляющие перекисное окисление липидов и аутолиз клетки [10].
Определение жизнеспособности клеток в зависимости от условий криоконсервации
Важным этапом процесса криоконсервирования клеток является оценка жизнеспособности после размораживания. Для этого применяют морфологические, электрофизиологические, биохимические и другие методы.
В работах по криоконсервации нервных клеток используются разные условия культивирования, замораживания, оттаивания и восстановления с последующим анализом жизнеспособности клеток. Однако можно выделить следующие сходства в методиках: в качестве криопротекторных агентов используются ДМСО или глицерин, криоконсервация проводится в парах жидкого азота, оттаивание на водяной бане, инкубирование в физиологическом растворе для восстановления метаболической активности.
О жизнеспособности нейронов после криоконсервации можно судить по сохранению их изначальной морфологии и ультраструктурной организации, электрической активности, синтетической (функциональной) активности, поведению клеток в культуре ткани in vitro. Для оценки этих параметров используют следующие методы: световая и электронная микроскопия [13,14], проточная цитофлуорометрия [15], люминесцентная микроскопия [13], витальное окрашивание [14], метод микроэлектродного отведения [13,14], культивирование in vitro [13] и др.
Для анализа сохранности криоконсервированных нейронов ниже будут рассмотрены эксперименты по криоконсервации ганглиев Lymnaea stagnalis L., проводившиеся при следующих условиях: замораживание в парах жидкого азота до –196°С со скоростью 380–450°С/мин, криопротектор ДМСО 1,8-2,1 М, оттаивание на водяной бане при 22-24°С со скоростью 380–500°С/мин, физиологический раствор (мМ): 80 NaCl, 1,6 KCl, 1 MgCl2, 2 CaCl2, 7,5 pH (инкубация 4-6°С до 15–18 ч, но не менее 1,5-2 ч) [13, 14].
В работах по криоконсервации ганглиев прудовика установлено, что функциональная активность оттаивших нейронов восстанавливается через 5-8 часов до исходного значения после инкубации в физиологическом растворе [9, 13]. При проверке электрической активности показано, что сразу после размораживания и отмывания криозащитного раствора нейроны имеют низкое значение мембранного потенциала (МП) и не генерируют потенциал действия (ПД). После нескольких часов инкубации в физиологическом растворе значения МП и ПД восстанавливались до контрольных значений [13]. Поведение криоконсервированных нейронов в культуре in vitro характеризуется адгезией к подложке, интенсивным ветвлением отростков и образованием контактов между ними, сохранением регенераторной способности [14]. У нейронов сохраняется рецепторная активность (регистрация ответов на аппликацию серотонина). Однако синаптических связей между нейронами, локализованными в разных ганглиях, обнаружено не было [9]. Срок жизни культуры 10-11 суток, что сравнимо со сроком жизни нативной культуры [13].
Таким образом, можно сделать вывод, что криоконсервированные нейроны сохраняют жизнеспособность, восстанавливают структуру и электрическую активность при соблюдении вышеперечисленных условий замораживания. Однако функциональные связи между нейронами разных ганглиев не восстанавливаются.
В экспериментах по криоконсервации ганглиев мозга взрослого моллюска Lymnaea stagnalis L. было показано, что одним из условий успешного криоконсервирования является наличие криопротекторного агента – ДМСО (2М) [13,14]. Было установлено, что при концентрации ДМСО равной 1М и 3М нейроны после криоконсервации обладали малой сохранностью (38 и 3% соответственно при р
В исследовании по витрификации срезов гиппокампа крыс сообщается о серьезных структурных поврежденияхклеток при замораживании до -79 °С с использованием 10% глицерина в качестве криопротектора. Также авторами было установлено, что после замораживания до -79°С с использованием 30% глицерина, более 50% клеток не восстанавливают исходное соотношение K + /Na + , которое является важным условием нормального функционирования. Однако замораживание до –130°С с использованием в качестве витрифицирующего раствора VM3 (22.3% ДМСО, 12.86% формамид, 16.84% этиленгликоль, 7% поливинилпирролидон K12, 1% ‘‘Supercool X-1000’’, 1% ‘‘Supercool Z-1000’’) дало хорошие результаты с восстановлением соотношения K + /Na + более чем у 90% клеток.
Следовательно, использование VM3 в качестве криопротектора дает результаты лучше, чем использование раствора глицерина. Также в исследовании сообщается о протекторном действии аскорбиновой кислоты в концентрации 0,8 мМ при добавлении в среду для отмывания [16].
В экспериментах по криоконсервации фетальных нервных клеток наиболее успешными режимами криоконсервации оказались следующие совокупности условий: 1.ДМСО 7% (экспозиция 10 мин при 4°С), охлаждение со скоростью 1 °С /мин до –5°С с последующей инициацией кристаллообразования,затем охлаждение со скоростью 2 °С /мин до –60°С и погружение в жидкий азот; 2. ДМСО 10% (экспозиция 10 мин при 4°С), охлаждение со скоростью 1 °С /мин до –9°С, остановка в течение 10 мин, затем охлаждение со скоростью 1 °С /мин до –25°С, 10 °С /мин до –60°С и погружение в жидкий азот. В обоих случаях отогревание проводилось на водяной бане 37°С в течение 50 с; для отмывания использовался раствор Хенкса. Сохранность клеток составила 72,8 ± 6,1% и 78,7 ± 1,9% при р
Из вышеописанного следует, что для фетальных нервных клеток более медленный режим замораживания в совокупности с большей концентрацией криопротектора ведут к большей доли сохранных клеток.
Таким образом, можно еще раз подчеркнуть, что криоконсервация нервных клеток является перспективным методом как в клинической практике, так и в научных исследованиях. Разные условия замораживания обусловливают различия в сохранности клеток. В большинстве случаев производится культивирование выделенного биообъекта в среде DMEM с добавками, затем ткань подвергается воздействию криопротекторного раствора (чаще всего ДМСО), охлаждается в парах жидкого азота и хранится неограниченное время. При оттаивании применяется водяная баня с последующим отмыванием криопротектора и помещением биообъекта в физиологический раствор. Существующие протоколы позволяют получать жизнеспособные нейроны, но требуют доработок для увеличения выхода сохранных клеток.
Компас посвящен нервным прогениторным клеткам, их изучению и возможным перспективам использования
- Содержание:
- Содержание:

О стволовых клетках (СК) и клетках-предшественниках написано очень много, в основном речь идет о гемопоэтических и мезенхимальных СК. О них в том числе вы можете прочитать здесь:
Но наиболее приемлемым клеточным материалом для клинических трансплантации пациентам с заболеваниями нервной системы служат нейральные и, в первую очередь, аутологические стволовые и прогениторные клетки, поскольку использование аутологических клеток снижает риск иммунного отторжения трансплантата, исключает возможность переноса генетических дефектов, вирусных и прионных заболеваний. В этой связи, одной из задач фундаментальных нейробиологических исследований является поиск источников аутологических нейральных стволовых и прогениторных клеток. В последние годы такие исследования направлены на выделение этих клеток из структур обонятельной системы - обонятельного эпителия и обонятельной луковицы.
Обонятельный эпителий, периферический рецепторный отдел обонятельной системы, составляет относительно небольшую часть слизистой оболочки носа и локализован в верхних носовых ходах и верхних отделах носовой перегородки. Схема работы этой системы представлена на рисунке. 
Площадь обонятельного эпителия определяется значением обонятельной функции у различных представителей класса млекопитающих. Так, по литературным данным, площадь обонятельного эпителия человека равна 5-10 см2, в то время как у собак она составляет 170 см2. Клеточная структура обонятельного эпителия и подстилающего его слоя соединительной ткани (Lamina propria) сходны у всех млекопитающих.
В некоторых работах высказывается предположение о возможности использования аутологических стволовых и прогениторных клеток обонятельной луковицы для трансплантации и клеточной терапии головного и спинного мозга человека, несмотря на то, что их выделение требует нейрохирургического вмешательства. Надо признать, что это обстоятельство, наряду со сложностью получения культур стволовых и прогениторных клеток обонятельной луковицы, существенно ограничивает перспективы их клинического использования. Этих недостатков лишена другая структура обонятельной системы, а именно, обонятельный эпителий.
Стволовые клетки были выделены из обонятельного эпителия мышей, крыс и человека (в том силе при аутописии спустя 6-18 часов post mortem) и переведены в культуру. При культивировании клеток обонятельного эпителия пролиферирующие стволовые клетки образуют нейросферы, 
включающие, помимо собственно стволовых нейральных клеток, также и глиальные клетки. При клонировании и культивировании в монослое стволовые клетки нейросфер способны дифференцироваться в нервные и глиальные клетки. Опубликована работа, в которой показано, что трансплантация стволовых нейральных клеток обонятельного эпителия человека в поврежденный спинной мозг крыс сопровождается активация регенераторного роста аксонов спинальных трактов и частичным восстановлением нарушенных моторных и сенсорных функций.

Таким образом, не вдаваясь в детальный анализ проблем клеточной терапии нервной системы, можно заключить, что обонятельный эпителий является доступным и, возможно, на сегодняшний день, единственным источником аутологических нейральных стволовых, прогениторных и обкладочных глиальных клеток, трансплантация которых открывает новые перспективы в лечении травматических повреждений спинного мозга и периферических нервов, а также ряда дегенеративных заболеваний центральной нервной системы человека.

Известно, что обонятельная луковица является конечной инстанцией переднего миграционного пути, по которому мигрируют стволовые клетки перивентрикулярной зоны. Длительное время оставался неясным вопрос о том, являются ли стволовые клетки обонятельной луковицы взрослых млекопитающих, включая человека, собственными стволовыми клетками этой структуры или клетками, мигрировавшими из перивентрикулярной зоны. Ответ на этот вопрос был получен в исследовании Liu Z. и соавт (Liu Z et al, 2003). Введение бромодеоксиуридина (BrdU) позволило показать, что сердцевина обонятельной луковицы (olfactory bulb core) содержит собственные, постоянно пролиферирующие, мультипотентные стволовые и прогениторные клетки, которые при последующем культивировании дифференцируются в нейроны и глию. Интересно отметить, что, как показано в этом исследовании, при совместном культивировании с миобластами стволовые клетки обонятельной луковицы, дифференцированные в нейральном направлении, образуют зрелые нейромышечные синапсы.
Культивирование клеток сильно зависит от условий. Они изменяются для каждого типа клеток, но обычно состоят из подходящего сосуда с субстратом или средой, которые обеспечивают необходимые питательные вещества (аминокислоты, углеводы, витамины, минералы), факторы роста, гормоны и газы (CO2, O2) и регулируют физико-химическую среду (буфер рН, осмотическое давление, температуру). Большинство клеток требуют поверхности или искусственного субстрата (адгезивная или монослойная культура), тогда как другие могут быть свободно размножены в культуральной среде (суспензионная культура). Продолжительность жизни большинства клеток генетически определена, но некоторые объекты культивирования клеток были трансформированы в бессмертные клетки, которые будут воспроизводиться бесконечно, если для этого будут созданы оптимальные условия.

Определение
История
Лабораторная техника получения и культивирования клеток, отделенных от исходного источника ткани, стала более устойчивой в середине 20 века. Основные прорывы в этой области были совершены учеными из Йельского университета.
Прорыв в середине века
Изначально получение и культивирование клеток практиковалось для того, чтобы найти панацею от множества опасных вирусов. Рядом исследователей было открыто, что многие штаммы вирусов могут спокойно жить, процветать и размножаться на искусственно выращиваемых клетках животных или даже целых органах, которые удерживаются автономно в специальных колбах. Как правило, для подобных испытаний используются клетки органов животных, максимально приближенных к человеку - к примеру, высших приматов вроде шимпанзе. Все эти открытия были совершены в 1940-х годах, когда эксперименты над людьми в силу определенных причин были наиболее актуальны.
Методология
Клетки могут быть выделены из тканей для культуры ex vivo несколькими способами. Они могут быть легко очищены от крови, однако только белые клетки способны к росту в культуре. Клетки могут быть выделены из твердых тканей путем переваривания внеклеточного матрикса с использованием ферментов, таких как коллагеназа, трипсин или проназа, перед перемешиванием ткани для высвобождения клеток в суспензию. Альтернативно кусочки ткани могут быть помещены в ростовые среды, а клетки, которые растут, доступны для культуры. Этот метод известен как культура эксплантатов.
Клетки, которые культивируются непосредственно у субъекта, известны как первичные клетки. За исключением некоторых, полученных из опухолей, большинство первичных клеточных культур имеют ограниченный срок службы.
Бессмертные и стволовые клетки
Установленная или иммортализованная клеточная линия приобрела способность размножаться бесконечно либо через случайную мутацию, либо преднамеренную модификацию, такую как искусственная экспрессия гена теломеразы. Многочисленные клеточные линии хорошо известны как типичные типы клеток.

Массовая культура линий клеток животных имеет основополагающее значение для производства вирусных вакцин и других продуктов биотехнологии. Культура стволовых клеток человека используется для расширения их числа и дифференциации клеток на различные типы, пригодные для трансплантации. Культивирование клеток человека (стволовых) также используется для сбора молекул и экзосом, высвобождаемых стволовыми клетками для целей терапевтического использования.
Связь с генетикой
Биологические продукты, полученные с помощью технологии рекомбинантной ДНК (рДНК) в культурах животных, включают ферменты, синтетические гормоны, иммунобиологические (моноклональные антитела, интерлейкины, лимфокины) и противораковые агенты. Хотя многие более простые белки могут быть получены с использованием рДНК в бактериальных культурах, более сложные белки, которые гликозилированы (модифицированы углеводами), в настоящее время должны быть сделаны в клетках животных.
Важным примером такого комплексного белка является гормон эритропоэтин. Расходы на выращивание клеточных культур млекопитающих высоки, поэтому ведутся исследования по созданию таких сложных белков в клетках насекомых или на высших растениях. Использование отдельных эмбриональных клеток и соматических эмбрионов в качестве источника прямого переноса генов путем бомбардировки частицами, экспрессии транзитных генов, и конфокальная микроскопия является одной из областей ее применений. Культивирование растительных клеток является самой распространенной формой этой практики.

Тканевые культуры
История тканевой культуры
В 1885 году Вильгельм Ру снял участок медуллярной пластины эмбриональной курицы и несколько дней поддерживал ее в теплом солевом растворе, устанавливая основной принцип тканевой культуры. В 1907 году зоолог Росс Гранвилл Харрисон продемонстрировал рост эмбриональных клеток лягушки, которые привели бы к возникновению нервных клеток в среде свернувшейся лимфы. В 1913 году Э. Штайнхардт, C. Исраэль и Р. А. Ламберт выращивали вирус коровьей оспы в фрагментах роговой ткани морской свинки. Это уже было чем-то куда более продвинутым, чем культивирование клеток растений.

От прошлого к будущему
В современном использовании тканевая культура обычно относится к росту клеток из ткани многоклеточного организма in vitro. Условия культивирования клеток при этом не очень важны. Эти клетки могут быть выделенными из донорского организма, первичными клетками или иммортализованной клеточной линией. Клетки омывают культуральной средой, которая содержит питательные вещества и источники энергии, необходимые для их выживания. Термин "тканевая культура" часто используется взаимозаменяемо с клеточной культурой.
Применение
Буквальное значение культуры тканей относится к культивированию кусочков ткани, то есть к эксплантационной культуре.
Тканевая культура является важным инструментом для изучения биологии клеток из многоклеточных организмов. Она обеспечивает in vitro модель ткани в четко определенной среде, которой можно легко манипулировать и анализировать ее.
В культуре тканей животных клетки можно выращивать в виде двумерных монослоев (обычная культура) или внутри волокнистых лесов или гелей для достижения более натуралистических трехмерных тканеподобных структур (3D-культура). Эрик Саймон в докладе гранта NIH SBIR 1988 года показал, что электроспиннинг можно использовать для получения полимерных волокнистых каркасов нано- и субмикронного масштаба, специально предназначенных для использования в качестве клеточных и тканевых субстратов in vitro.
Это раннее использование электропроводных волокнистых решеток для клеточной культуры и тканевой инженерии показало, что различные типы клеток будут прилипать и размножаться на поликарбонатных волокнах. Было отмечено, что, в отличие от сплюснутой морфологии, обычно наблюдаемой в 2D-культуре, клетки, выращенные на электрошнурных волокнах, демонстрируют более округлую 3-мерную морфологию, обычно наблюдаемую в тканях in vivo.
Культура растительной ткани, в частности, связана с выращиванием целых растений из мелких кусочков растительных волокон, культивируемых в среде.
Различия в моделях
Исследования в тканевой инженерии, в области стволовых клеток и молекулярной биологии в первую очередь включают в себя выращивание клеточных культур на плоских пластиковых блюдах. Этот метод известен как двумерная (2D) клеточная культура и впервые был разработан Вильгельмом Ру, который в 1885 году удалил часть медуллярной пластинки эмбриональной курицы и поддерживал ее в теплом физиологическом растворе в течение нескольких дней на плоском стекле.
От продвижения полимерной технологии возникла современная стандартная пластиковая посуда для двумерной клеточной культуры, широко известная как чашка Петри. Юлий Рихард Петри, немецкий бактериолог, как правило, упоминается в научной литературе как автор этого изобретения, работал помощником Роберта Коха. Сегодня различные исследователи также используют культуральные лабораторные колбы, конические и даже одноразовые мешки, подобные тем, которые используются в одноразовых биореакторах.

Помимо культуры хорошо устоявшихся иммортализованных клеточных линий, клетки из первичных эксплантов множества организмов могут культивироваться в течение ограниченного периода времени до появления чувствительности. Культурные первичные клетки широко использовались в исследованиях, как в случае кератоцитов рыб в исследованиях миграции клеток. Среды для культивирования клеток при этом могут использоваться самые разные.
Культуры растительных клеток обычно выращивают в виде культур клеточной суспензии в жидкой среде или в культурах каллюса на твердой среде. Культура недифференцированных растительных клеток и калли требует надлежащего баланса гормонов роста растений ауксина и цитокинина.
Долгое время считалось, что нейроны головного и спинного мозга, то есть клетки, относящиеся к центральной нервной системе (ЦНС), невозможно получить из нейральных стволовых клеток периферической нервной системы (ПНС), и наоборот. Ученым из Института Мозга (Max Planck Institute for Brain Research, Франкфурт) и Института Иммунобиологии и Эпигенетики (Max Planck Institute of Immunobiology and Epigenetics, Фрайбург) общества Макса Планка (Германия) впервые удалось получить клетки ЦНС из нейральных стволовых клеток ПНС. Обнаружено, что при культивировании клеток ПНС в определенных условиях они дают начало олигодендроцитам – клеткам, образующим миелиновую оболочку вокруг нейронов ЦНС.
Нервная система млекопитающих и человека подразделяется на центральную систему (ЦНС), включающую в себя все отделы головного мозга и спинной мозг, и периферическую нервную систему (ПНС), к которой относятся черепномозговые нервы, спинномозговые нервы и нервные сплетения. Хотя две эти системы тесно связаны друг с другом, они отличаются анатомически и состоят из разных типов клеток. Клетки ПНС развиваются из эмбриональных клеток-предшественниц, составляющих так называемый нервный валик. До настоящего времени считалось, что стволовые клетки нервного валика могут давать начало нейронам и глиальным клеткам периферической нервной системы, но отнюдь не ЦНС.
Факторы среды, вероятно, активируют различные генетические программы, посредством которых из эмбриональных столовых клеток развиваются разные типы клеток, чего в норме не происходит. Ученые еще не выяснили, какие именно факторы принимают участие в этих процессах. Есть лишь предположение, что это могут быть белки из семейства факторов роста фибробластов (fibroblast growth factor, FGF).
В головном мозге мышей на разных стадиях эмбрионального развития репрограммированные стволовые клетки преимущественно развивались в олигодендроциты, образующие миелиновую оболочку вокруг нейронов ЦНС. Проведя трансплантацию олигодендроцитов генетически модифицированным мышам, у которых не продуцировался миелин и имелись серьезные неврологические дефекты, ученые убедились в том, что утраченные функции трансплантированные олигодендроциты брали на себя.
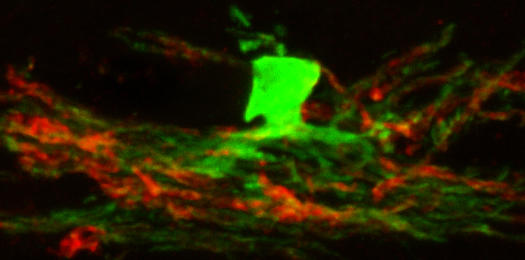
Трансплантация репрограммированных стволовых клеток нервного валика в головной мозг генетически модифицированных мышей, клетки которых не были способны к синтезу миелина. Стволовые клетки дают начало олигодендроцитам (окрашены зеленым флуоресцентным красителем), формирующим миелиновую оболочку (окрашена красным флуоресцентным красителем) (фото: Max Planck Institute for Brain Research).
Оригинальная статья:
E. Binder, M. Rukavina, H. Hassani, M. Weber, H. Nakatani, T. Reiff, C. Parras, V. Taylor, H. Rohrer. Peripheral Nervous System Progenitors Can Be Reprogrammed to Produce Myelinating Oligodendrocytes and Repair Brain Lesions. Journal of Neuroscience, 2011; 31 (17): 6379.
Читайте также:


