Лабораторная диагностика гнойных инфекций цнс
Инфекции могут возникать в любой области центральной нервной системы:
• менингиты (воспаление твердых оболочек);
• радикулиты (воспаление спинальных нервных корешков);
• миелиты (воспаление спинного мозга);
• энцефалиты (воспаление головного мозга);
• абсцесс мозга (локальное скопление гноя).
Кроме того, новые методы визуализации (например, МРТ) показали, что многие области ЦНС демонстрируют динамически флюктуирующие воспалительные процессы еще не известных синдромов. Причина этих повреждений не установлена, возможно это вирус или другой инфекционный агент.
ЦНС защищена черепом, спинным столбом и менингеальными мембранами, но доступна инфекционным агентам:
• через любое повреждение в защите ЦНС (например, перелом черепа);
• через кровь (например, сепсис с последующим формированием абсцесса);
• через нервы (например, вирус бешенства);
• иными способами (например, вирус простого герпеса, ВИЧ).
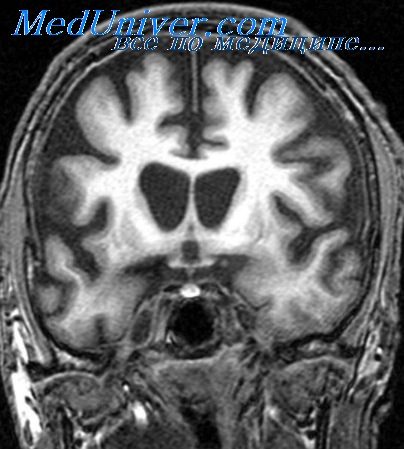
Локальный иммунный ответ ЦНС на инфекцию зависит от реакции организма на инфекционный агент. Степень и характер ответа на различные микробные агенты весьма разнообразны.
Организмы, инфицирующие ЦНС, могут быть различными: от гельминтных паразитов (например, Trichinella spiralis, нематоды), грибов и бактерий (например, Coccidioides immitis и Mycobacterium tuberculosis) до вирусов (например, ВИЧ) и подвирусных белков (например, прионы при болезни Крейтцфельдта-Якоба и бычьем губковидном энцефалите).
Диагноз инфекции ЦНС основан на анамнезе, физикальном и лабораторном исследованиях. Признаки и симптомы зависят от возбудителя: лихорадка, возбудимость вплоть до конвульсий, измененный процесс мышления, измененная двигательная функция, усталость, сонливость или кома. Абсцессы и паразитарные кисты, как значительные по площади повреждения, могут вызывать симптомы и признаки, возникающие в результате давления или деструкции примыкающих структур (например, дефекты полей зрения из-за давления или разрушения зрительного нерва).
Может быть полезно исследование СМЖ:
• повышенное начальное давление и увеличенная концентрация белка в СМЖ предполагают инфекцию;
• микроскопическое исследование может выявить лейкоцитоз (бактериальная инфекция), лимфоцитоз (вирусная инфекция) или эозинофилию (паразитарная инфекция);
• окраска по Граму может выявить менингококк (Neisseria meningitidis) или Streptococcus pneumoniae, синее окрашивание — некоторые патогенные грибковые инфекции;
• биохимический анализ может показать присутствие вирусов или паразитов или их соответствующих антител;
• специальное обследование ЦНС с помощью компьютерной аксиальной томографии или МРТ также помогает в постановке диагноза, особенно абсцесса или другого пространственного повреждения.
Если бактерии попадают в кровоток, есть вероятность, что разовьется абсцесс мозга. Довольно редко это может произойти после стафилококковой кожной инфекции.
Энцефалиты могут развиваться как с воспалением твердых оболочек, так и без воспаления, но часто энцефалиты возникают вместе с менингеальным раздражением из-за инфекции или присутствия в СМЖ индуцирующей воспаление субстанции (например, крови). Специфические признаки энцефалитов и признаки менингеального раздражения:
• ригидная шея;
• боль при сгибании шеи;
• боль, сопровождающая ограниченный пассивный подъем прямой ноги.
При наличии этих признаков необходимы дальнейшие исследования.
Кафедра клинической лабораторной диагностики
Утверждено на заседании кафедры
Протокол №…. от…. 2005 года
Заведующий кафедрой, д.м.н.
Микробиологические исследования при инфекционных поражениях ЦНС
Учебно-методическое пособие для студентов
Гомель, 2005 год
Введение.
Гнойный менингит - гнойное воспаление мозговых оболочек. Встречаются первичный менингит, вызываемый менингококками, и вторичный, возбудителями которого являются золотистый и эпидермальный стафилококки, пиогенный и пневмонийный стрептококк, кишечная палочка, инфлюэнца-бактерия. Возбудители заносятся в субарахноидальное пространство из инфекционных процессов в других органах гематогенным, лимфогенным, контактным путями, а также при травмах.
К поражениям ЦНС также относятся энцефалиты и такие редко встречающиеся болезни ЦНС, как хронические гранулематозные процессы и процессы, вызванные специфическими микроорганизмами (Neisseria meningitidis, Mycobacterium tuberculosis, Treponema pallidum).
Цель:Получение знаний и практических навыков по вопросам диагностики инфекционных поражений органов центральной нервной системы.
Задачи:
· Знать возбудителей инфекционных поражений органов центральной нервной системы.
· Знать этапы диагностики инфекционных поражений органов центральной нервной системы.
· Уметь собирать и доставлять патологический материал
· Иметь навыки в постановке диагностических реакций.
· Уметь оценить полученные результаты и выдать заключение по проведенному исследованию.
Практические навыки:
· Сбор и доставка патологического материала.
· Посев материала на селективные и неселективные среды.
· Отбор подозрительных колоний и выделение чистых культур.
· Идентификация по биохимическим свойствам
· Постановка реакции антибиотикочувсвительности.
· Оценка полученных результатов.
· Выдача заключения по проведенному исследованию.
Основные учебные вопросы:
1. Основные возбудители гнойных инфекций ЦНС.
2. Возбудители гнойных инфекций ЦНС в разных возрастных группах.
3. Малоизвестные бактерии - возбудители менингитов.
4. Клинические формы менингококковой инфекции.
5. Эпидемический цереброспинальный менингит.
6. Лабораторная диагностика менингококковой инфекции. Исследование СМЖ. Исследование крови. Исследование носоглоточной слизи для выявления бактерионосительства. Питательные среды.
7. Бактериальные менингиты другой этиологии. Лабораторная диагностика менингитов, вызванных Haemophilus influenzae, Streptococcus pneumoniae.
8. Этиология абсцессов головного мозга. Микробиологическое исследование патологического материала при абсцессах головного мозга.
Задания для самоподготовки и УИРС:
1. Основные возбудители гнойных инфекций ЦНС.
2. Возбудители гнойных инфекций ЦНС в разных возрастных группах.
3. Малоизвестные бактерии - возбудители менингитов.
4. Клинические формы менингококковой инфекции.
5. Эпидемический цереброспинальный менингит.
6. Лабораторная диагностика менингококковой инфекции. Исследование спинномозговой жидкости.
7. Исследование крови. Исследование носоглоточной слизи для выявления бактерионосительства. Питательные среды.
8. Бактериальные менингиты другой этиологии. Лабораторная диагностика менингитов, вызванных Haemophilus influenzae, Streptococcus pneumoniae.
9. Этиология абсцессов головного мозга. Микробиологическое исследование патологического материала при абсцессах головного мозга.
10. УИРС: Микробиологическая диагностика эцефалитов бактериальной этиологии (M. tuberculosis, T. pallidum, N. meningitidis).
Основная литература:
1. Клиническая лабораторная аналитика. Том IV./ Под ред. В.В. Меньшикова. –М.:Агат-Мед, 2003.-816 с.
2. А.Н. Маянский Микробиология для врачей (очерки патогенетической микробиологии). Нижний Новгород: Изд-во НГМА, 1999.
3. Медицинская микробиология. Часть первая./ Под. ред. А.М. Королюка и В.Б. Сбойчакова. –СПб., 1999. – 272с.
4. Медицинская микробиология./ Под. ред. В.И. Покровского. – М.:ГЭОТАР МЕДИЦИНА, 1999.
5. Конспект лекций.
Дополнительная литература:
1. : Медицинская микробиология, иммунология и вирусология: Учебник для мед. вузов./ Под. ред. А.И. Коротяева, С.А. Бабичева –СПб.: СпецЛит, 2000.
2. Справочник по клинической микробиологии./ Под. ред. В.В. Тец -СПб.: Стройлеспечать, 1994. – 224с.
3. Приказ №535 то 22апреля 1985 года.
Проведение исследования.
Исследование ликвора предусматривает следующие этапы:
• Центрифугируют образец при 2500-3000 об/мин (1500 х g) 15-20 мин., если позволяет объем материала (>1мл).
• Стерильной пастеровской пипеткой собирают надосадочную жидкость, оставляя в пробирке 0,5-1 мл осадочного материала.
• Надосадочную жидкость используют для обнаружения антигена серологическими методами (в реакции встречного иммуноэлектрофореза, в латекс-агглютинации) и сохраняют ее в холодильнике до 1 недели на случай необходимости проведения дополнительных исследований.
• Осадок тщательно перемешивают вращением пробирки не менее 30 сек; не следует для этих целей использовать пипетку, так как бактерии и клетки могут осесть на стенках пробирки, что может привести к получению ложно отрицательного результата.
• Стерильной пипеткой засевают по 1 -2 капли ликвора на предварительно прогретые в термостате плотные питательные среды, а оставшийся в пробирке материал - в 0,1% питательный полужидкий агар (среда обогащения). Если ликвора мало, то его засевают только на среду обогащения.
• Из оставшегося после посевов материала готовят мазок на обезжиренном в спирте стекле, позволяя капле свободно растечься до большого размера; высушивают на воздухе в биологически защищенном боксе. При исследовании ликвора с неопределённым возбудителем или на менингококк мазки после высушивания фиксируют спиртом или на пламени и окрашивают метиленовым синим или по Граму в модификации Калины. Результаты микроскопии оценивают сразу же и сообщают клиницисту.
Если пробирка с ликвором выглядит пустой или содержит всего 1-5 капель жидкости, а дополнительно получить образец не удается, предпринимают следующее:
- При наличии всего 1 капли ликвора стерильной пастеровской пипеткой берут частичку материала для приготовления мазков в окраске по Граму.
- Стерильной пастеровской пипеткой вносят около 1 мл бульона в пробирку, закупоривают ее и переворачивают несколько раз для перемешивания содержимого, а затем уже производят посевы как указано выше.
Если ликвор прозрачный, то центрифугирование не производится, мазок не делается, и вся его часть, оставшаяся после посева в чашки и серологических проб, засевается в среду обогащения. При необходимости проводят специальные исследования на грибы, микобактерии, паразиты и вирусы.
Культивирование
Проводят посев гнойного ликвора или ресуспензированного осадка на чашку со свежеприготовленными средами. Капли материала слегка растирают подогретым шпателем на поверхности агара. После этого одну чашку с простым агаром помещают в термостат в обычной атмосфере при 37°С, а две другие инкубируют при повышенной концентрации СО2. Инкубация при повышенных концентрациях СО2 способствует выявлению патогенных нейсерий, пневмококков, листерий и др. При подозрении на H. influenzae производят посев на чашку с шоколадным агаром. Пробирки с полужидким агаром инкубируют при 37ºС в аэробных условиях.
На второй день просматривают сделанные накануне посевы СМЖ. При появлении роста на плотных питательных средах изучают характер роста, морфологию выросших бактерий при окраске по Граму.
У бактерий, выросших на плотных питательных средах, определяют чувствительность к антибиотикам, а также проводят отсевы на элективные среды для получения чистой культуры с последующей их идентификацией.
При отсутствии роста колоний на твёрдых питательных средах делают высев из среды накопления на чашку с сывороточным агаром и КА.
Твёрдые среды с посевами ликвора при отсутствии роста на протяжении 24 часов надо инкубировать в течение 3-6 дней. При отрицательных результатах высевы повторяют через 8-10 дней.
При необходимости проводят специальные исследования на грибы, микобактерии, паразиты и вирусы.
Кафедра клинической лабораторной диагностики
Последнее изменение этой страницы: 2016-12-10; Нарушение авторского права страницы

Инфекции, возникающие в различных отделах центральной нервной системы, могут быть успешно вылечены неврологами нашей клиники. Мы проведем диагностические мероприятия на самом современном оборудовании для получения точного диагноза. Опыт наших неврологов позволяет эффективно справиться со многими болезнями ЦНС, какие бы инфекции их ни вызывали: вирусы, бактерии, грибковые инфекционные агенты, простейшие. Мы не только вылечим заболевание, но и восстановим противоинфекционный иммунитет.
Главное о нейроинфекциях
Инфекция может поразить любой участок ЦНС: головной мозг, спинной, периферические нервы. Инфекционные агенты могут проникать через разные повреждения центральной нервной системы. Это может быть перелом черепа, проникновение через кровь или нервы, а также иные способы. К самым опасным относят нейроинфекции головного мозга.
Инфекции делятся на первичные и вторичные. При первых возникает изначальное инфицирование ЦНС, при вторых инфекционные агенты попадают в центральную нервную систему из иных очагов. Нейроинфекции иногда выступают осложнением определенных инфекционных болезней (грипп, туберкулез, сифилис, герпес и проч.).
Отдельных видов инфекций ЦНС множество, но медики выделяют поражения оболочек головного мозга (менингиты) и спинного (миелиты), инфицирование вещества головного мозга (энцефалит) либо вещества спинного мозга (энцефаломиелит), воспаление корешков спинного мозга (радикулиты), поражения периферических нервов (невриты). Наши неврологи окажут помощь при самых разных типах нейроинфекций, таких как:
- Менингиты.
- Энцефалиты.
- Лептоспирозы.
- Миелиты.
- Бешенство.
- ВИЧ.
- Столбняк.
- Боррелиоз, клещевой энцефалит (инфекция передается клещами, возбудитель при укусе клеща попадает в кровь, далее в ЦНС).
- Поражения ЦНС при кори, краснухе, паротите.
- Инфицирование вирусами группы герпеса (герпес, цитомегаловирус и проч.).
- Вирусные гепатиты.
- Паразитарные болезни ЦНС.
- Токсоплазмоз.
- Лептоспироз.
- Хламидиоз.
- Микоплазмоз.
- Нейросифилис.
Симптомы поражения ЦНС
Симптоматика болезней самая разная, она зависит от вида инфекции. Случаются двигательные расстройства, мышечная слабость, параличи, тремор. Могут быть нарушения речи, координации, тактильной чувствительности. К симптомам относятся также головные боли, боли в спине, конечностях.
Диагностирование инфекций ЦНС в клинике
Эффективное лечение нейроинфекций возможно только при постановке точного диагноза. Диагностическое обследование может включать:
- Осмотр специалистом-неврологом.
- Общие анализы мочи, крови, биохимия крови.
- Лабораторные исследования, которые позволяют выявить возбудителя, оценить иммунитет (определение антител к инфекционным возбудителям, ПЦР-диагностика, культуральные посевы). Именно лабораторная оценка иммунитета может помочь определить, каким образом инфекция попала в ЦНС.
- Электронейромиография выполняется для определения инфекций спинного мозга, периферических нервов.
- УЗИ-диагностика.
- КТ головного либо спинного мозга позволяют выявить новообразования, кровоизлияния, то есть отличить инфекционные причины поражения ЦНС от неинфекционных.
- Люмбальную пункцию.
Лечение нейроинфекций
Специалисты клиники на основе проведенных диагностических исследований выберут интенсивную терапию, направленную на:
- Устранение возбудителя болезни. Для этого врачом назначаются самые современные антибиотики, противовирусные средства, интерфероны, иммуноглобулины.
- Устранение источника инфекции. К примеру, если источник находится в гайморовых пазухах носа, необходимо привести их в порядок.
- Восстановление противоинфекционного иммунитета. Для этого неврологом будут прописаны специальные препараты.
- Стимулирование функций пораженных участков ЦНС с помощью эффективных лекарственных препаратов.
Какими из нейроинфекций можно заразиться от человека, какими — только от животных?
Ответ: Только от животных можно заразиться бешенством, бруцеллезом (очень редко можно человеку заразиться от человека), лептоспирозом. Токсоплазмозом можно заразиться и от животного, и от человека. Большинством нейроинфекций человек заражается от человека.
Может ли инфекция ЦНС передаваться от матери ребенку во время беременности или родов?
Ответ: Да, некоторые инфекции могут передаваться от матери либо через плаценту (к примеру, цитомегаловирус, краснуха, токсоплазмоз), либо через периферические нервы (менингоэнцефалит, бешенство, герпес, острый полиомиелит).
Правда ли, что от большинства инфекций ЦНС еще не существует лекарств?
Ответ: Это далеко не так. Например, менингиты, лечение которых начато вовремя, вылечиваются очень часто полностью и без осложнений благодаря современным антибиотикам. При различных видах энцефалита лечение симптоматическое, прогнозы при разных видах болезни колеблются от благоприятных до неблагоприятных. Лечение должно начинаться немедленно. Для клещевых энцефалитов существуют специфические препараты, в связи с этим вероятность полного излечения высока. Разные виды миелита тоже отличаются разными прогнозами. Герпес эффективно лечится противовирусными препаратами, бешенство излечивается, если специальную вакцину начинают вводить не позднее двух недель после укуса зараженного животного. Можно говорить, что от очень многих инфекций ЦНС существуют эффективные лекарственные средства, применение которых ведет к выздоровлению. Но, к сожалению, не от всех. При малейших подозрениях на наличие нейроинфекции нужно обратиться к нашим неврологам.
Какой процент клещей является переносчиками инфекции?
Ответ: В европейской части России переносят инфекцию несколько процентов всех клещей, в Сибири, на Дальнем Востоке таких клещей до 20 %.
Общее название группы инфекционных болезней с локализацией возбудителя в различных отделах ЦНС – нейроинфекции. Причиной нейроинфекции могут быть вирусы, бактерии, грибы, простейшие и прионы. Выделяют воспаление оболочек головного и спинного мозга (менингит), поражение вещества головного мозга (энцефалит) и спинного мозга (миелит). При наличии признаков менингита и энцефалита ставится диагноз менингоэнцефалит.
Все эти заболевания носят полиэтиологичный характер, сопровождаются общей интоксикацией организма и воспалительными изменениями в СМЖ, различаясь клиническими проявлениями в зависимости от вида возбудителя, локализации процесса и масштаба поражения инфекцией.
В зависимости от особенностей клеточного состава СМЖ у больного – нейтрофильный или лимфомоноцитарный плеоцитоз, – нейроинфекции разделяют на гнойные или серозные менингиты (энцефалиты), соответственно. Примерно равное соотношение нейтрофильных лейкоцитов и лимфоцитов в СМЖ свидетельствует о смешанном характере плеоцитоза, который может определяться на ранних сроках заболевания при бактериальном менингите любой этиологии. Гнойный ликвор чаще всего подразумевает бактериальную природу инфекции, преобладание в ликворе лимфоцитов свидетельствует о преимущественно вирусной этиологии заболевания. Поэтому получение результатов пункции СМЖ у больного в первые часы поступления в стационар позволяет определить спектр возможных возбудителей заболевания (бактерии или вирусы) и назначить адекватное лечение. В тоже время необходимо помнить, что ряд бактериальных менингитов (туберкулезный, сифилитический, иерсиниозный и др.) могут иметь как гнойный, так и серозный характер.
Наиболее частой причиной гнойных бактериальных менингитов (энцефалитов) являются менингококки (Neisseria meningitidis), пневмококки (Streptococcus pneumoniae), гемофильные палочки тип b (Haemophilus influenzae b), золотистый стафилококк (Staphylococcus aureus), прочие возбудители (род Streptococcus, Staphylococcus, Listeria, Pseudomonas, семейство Enterobacteriaceae и др.) встречаются значительно реже. По первичности поражения оболочек и (или) вещества мозга эти заболевания разделяют на первичные, характеризующиеся развитием болезни без предшествующего очагового или септического поражения организма микробным агентом и вторичные, осложнившие локализованную острую или хроническую инфекцию в результате генерализации процесса или травмы. Первичные бактериаль ные менингиты в первую очередь вызывают менингококки (Neisseria meningitidis), в меньшей степени гемофильные палочки тип b (Haemophilus influenzae b) и пневмококки (Streptococcus pneumoniae), остальные возбудители, как правило, являются причиной вторичных менингитов.
Серозные бактериальные менингиты, кроме уже упоминавшихся менингитов со смешанным плеоцитозом (иерсиниозный, сифилитический и др.), включают в себя заболевания микоплазменной (род Mycoplasma), лептоспирозной (род Leptospira) и боррелиозной (род Borrelia) этиологии. Серозные протозойные менингиты (менингоэнцефалиты) чаще всего вызываются Toxoplasma gondii. Грибковые менингиты обуславливают криптококки (Cryptococcus neofomans), грибки рода Candida, грибки кокцидоидоза (Coccidoides immitis). Кроме того, серозные менингиты могут быть вызваны Mycobacterium tuberculosis complex.
Первичные вирусные менингиты преимущественно представлены менингоэнцефалической формой клещевого вирусного энцефалита (вызывается вирусом, принадлежащим к группе Arbovirus, род Flavivirus), менингеальной формой острого полиомиелита (возбудитель относиться к роду Enterovirus, Poliovirus hominis) и некоторыми другими.
Наиболее частой причиной вторичных вирусных менингитов (энцефалитов) являются возбудители энтеровирусных инфекций (семейство Picornaviridae род Enterovirus), вирус эпидемического паротита (семейство Paramyxoviridae, род Rubulavirus), вирусы герпеса (семейство Herpesviridae), значительно реже вирусы кори и краснухи.
Показаниями для обследования с целью выявления нейроинфекции служат признаки общей инфекционной интоксикации больного, сопровождающиеся синдромом повышенного внутричерепного давления, синдромом отека и набухания головного мозга, синдромом поражения мозговых оболочек или энцефалическим синдромом, воспалительными изменениями в ликворе. В тоже время необходима комплексная оценка состояния больного, тщательный сбор анамнестических данных, особенно относящихся к эпидемиологической составляющей (случаи подобных заболеваний в окружении больного, укусы клещей, наличие домашних животных, предшествующую инфекционную патологию, принадлежность к группам риска и т.д.).
Учитывая сходство симптомов при инфекционном поражении ЦНС разными возбудителями, определение этиологии заболевания должно происходить только с применением лабораторных методов диагностики. Для этого в первую очередь исследуется ликвор и кровь пациентов с использованием прямых (визуальное выявление возбудителя с использованием микроскопии, выделение возбудителя в культуре клеток, обнаружение его АГ или фрагментов генетического материала) и косвенных методов лабораторной диагностики (определение АТ).
Прямые методы диагностики бактериальных и грибковых поражений ЦНС:
Косвенные методы диагностики – обнаружение специфических антител к возбудителю в сыворотке крови больного с использованием различных методов (РПГА, РНГА, РТГА, РСК, ИФА и др.) преимущественно предназначены для ретроспективного подтверждения диагноза.
Общепринятые методы лабораторной диагностики отсутствуют. Диагноз устанавливают преимущественно на основании клинической картины заболевания и подтверждают гистологическим исследованием тканей пораженных участков головного мозга. Наблюдается дегенерация нейронов и аксонов серого вещества головного мозга, накопление амилоидоподобного вещества, образующего бляшки и фибриллярные скопления внутри и вне нейронов, гипертрофия глиальных клеток и другие изменения, характерные для спонгилоформной энцефалопатии. В последние годы разработаны методы иммунохимичес-кого обнаружения аномальной формы приона (РгР^ с ) в клетках головного мозга методом ИФ. Метод также позволяет продемонстрировать накопление PrP Sc в клетках роговицы глаза на ранних стадиях болезни.
• Диагностические, профилактические и лечебные препараты
Диагностические поливалентная и типоспецифические полио-миелитные сыворотки.Применяют для идентификации и типи-рования вирусов полиомиелита.
Диагностические поливалентные и типоспецифические (моновалентные) сыворотки к вирусам Коксаки и ECHO.Применяют для идентификации и типирования соответствующих вирусов.
Пероральная живая вакцина против полиомиелита (трехвалентная).Содержит ослабленные штаммы вирусов полиомиелита I—III типов. Вакцина выпускается в жидком виде и в форме драже. Применяют для профилактики полиомиелита (создание активного иммунитета).
Парентеральная инактивированная вакцина против полиомиелита (трехвалентная).Содержит инактивированные вирусы полиомиелита I—IIIтипов. Применяют для профилактики полиомиелита (создание активного иммунитета).
Диагностикум из вируса клещевого энцефалита.Используют для серодиагностики клещевого энцефалита.
Инактивированная культуральная вакцина против клещевого энцефалита.Стерильный специфический антиген вируса клещевого энцефалита, инактивированного формалином. Применяют для профилактики клещевого энцефалита по эпидемическим показаниям (создание активного иммунитета).
Иммуноглобулин против клещевого энцефалита.Содержит противовирусные специфические антитела, получаемые из сыворотки крови лошадей, гипериммунизированных вирусом клещевого энцефалита. Применяют для лечения и экстренной профилактики клещевого энцефалита (пассивный иммунитет).
Живая антирабическая вакцина Ферми.Изготавливают из мозга молодых овец, зараженных фиксированным (аттенуиро-ванный штамм) вирусом бешенства. Вирус в суспензии мозга обрабатывают 1 % раствором фенола и лиофилизируют. Применяется для создания активного иммунитета с целью профилактики бешенства. Вакцину вводят лицам, укушенным подозрительными на бешенство животными. Поствакцинальный иммунитет развивается через 2 нед и сохраняется в течение 6 мес.
Культуральная убитая антирабическая вакцина.Получают путем химической инактивации вируса бешенства, выращенного в культуре клеток. Применяют для профилактики бешенства (создание активного иммунитета).
Антирабический иммуноглобулин.Получают путем гипериммунизации лошадей фиксированным вирусом бешенства. Применяют для создания пассивного иммунитета с целью профилактики бешенства. Препарат вводят не позднее 72 ч после укуса животного в сочетании с антирабической вакциной. Препарат обезвреживает вирус бешенства и предупреждает развитие поствакцинальных энцефалитов.



жительный инкубационный период, а также способность к персистенции, что является причиной развития хронической инфекции. Обязательной мерой профилактики заражения вирусным гепатитом при переливании крови является контроль доноров крови на носительство вирусов гепатита. Заболевания, протекающие с поражением печени — гепатитом — в качестве одного из проявлений генерализованной инфекции, способны вызывать также другие вирусы. Наиболее часто гепатит возникает при инфекциях, вызванных вирусом желтой лихорадки, герпесвирусами (CMV, HSV-l, HSV-2, EBV). Гепатит также может развиваться при тяжелых формах кори, паротита, краснухи, вирусных системных лихорадок. Лабораторная диагностика этих инфекций описана в соответствующих главах.
Тема 20.1. МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА КИШЕЧНЫХ ВИРУСНЫХ ИНФЕКЦИЙ И ВИРУСНЫХ ГЕПАТИТОВ
1. Биологические свойства возбудителей кишечных вирусных инфекций и вирусных гепатитов, их патоген-ность, экология, особенности инфекции и эпидемиология вызываемых заболеваний.
2. Микробиологическая диагностика.
3. Диагностические, профилактические и лечебные препараты.
1. Реакция преципитации в агаре (встречная диффузия в геле по Оухтерлони) для обнаружения HBs-антигена в сыворотке крови больного вирусным гепатитом В.
2. Диагностические, профилактические и лечебные препараты.
1. Указать материал для исследования.
2. Учесть результаты выявления специфических HBs-ан-тигенов в сыворотке крови больного с помощью РИГА.
3. Учесть результаты выявления специфических HBs-ан-тигенов в сыворотке крови донора с помощью имму-ноферментного метода.
4. Учесть результаты выявления анти-НВз-антител в сыворотке крови больного с помощью РИГА. Оценить нарастание титра анти-ИВв-антител в динамике заболевания.
5. Учесть результаты выявления в сыворотке больного IgM против вируса гепатита А.
6. Дать краткую характеристику демонстрируемым диагностическим, профилактическим и лечебным препаратам.
• Микробиологическая диагностика кишечных вирусных инфекций
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения.
Вирусоскопическое исследование. Является одним из ведущих методов диагностики кишечных вирусных инфекций. Зрелые вирионы в испражнениях можно обнаружить с помощью метода электронной микроскопии.
Вирусологическое исследование. Применяют исключительно с целью диагностики эпидемий и вспышек кишечных вирусных инфекций. Для выделения реовирусов и ротавирусов из испражнений используют различные типы клеточных культур (HeLa, первичные культуры клеток почек обезьян и др.). Индикацию осуществляют по ЦПД, которое развивается в течение 3 нед и характеризуется появлением внутрицитоплазматичес-ких включений и неспецифической дегенерацией клеток. Ведущим методом идентификации и типирования является анализ фрагментов вирусной РНК методом электрофореза. Выделение чистой культуры вирусов ECHO — см. главу 9. Кишечные коронавирусы, калицивирусы, астровирусы и аденовирусы не удается культивировать in vitro.
Экспресс-методы диагностики: иммунохимические и молеку-лярно-биологические исследования. Иммунохимические исследования. Присутствие антигенов вирусов в испражнениях можно определить с помощью метода ИЭМ (антигены цельных вирионов) и чувствительных серологических реакций (латекс-агглютинации, ИФА, РИФ и др.).
Молекулярно-биологические исследования. Вирусные НК в испражнениях можно обнаружить с помощью ПЦР или метода ДНК-зондов.
Серодиагностика. Серодиагностика при кишечных вирусных инфекциях малоинформативна и применяется преимущественно с целью ретроспективной диагностики и для оценки эпидемиологической ситуации. Для определения противовирусных антител в крови пациента применяют различные серологические реакции (РИГА, ИФА, РИА и др.). Ретроспективную диагностику осуществляют методом парных сывороток. Диагностическое значение имеет нарастание титра антител в поздней сыворотке не менее чем в 4 раза. Выявление (методом ИФА) специфических противовирусных иммуноглобулинов класса М (IgM) свидетельствует об активной инфекции.



• Микробиологическая диагностика вирусного гепатита А
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь, испражнения. МЕТОДЫ ДИАГНОСТИКИ:
Вирусоскопическое исследование. Зрелые вирионы в испражнениях можно обнаружить с помощью метода электронной микроскопии.
Экспресс-методы диагностики: иммунохимические и молеку-лярно-биологические исследования. Иммунохимические исследования. Присутствие антигенов вируса в испражнениях можно определить с помощью метода ИЭМ (антигены цельных вирионов) и чувствительных серологических реакций ИФА, РИА и др. В типичных случаях вирус гепатита А удается обнаружить в фекалиях за 10—14 дней до появления клинических признаков заболевания. Вирус продолжает выделяться с испражнениями в течение 2—3 нед после начала желтухи.
Молекулярно-биологические исследования. Вирусные нуклеиновые кислоты в крови пациента на ранних сроках болезни обнаруживают с помощью ПЦР или метода ДНК-зондов.
Серодиагностика. Является ведущим методом диагностики вирусного гепатита А. Для определения противовирусных антител в крови пациента применяют различные серологические реакции (РИГА, ИФА, РИА и др.). Серодиагностику осуществляют методом парных сывороток (диагностическое значение имеет нарастание титра антител в поздней сыворотке не менее чем в 4 раза) или на основании выявления (методом ИФА) специфических противовирусных иммуноглобулинов класса М (IgM), свидетельствующих об активной инфекции. Последние присутствуют в сыворотке крови с первых дней заболевания и исчезают не ранее чем через 3—4 мес.
Для выявления IgM против вируса гепатита А используют различные варианты ИФА. Противовирусные IgM можно выявить следующим способом: на первом этапе на стенках лунок пластиковых планшетов адсорбируют антитела против человеческих IgM, на втором этапе в лунки вносят испытуемую сыворотку в различных разведениях. Фиксированные анти-IgM-антитела связывают все IgM сыворотки, в том числе и противовирусные антитела. Далее вносят стандартный антиген вируса гепатита А и меченые антитела против этого антигена. После инкубации и тщательного промывания буферным раствором с детергентами в лунки добавляют субстрат и хромоген. В положительном случае через несколько минут наблюдается появление окраски.
• Микробиологическая диагностика вирусного гепатита В
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь, биоптат печени.
Экспресс-методы диагностики: иммунохимические и молекулярно-биологические исследования. Иммунохимические исследования. Присутствие вирусспецифических антигенов в крови можно определить с помощью различных серологических реакций: иммунопреципитации в геле, РНГА, ИФА, РИА и др. На разных стадиях заболевания и при разных формах инфекции (острой, хронической, вирусоносительстве) в крови присутствуют разные антигены вируса (HBs, НВё), что используют с целью диагностики (табл. 20.1.1). Через 3—5 нед после заражения вирусом гепатита В и за 4—5 нед до появления клинической картины в сыворотке крови больных обнаруживают поверхностный антиген вируса — Я&-антиген (австралийский антиген). Выявление ЯДу-антигена свидетельствует о текущей острой или хронической инфекции и является основным методом контроля крови доноров. Присутствие ЯЯе-антигена является ведущим маркером активной репродукции вируса.
Таблица 20.1.1. Определение антигенов (Аг) и антител (Ат) в крови при лабораторной диагностике вирусного гепатита В
| Период болезни | HBs | НВс | HBe | ||
| Аг | Ат | Ат | Аг | At | |
| Инкубационный период | + | — | — | + | — |
| Продромальный период | + | — | ± (IgM) | + | — |
| Острый период | + | — | + (IgM) | + | — |
| Реконвалесценция: ранняя | — | — | + | — | ± |
| поздняя | — | + | + (IgG) | — | + |
| Хроническая активная форма | + | ± | + (IgG) | + | ± |
| Хроническая бессимптомная | + | — | _ | — | ± |
| форма (носительство) |
Наиболее простой и специфичный, но низкочувствительный метод обнаружения Я&-антигена — реакция встречной иммунодиффузии в геле. Сыворотку крови больного вносят в периферические лунки агаровой пластинки, в центральную лунку вносят стандартную сыворотку акт-HBs, полученную от переболевших гепатитом В. Учет реакции производят через 48—72 ч по появлению дуг преципитации между лунками.
Наиболее простым из чувствительных методов выявления ЯЯу-антигена является РНГА. В этой реакции используют эритроцитарный антительный диагностикум, т.е. эритроциты, нагруженные гипериммунным анти-ЯА-иммуноглобулином. Чувствительность РНГА в 100 раз выше, чем реакции преципитации в геле. К наиболее чувствительным реакциям относится ИФА, основанный на принципе "сандвича". Первона-

чально на поверхности твердой фазы (полимера) адсорбируют анти- 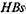
-антитела из стандартной сыворотки. Обычно используют лунки микротитрационных панелей. На втором этапе в отмытые лунки вносят исследуемую сыворотку крови больного. При наличии 
-антигена он связывается фиксированными на твердой фазе антителами. На третьем этапе добавляют анти- 
-антитела, несущие ферментную метку. В качестве метки используют фермент пероксидазу. Для выявления связанных антигеном меченых антител в отмытые лунки добавляют субстрат — пероксид водорода и хролюген — ортофенилендиамин, который окисляется в присутствии кислорода, выделяющегося при разложении пероксида водорода под воздействием фермента с образованием продуктов желто-коричневого цвета. Степень окраски отражает интенсивность связывания меченых антител, которая пропорциональна количеству 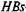
-антигена в исследуемой сыворотке.
Реакции РНГА, ИФА, РИА и другие могут быть использованы и для выявления 
-антигена в исследуемой сыворотке.
В биоптатах печени при активной форме инфекции можно выявить наличие НВс-антигена, ассоциированного с гепатоци-тами, методом ИФ.
Молекулярно-биологические исследования. Вирусные ДНК в крови пациента обнаруживают с помощью ПЦР или метода ДНК-зондов.
Серодиагностика.На разных стадиях заболевания и при разных формах инфекции (острой, хронической, вирусоноситель-стве) в крови присутствуют антитела к разным антигенам вируса гепатита В (HBs, HBc, НВе), что используют с целью диагностики (см. табл. 20.1.1). Для определения антител применяют различные серологические реакции: РНГА, ИФА, РИА и др. (см. выше).
Так, для выявления анти- 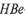
-антител в исследуемой сыворотке необходим соответствующий эритроцитный диагности-кум — эритроциты, нагруженные стандартным 
-антигеном. Реакцию, как правило, ставят с парными сыворотками. В тесте ИФА на поверхности твердой фазы адсорбируют стандартный 
-антиген, на втором этапе вносят исследуемую сыворотку в десятикратных разведениях, инкубируют, отмывают и добавляют меченую антиглобулиновую сыворотку.
Выявление антител к 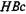
-антигену свидетельствует об активной инфекции и является одним из методов контроля крови доноров. Определение анти- 
IgM является ведущим методом дифференциальной диагностики острого и хронического активного вирусного гепатита В.
• Микробиологическая диагностика вирусного гепатита С МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь.
Экспресс-методы диагностики.Молекулярно-биологические исследования. Вирусную РНК в крови пациента обнаруживают с помощью ПЦР или методом ДНК-зондов.
Серодиагностика.Является ведущим методом диагностики хронического вирусного гепатита С и контроля крови доноров. Противовирусные антитела в крови пациентов определяют с помощью чувствительных серологических реакций (ИФА, РИА и др.) с рекомбинантным вирусным антигеном. Необходимо иметь в виду, что в остром периоде заболевания антитела в крови присутствуют в низком титре ичасто в комплексе с антигеном, поэтому их выявление не всегда удается.
• Микробиологическая диагностикавирусного гепатитаD
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь.
МЕТОДЫ ДИАГНОСТИКИ:
Экспресс-методы диагностики: иммунохимические и молекулярно-биологические исследования.Иммунохимические исследования. Присутствие дельта-антигена в крови можно определить с помощью чувствительных серологических реакций ИФА, РИА и др.
Молекулярно-биологические исследования. Вирусную НК в исследуемом материале обнаруживают с помощью ПЦР или метода ДНК-зондов.
Серодиагностика.Является ведущим методом диагностики вирусного гепатита D и контроля крови доноров. Антитела к дельта-антигену в крови пациентов определяют с помощью чувствительных серологических реакций (ИФА, РИА и др.).
• Микробиологическая диагностика вирусного гепатита G
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь.
МЕТОДЫ ДИАГНОСТИКИ:
Экспресс-методы диагностики: иммунохимические и молекулярно-биологические исследования:
Иммунохимические исследования. Присутствие антигенов вируса гепатита G в крови можно определить с помощью чувствительных серологических реакций ИФА, РИА и др.
Молекулярно-биологические исследования. Вирусную НК в исследуемом материале обнаруживают с помощью ПЦРили метода ДНК-зондов.
Серодиагностика.Является ведущим методом диагностики вирусного гепатита G и контроля крови доноров. Антитела к антигенам вируса гепатита G в крови пациентов определяют с помощью чувствительных серологических реакций (ИФА, РИА и др.).
Читайте также:


