Медиаторы синапсов периферической нервной системе
В периферической нервной системе функционируют адрснергические (медиатор - норадреналин), холинергические (медиатор - ацетилхолин), пуринергические (медиаторы - аденозин и АТФ), дофаминергические и серотонинергические нейроны. Наибольшее количество синаптотропных средств влияет на адренергические и холинергичесю синапсы.
Различают 2 типа центробежных (эфферентных) нервов:
1. Двигательные (соматические) нервы состоят из холинергичеких аксонов, следующих непрерывно от мотонейронов передних рогов спинного мозга (спинномозговые нервы) или ствола головного мозг (черепномозговые нервы) до скелетных мышц.
2. Вегетативные нервы иннервируют внутренние органы, разделяются на симпатические и парасимпатические:
• Симпатические нервы состоят из коротких преганглионарных и длинных постганглионарных волокон, образующих синаптический контакт в вегетативных ганглиях. Центры преганглионарных волока находятся в боковых рогах грудного отдела спинного мозга (ceгменты С8, Th-L3). Ганглии образуют цепочку около позвоночник: Симпатические преганглионарные волокна - холинергические, постганглионарные волокна - адренергические.
• Парасимпатические нервы состоят из длинных преганглионарных коротких постганглионарных волокон. Ганглии локализованы около исполнительных органов или внутриорганно. Парасимпатические волокна находятся в составе черепномозговых нервов (глазо, вигательный, лицевой, языкоглоточный, блуждающий) и спинномозговых тазовых нервов (центры - в боковых рогах крестцового отдела спинного мозга). Парасимпатические преганглионарные и постганглионарные волокна - холинергические. Эфферентные нервы мозгового слоя надпочечников не прерываются в ганглиях и представляют собой преганглионарные холинергические волокна. Хромаффинную ткань надпочечников рассматривают как аналог симпатических ганглиев, у которых редуцировались аксоны, а медиатор стал гормоном (70-90% составляет адреналин, И 30% - норадреналин).
В каротидных клубочках ацетилхолин выделяется клетками клубе ков, а холинорецепторы расположены на окончаниях афферентш нервов, идущих к дыхательному центру.
Таким образом, холинергические волокна - двигательные, симпатические преганглионарные, парасимпатические преганглионарные, постганглионарные, адренергические волокна - симпатические постганглионарные.
АДРЕНЕРГИЧЕКИЕ СИНАПСЫ
Адренергические нейроны расположены в ЦНС (голубое пятно среднего мозга, мост, продолговатый мозг) и в симпатических ганглиях.
Периферические адренергические синапсы образованы варикозными утолщениями разветвлений постганглионарных симпатических волокон.
Медиатор адренергических синапсов - норадреналин. Его предшественник в биосинтезе дофамин выполняет медиаторную функцию в дофаминергических синапсах. Адреналин представляет собой гормон мозгового слоя надпочечников. Все три вещества относятся к группе катехоламинов, так как содержат гидроксилы в 3-м и 4-м положениях ароматического кольца.
Синаптические пузырьки в адренергических синапсах имеют под электронным микроскопом гранулярное строение и поэтому получили звание гранулы.
В гранулах норадреналин депонирован в связи с АТФ и белком хромогранином. В составе гранул обнаружены также ферменты и модулирующие нейропептиды (энкефалины. нейропептид У). Норадреналин синтезируется из аминокислоты тирозина. Превращение фенилаланина в тирозин является неспецифическим процессом и происходит в печени. Обе аминокислоты в большом количестве держатся в твороге, сыре, шоколаде, бобовых. Тирозин с помощью активного транспорта поступает в адренергические окончания. В их цитоплазме включает второй гидроксил в 3-м положении ароматического кольца, превращаясь в диоксифенилаланин (ДОФА). Эту реакцию катализирует тирозингидроксилаза. Затем декарбоксилаза ароматических L-аминокислот декарбоксилирует ДОФА в дофамин, транспортируемый в гранулы. На последнем этапе дофамин приобретает третий гидроксил в Р-положении боковой цепи при участии дофамин-Р-гидроксилазы.
В мозговом слое надпочечников норадреналин подвергается тилированию в гормон адреналин под влиянием N-метилтрансферазы (донатор метильных групп - S-аденозилметионин). Образование адреналина стимулируют глюкокортикоиды, эстрогены и тирокс Глюкокортикоиды, поступая в мозговой слой по воротной системе надпочечников, активируют тирозингидроксилазу, дофамин-b-гидроксилазу и N-метилтрансферазу. У некоторых видов акул корковый мозговой слои надпочечников представляют собой изолированн железы, поэтому у них адреналин не синтезируется, а единственнным гормоном хромаффинных клеток является норадреналин.
После диссоциации комплексов норадреналин-адренорецептор медиатор инактивируется при участии ряда механизмов:
• Нейрональный захват (захват-1) - активный транспорт вначале рез пресинаптическую мембрану (сопряжен с выходом ионов натрия), а затем через мембрану гранул под влиянием АТФ-зав1 мой протонной транслоказы (при входе в гранулы одной молекулы норадреналина в цитоплазму выходят 2 протона):
• Экстранейрональный захват (захват-2) нейроглией, фибробластами, миокардом, эндотелием и гладкими мышцами сосудов;
• Инактивация ферментами.
70-80% норадреналина участвует в нейрональном захвате, по 104 подвергается экстранейрональному захвату и ферментативному расщеплению. Необходимость нейронального захвата диктуется дефицитом субстратов и большой потребностью в энергии для синтеза норадреналина из тирозина. Для сохранения адреналина основное значение имеет Экстранейрональный захват.
Ферменты инактивации катехоламинов - моноаминоксидаза (МАО) и катехол-О-метилтрансфераза(КОМТ). МАО, локализованная на внешней мембране митохондрий и в гранулах, осуществляет окислительное дезаминирование катехоламинов с образованием биогенных альдегидов. Затем альдегиды окисляются НАД-зависимой альдегиддегирогеназой в кислоты или восстанавливаются альдегидредуктазой в гликоли.
Цитоплазматический фермент КОМТ катализирует присоединение метильной группы к гидроксилу в 3-м положении ароматического кольца (только при наличии гидроксила в 4-м положении). Донатором метильных групп служит S-аденозилметионин. Метилированные продукты в 200-2000 раз (по разным тестам) менее активны, чем норадреналин и адреналин.
Адренорецепторы
В 1948 г. английский фармаколог Р. Алквист высказал гипотезу о нескольких типах адренорецепторов. a-Адренорецепторы вызывают сужение сосудов, наиболее чувствительны к адреналину, намного меньше реагируют на норадреналин и очень слабо воспринимают действие изадрина (изопропилнорадреналин). b-Адренорецепторы расширяют сосуды, обладают максимальной чувствительностью к изадрину, в 10-50 раз слабее возбуждаются адреналином и мало реагируют на норадреналин.
Адренорецепторы локализованы на постсинаптической, пресинаптической мембранах и в органах, не получающих адренергическую иннервацию. Постсинаптические адренорецепторы имеют индексы 1 или 2, пресинаптические и внесинаптические адренорецепторы обозначаются индексом 2. Внесинаптические адренорецепторы возбуждаются циркулирующими в крови норадреналином и адреналином.
Сведения о механизмах функционирования, чувствительности к агонистам и антагонистам, физиологической роли адренорецепторов представлены в таблицах 9.1-9.3. Все адренорецепторы ассоциированы с G-белками.
Постсинаптические a1-адренорецепторы (А, В, D) регулируют функцию мембранных фосфолипаз и проницаемость кальциевых каналов L-типа. В гладких мышцах ионы кальция активируют кальмодулин-зави-симую киназу легких цепей миозина, что необходимо для образования актомиозина и сокращения. Только в желудке и кишечнике a1-адренорецепторы, открывая кальций-зависимые калиевые каналы, вызывают гиперполяризацию сарколеммы и расслабление гладких мышц. Эффекты возбуждения a1-адренорецепторов:
• Сокращение радиальной мышцы радужки с расширением зрачков (мидриаз; греч. amydros - темный, неясный);
• Сужение сосудов кожи. слизистых оболочек, органов пищеварения, почек и головного мозга;
• Сокращение капсулы селезенки с выбросом депонированной крови;
• Сокращение сфинктеров пищеварительного тракта и мочевого пузыря;
• Уменьшение моторики и тонуса желудка и кишечника.
Несмотря на общность основных черт организации, химические синапсы различаются по используемым медиаторам, характеру действия и месторасположению. По этой причине существует множество способов классификации химических синапсов.
По типу медиатора синапсы подразделяются на холинергические (медиатор — АХ), глутаматергические (медиатор — глутамат), адренергические (медиатор — норадреналин), дофаминергические (медиатор — дофамин) и т.д.
По вызываемому эффекту синапсы делятся на возбуждающие и тормозные.
По расположению в нервной системе синапсы подразделяют на центральные (расположенные в ЦНС) и периферические (расположенные в периферической нервной системе).
Периферические синапсы представляют собой контакты аксонов с мышцами всех типов, а также с клетками желез. Периферические синапсы крупнее центральных и достигают размеров 50—100 мкм (рис. 3.26). Так, на каждом зрелом скелетном мышечном волокне имеется только один нервно-мышечный синапс, образованный нервной терминалыо аксона моторного нейрона.

Рис. 3.26. Концевая пластинка
Синаптическая передача в концевой пластинке происходит с участием медиатора АХ и приводит к генерации высокоамплитудного ПКП (30—40 мВ). Такой ПКП в 2—3 раза превышает порог для генерации ПД. Поэтому каждый одиночный пресинаптический ПД, вызывая генерацию высокоамплитудного ПКП, в 100% случаев приводит к генерации мышечного ПД и последующему сокращению мышечного волокна.
Синапсы с внутренними органами (клетками гладких мышц, кардиомиоцитами или клетками желез) образуют аксоны постганглионарных симпатических и парасимпатических нейронов. Как правило, в таких аксонах группирование везикул и выделение медиатора происходят не из конечного одиночного бутона, как в нервно-мышечных синапсах, а по ходу аксона из его многочисленных варикоз. Таких расширений насчитывается до 250—300 на 1 мм длины аксона. Расстояние между иресинаптиче- ской и постсинаптической мембраной в таких синапсах большое — от 80 до 250 нм, а выделившийся медиатор адресует свое действие метаботропным иостсинаитическим рецепторам.
11а рис. 3.27 приведен пример синапса, образуемого иостганглионар- ными парасимпатическими волокнами в гладкомышечной ткани желудка. Видно, что по ходу постганглионарного парасимпатического аксона имеются многочисленные варикозы, содержащие синаптические везикулы с медиатором АХ. Здесь же в составе пресинаптической мембраны расположены Са 2+ -каналы. Соответственно, под влиянием распространяющихся по аксонам ПД и вызванного деполяризацией поступления ионов кальция внутрь варикоз в них происходит экзоцитоз везикул, т.е. высвобождение квантов медиатора.

Рис. 3.27. Синапсы, характерные для постганглионарных аксонов вегетативной нервной системы
При взаимодействии АХ с метаботропными мХР постсинаптической мембраны после длительной синаптической задержки (1,5—2 мс по сравнению с 0,3—0,5 мс в быстрых синапсах) возникает ВПСП продолжительностью 20—50 мс. Для возникновения ПД в гладкомышечной клетке необходимо достижение пороговой амплитуды ВПСП 8—25 мВ. Как правило, одиночный пресинаптический сигнал (одиночный ПД) оказывается недостаточным, чтобы вызвать вход ионов кальция в варикозу и запуск экзо- цитоза везикул. Поэтому выброс медиатора из варикоз постганглионарных аксонов осуществляется лишь под действием некоторого количества (залпа) следующих друг за другом пресинаптических ПД. Срабатывание передачи в таких контактах вызывает изменение тонуса мышечных волокон в стенках внутренних органов либо вызывает секрецию в железистых клетках.
Центральные синапсы имеют очень большое структурное разнообразие. Наиболее многочисленны аксодендритные и аксосоматические синапсы - контакты между нервной терминалыо аксона одной клетки и дендритом либо телом другой клетки (рис. 3.28).

Рис. 3.28. Разнообразие центральных синапсов
Встречаются, однако, и все остальные варианты: дендро-дендритные, соматодендритные, аксо-аксональные и прочие типы синапсов. Ультра- структура нервных терминалей в ЦЫС демонстрирует характерные черты химического синапса: наличие синаптических везикул, активных зон в пре- синаптических бутонах и постсинаптических рецепторов на мембране клетки-мишени. Отличием являются небольшие размеры центральных синапсов. Поэтому в ЦНС у химических синапсов в пресинаптических бутонах число активных зон не превышает 10, а у большинства сведено до 1—2. Это связано с малыми размерами пресинаптических бутонов (1—2 мкм).
Наряду с простыми синапсами, состоящими из одного пре- и одного постсинаптического окончаний, в центральной нервной системе существуют и сложные синапсы. Их подразделяют на несколько групп. В одной группе сложных синапсов пресинаптическое окончание аксона образует несколько ответвлений — мембранных выростов, заканчивающихся маленькими бутонами. С их помощью аксон контактирует с дендритами сразу нескольких нейронов. В другой группе сложных синапсов на небольшом грибовидном выросте дендрита (дендритном шипике) сходятся преси- наптичсские окончания разных аксонов. Эти окончания тесно охватывают постсинаптическую зону — головку шипика. Еще более сложную структуру имеют синаптические гломерулы — компактные скопления отростков разных нейронов, формирующие большое количество взаимных синапсов. Обычно такие гломерулы окружены оболочкой из глиальных клеток (см. рис. 3.28).
Синапс можно рассматривать как функциональную единицу нервной ткани, обеспечивающую передачу информации в нервной системе. Однако взаимодействие расположенных рядом работающих синапсов является не менее важным условием для обработки информации в ЦНС. Именно присутствие сложных синапсов (особенно синаптических гломерул) позволяет осуществлять этот процесс особенно эффективно. Отсюда ясно, почему наибольшее количество сложных синапсов находится именно в тех зонах мозга, где происходит наиболее сложная обработка сигналов, — в коре больших полушарий переднего мозга, коре мозжечка, таламусе.
Количество синапсов на мембране одного центрального нейрона колеблется в среднем от 2—5 тыс. до 15 тыс. и более. При этом расположение контактов очень вариабельно. Синапсы присутствуют на теле нейрона, его дендритах и в меньшей степени на аксоне. Наибольшее значение для деятельности нервных клеток имеют контакты с их сомами, основаниями дендритов, а также точками первого разветвления дендритов. Пресинапти- ческую функцию выполняют чаще всего конечные разветвления аксонов (пресинантические бутоны) либо варикозные расширения по ходу аксона. Реже в качестве нресинаптических структур могут выступать тонкие ветвления дендритов.
Как мы уже отмечали, постсинаптические потенциалы в химических синапсах могут быть либо деполяризующими и возбуждающими (ВИСИ), либо гиперполяризующими и тормозными (ТПСП).
МЕДИАТОРЫ нервной системы (лат. mediator посредник; син.: нейротрансмиттеры, синаптические передатчики) — химические передатчики нервного импульса с нервного окончания на клетки периферических органов или на нервные клетки. Чаще всего в роли Медтаторов выступают низкомолекулярные (150—300 дальтон) вещества, выполняющие в организме человека и животных и другие функции. К Медиаторам относят ацетилхолин (см.), различные катехоламины (см.), в частности норадреналин (см.), некоторые аминокислоты (см.), пептиды (см.) и другие биологически активные вещества. Исследования Медиаторов дали важные практические результаты для клиники. Оказалось, что при ряде заболеваний нервной системы, некоторых видах отравлений нарушаются образование М., механизм их действия и распада. Знание особенностей хим. превращений М. в норме и при патологии позволило рекомендовать и ввести новые методы медикаментозного лечения.
Гипотеза о существовании веществ—посредников нервных влияний возникла в начале 20 в. Первоначально она основывалась на опыте фармакологии (имитация симпатических нервных влияний одними экзогенными веществами, а парасимпатических — другими) и относилась только к периферическим нейроэффекторным соединениям. Эллиотт (Th. R. Elliott, 1904) назвал адреналин веществом, к-рое могло бы опосредовать действие симпатических нервов на эффекторные органы. Экспериментально существование ОД. вегетативных нервов доказал в 1921 г. австр. фармаколог О. Леви, установивший, что перфузат сердца после раздражения блуждающего нерва способен оказывать вагоподобное действие. На этом основании М. первоначально называли гуморальными факторами нервного возбуждения. Впоследствии от этого названия отказались, т. к. стало ясно, что попадание М. в кровь — побочное и необязательное следствие процесса синаптической передачи.
Тип медиаторов вегетативных нейроэффекторных соединений не во всех случаях определяется их принадлежностью к тому или иному отделу в. н. с. В связи с этим возникло предположение, что он специфичен для клеточных, а не для анатомических единиц нервной системы. Г. Дейл (1933) предложил называть нервные волокна, выделяющие ацетилхолин, холинергическими, а волокна, выделяющие адреналин (фактически норадреналин),— адренергическими.
Значительный вклад в понимание механизмов действия М. внесли также советские ученые А. Г. Гинецинский, X. С. Коштоянц, М. Я. Михельсон, В. Н. Черниговский, С. В. Аничков и др. Уже в 30-х гг. в СССР развернулась работа по применению М. для лечения нервных болезней.
Участие М. в проведении возбуждения представляется следующим образом. Местом приложения М. является синапс (см.). Пресинаптическим звеном его может быть нейрон (см. Нервная клетка), либо рецепторная клетка (напр., палочки и колбочки сетчатки, волосковые клетки органов слуха и равновесия). Пресинаптической клетке, по-видимому, присуща медиаторная специфичность, т. е. способность синтезировать, запасать, секретировать и реутилизировать строго определенный М. Цитоплазматическими органеллами, в которых запасаются и посредством которых выделяются из клетки М., служат, по везикулярной гипотезе секреции М., особые окруженные мембраной пузырьки. Специализированный для секреции участок пресинаптической клетки (в нейроне — терминальные части аксона, а иногда и дендриты) имеет особую наружную так наз. секреторную мембрану, для к-рой характерно наличие потенциалзависимых кальциевых каналов. Секрецию вызывает входящий ток ионов кальция, возникающий при деполяризации пресинаптической клетки (т. е. при ее возбуждении). Тонкие механизмы действия ионов кальция на синаптические пузырьки еще не изучены; по-видимому, секреция протекает по типу экзоцитоза: мембрана пузырька соединяется с наружной клеточной мембраной так, что образуется отверстие, через к-рое содержимое пузырька выходит в межклеточную среду.
Выйдя в синаптическую щель, М. диффундирует к постсинаптической клетке и взаимодействует с ее специфическими рецепторами, вследствие чего происходит то или иное изменение в состоянии клетки. В основе этого регуляторного эффекта чаще всего лежит изменение ионной проводимости постсинаптической мембраны.
Для каждого М. стараются найти наиболее характерные признаки, позволяющие обнаруживать клеточные системы с данным М. С помощью различных гистохим, методов, в частности формальдегидной конденсации, удалось детально картировать системы моноаминергических нейронов мозга. Однако прямая гистохим. локализация пока возможна лишь для немногих М. Более перспективным и универсальным методом считается иммуногистохим, выявление фермента, участвующего в синтезе данного М. или другого специфического белка, связанного с определенным М. С этой целью используют также способность нейронов реутилизировать собственный М. Для этого в окружающую нейрон среду вводят М. или его метаболический предшественник с какой-либо (напр;, радиоактивной) меткой и изучают последующее распределение метки. О принадлежности к тому или иному известному типу М. помогает судить также изучение морфологии секреторных пузырьков пресинаптической клетки с помощью электронного микроскопа.
Распределение нейронов, обладающих одним и тем же М., и их функции сходны у систематически близких организмов. Это сходство прослеживается в пределах только одного зоол, типа и не наблюдается при сравнении разных типов (напр., позвоночных, членистоногих и моллюсков). Однако организмы, относящиеся к разным зоол, типам, имеют одни и те же медиаторные вещества, т. е. сходный клеточный состав нервных систем. Это указывает на глубокую древность медиаторных различий между нейронами и на консерватизм специфического секреторного химизма нервных клеток.
Значительная часть известных М. относится к группе биогенных аминов (см.), к-рую составляют декарбоксилированные производные ароматических аминокислот (так наз. арилэтиламины). В эту группу входят катехоламиновые М. Древнейшим (с эволюционной точки зрения) из них является, по-видимому, дофамин, представленный в специальной категории нейронов у большинства организмов, обладающих нервной системой. Медиаторная функция дофамина доказана на гигантском интернейроне педального ганглия некоторых водных улиток. У млекопитающих системы дофаминергических нейронов находятся преимущественно в среднем мозге — нигронеостриарная система (см. Лимбическая система). Кроме того, нейроны этого типа имеются в гипоталамической области, в сетчатке. Предполагают, что дофамин выступает в качестве М. интернейронов симпатических ганглиев (нейронный вариант хромаффинных клеток). Функция норадреналина в качестве М. наиболее изучена в нейроэффекторных окончаниях симпатических нервов. Группы нор адренергических нейронов имеются также в среднем мозге, мозговом варолиевом мосту, продолговатом и промежуточном мозге. Адреналин, являющийся метилированным производным норадреналина, служит М. симпатических нейронов у бесхвостых амфибий. В продолговатом мозге млекопитающих найдены небольшие группы нейронов, синтезирующих адреналин, однако вопрос о медиаторной функции адреналина у них изучен еще недостаточно.
Широко распространенный биогенный амин серотонин (см.) является производным триптофана. Медиаторная функция серотонина была впервые показана на моллюсках. Серотонинергические нейроны некоторых ядер ствола головного мозга иннервируют обширные области ц. н. с. млекопитающих, включая новую кору, гиппокамп, подбугровую область, спинной мозг. Содержащие серотонин нейроны найдены также в кишечном нервном сплетении у некоторых позвоночных животных.
Ацетилхолин — единственный известный Медиатор, относящийся к простым эфирам (уксуснокислый эфир холина). Медиаторная функция ацетилхолина детально исследована на некоторых нейроэффекторных соединениях и межнейронных синапсах периферической нервной системы у позвоночных животных. Их периферические секреторные терминали происходят из следующих групп холинергических нейронов: клеток моторных ядер, иннервирующих скелетные мышцы; спинномозговых нейронов, иннервирующих хромаффинную ткань; преганглионарных нейронов, иннервирующих клетки интрамуральных и экстрамуральных ганглиев; значительной части периферических нейронов, в особенности интрамуральных ганглиев. Холинергические нейроны найдены у многих беспозвоночных, часть из них хорошо изучена (моторные нейроны стоматогастрической системы и некоторые афферентные нейроны ракообразных, интернейроны центральных ганглиев моллюсков, мотонейроны соматических мышц круглых и кольчатых червей и др.). Значительно хуже в связи с методическими трудностями идентификации холинергических нейронов исследованы интернейроны головного и спинного мозга. Данные, на основании которых идентификация холинергических нейронов базировалась на гистохим, выявлении ацетилхолинэстеразы, следует считать в основном ошибочными.
Вещество считают нейромедиатором при соответствии следующим критериям:
• В нейронах должны присутствовать белки, в том числе ферменты, для синтеза данного вещества.
• Вещество должно выделяться из нейрона после деполяризации нервного окончания и под влиянием входа ионов Са 2+ в клетку.
• На постсинаптической мембране должны присутствовать специфические рецепторы, способные изменять мембранный потенциал нейрона-мишени.
• Вещество должно оказывать аналогичный эффект при нанесении на нейрон-мишень путем микроионофореза.
• Для предполагаемого нейромедиатора должен существовать антагонист, блокирующий его действие при поступлении из кровотока или путем ионофореза.
• Должен быть установлен физиологический механизм прекращения действия вещества: ферментативное расщепление либо активный транспорт в нейрон-источник данного вещества или прилежащие клетки нейроглии.
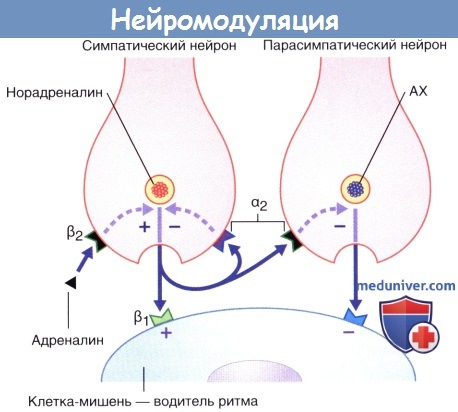
Процесс нейромодуляции осуществляется в нервных окончаниях синоатриального узла сердца, где симпатические и парасимпатические нервные окончания часто расположены парами.
На данном изображении показано, что симпатическая нервная система находится в активном состоянии, происходит высвобождение медиатора норадреналина, деполяризующего клетки-водители ритма через β1-рецепторы на их мембранах.
Эпинефрин, свободно циркулирующий в кровеносном русле, оказывает положительное модулирующее действие на симпатическое нервное окончание, увеличивая высвобождение медиатора за счет влияния на β1-пресинаптические мембранные гетерорецепторы.
Ингибирующая модуляция избыточного высвобождения норадреналина происходит за счет α2-пресинаптических мембранных ауторецепторов. В это же время высвобождение тормозного медиатора ацетилхолина (АХ) из парасимпатического нейрона ингибируется через α2-гетерорецепторы.
Ингибирование высвобождения некоторых медиаторов контролируется за счет механизма отрицательной обратной связи путем активации ауторецепторов на пресинаптической мембране. В идеале существование таких специфических тормозных ауторецепторов должно быть установлено.
В подписи к рисунку также идет речь об ауторецепторах и гетерорецепторах. Рецепторы к определенному медиатору, располагающиеся, как правило, на пресинаптической и постсинаптической мембранах, называют ауторецепторами. Ауторецепторы активируются высокими концентрациями медиатора в синаптической щели, а также ингибируют дальнейшее высвобождение медиатора из булавовидного утолщения синапса по механизму отрицательной обратной связи. Гетерорецепторы располагаются на плазматической мембране нейронов, которые не высвобождают данный медиатор. На примере рисунка показано, что во время активации симпатических нервных окончаний за счет гетерорецепторов, расположенных на парасимпатических нервных окончаниях, происходит их ингибирование.

Дальнейшие преобразования нейромедиаторов. В дальнейшем нейромедиаторы подвергаются разнообразным преобразованиям. Некоторые из них инактивируются в синаптической щели, другие проникают через внеклеточную жидкость в спинномозговую жидкость путем диффузии, а часть нейромедиаторов подвергается обратному захвату глиальными клетками напрямую или опосредованно.
Наиболее значимые медиаторы и модуляторы представлены и соответствующие им рецепторы представлены в таблицах.

Редактор: Искандер Милевски. Дата публикации: 11.11.2018
Синапс
Как передается возбуждение от одного нейрона другому или от нейрона, например, на мышечное волокно? Этой проблемой интересуются не только профессиональные нейробиологи, но и врачи, особенно фармакологи. Знание биологических механизмов необходимо для лечения некоторых заболеваний, а также для создания новых лекарств и препаратов. Дело в том, что одними из основных мест воздействия этих веществ на организм человека являются места передачи возбуждения с одного нейрона на другой (или на другую клетку, например клетку сердечной мышцы, стенки сосудов и пр.). Отросток нейрона аксон направляется к другому нейрону и образует на нем контакт, который называют синапсом (в переводе с греческого - контакт; см. рис. 2.3). Именно синапс хранит многие тайны мозга. Нарушение этого контакта, например, веществами, блокирующими его работу, приводит к тяжелейшим последствиям для человека. Это место приложения действия наркотиков. Примеры будут приведены ниже, а сейчас рассмотрим, как устроен и как работает синапс.
Трудности этого исследования определяются тем, что сам синапс очень маленький (его диаметр не более 1 мкм). Один нейрон получает такие контакты, как правило, от нескольких тысяч (3 - 10 тыс.) других нейронов. Каждый синапс надежно закрыт специальными клетками глии, поэтому исследовать его очень непросто. На рис. 2.12 показана схема синапса, как это представляет себе современная наука. Несмотря на свою миниатюрность, он устроен весьма сложно. Одним из его основных компонентов являются пузырьки, которые находятся внутри синапса. Эти пузырьки содержат биологически очень активное вещество, которое называется нейротрансмиттером, или медиатором (передатчиком).
Вспомним, что нервный импульс (возбуждение) с огромной скоростью продвигается по волокну и подходит к синапсу. Этот потенциал действия вызывает деполяризацию мембраны синапса (рис. 2.13), однако это не приводит к генерации нового возбуждения (потенциала действия), а вызывает открывание специальных ионных каналов, с которыми мы еще не знакомы. Эти каналы пропускают ионы кальция внутрь синапса. Ионы кальция играют очень большую роль в деятельности организма. Специальная железа внутренней секреции - паращитовидная (она находится поверх щитовидной железы) регулирует содержание кальция в организме. Многие заболевания связаны с нарушением обмена кальция в организме. Например, его недостаток приводит к рахиту у маленьких детей.
На мембране одного нейрона могут одновременно находиться два вида синапсов: тормозные и возбудительные. Все определяется устройством ионного канала мембраны. Мембрана возбудительных синапсов пропускает как ионы натрия, так и ионы калия. В этом случае мембрана нейрона деполяризуется. Мембрана тормозных синапсов пропускает только ионы хлора и гиперполяризуется. Очевидно, что если нейрон заторможен, потенциал мембраны увеличивается (гиперполяризация). Таким образом, нейрон благодаря воздействию через соответствующие синапсы может возбудиться или прекратить возбуждение, затормозиться. Все эти события происходят на соме и многочисленных отростках дендрита нейрона, на последних находится до нескольких тысяч тормозных и возбудительных синапсов.
В качестве примера разберем, как действует в синапсе медиатор, который называется ацетилхолином. Этот медиатор широко распространен в головном мозге и в периферических окончаниях нервных волокон. Например, двигательные импульсы, которые по соответствующим нервам приводят к сокращению мышц нашего тела, оперируют ацетилхолином. Ацетилхолин был открыт в 30-х годах австрийским ученым О. Леви. Эксперимент был очень прост: изолировали сердце лягушки с подходящим к нему блуждающим нервом. Было известно, что электрическая стимуляция блуждающего нерва приводит к замедлению сокращений сердца вплоть до полной его остановки. О. Леви простимулировал блуждающий нерв, получил эффект остановки сердца и взял из сердца немного крови. Оказалось, что если эту кровь добавить в желудочек работающего сердца, то оно замедляет свои сокращения. Был сделан вывод: при стимуляции блуждающего нерва выделяется вещество, останавливающее сердце. Это и был ацетилхолин. Позже был открыт фермент, который расщеплял ацетилхолин на холин (жир) и уксусную кислоту, в результате чего прекращалось действие медиатора. Этим исследованием впервые была установлена точная химическая формула медиатора и последовательность событий в типичном химическом синапсе. Эта последовательность событий сводится к следующему.
Потенциал действия, пришедший по пресинаптическому волокну к синапсу, вызывает деполяризацию, которая включает кальциевый насос, и ионы кальция поступают в синапс; ионы кальция связываются белками мембраны синаптических пузырьков, что приводит к активному опорожнению (экзоцитозу) пузырьков в синаптическую щель. Молекулы медиатора связываются (узнающим центром) соответствующими рецепторами постсинаптической мембраны, при этом открывается ионный канал. Через мембрану начинает протекать ионный ток, что приводит к возникновению на ней постсинаптического потенциала. В зависимости от характера открытых ионных каналов возникает возбудительный (открываются каналы для ионов натрия и калия) или тормозной (открываются каналы для ионов хлора) постсинаптический потенциал.
Ацетилхолин весьма широко распространен в живой природе. Например, он находится в стрекательных капсулах крапивы, в стрекательных клетках кишечнополостных животных (например, пресноводной гидры, медузы) и пр. В нашем организме ацетилхолин выбрасывается в окончаниях двигательных нервов, управляющих мышцами, из окончаний блуждающего нерва, который управляет деятельностью сердца и других внутренних органов. Человек давно знаком с антагонистом ацетилхолина - это яд кураре, которым пользовались индейцы Южной Америки при охоте на животных. Оказалось, что кураре, попадая в кровь, вызывает обездвиживание животного, и оно погибает фактически от удушья, но кураре не останавливает сердце. Исследования показали, что в организме существуют два типа рецепторов к ацетилхолину: один успешно связывает никотиновую кислоту, а другой - мускарин (вещество, которое выделено из гриба рода Muscaris). На мышцах нашего тела находятся рецепторы никотинового типа к ацетилхолину, тогда как на сердечной мышце и нейронах головного мозга - рецепторы к ацетилхолину мускаринового типа.
К биогенным аминам относят также адреналин и норадреналин, которые содержатся в синапсах нейронов автономной нервной вегетативной системы. Во время стресса под влиянием специального гормона - адренокортикотропного (подробнее см. ниже) - из клеток коры надпочечников в кровь также выбрасываются адреналин и норадреналин.
В настоящее время при классификации медиаторных веществ принято выделять: первичные медиаторы, сопутствующие медиаторы, медиаторы-модуляторы и аллостерические медиаторы. Первичными медиаторами считают те, которые действуют непосредственно на рецепторы постсинаптической мембраны. Сопутствующие медиаторы и медиаторы-модуляторы могут запускать каскад ферментативных реакций, которые, например, фосфорилируют рецептор для первичного медиатора. Аллостерические медиаторы могут участвовать в кооперативных процессах взаимодействия с рецепторами первичного медиатора.
Одними из самых распространенных являются медиаторы, принадлежащие к группе биогенных аминов. Эта группа медиаторов достаточно надежно идентифицируется микрогистологическими методами. Известны две группы биогенных аминов: катехоламины (дофамин, норадреналин и адреналин) и индоламин (серотонин). Функции биогенных аминов в организме весьма многообразны: медиаторная, гормональная, регуляция эмбриогенеза.
Основным источником норадренергических аксонов являются нейроны голубого пятна и прилежащих участков среднего мозга (рис. 2.14). Аксоны этих нейронов широко распространяются в мозговом стволе, мозжечке, в больших полушариях. В продолговатом мозге крупное скопление норадренергических нейронов находится в вентролатеральном ядре ретикулярной формации. В промежуточном мозге (гипоталамусе) норадренергические нейроны наряду с дофаминергическими нейронами входят в состав гипоталамо-гипофизарной системы. Норадренергические нейроны в большом количестве содержатся в нервной периферической системе. Их тела лежат в симпатической цепочке и в некоторых интрамуральных ганглиях.
Дофаминергические нейроны у млекопитающих находятся преимущественно в среднем мозге (так называемая нигро-неостриарная система), а также в гипоталамической области. Дофаминовые цепи мозга млекопитающих хорошо изучены. Известны три главные цепи, все они состоят из однонейронной цепочки. Тела нейронов находятся в мозговом стволе и отсылают аксоны в другие области головного мозга (рис. 2.15).
Одна цепь очень проста. Тело нейрона находится в области гипоталамуса и отсылает короткий аксон в гипофиз. Этот путь входит в состав гипоталамо-гипофизарной системы и контролирует систему эндокринных желез.
Вторая дофаминовая система также хорошо изучена. Это черная субстанция, многие клетки которой содержат дофамин. Аксоны этих нейронов проецируются в полосатые тела. Эта система содержит примерно 3/4 дофамина головного мозга. Она имеет решающее значение в регулировании тонических движений. Дефицит дофамина в этой системе приводит к болезни Паркинсона. Известно, что при этом заболевании происходит гибель нейронов черной субстанции. Введение L-DOPA (предшественника дофамина) облегчает у больных некоторые симптомы заболевания.
Третья дофаминергическая система участвует в проявлении шизофрении и некоторых других психических заболеваний. Функции этой системы пока изучены недостаточно, хотя сами пути хорошо известны. Тела нейронов лежат в среднем мозге рядом с черной субстанцией. Они проецируют аксоны в вышележащие структуры мозга, мозговую кору и лимбическую систему, особенно к фронтальной коре, к септальной области и энторинальной коре. Энторинальная кора, в свою очередь, является главным источником проекций к гиппокампу.
Согласно дофаминовой гипотезе шизофрении, третья дофаминергическая система при этом заболевании сверхактивна. Эти представления возникли после открытия веществ, снимающих некоторые симптомы заболевания. Например, хлорпромазин и галоперидол имеют разную химическую природу, но они одинаково подавляют активность дофаминергической системы мозга и проявление некоторые симптомов шизофрении. У больных шизофренией, в течение года получавших эти препараты, появляются двигательные нарушения, получившие название tardive dyskinesia (повторяющиеся причудливые движения лицевой мускулатуры, включая мускулатуру рта, которые больной не может контролировать).
Серотонин почти одновременно открыли в качестве сывороточного сосудосуживающего фактора (1948) и энтерамина, секретируемого энтерохромаффиновыми клетками слизистой оболочки кишечника. В 1951 г. было расшифровано химическое строение серотонина и он получил новое название - 5-гидрокситриптамин. В организме млекопитающих он образуется гидроксилированием аминокислоты триптофана с последующим декарбоксилированием. 90% серотонина образуется в организме энтерохромаффиновыми клетками слизистой оболочки всего пищеварительного тракта. Внутриклеточный серотонин инактивируется моноаминоксидазой, содержащейся в митохондриях. Серотонин внеклеточного пространства окисляется перулоплазмином. Большая часть вырабатываемого серотонина связывается с кровяными пластинками и по кровяному руслу разносится по организму. Другая часть действует в качестве местного гормона, способствуя авторегулированию кишечной перистальтики, а также модулируя эпителиальную секрецию и всасывание в кишечном тракте.
Серотонинергические нейроны широко распространены в центральной нервной системе (рис. 2.16). Они обнаруживаются в составе дорсального и медиального ядер шва продолговатого мозга, а также в среднем мозге и варолиевом мосту. Серотонинергические нейроны иннервируют обширные области мозга, включающие кору больших полушарий, гиппокамп, бледный шар, миндалину, область гипоталамуса. Интерес к серотонину был привлечен в связи с проблемой сна. При разрушении ядер шва животные страдали бессонницей. Сходный эффект оказывали вещества, истощающие хранилище серотонина в мозге.
Самая высокая концентрация серотонина обнаружена в эпифизе (pineal gland). Серотонин в эпифизе превращается в мелатонин, который участвует в пигментации кожи, а также влияет у многих животных на активность женских гонад. Содержание как серотонина, так и мелатонина в эпифизе контролируется циклом свет - темнота через нервную симпатическую систему.
Другую группу медиаторов ЦНС составляют аминокислоты. Уже давно известно, что нервная ткань с ее высоким уровнем метаболизма содержит значительные концентрации целого набора аминокислот (перечислены в порядке убывания): глутаминовой кислоты, глутамина, аспарагиновой кислоты, гамма-аминомасляной кислоты (ГАМК).
Глутамат в нервной ткани образуется преимущественно из глюкозы. У млекопитающих больше всего глутамата содержится в конечном мозге и мозжечке, где его концентрация примерно в 2 раза выше, чем в стволе мозга и спинном мозге. В спинном мозге глутамат распределен неравномерно: в задних рогах он находится в большей концентрации, чем в передних. Глутамат является одним из самых распространенных медиаторов в ЦНС.
Постсинаптические рецепторы к глутамату классифицируются в соответствии с аффинностью (сродством) к трем экзогенным агонистам - квисгулату, каинату и N-метил-D-аспартату (NMDA). Ионные каналы, активируемые квисгулатом и каинатом, подобны каналам, которые управляются никотиновыми рецепторами - они пропускают смесь катионов (Na + и. К + ). Стимуляция NMDA-рецепторов имеет сложный характер активации: ионный ток, который переносится не только Na + и К + , но также Са ++ при открывании ионного канала рецептора, зависит от потенциала мембраны. Вольтзависимая природа этого канала определяется разной степенью его блокирования ионами Mg ++ с учетом уровня мембранного потенциала. При потенциале покоя порядка - 75 мВ ионы Mg ++ , которые преимущественно находятся в межклеточной среде, конкурируют с ионами Са ++ и Na + за соответствующие каналы мембраны (рис. 2.17). Вследствие того, что ион Mg ++ не может пройти через пору, канал блокируется всякий раз, как попадает туда ион Mg ++ . Это приводит к уменьшению времени открытого канала и проводимости мембраны. Если мембрану нейрона деполяризовать, то количество ионов Mg ++ , которые закрывают ионный канал, снижается и через канал беспрепятственно могут проходить ионы Са ++ , Na + и. К + . При редких стимуляциях (потенциал покоя изменяется мало) глутаматергического рецептораВПСП возникает преимущественно за счет активации квисгулатных и каинатных рецепторов; вклад NMDA-рецепторов незначителен. При длительной деполяризации мембраны (ритмическая стимуляция) магниевый блок удаляется, и NMDA-каналы начинают проводить ионы Са ++ , Na + и. К + . Ионы Са ++ через вторичные посредники могут потенцировать (усиливать) минПСП, что может привести, например, к длительному увеличению синаптической проводимости, сохраняющейся часами и даже сутками.
Из тормозных медиаторов ГАМК является самой распространенной в ЦНС. Она синтезируется из L-глутаминовой кислоты в одну стадию ферментом декарбоксилазой, наличие которой является лимитирующим фактором этого медиатора. Известно два типа ГАМК-рецепторов на постсинаптической мембране: ГАМКА (открывает каналы для ионов хлора) и ГАМКБ (открывает в зависимости от типа клетки каналы для. К + или Са ++ ). На рис. 2.18 показана схема ГАМК-рецептора. Интересно, что в его состав входит бензодиазипиновый рецептор, наличием которого объясняют действие так называемых малых (дневных) транквилизаторов (седуксена, тазепама и др.). Прекращение действия медиатора в ГАМК-синапсах происходит по принципу обратного всасывания (молекулы медиатора специальным механизмом поглощаются из синаптической щели в цитоплазму нейрона). Из антагонистов ГАМК хорошо известен бикукулин. Он хорошо проходит через гематоэнцефалический барьер, оказывает сильное воздействие на организм даже в малых дозах, вызывая конвульсии и смерть. ГАМК обнаруживается в ряде нейронов мозжечка (в клетках Пуркинье, клетках Гольджи, корзинчатых клетках), гиппокампа (в корзинчатых клетках), в обонятельной луковице и черной субстанции.
Идентификация ГАМК-цепей мозга трудна, так как ГАМК - обычный участник метаболизма в ряде тканей организма. Метаболическая ГАМК не используется как медиатор, хотя в химическом отношении их молекулы одинаковы. ГАМК определяется по ферменту декарбоксилазы. Метод основан на получении у животных антител к декарбоксилазе (антитела экстрагируют, метят и вводят в мозг, где они связываются с декарбоксилазой).
Другим известным тормозным медиатором является глицин. Глицинергические нейроны находятся главным образом в спинном и продолговатом мозге. Считают, что эти клетки выполняют роль тормозных интернейронов.
Ацетилхолин - один из первых изученных медиаторов. Он чрезвычайно широко распространен в нервной периферической системе. Примером могут служить мотонейроны спинного мозга и нейроны ядер черепных нервов. Как правило, холинергические цепи в мозге определяют по присутствию фермента холинэстеразы. В головном мозге тела холинергических нейронов находятся в ядре перегородки, ядре диагонального пучка (Брока) и базальных ядрах. Нейроанатомы считают, что эти группы нейронов формируют фактически одну популяцию холинергических нейронов: ядро педнего мозга, nucleus basalis (оно расположено в базальной части переднего мозга) (рис. 2.19). Аксоны соответствующих нейронов проецируются к структурам переднего мозга, особенно в новую кору и гиппокамп. Здесь встречаются оба типа ацетилхолиновых рецепторов (мускариновые и никотиновые), хотя считается, что мускариновые рецепторы доминируют в более рострально распоженных мозговых структурах. По данным последних лет складывается впечатление, что ацетилхолиновая система играет большую роль в процессах, связанных с высшими интегративными функциями, которые требуют участия памяти. Например, показано, что в мозге больных, умерших от болезни Альцгеймера, наблюдается массивная утрата холинергических нейронов в nucleus basalis.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:


