Нейровизуализация при болезни альцгеймера

Несмотря на то, что научное общество до сих пор не может прийти к единому мнению относительно гипотезы возникновения болезни Альцгеймера, морфологические изменения, возникающие при данной патологии, изучены достаточно тщательно. Знание механизмов развития заболевания и отдельных его проявлений необходимо для своевременной диагностики сенильной деменции альцгеймеровского типа. Понимание патогенеза играет важную роль и в создании новых направлений терапии.

Молекулярный уровень
Что происходит с мозгом при болезни Альцгеймера на молекулярном уровне?
Все начинается с нарушения метаболизма. В нормальных условиях предшественник бета-амилоида расщепляется ферментом на одинаковые по размеру непатогенные пептиды. При дефекте ферментной системы или самого белка в результате указанной реакции получаются разные по длине фрагменты.
Нерастворимые длинные молекулы начинают откладываться в стенках сосудов и веществе головного мозга, затем объединяются между собой в бета-амилоидную структуру. Получившийся белок обладает токсичным воздействием на нейроны. Он способствует развитию оксидативного стресса, активирует медиаторы воспаления — вещества, поддерживающие воспалительную реакцию. Все эти процессы приводят к повреждению и смерти нервных клеток.
В свою очередь, из-за гибели нейронов базального ядра снижается концентрация ацетилтрансферазы, фермента, катализирующего образование ацетилхолина, одного из главных возбуждающих нейромедиаторов. Ацетилхолин отвечает за передачу нервного импульса: снижение его количества негативно отражается на когнитивных функциях и ведет к нарушению регуляции процессов памяти.

Клеточный уровень
Какие изменения характеризуют головной мозг при болезни Альцгеймера на клеточном уровне? Самыми главными являются появление сенильных бляшек и нейрофибриллярных сплетений, а также массовая гибель клеток вещества головного мозга.
- центральное ядро — очаговое скопление бета-амилоида;
- клеточное окружение из микроглии, в этой же зоне изредка встречаются астроциты;
- аксоны и дендриты, находящиеся в стадии дегенерации;
- отростки нейронов, которые уже наполнены плотными тельцами.
Мозг больного Альцгеймером содержит сенильные бляшки в гиппокампе, миндалевидном теле, во всех отделах коры головного мозга, кроме чувствительных и двигательных зон.
Это внутриклеточные включения, основной составляющей которых считается гиперфосфорилированнный белок под названием тау-протеин. Они выглядят как узелки, либо клубочки, и представлены спиралевидными скрученными попарно филаментами.
Тау-протеин предназначен для стабилизации микротрубочек, органелл, отвечающих за создание цитоскелета и транспортировку веществ внутри клетки. Гиперфосфорилирование белка тау приводит к нарушению его связей с микротрубочками, что в итоге вызывает гибель нейрона.
Пораженные клетки уменьшаются в объеме, их цитоплазма вакуолизируется. В ней часто обнаруживают агрофильные гранулы.

| Свойства/Патоморфологический элемент | Сенильные бляшки | Нейрофибриллярные сплетения |
|---|---|---|
| внешний вид | скопления разных размеров овальной формы | узелки или клубочки из филаментов |
| локализация по отношению к клетке | внеклеточное пространство | внутри клетки, на внутренней стороне мембраны нейрона |
| локализация в головном мозге | гиппокамп, амигдала, кора | гиппокамп, амигдала, кора, базальное ядро Мейнерта |
Нейрофибриллярные сплетения локализуются там же, где сенильные бляшки, а также в базальном крупноклеточном ядре переднего мозга. К патоморфологическим элементам, схожим с ними по происхождению, относятся скопления актиновыхфиламентов или тельца Хирано, которые располагаются в нейронах гиппокампа и проксимальных дендритах.

Выраженность когнитивных нарушений при данной патологии не коррелирует с концентрацией двух предыдущих элементов (бляшек и нейрофибриллярных сплетений), зато напрямую зависит от того, насколько поврежден мозг при болезни Альцгеймера, и количества связей между нервными клетками. Чем меньше синапсов, тем тяжелее выражены нарушения.
Головной мозг при Альцгеймере страдает неоднородно. Массовую гибель нейронов отмечают на следующих участках:
- гиппокампе, отвечающем за консолидацию памяти;
- медиобазальных участках лобных долей;
- глубинных отделах височных долей;
- кореатрофичных долей головного мозга.
Нейробиологи из Университета штата Аризона во время испытаний обнаружили, что изменения в мозге при болезни Альцгеймера на клеточном уровне включают в себя также некроптоз. При изучении посмертных образцов в тканях мозга были обнаружены белки, являющиеся маркерами этого программируемого процесса. Поэтому некроптоз можно отнести к одному из механизмов развития нейродегенерации.
Тканевой уровень
Гистологические исследования показывают, что вышеуказанные процессы приводят к постепенной атрофии ткани головного мозга, значительному уменьшению числа нейронов гиппокампа (особенно на уровне крючка), коры, подкорковых структур.
Отмечаются дегенеративные изменения дендритов, белого вещества, накопление бета-амилоида и нейрофибриллярных сплетений. Вместе с гибелью нейронов нарушаются синаптические связи. Сильнее всего эти изменения заметны в височной коре, базальных ядрах, гиппокампе, поясной извилине и в медиобазальных участках коры больших полушарий мозга.
Важно! У многих людей в пожилом возрасте в веществе мозга обнаруживаются сенильные бляшки и клубки из филаментов. Однако при Альцгеймере они распределяются неравномерно, преимущественно в определенных областях (например, в височных долях).
Скопления бета-амилоида выявляются не только во внеклеточном пространстве, но и в церебральных сосудах, а также в сосудистых сплетениях. Возможна дистрофия (иногда избыточная пролиферация) глии.

Органный уровень
Мозг человека с болезнью Альцгеймера характеризуется следующими признаками:
- диффузной атрофией вещества, преимущественно височных, теменных и затылочных долей;
- сужением извилин;
- углублением борозд;
- асимметрией гиппокампов;
- расширением желудочков;
- расширением субарахноидальных пространств;
- уменьшением общей массы и объема;
Из-за атрофии коры и уменьшения общего объема мозга развивается компенсаторная гидроцефалия — ликвор постепенно заполняет образующиеся в белом веществе полости. Истончается дно III желудочка. Результатом этого является поражение области гипоталамуса и нарушение метаболизма вплоть до серьезных эндокринных сдвигов (яркий пример — прогрессирующая кахексия).
Нейровизуализация мозга при Альцгеймере
Немалый вклад в изучение патогенеза и проявлений данного заболевания внесли методы нейровизуализации: КТ, МРТ, ПЭТ, ОФЭКТ и т.д. Большое значение в диагностике Альцгеймера придается методу магнитно-резонансной томографии. Изменения на МРТ при болезни Альцгеймера позволяют учитывать возрастную инволюцию и упрощают дифференциальный диагноз с другими, схожими по клиническим проявлениям патологиями.
Магнитно-резонансную томографию проводят минимум два раза. Интервал между исследованиями должен составлять не меньше месяца — для оценки наличия и динамики дегенеративного процесса. При анализе учитывают возрастные изменения, церебральную атрофию и компенсаторную гидроцефалию.
Уже для ранних стадий заболевания характерно уменьшение объема медиальных участков височных долей. Наиболее точно дифференцировать возрастную норму от Альцгеймера удается благодаря измерению гиппокампа и энториальной коры: степень дегенерации гиппокампа у больных сенильной деменцией больше примерно в два раза. То же самое можно сказать о размерах височного рога.
Мозг больного Альцгеймером на МРТ на более поздних стадиях имеет следующие признаки:
- наличие включений (крупных очагов-бляшек и нейрофибриллярных сплетений);
- уменьшение массы и объема церебрального вещества;
- расширение желудочков;
- нарушение метаболизма в мозговом веществе.
У пациентов с БА на МРТ чаще выявляется поражение белого вещества в форме лейкоареоза. Особое значение имеют перивентрикулярные гиперинтенсивные очаги, в то время как глубокие поражения не имеют особой корреляции с сенильной деменцией.
В 60% случаев обнаруживаются изменения в подкорковых структурах в виде лакунарных кист, не прозвучавших клинически корковых инсультов, изолированных очагов.

Помимо обычного МРТ, в диагностику иногда включают перфузионную МРТ, диффузионно-взвешенную и спектроскопию.
Перфузионная МРТ — методика получения изображения после внутривенного введения специального вещества. Благодаря ей можно измерить гемодинамические параметры мозга. Ряд исследований выявил снижение объема гемоперфузии у пациентов с Альцгеймером почти на 20% по сравнению с нормой.
Спектроскопия — позволяет получить информацию о химическом составе тканей.
Важно! Большинство назначаемых методик исследования, даже МРТ, не всегда позволяет однозначно вынести вердикт о наличии болезни Альцгеймера на ступени ранней деменции. Поэтому при изучении изменений в церебральном веществе следует принимать во внимание все виды диагностики, не отдавая приоритет какому-либо из них.
Болезнь Альцгеймера на МРТ головного мозга с участием спектроскопии демонстрирует подъем уровня холина, что отражает разрушение миелиновых оболочек нервных волокон, подъем уровня мио-инозитола, что показывает аномалию цитоскелета. У пациентов с БА регулярно выявляются оба признака. Уровень других метаболитов, таких как креатин, N-ацетиласпартат, коррелируют с тяжестью деменции при Альцгеймере.
Если МРТ покажет болезнь Альцгеймера точно, то с компьютерной томографией все сложнее. Чувствительность компьютерного томографа по сравнению с ЯМР намного ниже, на КТ видны лишь значительные поражения вещества мозга.
| Изменения/метод исследования | КТ | МРТ |
|---|---|---|
| атрофия вещества мозга | при выраженных изменениях | на ранних стадиях |
| расширение желудочков | да | да |
| гидроцефалия | да | да |
| бляшки в сосудах | с контрастированием | да |
| очаги лейкоареоза | да | да |
| изменения размеров гиппокампа | при выраженных изменениях | да |
| изучение оболочек мозга | нет | да |
| изучение мягкого вещества | средняя точность | высокая точность |
| исследование структуры нервных волокон | нет | да |
На срезах КТ хорошо заметна атрофия коркового вещества, расширение субарахноидальных пространств и желудочков мозга, а также компенсаторная гидроцефалия, характерные для Альцгеймера. Видны будут и небольшие зоны лейкоареоза, а КТ с внутривенным введением контраста помогает обнаружить и амилоидные отложения в церебральных сосудах и сосудистых сплетениях.
Хотя все эти признаки и повторяют МР-симптоматику для сенильной деменции альцгеймеровского типа, но они становятся заметны только на поздних стадиях и нужны лишь для подтверждения уже поставленного диагноза. Если болезнь Альцгеймера МРТ покажет в стадии ранней деменции, то разрешающая способность компьютерного томографа попросту не позволит этого сделать.

Видео

Методы нейровизуализации играют все более заметную роль в современной медицине (и производят наиболее сильное впечатление на пациентов). Они дают ценную информацию о структурных изменениях в мозге, позволяя выявлять различные нарушения органического характера (опухоли, амилоидные отложения, изменения сосудистого происхождения).
При болезни Альцге й мера методы не й ровизуализации (МРТ) обнаруживают выраженную атрофию в глубинных отделах височных доле й (в гиппокампе) и в коре теменных долей головного мозга.
При деменции сосудистого происхождения не й ровизуализация позволяют выявлять кисты или очаговые изменения серого и белого вещества, свидетельствующие об инфарктах мозга.
Деменция с тельцами Леви проявляется на МР–томограмме расширением задних рогов боковых желудочков, а лобно–височная деменция – атрофие й лобных и передних отделов височных доле й .
К основным и наиболее распространенным методам не й ровизуализации относятся компьютерная рентгеновская томография (КТ) и магнитно–резонансная томография (МРТ). Значимость этих методов подчеркивается уже тем, что Но — белевская премия была присуждена как изобретателям компьютерно й томографии (1979), так и разработчикам метода магнитно–резонансно й томографии (2003).
Компьютерная рентгеновская томография использует рентгеновское излучение в комбинации с измерением и сложно й компьютерно й обработко й разности ослабления этого излучения отличающимися по плотности тканями. В результате на монитор выводится изображение, на котором варьирование плотности визуализируется оттенками серого цвета.
Противопоказания для проведения компьютерно й томографии: (без контраста) беременность, (с контрастом) аллергия на контрастны й препарат, почечная недостаточность, тяжелая форма сахарного диабета, миеломная болезнь, заболевания щитовидно й железы.
При деменциях более точным методом является магнитно–резонансная томография , при которой визуализация осуществляется за счет измерения электромагнитного отклика ядер атомов водорода на их возбуждение комбинацией электромагнитных волн в постоянном магнитном поле высокой напряженности.
Существуют относительные противопоказания, при которых проведение исследования возможно при определенных условиях, и абсолютные, при которых исследование недопустимо.
К абсолютным противопоказаниям относят: установленный кардиостимулятор, ферромагнитные или электронные имплантаты среднего уха, большие металлические имплантаты, ферромагнитные осколки, ферромагнитные аппараты Илизарова, кровоостанавливающие клипсы сосудов головного мозга. Относительные противопоказания: инсулиновые насосы, нервные стимуляторы, неферромагнитные имплантаты внутреннего уха, протезы клапанов сердца (в высоких полях, при подозрении на дисфункцию), кровоостанавливающие клипсы (кроме сосудов мозга), декомпенсированная сердечная недостаточность, беременность (в условиях обязательной диагностики этот метод предпочтительнее КТ), клаустрофобия (панические приступы во время нахождения в тоннеле аппарата могут не позволить провести исследование), татуировки, выполненные с содержанием металлических соединений.
Широко используемый в протезировании титан не является ферромагнетиком и практически безопасен при магнитно–резонансной томографии.
Важное диагностическое значение имеет также метод магнитно–резонансной ангиографии (визуализации сосудов головного мозга).
Поскольку нормальное старение также сопровождается атрофией головного мозга, нередко для выявления нейродегенеративного заболевания необходимо установить динамику изменений, что предполагает повторение нейровизуализации с интервалом в несколько месяцев.
Кроме методов, дающих статическое отображение структуры головного мозга, сегодня изобретены и получают все более широкое (но совсем еще недостаточное) распространение методы, позволяющие демонстрировать динамику процессов в головном мозге.
К ним относится метод функциональной магнитно–резонансной томографии, которая обеспечивает картирование коры головного мозга, отображающее индивидуальное местоположение и особенности областей мозга, отвечающих за движение, речь, зрение, память и другие функции, на основе фиксации кровотока при выполнении пациентом определенных заданий и наложения получившихся изображений на обычную МРТ мозга.
Другой метод динамической нейровизуализации – позитронная эмиссионная (двухфотонная) томография. В медицинских учреждениях она используется крайне редко, применяется в основном в научных исследованиях. Метод состоит в отслеживании при помощи специального оборудования распределения биологически активных соединений, меченных вводимыми в организм позитрон–излучающими радиоизотопами.
Это позволяет получить отображение процессов метаболизма нервных клеток, транспорта веществ в различных отделах мозга, экспрессию генов. Таким образом могут быть выявлены изменения еще до появления клинически значимой атрофии мозга.
История ПЭТ–обследований
Наиболее распространенная гипотеза развития патологии при болезни Альцгеймера связывает когнитивные нарушения с отложением в мозгу белка–амилоида в виде бляшек. Между тем достоверной информации о времени появления бляшек, о механизме их образования, а также о том, выступают ли они причиной заболевания или одним из сопутствующих факторов, до сих пор нет. Ответ на некоторые важные вопросы дает использование метода позитронной эмиссионной томографии.
Первое ПЭТ–обследование мозга 56–летнего пациента с болезнью Альцгеймера на предмет амилоидных бляшек с использованием вещества 11C–PIB было проведено в 2002 году профессором Каролинского института (Швеция) Агнетой Нордберг. Анализ результатов позволил представить общую картину развития болезни Альцгеймера. Например, было обнаружено, что высокая концентрация амилоидных бляшек происходит на ранней стадии заболевания, когда у пациента отмечаются лишь незначительные проблемы с памятью. На стадии умеренных когнитивных расстройств объем отложений бета–амилоида уже перестает увеличиваться. Дальнейшее развитие заболевания, приводящее к деменции, никак не связано с увеличением количества амилоидных бляшек.
Позитронная эмиссионная томография позволила сделать целый ряд открытий, заинтересовавших специалистов.
Сегодня этот метод рекомендован Американской ассоциацией по борьбе с болезнью Альцгеймера как самое раннее средство диагностики заболевания.
К сожалению, в настоящее время использование позитронной эмиссионной томографии доступно только некоторым научным центрам, так как вещество PIB имеет очень короткий период полураспада (20 минут). Однако уже ведется разработка более стойких веществ, что, несомненно, расширит возможности использования этой процедуры, имеющей очень высокий диагностический потенциал для выявления пациентов, нуждающихся в антиамилоидной терапии.
Но лучше всего, конечно, вообще избежать болезни. Поэтому наряду с разработками лекарств ученые и врачи ищут методы предотвращения заболеваний. Эксперты анализируют образ жизни, состояние здоровья больших групп людей по всему миру и показатели их заболеваемости тем или иным недугом. Недавно в авторитетном международном научно-медицинском журнале Frontiers in neurology вышел обзор данных о профилактике болезни Альцгеймера и деменции (слабоумия). Работу провела крупная группа ученых из Китая , США , Великобритании , Израиля и Канады .
ЧТО ТАКОЕ ПРОФИЛАКТИКА НА САМОМ ДЕЛЕ
Чтобы понять, на каком этапе и кому может помочь соблюдение правил (см. ниже), важно знать, что такое профилактика на самом деле, поясняют авторы работы. Всемирная организация здравоохранения выделяет три вида профилактики:
- первичная профилактика направлена на то, чтобы избежать возникновения болезни;
- вторичная предназначена для того, чтобы распознавать болезнь на ранних стадиях, когда еще даже не появились симптомы. Задача — остановить или замедлить развитие болезни. Этот вид профилактики включает в себя, в том числе, скрининги. То есть проверки и обследования людей из групп риска развития той или иной болезни;
- третичная профилактика применяется, когда человек уже заболел. В данном случае стоит цель избежать прогрессирования болезни, тяжелых осложнений и инвалидности.
Итого: в отличие от бытующих представлений профилактика возможна и тогда, когда человек уже болен. Скажем, ему поставлен диагноз болезнь Альцгеймера. А это значит, что правила, о которых рассказывается ниже, способны помочь абсолютно любому человеку. Если не избежать болезни, то как минимум снизить риск тяжелых осложнений.
ТРИ СТАДИИ АЛЬЦГЕЙМЕРА
Национальный институт исследований старения (США) и Альцгеймеровская ассоциация в 2011 году разработали модель, выделяющую три стадии болезни. На первой стадии у пациента нет ни малейших внешних признаков заболевания, в то время как в мозге уже появляются предшественники грядущей катастрофы. Стартует процесс накопления амилоидных бляшек и деформированного тау -белка, которые впоследствии буквально душат клетки мозга нейроны. Справедливости ради отметим: для исследователей еще остается немало загадок. В частности, амилоидные сгустки-бляшки с помощью метода позитронно-эмиссионной томографии мозга можно найти у многих людей уже с 40 лет. Но, к счастью, болезнь Альцгеймера при этом развивается далеко не у всех. Потому-то ранняя диагностика недуга по-прежнему остается одной из главных проблем.
СПАСИ СЕБЯ САМ
1. Отказаться от курения.
4,7 миллионов случаев заболевания болезнью Альцгеймера во всем мире связаны в первую очередь с курением, посчитали исследователи. Как такое может быть? Если пояснять упрощенно, то вредные токсины, которые попадают в организм при курении, вызывают воспаление стенок кровеносных сосудов. В том числе в головном мозге. Из-за этого ускоренно накапливаются те самые опасные амилоидные бляшки, из-за которых гибнут нервные клетки нейроны.
Если сократить уровень курения в мире на 25%, то удалось бы спасти от Альцгеймера примерно 1 миллион людей, уверяют ученые.

2. Избавиться от лишнего веса и ожирения в среднем возрасте (после 40 лет).
Речь идет о тех, у кого индекс массы тела (ИМТ) выше 30, уточняют ученые. Напомним: чтобы посчитать ИМТ, берем свой рост в метрах, возводим в квадрат. А потом массу тела в кг делим на полученную цифру.
Около 677 000 случаев болезни Альцгеймера в мире связаны главным образом именно с избыточным весом, говорится в исследовании.
В том числе из-за снижения такой защиты начинают ускоренно развиваться процессы, вызывающие болезнь Альцгеймера.
3. Заниматься физическими упражнениями, не вести сидячий образ жизни.
4,3 млн случаев болезни Альцгеймера связаны с недостатком физнагрузок, ужасаются ученые. Из-за этого страдает кровообращение в мозге. А значит — выше риск накопления опасных веществ, которые могли бы вымываться с током крови.
Совет: золотым международным стандартом на сегодня считается минимум 150 минут двигательной активности в неделю, или не менее чем по 30 минут 5 дней в неделю. А лучше — по 40 — 60 минут каждый день. Самый безопасный вид физнагрузок — кардиологическая ходьба, то есть максимально быстрым шагом, но так, чтобы не было одышки.
4. Повышать свое образование.
Низкий уровень образования способствует развитию болезни Альцгеймера у 6,5 млн человек во всем мире, утверждают ученые (как оценивать свой уровень образования — не уточняется).
- Для профилактики болезни Альцгеймера важно создавать так называемый когнитивный резерв. Этого можно добиться с помощью занятий, которые ведут к образованию новых связей между нейронами и стимулируют образование новых нервных клеток (у взрослого человека их появляется очень мало, но тем не менее), - поясняет профессор Яшин . - А самое мощное средство для создания когнитивного резерва — это как раз получение незнакомых навыков и знаний. Например, изучение иностранного языка, посещение увлекательных образовательных лекций или их просмотр по телевизору, овладение компьютерными навыками в пожилом возрасте, обучение танцам, рисованию, лепке — все, что требует от нас запоминания и вспоминания, творческого подхода — все это помогает создавать и укреплять связи между нейронами.
5. Вовремя диагностировать и лечить сахарный диабет.
Примерно 825 000 случаев развития болезни Альцгеймера ассоциируется с сахарным диабетом, пишут авторы исследования.
6. Уделять внимание лечению депрессии.
Это заболевание провоцирует не менее 3,6 млн случаев болезни Альцгеймера во всем мире, предупреждают ученые.
Наличие депрессии само по себе уже сигналит, что в мозге какие-то неполадки, из-за которых нейроны могут оказаться более беззащитны перед повреждающими процессами. Долговременные наблюдения за большими группами людей показывают, что депрессия является важным фактором риска, повышающим вероятность болезни Альцгеймера.
7. Нормализовать давление и не допускать усугубления гипертонии в среднем возрасте (после 40 лет).
По данным авторов исследования из-за нелеченой гипертонии зарабатывают себе Альцгеймер 1,7 млн пациентов. Повышенное давление грозит не только инфарктами и инсультами, но и развитием деменции, подчеркивают ученые.
В ТЕМУ
- 1161
- 0,9
- 0
- 5
Описанный в статье вид деменции — LATE-энцефалопатия — не зря так назван. Он поражает людей в возрасте 80 лет и старше. По предположению ученых, вклад LATE-энцефалопатии в заболеваемость деменцией может быть серьезно недооценен.
![]()
Виктор Лебедев
![]()
Андрей Панов
- Диагностика
- Медицина
- Нейробиология
- Нейродегенерация
Что такое LATE-энцефалопатия?
LATE-энцефалопатия (limbic-predominant age-related TDP-43 encephalopathy, LATE; связанная с возрастом TDP-43-энцефалопатия с преимущественным поражением гиппокампа) — это поражение головного мозга, связанное с накоплением белка TDP-43 в нейронах и глиальных клетках. В норме этот белок расположен в ядрах клеток. Он регулирует трансляцию и транскрипцию многих белков в центральной нервной системе, в частности, тех, которые вовлечены в процессы аутофагии и очистки клеток от поврежденных элементов. Кроме этого, TDP-43 участвует в организации движения молекул внутри аксона. При LATE-энцефалопатии TDP-43 фосфорилируется, что приводит к образованию агрегатов белка [1]. Массивы измененного белка накапливаются в цитоплазме клеток и начинают нарушать их работу. Кроме этого, скопления протеина обнаруживают при болезни Альцгеймера (БА) [2] и лобно-височной деменции (ЛВД).
Ответ на вопрос пришел из исследований уже известных неврологических заболеваний — бокового амиотрофического склероза (БАС — заболевания, которым страдал Стивен Хокинг) и ЛВД. В 2006 году описали белок TDP-43, который в фосфорилированном виде играет большую роль в патогенезе этих расстройств [4]. Через год обнаружили, что фосфорилированный TDP-43 накапливается в клетках головного мозга у людей старше 80 лет, которые не страдают ни БАС, ни ЛВД, но при этом обнаруживают клиническую картину деменции, схожую с БА [5]. У таких пациентов значительно ухудшалась память: в первую очередь эпизодическая (кратковременная). Научные наблюдения следующих лет позволили выделить когнитивное снижение при накоплении TDP-43 в отдельное заболевание с рядом специфических черт.
Биология новой деменции
В ходе исследований обнаружили пять генов, которые связаны с возникновением LATE-энцефалопатии. При этом нейродегенеративном заболевании зафиксированы мутации в генах GRN (на 17-й хромосоме) и TMEM106B (на 7-й хромосоме) [6]. Мутации в этих же генах сопровождают лобно-височную деменцию и склероз гиппокампа. О последнем состоянии мы еще поговорим, но сейчас важно обратить внимание на то, что на генетическом уровне существует пересечение между ЛВД и LATE-энцефалопатией. Мы уже знаем, что между ними есть общность в виде отложений фосфорилированного TDP-43, но теперь мы видим и генетическую связь этих заболеваний. Кроме упомянутых двух генов с развитием LATE-энцефалопатии связаны гены ABCC9 (на 12-й хромосоме), KCNMB2 (на 3-й хромосоме) и APOE (на 19-й хромосоме) [6]. Последний хорошо известен тем, что увеличивает риск развития БА.
Основной морфологический субстрат новой деменции — это накопление фосфорилированного TDP-43. Отложение протеина происходит во многих отделах головного мозга. Агрегаты TDP-43 обнаруживают в лимбической системе, обонятельных луковицах, коре головного мозга, базальных ганглиях и стволе (рис. 1) [7].
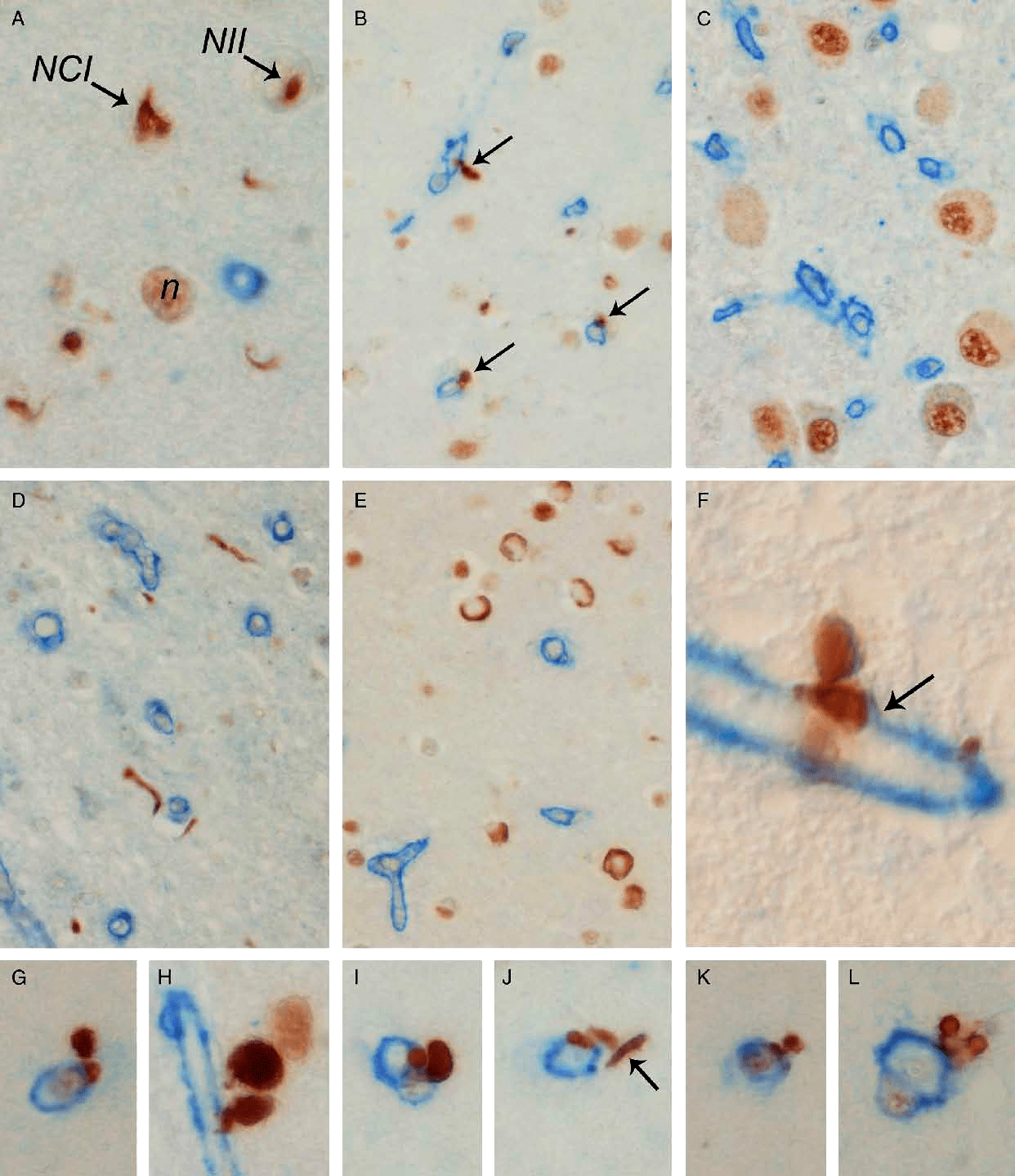
Рисунок 1. Включения TDP-43 (коричневый цвет) при лобно-височной дегенерации в различных отделах головного мозга. Голубым цветом окрашен коллаген 4-го типа.
На основании материалов вскрытий пациентов с LATE-энцефалопатией ученые выяснили этапность поражения головного мозга при этом расстройстве. На первом этапе изменению подвергаются миндалевидные тела, затем патологический процесс захватывает гиппокамп. Завершающие процессы происходят в средней лобной извилине. Для посмертной диагностики LATE-энцефалопатии рекомендовано проводить иммуногистохимическое исследование тканей из этих трех областей мозга.
Из-за сложностей нейровизуализации заболевание, к сожалению, обнаруживают уже на стадии структурных нарушений в гиппокампе. Способы нейровизуализации, которые широко доступны врачам и ученым, не обладают достаточной чувствительностью для выявления изменений в миндалевидных телах при LATE-энцефалопатии. Поэтому гиппокамп, лучше доступный для визуализации, получил особое внимание специалистов.
Очень важно было найти разницу между изменениями в гиппокампе при LATE-энцефалопатии, при болезни Альцгеймера и при гиппокампальном склерозе как отдельном состоянии.
Склеротические нарушения в структуре гиппокампа — первое обнаруженное, но не единственное отличие LATE-энцефалопатии от БА. Склероз гиппокампа — это потеря нервных клеток в основании гиппокампа и в области CA1 с последующим замещением глиальной тканью (рис. 2). Этот процесс не совпадает по объему с поражением гиппокампа при БА, которое имеет более обширный характер.
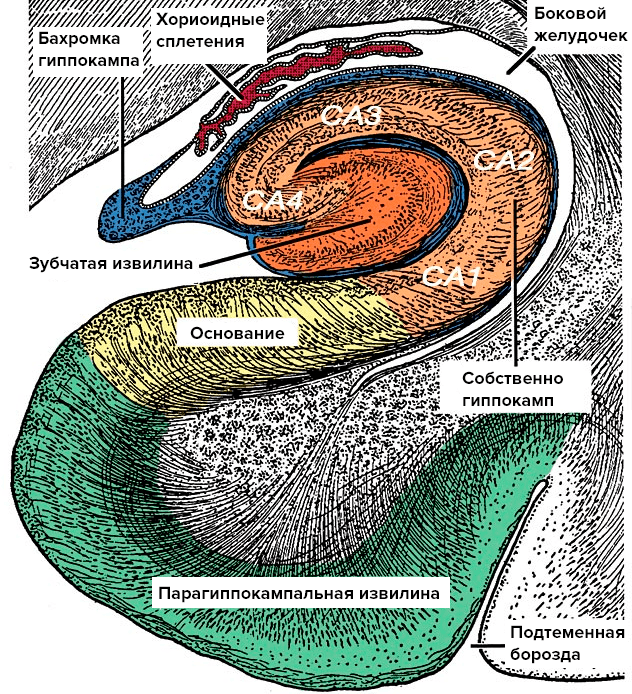
Рисунок 2. Анатомия гиппокампа. Гиппокамп — это сложно устроенная часть головного мозга, которая скрыта под толщей больших полушарий. При гиппокампальном склерозе патологический процесс затрагивает основание гиппокампа и область CA1.
Также необходимо отделить нарушения структуры гиппокампа при LATE-энцефалопатии от гиппокампального склероза. Склероз гиппокампа как самостоятельное структурное изменение встречается при эпилепсии, нейроинфекциях и некоторых нейродегенеративных заболеваниях. Существует два принципиальных различия между этими типами изменений гиппокампа:
- Поражение лимбических структур (гиппокампа и миндалевидных тел) при LATE-энцефалопатии происходит в большей степени, чем при гиппокампальном склерозе. При этомчем выраженнее структурные нарушения в миндалевидных телах, тем сильнее когнитивное снижение у пациента [8].
- Поражение гиппокампа, вызванное отложениями фосфорилированного TDP-43, всегда двустороннее, в отличие от гиппокампального склероза, который может быть односторонним.
Самостоятельный гиппокампальный склероз также может сопровождать LATE-энцефалопатию, и в этом случае прогрессирование деменции будет быстрым (рис. 3).
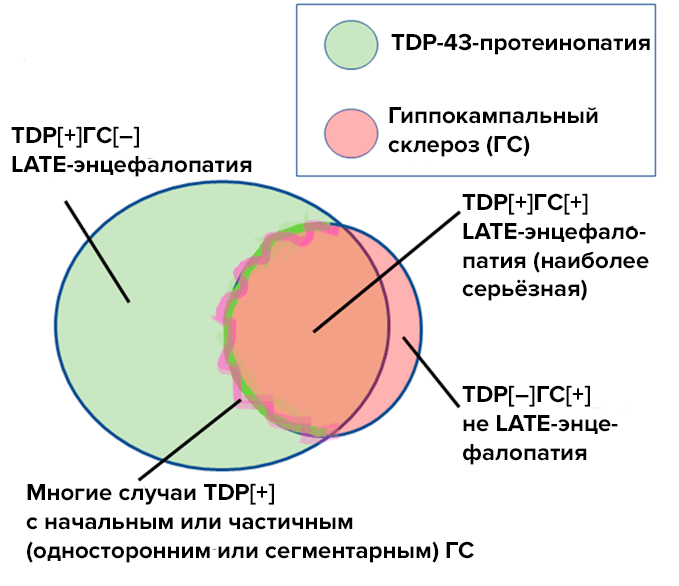
Рисунок 3. TDP-43-протеинопатия, или LATE-энцефалопатия (зеленый круг), и гиппокампальный склероз (розовый круг) — это самостоятельные заболевания. При сочетании этих патологий у пациентов ппоисходит быстрое прогрессирование деменции. Часть случаев LATE-энцефалопатии сопровождается частичным или односторонним гиппокампальным склерозом (розово-зеленая зона на границе розового круга).
Клиническая картина LATE-энцефалопатии
Ключевой признак LATE-энцефалопатии — нарушение эпизодической памяти у лиц старше 80 лет. Этот симптом сближает LATE-энцефалопатию с БА, и дифференциальный диагноз между ними — это сложная и не решенная до конца задача. Клинически LATE-энцефалопатия сопровождается преимущественным поражением памяти без нарушений настроения и поведения. Также при LATE-энцефалопатии в отличие от БА не возникает афазии (нарушений речи) и психотических симптомов (бреда и галлюцинаций). В этом свете течение LATE-энцефалопатии можно назвать доброкачественным, хотя сложно использовать это слово в отношении непрерывно прогрессирующего неврологического заболевания, приводящего к потере самостоятельности.
Куда более заметные различия можно обнаружить между LATE-энцефалопатией и лобно-височной деменцией, при которых происходит отложение TDP-43 в нервных клетках. LATE-энцефалопатия начинается в возрасте 80 лет и старше, а ЛВД поражает людей меньшего возраста, иногда даже в 50 лет. Последняя сопровождается эмоциональными изменениями, такими как уплощение эмоций или их огрубление и стереотипизацию. При ЛВД можно обнаружить нарушение социальной дистанции или сексуальную расторможенность. LATE-энцефалопатия не сопровождается подобными симптомами. При ней развивается деменция с преимущественным поражением памяти. Нейровизуализация при LATE-энцефалопатии обнаруживает также поражение лимбической системы мозга, чего не происходит при ЛВД. Лобно-височная деменция, в свою очередь, вызывает более обширные и выраженные изменения в коре головного мозга, чем LATE-энцефалопатия.
Что нам дает новый тип деменции?
Авторы отчета признают, что определение LATE-энцефалопатии как отдельного заболевания — это только начало пути. Впереди еще много исследований, которые должны пролить свет на возникновение и течение заболевания, а также открыть путь к его лечению. Однако признание LATE-энцефалопатии уже дало многое.
Сейчас в клинических исследованиях фиксируют большое количество пациентов пожилого возраста, которые демонстрируют признаки когнитивного снижения с преимущественным поражением памяти и атрофией гиппокампа, но при исследованиях у них не обнаруживают характерный для БА амилоидоз. Доля таких пациентов достигает 15-30% от числа людей, включенных в исследование [9]. Что с ними происходит? Чем они болеют? LATE-энцефалопатия становится ответом на этот вопрос.
Часть случаев деменции, которая диагностирована как проявление БА, может оказаться вызвана совсем не ею, а нейродегенеративным заболеванием, описанным в отчете. Это касается людей в возрасте 80 лет и старше — той возрастной группы, число представителей которой постепенно увеличивается благодаря достижениям медицины. К сожалению, пока не существует достоверных биомаркеров LATE-энцефалопатии за исключением определения отложений TDP-43 в нервных и глиальных клетках. Мы не можем брать биопсию головного мозга у всех пациентов с подозрением на LATE-энцефалопатию. По этой причине придется придумывать пока что-то более безопасное, чем инвазивное вмешательство.
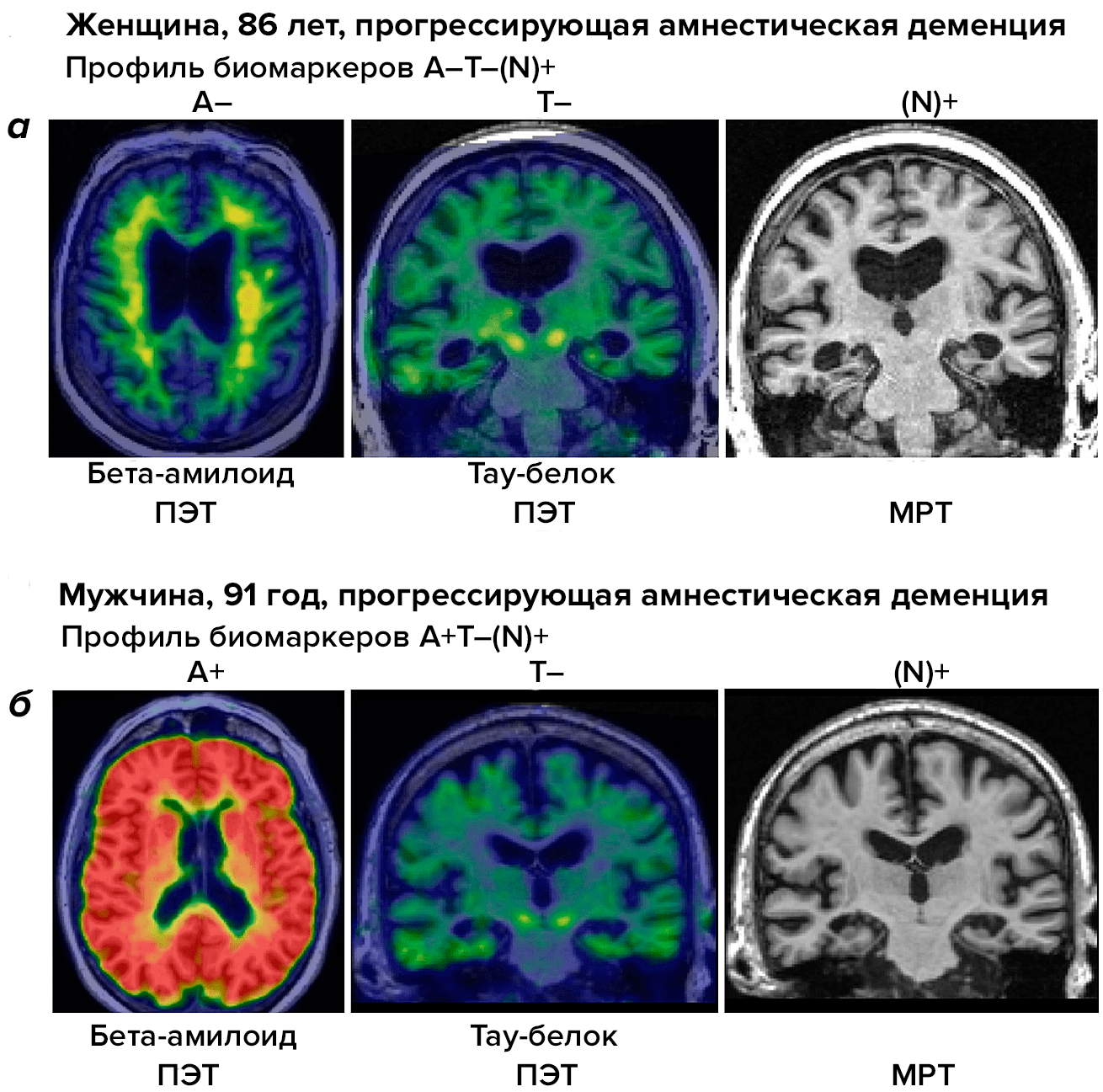
Рисунок 4. Система ATN для дифференциальной диагностики болезни Альцгеймера и других нейродегенеративных заболеваний у пожилых людей. На панели а видны результаты сканирования мозга при разных методах нейровизуализации у пациентки с подозрением на БА. ПЭТ (позитронно-эмиссионная томография) для выявления бета-амилоида (А) и тау-протеина (Т) не дает положительного результата. МРТ для выявления нейродегенеративного поражения (N) дает положительный результат. В последующем при вскрытии у пациентки диагностирована LATE-энцефалопатия. На панели б мы видим результаты сканирования мозга другого пациента с подтвержденной БА. ПЭТ на бета-амилоид и тау-протеин дает положительный ответ, как и МРТ, нацеленная на поиск нейродегенеративных изменений.
Читайте также:




