Нервная регуляция водного обмена
Питьевое поведение человека обусловлено изменением состояния центра жажды в гипоталамусе, представляющего собой нейроны, чувствительные к ангиотензину-II, в меньшей степени к ангиотензину-III (эти вещества активируют центр жажды), к атриопептину – предсердному натрийуретическому фактору (снижает активность центра жажды).
Кроме этого, жажда может быть обусловлена как возрастанием осмотической концентрации внеклеточной жидкости и раздражением осморецепторов гипоталамуса (гиперосмотическая жажда), так и сокращением объема циркулирующей крови (ОЦК) и воздействием образующегося при этом ангиотензина-II на центр жажды (гиповолемическая жажда).
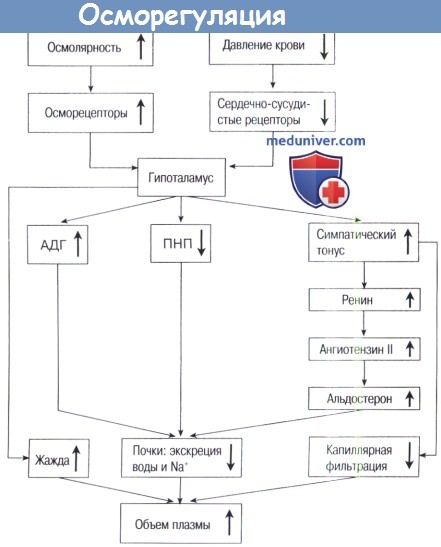
Гуморальную регуляцию осуществляют антидиуретическая и антинатрийуретическая системы, главным исполнительным органом которых являются почки (рис. 1).
Сенсорами антидиуретической системы служат осморецепторы, основная рефлексогенная зона которых заложена в переднем гипоталамусе. Кроме того, имеются и менее чувствительные осморецепторы печени (от печени по афферентным нервным путям сигналы достигают гипоталамуса).
При повышении осмотического давления крови отмечается раздражение осморецепторов, что приводит к увеличению выделения антидиуретического гормона (АДГ) гипоталамусом. АДГ повышает реабсорбцию воды в дистальных канальцах нефрона, при этом диурез уменьшается.
Сенсорами антинатрийуретической системы являются волюморецепторы (рецепторы объема) предсердий, адекватным раздражителем для которых служит изменение объёма циркулирующей крови.
При уменьшении ОЦК раздражение волюморецепторов сопровождается увеличением секреции надпочечниками альдостерона, который повышает реабсорбцию ионов Na+ в почечных канальцах и способствует его задержке в организме (рис. 2).
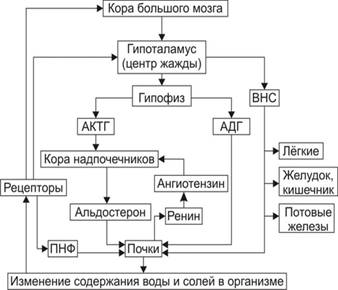
Рис. 1.Система регуляции водного обмена организма (ВНС – вегетативная нервная система; ПНФ – предсердный натрийуретический фактор; Рецепторы – чувствительные нервные окончания)
Активация секреции альдостерона осуществляется также через ренин-ангиотензин-альдостероновую систему – РААС(рис. 2).
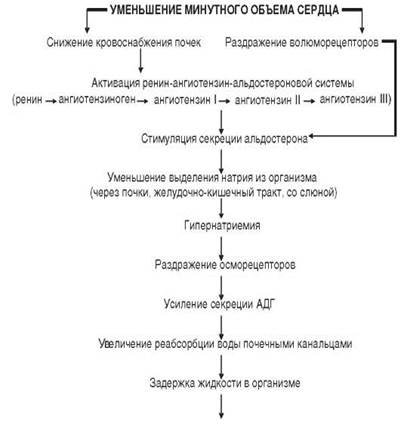
Рис. 2.Нервно-гуморальное звено в механизме задержки воды и солей
Ренинстимулирующие факторы (↓ МОК, ↓ ОЦК, гипотонические состояния, ишемия почек) обеспечивают выработку ренина клетками юкстагломерулярного аппарата почек. Под влиянием ренина из ангиотензиногена образуется ангиотензин-I. Ангиотензиноген продуцируется печенью и находится в α2-глобулиновой фракции плазмы. Под влиянием ангиотензинпревращающего фермента (АПФ) из ангиотензина-I преимущественно в сосудах лёгких образуется ангиотензин-II.
Ангиотензин-II – ключевой эффектор в рениновой системе. Он является мощным вазоконстриктором. Действие ангиотензина-II на гипоталамус способствует активации симпатической нервной системы, что ведёт к гипертензии; стимулирует центр жажды; в гипоталамусе усиливает продукцию АДГ; в надпочечниках усиливает продукцию альдостерона; оказывает митогенное действие на миоциты сосудов.
При последовательном протеолизе ангиотензин-II дает ряд производных, среди них – ангиотензин-III, который обладает слабой, сходной с ангиотензином-II биологической активностью. Ангиотензин-II и ангиотензин-III стимулируют синтез минералкортикоида – альдостерона.
В почечных канальцах альдостерон способствует реабсорбции ионов Na+. Под влиянием ангиотензинов задержка ионов Na+ происходит также в потовых и слюнных железах, тонком и толстом кишечнике. В результате в крови увеличивается содержание натрия (гипернатриемия). Это сопровождается раздражением осморецепторов гипоталамуса и увеличением секреции АДГ, который усиливает реабсорбцию воды в дистальных почечных канальцах.
Таким образом, в результате активации РААС происходит задержка в организме воды и Na+, что может привести к появлению отёков и водянок (рис. 2).
Атриопептины (предсердный натрийуретический фактор – ПНУФ) синтезируются в кардиомиоцитах предсердий. Секреция ПНУФ возрастает при гиперволемии (↑ ОЦК), солевой нагрузке, растяжении предсердий. Атриопептины обеспечивают увеличение натрийуреза и диуреза в почках; подавляют функцию РААС; уменьшают секрецию ренина, альдостерона, АДГ, обладают вазодилататорным эффектом, угнетают центр жажды.
Таким образом, атриопептины предохраняют организм от перегрузки солью и водой.
Типовые формы нарушения водного обмена.
ЭТИОЛОГИЯ, патогенез, проявления гипо- и гипергидратаций
Дисгидрии – нарушения водного обмена. Дисгидрии классифицируют с учётом трёх критериев:
• Содержание жидкости в организме: выделяют гипогидратацию (обезвоживание) и гипергидратацию (гипергидрия), в том числе отёк.
• Осмолярности внеклеточной жидкости: различаю гипоосмолярную (осмоляльность плазмы менее 280 мОсм/кг), гиперосмолярную (осмоляльность плазмы крови более 300 мОсм/кг) и изоосмолярную формы дисгидрии (осмоляльность плазмы 290±10 мОсм/кг).
• Сектора организма, в котором преимущественно нарушается водный обмен: выделяют клеточную, внеклеточную и смешанную (ассоциированную) формы дисгидрии.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
ТЕМА: Нарушение водного обмена
Водный баланс. Механизмы регуляции водного обмена
Вода – один из важнейших компонентов живого организма. Общее содержание воды в организме взрослого человека составляет 55% от массы тела, у новорожденного 75-80 % (у эмбриона – до 95%). Содержание воды в организме определяется в основном, его возрастом, массой и полом (у взрослых мужчин массой 70 кг 53-55%, а у женщин 43-46% – ↑ содержание жира). Вода в организме находится в разных секторах, или компартментах: внутриклеточный компартмент – около 55%, внеклеточный компартмент – 45% всей воды организма.
Водный баланс.Водный баланс зависит от трёх процессов:
• поступления воды в организм с пищей и питьём;
• образования воды при обмене веществ (эндогенная вода);
• выделения воды из организма.
Табл.1. Суточный баланс воды в организме взрослого человека
| Поступление (мл) | Выделение (мл) |
| С твёрдой пищей (1000) С жидкой пищей (1200) Образующаяся в организме (300) Всего: 2500 | С мочой (1400) С потом (600) С выдыхаемым воздухом (300) С фекальными массами (200) Всего: 2500 |
Различают водный баланс:
• положительный: поступление воды превышает её выделение.
• отрицательный: выделение воды преобладает над её поступлением.
• нейтральный: количество поступающей и выводимой воды совпадают.
Нейрогуморальная регуляция водного обмена
Питьевое поведение человека обусловлено изменением состояния центра жажды в гипоталамусе, представляющего собой нейроны, чувствительные к ангиотензину-II, в меньшей степени к ангиотензину-III (эти вещества активируют центр жажды), к атриопептину – предсердному натрийуретическому фактору (снижает активность центра жажды).
Кроме этого, жажда может быть обусловлена как возрастанием осмотической концентрации внеклеточной жидкости и раздражением осморецепторов гипоталамуса (гиперосмотическая жажда), так и сокращением объема циркулирующей крови (ОЦК) и воздействием образующегося при этом ангиотензина-II на центр жажды (гиповолемическая жажда).
Гуморальную регуляцию осуществляют антидиуретическая и антинатрийуретическая системы, главным исполнительным органом которых являются почки (рис. 1).
Сенсорами антидиуретической системы служат осморецепторы, основная рефлексогенная зона которых заложена в переднем гипоталамусе. Кроме того, имеются и менее чувствительные осморецепторы печени (от печени по афферентным нервным путям сигналы достигают гипоталамуса).
При повышении осмотического давления крови отмечается раздражение осморецепторов, что приводит к увеличению выделения антидиуретического гормона (АДГ) гипоталамусом. АДГ повышает реабсорбцию воды в дистальных канальцах нефрона, при этом диурез уменьшается.
Сенсорами антинатрийуретической системы являются волюморецепторы (рецепторы объема) предсердий, адекватным раздражителем для которых служит изменение объёма циркулирующей крови.
При уменьшении ОЦК раздражение волюморецепторов сопровождается увеличением секреции надпочечниками альдостерона, который повышает реабсорбцию ионов Na+ в почечных канальцах и способствует его задержке в организме (рис. 2).
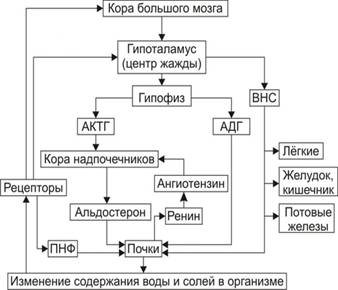
Рис. 1.Система регуляции водного обмена организма (ВНС – вегетативная нервная система; ПНФ – предсердный натрийуретический фактор; Рецепторы – чувствительные нервные окончания)
Активация секреции альдостерона осуществляется также через ренин-ангиотензин-альдостероновую систему – РААС(рис. 2).
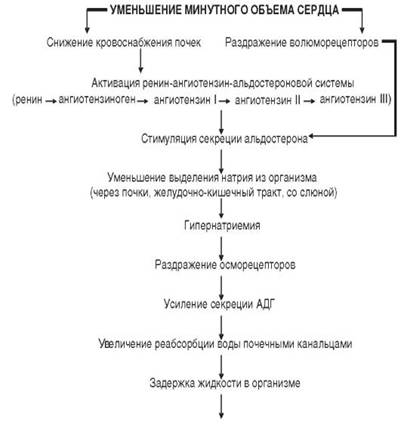
Рис. 2.Нервно-гуморальное звено в механизме задержки воды и солей
Ренинстимулирующие факторы (↓ МОК, ↓ ОЦК, гипотонические состояния, ишемия почек) обеспечивают выработку ренина клетками юкстагломерулярного аппарата почек. Под влиянием ренина из ангиотензиногена образуется ангиотензин-I. Ангиотензиноген продуцируется печенью и находится в α2-глобулиновой фракции плазмы. Под влиянием ангиотензинпревращающего фермента (АПФ) из ангиотензина-I преимущественно в сосудах лёгких образуется ангиотензин-II.
Ангиотензин-II – ключевой эффектор в рениновой системе. Он является мощным вазоконстриктором. Действие ангиотензина-II на гипоталамус способствует активации симпатической нервной системы, что ведёт к гипертензии; стимулирует центр жажды; в гипоталамусе усиливает продукцию АДГ; в надпочечниках усиливает продукцию альдостерона; оказывает митогенное действие на миоциты сосудов.
При последовательном протеолизе ангиотензин-II дает ряд производных, среди них – ангиотензин-III, который обладает слабой, сходной с ангиотензином-II биологической активностью. Ангиотензин-II и ангиотензин-III стимулируют синтез минералкортикоида – альдостерона.
В почечных канальцах альдостерон способствует реабсорбции ионов Na+. Под влиянием ангиотензинов задержка ионов Na+ происходит также в потовых и слюнных железах, тонком и толстом кишечнике. В результате в крови увеличивается содержание натрия (гипернатриемия). Это сопровождается раздражением осморецепторов гипоталамуса и увеличением секреции АДГ, который усиливает реабсорбцию воды в дистальных почечных канальцах.
Таким образом, в результате активации РААС происходит задержка в организме воды и Na+, что может привести к появлению отёков и водянок (рис. 2).
Атриопептины (предсердный натрийуретический фактор – ПНУФ) синтезируются в кардиомиоцитах предсердий. Секреция ПНУФ возрастает при гиперволемии (↑ ОЦК), солевой нагрузке, растяжении предсердий. Атриопептины обеспечивают увеличение натрийуреза и диуреза в почках; подавляют функцию РААС; уменьшают секрецию ренина, альдостерона, АДГ, обладают вазодилататорным эффектом, угнетают центр жажды.
Таким образом, атриопептины предохраняют организм от перегрузки солью и водой.
Типовые формы нарушения водного обмена.
ЭТИОЛОГИЯ, патогенез, проявления гипо- и гипергидратаций
Дисгидрии – нарушения водного обмена. Дисгидрии классифицируют с учётом трёх критериев:
• Содержание жидкости в организме: выделяют гипогидратацию (обезвоживание) и гипергидратацию (гипергидрия), в том числе отёк.
• Осмолярности внеклеточной жидкости: различаю гипоосмолярную (осмоляльность плазмы менее 280 мОсм/кг), гиперосмолярную (осмоляльность плазмы крови более 300 мОсм/кг) и изоосмолярную формы дисгидрии (осмоляльность плазмы 290±10 мОсм/кг).
• Сектора организма, в котором преимущественно нарушается водный обмен: выделяют клеточную, внеклеточную и смешанную (ассоциированную) формы дисгидрии.
Водно-электролитные нарушения характерны для тяжелых нейрохирургических больных, т. к. повреждение центральной нервной системы (ЦНС) зачастую нарушает способность мозга к регуляции гомеостаза.
Потенциально последствия водно-электролитных расстройств для пораженного мозга могут включать развитие цитотоксического и вазогенного отека мозга, потерю церебральной ауторегуляции, повышение ВЧД и снижение ПДМ.
Раннее выявление и адекватное лечение водноэлектролитных нарушений минимизирует вторичное повреждение мозга.
а) Основные положения регуляции водно-солевого обмена:
1. Вода в организме человека. Объем воды в теле человека (ОВТ) существенно варьирует (45-80%, в среднем около 55%) и зависит от возраста, пола и конституции. ОВТ состоит из двух секторов. Внутриклеточный объем жидкости составляет три пятых ОВТ. Внеклеточный объем включает внутрисосудистое (25%) и интрестициальное пространство (75%).
2. Электролиты. Во внеклеточном секторе основными компонентами являются натрий и хлориды, в то время как во внутриклеточном пространстве больше калия и фосфата. Нормальным уровнем натрия во внеклеточном пространстве является 135-145 мг-экв/л. Всего 2% натрия содержится внутри клеток.
Напротив, практически весь калий находится внутриклеточно; около 2% содержится во внеклеточном пространстве. Нормальный уровень калия в экстрацеллюлярном секторе составляет 3,5-5,0 мг-экв/л. Высокие градиенты между внутри- и внеклеточным содержанием Na и К поддерживаются работой Na + /К + -АТФазы и необходимы для нормального мембранного потенциала.
На основании фактов, что внеклеточный объем зависит в основном от содержания натрия и вода свободно перемещается по градиенту концентрации между внутри- и внеклеточными секторами, сформулируем два основополагающих правила:
1. При сохранении нормальной осморегуляции первичные изменения концентрации натрия приводят к различным изменениям во внеклеточном пространстве.
2. Недостаточное содержание воды сопровождается нарушениями внутри- и внеклеточного объемов. Изменение соотношения воды и растворенных в ней веществ приводит к нарушению нормальной осмолярности.
3. Осмолярность, осмоляльность и эффективное осмотическое давление раствора. Чтобы лучше понимать разницу между терминами их определение дано в таблице ниже.

б) Регуляция водно-электролитного обмена и осмолярности. На рисунке ниже обобщены процессы волюмо- и осморегуляции. В организме здорового человека возможности поддержания осомолярности плазмы и содержащегося в ней натрия ограничены. Барорецепторы, находящиеся в аорте и предсердии, улавливают изменения объема циркулирующей жидкости и внутрисосудистого давления и модулируют потребность организма в жидкости (жажда) и экскрецию жидкости (почки).
Антидиуретический гормон. Одним из главных механизмов регуляции является выброс антидиуретического гормона (АДГ). АДГ секретируется в соответствии с осмолярностью плазмы крови. Пороговой осмолярностью считают уровень около 280 мОсм/л. АДГ способствует увеличению реабсорбции воды в почках и приводит к концентрации мочи. При максимальном выбросе АДГ осмолярность первичной мочи может достигать 1000 мОсм/л и выше.
Секрецию АДГ могут стимулировать различные препараты (наркотики, барбитураты, карбамазенин), а также повышение тонуса симпатической нервной системы. Секреция АДГ может осуществляться даже при гипоосмолярности плазмы.
При гиперосмолярном состоянии для поддержания водного баланса важны чувство жажды и питьевые привычки. Даже при отсутствии АДГ осмолярность плазмы будет находиться в нормальных пределах, если пациент может испытывать чувство жажды и голода и имеет возможность их утолить.
в) Регуляция концентрации натрия. Регуляция концентрации натрия осуществляется для поддержания адекватного давления и объема жидкости. Концентрация натрия в организме регулируется ренальным, центральным и гуморальным механизмами.
Ключевую роль в регуляции внеклеточного содержания натрия играют силы гидростатического и онкотического давления, действующие на микроциркуляторном уровне в почках. Повышение перфузионного давления почек или снижение онкотического давления приводит к усилению экскреции натрия и наоборот. При дофаминергической вазодилатации повышается гидростатическое давление в капиллярах, что приводит к потере натрия.
Вазоконстрикция (например, при гиповолемическом шоке или сердечной недостаточности) способствует задержке натрия. Адренергическая стимуляция усиливает реабсорбцию ионов Na, а денервация уменьшает.
1. Ренин-ангиотензин-альдостероновая система. Основным гормональным механизмом регуляции натрия является ренин-ангиотензин-альдостеро-новая система. Уменьшение объема циркулирующей крови улавливается юкстагломерулярным аппаратом, что приводит к выбросу в кровь ренина. В конечном итоге происходит повышение уровня ангиотензина II и альдостерона. Ангиотензин II оказывает вазоконстрикторный эффект, также действует на гипоталамический центр жажды. Альдостерон способствует повышению реабсорбции натрия и экскреции калия в дистальных канальцах.
2. Предсердный натриуретический пептид (ПНП). Предсердный натриуретический пептид (ПНП), секретируемый из кардиомиоцитов при повышении артериального давления или повышении нагрузки на правое предсердие, действует непосредственно на функцию почек. ПНП повышает диурез и натриурез, ингибирует ренин-ангиотензиновую систему, а также выброс АДГ, снижает общее периферическое сопротивление сосудов и артериальное давление, что в итоге уменьшает чувство жажды. ПНП, секретируемый в ЦНС, принимает участие в регуляции внутриклеточного объема в головном мозге, а также водно-электролитного состава, вероятно, за счет воздействий на капиллярное русло.
г) Регуляция концентрации калия. Выделение калия осуществляется почками, в зависимости от градиента концентрации в дистальных канальцах. Выброс альдостерона происходит при повышении концентрации калия в сыворотке крови. Альдостерон стимулирует не только реабсорбцию натрия, но и экскрецию калия. Распределение калия между внутри- и внеклеточными водными секторами также регулируется кислотно-щелочным равновесием. При алкалозе, который наблюдается при гипервентиляции, происходит перемещение калия в клетки, снижается его плазменная концентрация и усиливается почечная экскреция. При ацидозе наблюдаются противоположные изменения.
д) Регуляция водного обмена в головном мозге. В периферических органах распределение внутри-и внеклеточной жидкости регулируется онкотическим и гидростатическим давлением. В ЦНС регуляция осуществляется посредством гематоэнцефалического барьера (ГЭБ). Распределение жидкости между внутрисосудистым и внеклеточным пространствами прежде всего определяется градиентом осмотического давления вдоль эндотелия капилляров в головном мозге.
1. Гематоэнцефалический барьер. Гематоэнцефалический барьер представляет собой механический барьер со средним диаметром пор 7 А. Даже небольшие молекулы, как например, натрий, не могут проходить через поры и оказывать осмотическое давление. Из этого следует, что онкотические растворы при условии сохранности ГЭБ оказывают незначительное воздействие на водный баланс головного мозга. Вода же легко проходит сквозь поры ГЭБ и следует по осмотическому градиенту, который быстро выравнивается.
Как следует из вышесказанного, изменения в концентрации онкотически активных веществ в крови (например, при гемодилюции или инфузии коллоидных растворов) при интактном ГЭБ не оказывают значимого влияния на содержание воды во внеклеточном пространстве, а также на степень выраженности отека мозговой ткани. Напротив, введение в циркуляторное русло осмотически активных растворов (маннитол, гипертонический раствор хлорида натрия) приведет к значительным сдвигам ВЧД.
2. Регуляция водного обмена при повреждении ГЭБ. В области повреждения ГЭБ повышается проницаемость эндотелия сосудов для больших молекул, в этом случае онкотическое и гидростатическое давление становятся ведущими факторами регуляции баланса жидкостей. Следовательно, для предотвращения отека мозговой ткани предпочтительнее использовать коллоидные растворы.
е) Водно-электролитный баланс в послеоперационном периоде. В послеоперационном периоде обычно наблюдается задержка натрия и воды. Это обусловлено повышенной секрецией (не связанной с плазменной осмолярностью) АДГ и адренокортикостероидов. Уровень гормонов снижается приблизительно на 3-4 сутки после операции. На секрецию АДГ в периоперативном периоде может влиять ряд факторов:
- Изменения циркуляции, обусловленные кровоизлиянием
- Гипотензивные препараты
- Потеря жидкости с рвотой
- Инфузия осмодиуретиков (маннитол).
Очень важно следить за повышением уровня антидиуретических гормонов в раннем послеоперационном периоде, а также при ЧМТ, и проводить своевременную коррекцию возникающих расстройств. Необдуманная инфузия и неадекватная секреция АДГ, вероятно, являются наиболее частыми причинами гипонатриемии у больных нейрохирургического профиля.
ж) Гипернатриемия. Определение. Для нейрохирургических пациентов гипернатриемией считается превышение концентрации натрия в сыворотке 150 ммоль/л, что может наблюдаться в случае несахарного мочеизнурения или после инфузии гипертонического раствора NaCl.
Симптомы. Умеренное повышение натрия в плазме (3-4 ммоль/л) может проявляться чувством сильной жажды. Уровень натрия выше 160 ммоль/л или осмолярность выше 330 мОсм/л может сопровождаться оглушением, возбуждением, сонливостью, припадками, тремором и гиперрефлексией.
з) Гипонатриемия. Определение. Диапазон нормы натрия в сыворотке крови 135-145 ммоль/л. Проявления тяжелой ги-понатриемии можно наблюдать при снижении уровня натрия ниже 120 ммоль/л.
Этиология и эпидемиология. В нейрохирургической практике гипонатриемия чаще всего встречается при синдроме неадекватной секреции АДГ (SIADH) или при так называемом синдроме церебральной потери солей (CSWS). Считается, что при SIADH развивается дилюционная гипонатриемия. При CSWS происходит потеря как ионов натрия, так и свободной жидкости. Следовательно, лечение при этих синдромах различается.
и) Несахарное мочеизнурение (diabetes insipidus). Определение. Для несахарного мочеизнурения характерна избыточная потеря воды вследствие дефицита АДГ, секреция которого не изменяется под влиянием сдвигов в осмолярности плазмы или при повышении артериального давления.
Симптомы. Клинически у пациентов в сознании несахарное мочеизнурение проявляется полиурией и полидипсией (жажда), которые приводят к гипернатриемии. Первая фаза несахарного мочеизнурения (6-8 часов после травмы или хирургического вмешательства): полиурия и гипернатриемия, т. к. в крови еще циркулирует эндогенный АДГ. Первая фаза может длиться 2-5 суток и часто наблюдается после операций в области стебля гипофиза. Вторая фаза: олигурия и снижение концентрации натрия в сыворотке.
Может продолжаться 5-14 суток и переходить в постоянную форму несахарного мочеизнурения (при поражении гипоталамуса, голубоватого пятна).
Этиология и эпидемиология. У нейрохирургических пациентов проявления несахарного мочеизнурения обычно наблюдаются после хирургических вмешательств по поводу аневризм передней соединительной артерии (поражение переднего отдела гипоталамуса) или после операций транссфеноидальным доступом (повреждение стебля гипофиза). При тяжелой ЧМТ частота возникновения несахарного мочеизнурения около 2%, в особенности если линия перелома проходит через турецкое седло или рядом с ним.
Хирургия краниофарингиом, а также операции, выполняемые из транссфеноидального доступа, в 7% случаев сопровождаются симптомами несахарного мочеизнурения, которые обычно исчезают в течение 12-36 часов.
Можно ожидать развитие несахарного мочеизнурения у больных со смертью мозга при поддержании жизненных функций.
Диагностика. Для диагноза несахарного мочеизнурения используются следующие критерии:
- Высокий темп диуреза > 200-250 мл/ч.
- Низкий удельный вес мочи 1,001-1,005.
- Низкая осмолярность мочи 50-150 мОсм/л.
- Нормальная или повышенная концентрация. натрия в сыворотке.
- Нормальная функция адреналовой системы. Дифференциальный диагноз. Необходимо исключить:
- Психогенную полидипсию.
- Почечную форму несахарного мочеизнурения (почки нечувствительны к АДГ).
- Осмодиурез (инфузия маннитола).
Лечение несахарного мочеизнурения. Терапия несахарного мочеизнурения при полиурии заключается в назначении препаратов десмопрессина (АДГ). Существуют формы выпуска для парентерального и интраназального применения. Первое введение следует несколько отложить (до отрицательного баланса 2500 мл), чтобы избежать ятрогенной гипонатриемии при возможной передозировке препарата. Пациентам в сознании с интактным центром жажды замещение АДГ необходимо только при суточном диурезе более 4000 мл. Пациенты, которые теряют меньший объем жидкости с мочой, могут возместить дефицит жидкости питьем.
Дозирование десмопрессина производят в соответствии с диурезом. Терапевтической целью является поддержание нулевого баланса жидкости с диурезом около 2500 мл/сут. Существующий дефицит свободной воды корригируют гипотоническим Na + 100-содержащим раствором. Ранее использовавшийся 5% раствор глюкозы менее выгоден, т. к. несет дополнительную гликемическую нагрузку.
к) Синдром неадекватной секреции АДГ. Определение. SIADH (синдром Schwartz-Bartter) сопровождается постоянной секрецией АДГ несмотря на гипонатриемию, снижение осмолярности сыворотки, нормальный или избыточный объем внеклеточной жидкости.
Симптомы. Вызвать подозрение по поводу гипонатриемии и гипоосмолярности сыворотки должно появление в клинической картине угнетение сознания, новая очаговая симптоматика, припадки или повышение ВЧД. Пациенты в сознании часто испытывают парадоксальную жажду.
Эпидемиология. Около 5% пациентов ОРИТ с субарахноидальным кровоизлиянием или ЧМТ предъявляют симптомы SIADH. Также синдром встречается при опухолях головного мозга, после краниэктомии и при менингите.
Диагностика: для диагноза SIADH необходимы следующие критерии:
- Нормальная функция почек и адреналовой системы
- Осмолярность сыворотки 25-30 мэкв/л), зачастую 50-150 мэкв/л.
Диагноз SIADH у тяжелых нейрохирургических больных затруднен, т. к. оценить волемический статус довольно затруднительно. Диагноз можно подтвердить, если при ограничении инфузии происходит уменьшение потери электролитов и коррекция гипонатриемии. Также может быть полезным определение мочевой кислоты, так как при SIADH ее уровень низкий, а при гиповолемии — повышается.
Лечение синдрома неадекватной секреции АДГ. Перед ограничением поступления жидкости необходимо исключить синдром церебральной потери солей в качестве причины гипонатриемии. При легких формах SIADH ограничение жидкости до 1 л/сут. является первоочередным лечением. Лечение хронической формы SIADH состоит в длительном ограничении жидкости (1200-1800 мл/сут.) и назначении фуросемида (40 мг/сут.). Возможно назначение антибиотика из группы тетрациклинов демеклоциклина (150-300 мг перорально каждые 6 часов), который оказывает антагонистический по отношению к АДГ эффект на почечные канальцы.
Лечение SIADH у пациентов с вазоспазмом или ЧМТ. При лечении таких пациентов не следует ограничивать количество жидкости. Напротив, поддержание эуволемического статуса следует проводить, используя коллоидные растворы, богатые натрием. Приоритетными задачами являются поддержание адекватного перфузионного давления мозга и профилактика вторичных повреждений. Гиперволемия не является главной проблемой у пациентов в острой фазе болезни.
Лечение тяжелой гипонатриемии при SIADH. Для коррекции тяжелой гипонатриемии ( 25-30 мэкв/л, часто 50-150 мэкв/л.
- Нормальная концентрация мочевой кислоты в моче.
Лабораторная диагностика, включая анализ электролитов в сыворотке и в моче может не выявить большой разницы при CSW и SIADH. Истощение объема вследствие натрийуреза бывает трудно заметить. Для CSWS более характерны снижение массы тела и отрицательный баланс жидкостей.
Лечение CSWS. Краеугольным камнем в лечении CSWS является восполнение дефицита жидкости с помощью изо- и гипертонического (3%) растворов хлорида натрия, а также назначение минералкортикоида флюдрокортизона (0,2 мг в/в).
м) Дифференцирование CSWS и SIADH. Ключевой отличительной характеристикой при CSWS и SIADH является волемический статус, который иногда трудно оценить. ЦВД нельзя считать достаточно информативным признаком. Общий баланс жидкостей на протяжении нескольких дней более информативен при дифференциальном диагнозе CSWS и SIADH. У пациентов обеих групп наблюдается повышенный уровень АДГ. Повышение АДГ при SIADH неадекватное, а при CSWS считается адекватным. Патогномоничных лабораторных показателей для этих синдромов не выделено.
В ситуации неясного дифференциального диагноза при всех возможностях клинической и лабораторной диагностики, проводится коррекция гипонатриемии и пробная терапия минералокортикоидом, при этом необходимо поддерживать соответствующий изоволемический статус.
Содержание и распределение воды в организме. Наряду с белками, углеводами, липидами, ферментами, витаминами и гормонами в клетках различных органов, тканей и межклеточных пространствах содержатся неорганические вещества, к которым относятся вода и соли.
Вода — важнейшая составная часть всех клеток. В количественном отношении ее содержится значительно больше, чем других компонентов. Однако вода является не только составной частью клеток, она служит также средой, в которой существуют клетки и с помощью которой поддерживается связь между ними. Кроме того, вода — это среда, где протекают все химические реакции, связанные с жизнедеятельностью организма.
Вода выполняет важную механическую роль, способствуя скольжению трущихся поверхностей (суставы, связки и т.д.).
Благодаря испарению воды с поверхности кожи человек и теплокровные животные сохраняют постоянную температуру тела при усиленном образовании теплоты в организме или при высокой температуре окружающей среды.
Вода составляет основу всех жидкостей в организме: крови, лимфы, мочи, соков пищеварительного аппарата, спинномозговой жидкости и др. Поэтому все живые организмы, как правило, не способны переносить обезвоживание. Человек и животные погибают от недостатка воды значительно скорее, чем от недостатка пищи. Если полное голодание человек может выдержать в течение 30 сут и более, то без воды смерть наступает через несколько суток.
В организме человека содержание воды составляет 2/3 массы тела и меняется с возрастом. Так, у четырехмесячного эмбриона количество воды составляет 94 %, у новорожденных — 77 %, у взрослых людей — 50—65 %. В теле мужчин содержится в среднем 60 % воды, тогда как у женщин — 50 %.
Уровень воды в разных тканях неодинаков. Соединительная и костная ткани содержат относительно мало воды, а кровь, нервная ткань, мышцы, печень — значительно больше. Количество воды в организме зависит также от содержания жира: чем больше жира, тем меньше воды.
Всю воду в организме можно подразделить на внутриклеточную, или интрацеллюлярную (
72 %), и внеклеточную, или экстрацеллюлярную (
Кровь, лимфа и межклеточная жидкость всего организма образуют единую фазу. Состав лимфы и межклеточной жидкости примерно соответствуют составу плазмы крови. Жидкая среда клеток различных тканей организма имеет примерно одинаковый состав и определяется как внутриклеточная жидкость. Внутриклеточная жидкость содержит в среднем около 35—45 % воды по отношению к массе тела, внеклеточная — 15 %. Эти жидкости различаются также по составу электролитов. Во внеклеточной жидкости преобладают ионы натрия, хлора и гидрокарбонатов; во внутриклеточной — ионы калия, а также белки и фосфорные эфиры.
Состояние воды в организме. В органах, тканях и клетках вода находится в виде свободной, гидратационной и иммобильной.
Свободная вода составляет основу многих биологических жидкостей: крови, лимфы, пищеварительных соков, спинномозговой жидкости .
Она участвует в доставке питательных веществ и удалении продуктов обмена из органов, тканей и клеток.
Часть воды находится в связанном состоянии, участвуя в образовании гидратных оболочек. Это так называемая гидратационная вода. Она образует гидратные оболочки вокруг молекул белков, нуклеиновых кислот и неорганических ионов. Гидратационная вода составляет около 40 % всей воды тканей, причем 10—40 % ее связывают белки. Эта вода по своим свойствам отличается от обычной: она не замерзает при снижении температуры до 0 °С и ниже и не обладает свойствами растворителя.
Большая часть воды в организме сосредоточена между различными молекулами, мембранами, волокнистыми структурами и механически ими зафиксирована, не входя в состав гидратных оболочек. Такая вода получила название иммобильной. Иммобильная вода замерзает при температуре ниже 0 °С, растворяет многие вещества и легко участвует в реакциях обмена веществ.
Между различными видами воды существует динамическое равновесие, одна ее форма может переходить в другую. Так, пополнение количества гидратной воды происходит за счет иммобильной и свободной воды.
Количество воды в отдельных органах и тканях изменяется в зависимости от их функционального состояния. Так, при мышечной работе содержание воды в мышцах увеличивается. При этом при непродолжительной работе, в течение 10—15 мин, количество воды в мышцах увеличивается за счет экстрацеллюлярной воды, при работе в течение 30—60 мин — главным образом за счет интрацеллюлярной. Такое явление объясняется приливом крови и повышением гидрофильности белков работающих мышц.
Обмен воды и регуляция водного обмена. Основными источниками воды для организма являются продукты питания и питьевая вода. Вода, поступающая с пищей, называется экзогенной и составляет 6/7 всей воды организма. Остальная часть (1/7) общей массы воды образуется в тканях человека как конечный продукт окисления нуклеиновых кислот, белков, липидов, углеводов. Это — эндогенная вода. Установлено, что при полном окислении 100 г жиров организм получает 107,1 г, углеводов — 55,6 г и белков 41,3 г воды. Ежесуточно взрослому человеку необходимо около 2,5—3 л воды. Однако это количество может сильно изменяться в зависимости от возраста человека, характера его работы, температуры окружающей среды и вида пищи. Обычно около 1 л воды вводится в организм в составе так называемой твердой пищи (хлеба, мяса, картофеля и т.п.), остальное количество — в виде питья (воды, чая, супа, молока и др.).
Обмен воды в организме является частью общего обмена веществ и тесно связан с обменом нуклеиновых кислот, белков, липидов и углеводов. В водном обмене принимают участие почки, легкие, кожа и пищевой канал.
Вода всасывается слизистой оболочкой пищевого канала на всем его протяжении, однако преимущественно в толстой кишке. Молекулы воды вместе с переваренными веществами проникают в глубь эпителиальных клеток слизистых оболочек в результате диффузии и осмоса, а также частично путем активного транспорта, который осуществляется белками крови — альбуминами и глобулинами.
Из организма вода выделяется главным образом с мочой — около 1,2—1,5 л, что составляет около 60 % всей выделяемой воды. Небольшое количество ее, около 0,2—0,3 л, выделяется через легкие в процессе дыхания. Это происходит в результате того, что воздух в альвеолах при температуре тела насыщается водяными парами. Через кожу потеря воды в количестве до 1 л происходит путем потоотделения и испарения. Незначительная часть воды — 0,2 л — выделяется через пищевой канал вместе с калом.
Количество выделяемой организмом воды может значительно изменяться в зависимости от условий окружающей среды, выполняемой работы и состояния организма. Так, в жарком климате значительно возрастает выделение воды при потоотделении (до 4—5 л). При интенсивной работе, повышении температуры тела, вследствие увеличения объема дыхания усиливается выделение воды через легкие.
В регуляции водного обмена активное участие принимает центральная нервная система, в частности, такие ее отделы, как кора больших полушарий, промежуточный и продолговатый мозг, а также многие железы внутренней секреции. Некоторые гормоны, выделяющиеся железами, способствуют задержанию воды в организме, другие — наоборот, стимулируют ее выделение.
Вазопрессин вызывает сокращение почечных сосудов, в результате чего уменьшается диурез (мочеотделение), а следовательно, и выделение воды из организма. Поэтому вазопрессин часто называют антидиуретическим гормоном. Секреция этого гормона регулируется величиной осмотического давления плазмы крови. Повышение давления стимулирует выработку вазопрессина, который снижает выделение воды из организма путем повышения водоудерживающей способности тканей и за счет увеличения выделения концентрированной мочи. В результате этого осмотическое давление уменьшается, раздражение нейрогипофиза снижается и секреция вазопрессина прекращается.
Действие на водный обмен альдостерона связано с уровнем натрия в плазме крови. Понижение осмотического давления и выделение из организма воды и, следовательно, разбавленной мочи в большом количестве связано с понижением концентрации натрия в плазме крови. Снижение уровня натрия вызывает повышенную секрецию альдостерона, который усиливает процессы обратного всасывания натрия в почках и тем самым задерживает его в организме. Повышение уровня натрия в плазме тормозит секрецию этого гормона.
Таким образом, различные механизмы действия этих двух гормонов зависят от осмотического давления плазмы, снижение которого обусловливает повышенную секрецию альдостерона и торможение выработки вазопрессина. При повышении осмотического давления наблюдаются обратные процессы в регуляции водного обмена.
Среди других гормонов, участвующих в регуляции обмена воды, необходимо отметить тироксин — гормон щитовидной железы, паратирин — гормон паращитовидной железы, андрогены и экстрогены — гормоны половых желез. Они стимулируют выделение воды почками.
Важную роль в гидратации и дегидратации тканей выполняют минеральные вещества. Ионы натрия увеличивают гидратацию тканей и задерживают воду в организме. Ионы калия и кальция, наоборот, дегидратируют ткани и способствуют удалению воды из организма.
Поступление воды в организм регулируется чувством жажды, которое возникает в результате рефлекторного возбуждения определенных участков коры головного мозга при изменении осмотического давления плазмы крови. Вся введенная в организм вода более или менее быстро всасывается и поступает в кровяное русло.
Таким образом, регуляция водного обмена осуществляется нейрогормональным путем.
Обмен минеральных веществ
Значение минеральных веществ в организме человека. К числу незаменимых веществ организма относятся минеральные соли и отдельные химические элементы, хотя они, так же как и вода, не обладают питательной ценностью и не являются источниками энергии.
В составе живых организмов обнаружено около 70 химических элементов, из них 47 содержатся в них постоянно. Это так называемые биогенные химические элементы. Их значение определяется тем, что они входят в состав клеток органов и тканей, а также биологически активных веществ — ферментов, гормонов, витаминов, белков, участвуют в реакциях обмена. Это такие элементы, как кислород, углерод, азот, водород, кальций, фосфор, калий, сера, хлор, натрий, магний, цинк, железо, медь, иод, марганец, вольфрам, молибден, кобальт, кремний. Роль и значение остальных элементов изучены недостаточно, хотя они также содержатся в тканях организма.
Четыре элемента составляют органическую основу живых организмов. Это кислород, углерод, водород и азот, процентное содержание которых составляет соответственно 62, 43 %, 21,15 %, 9,86% и 3,10 %. Остальные макро-, микро- и ультрамикроэлементы принято считать минеральными.
Больше всего минеральных веществ содержится в костях (48— 74 % общей массы) и хрящах (2—10 %). Остальные органы и ткани содержат небольшое количество минеральных веществ.
В клетках и тканях организма минеральные вещества находятся как в свободном, так и в связанном состояниях. В костях, хрящах и дентине зубов, например, они находятся в виде прочных нерастворимых соединений — неорганических солей угольной, фосфорной и других кислот. В свободном состоянии, а также в виде ионов минеральные вещества содержатся в биологических жидкостях — крови, лимфе, пищеварительных соках.
Значительная часть элементов входит в состав растворимых неорганических соединений, которые участвуют в регуляции осмотического давления. Натриевые и калиевые соли фосфорной и угольной кислот образуют с белками тканей и крови буферные системы, участвуя в поддержании постоянства рН среды в тканях и клетках.
Ионы неорганических веществ определяют физико-химические свойства коллоидов организма — явления гидратации, вязкость, растворимость, способность к набуханию и др. Некоторые минеральные вещества, например серная кислота, участвуют в нейтрализации ядовитых продуктов.
Особенно велика роль химических элементов, являющихся активаторами или парализаторами действия ферментов или участвующих в формировании их третичной и четвертичной структуры. Ионы металла, вступая во взаимодействие с различного рода функциональными группами аминокислот, расположенных в разных местах молекулы фермента, стабилизируют ее третичную и четвертичную структуры, поддерживая тем самым специфическую геометрическую конфигурацию активного центра (рис. 50, а). Кроме того, ионы металлов могут взаимодействовать также с отдельными функциональными группами аминокислот самого активного центра (рис. 50, б) и удерживать таким образом его определенную геометрическую конфигурацию, а вместе с тем третичную и четвертичную структуры молекулы фермента в целом.

Рис. 50. Функции металла (Me) в ферментных системах.
В качестве примеров участия ионов металлов в формировании и стабилизации третичной и четвертичной структур ферментов можно привести стабилизацию структуры α-амилазы и трипсина ионами Са 2+ , ксантиноксидазы — ионами Сu 2+ , креатинкиназы — ионами Mg 2+ , пируваткарбоксилазы — ионами Мn 2+ и т.д.
Все биогенные элементы делят на макро-, микро- и ультрамикроэлементы. Макроэлементы содержатся в организме в количестве от 10 -2 % и выше. К ним относятся кальций, калий, фосфор, натрий, сера, хлор, магний. К микроэлементам относятся железо, цинк, фтор, молибден, медь, бром, кремний, иод, марганец, алюминий, свинец и др. Их количество в организме составляет от 10 -3 до 10 -5 %.
Ультрамикроэлементы — вольфрам, хром, никель, цинк, барий, серебро и многие другие — составляют порядка 10 -6 % и меньше.
Читайте также:


