Способ передачи информации между нервными клетками
Нейрон- нервная клетка, основная функциональная и структурная единица нервной системы; принимает сигналы, поступающие от рецепторов. Нейрон перерабатывает их и в форме нервных импульсов передаёт к эффекторным нервным окончаниям, контролирующим деятельность исполнительных органов. Для восприятия информации развились ветвящиеся отростки — дендриты, обладающие избирательной чувствительностью к определённым сигналам.Процессы местного возбуждения и торможения с рецепторной мембраны, суммируясь, воздействуют на триггерную (пусковую) область — наиболее возбудимый участок поверхностной мембраны нейрона, служащий местом возникновения распространяющихся биоэлектрических потенциалов. Для их передачи служит длинный отросток — аксон. Достигнув концевых участков аксона, импульс нервный возбуждает секреторную мембрану, вследствие чего из нервных окончаний секретируется физиологически активное вещество — медиатор или нейрогормон. Сложность и многообразие функций нервной системы определяются взаимодействием между нейронами, которое, в свою очередь, представляют собой набор различных сигналов, передаваемых в рамках взаимодействия нейронов с другими нейронами или мышцами и железами. Сигналы испускаются и распространяются с помощью ионов, генерирующих электрический заряд, который движется вдоль нейрона. Передача информации в мозг при восприятии звука, прикосновения, запаха или зрительного образа требует последовательного вовлечения нейрона за нейроном, так же как и при выполнении простого произвольного движения.Информация от клетки к клетке передается через синапсы. Анализатор– совокупность центральных и периферических образований, воспринимающих и анализирующих изменения окружающей среды и внутренней среды организма. Периферический отдел анализатора представлен рецепторами . Рецепторы улавливают изменения показателей текущего состояния, а затем проводят первичный анализ информации: сравнивают полученные значения с генетически запрограммированными. Полученная информация через проводниковое звено анализатора посредством нервной, гормональной, метаболической систем регуляции передается в центры головного мозга отвечающие за сознание. Информация анализируется, после чего вырабатывается управляющий сигнал, поступающий посредством нервных, гормональных, метаболических механизмов к эффекторам. Эффекторы под влиянием управляющего воздействия корригируют параметры текущего состояния, подстраивая их до нормальных значений, что фиксируется рецепторами. В ответ на раздражение в рецепторах кодируется качественная характеристика раздражителя, сила, время и локализация его действия, а также месторасположение источника воздействия в окружающем пространстве. В проводниковом отделе анализатора при передаче сигнала от одного нейрона к другому происходит смена информационного кода. Таким образом, информация о внешнем стимуле многократно кодируется и перекодируется, пока сигнал возбуждения не достигнет центрального отдела анализатора. Отметим, что смысловое значение передаваемого сигнала обычно остается прежним, и лишь при определенных негативных обстоятельствах содержание информации может искажаться. Для каждого раздражителя эволюция нашла свой оптимальный способ передачи информации. Для многих нервных волокон была установлена логарифмическая зависимость между интенсивностью раздражителя и частотой вызываемых им вынужденных колебаний. В процессе передачи информации могут принимать участие одновременно множество рецепторов и нервных волокон . Ансамбль нейронов – это группа нейронов, имеющая общий для них раздражитель. Д. Хебб высказал предположение, что информация передается исключительно через возбуждение группы нейронов, он предложил рассматривать ансамбль нейронов в качестве основного способа кодирования и передачи информации. Такой способ передачи информации вполне надежен, так как не зависит от состояния одного нейрона. Нейроны - специализированные клетки, способные принимать, обрабатывать, кодировать, передавать и хранить информацию, организовывать реакции на раздражения, устанавливать контакты с другими нейронами, клетками органов. Уникальными особенностями нейрона являются способность генерировать электрические разряды и передавать информацию.
Способы: 1. Синаптическая передача 2.ИЭА
Действие медиатора на постсинаптическую мембрану заключается в повышении ее проницаемости для ионов натрия Возникновение потока ионов Иа + из синаптической щели через постсинаптическую мембрану ведет к ее деполяризации и вызывает генерацию возбуждающего постсинаптического потенциала (ВПСП).
Считается, что переносчиком инф-ции яв-ся ПД, однако это не так (ПД один, инф-я различна, работает по з-ну все или ничего, скоросьт невысокая 30-120млс, не обладает св-вом быстродействия, не объясняет явление биорадиосвязи). Все это объясняет ИЭА-колебания м-ны нейронов (2,5мв-амплитуда, когда ПД 120 мв). Частоты от 0,3 до 70 имп/сек.(часто реагирует на состояние орг-мя: 10-12имп/с-норма, до 4-адаптация). Может распространяться на расстояния от мкм до км. Энергетика не завист от митохондр.акт-ти. Высок скорость. ИЭА возникает благодаря О2 и АФК- обеспечивают возн-ние ИЭзарядов, создают электрон-возбужденное состояние(ЭВС). При переходе О2 до ОН (одноэлектронный путь вос-ния О2 образуется 8 эВ(160ккал-16м-л АТФ). АФК вызывают открытие-закрытие м-н. Низк конц-я АФК-ад-ция, высок-патология. ЭВС сопровождаются акустическими импульсами.
Последнее изменение этой страницы: 2016-08-06; Нарушение авторского права страницы
- 3651
- 2,3
- 1
- 7
![]()
Олег Жуков
![]()
Анна Петренко![]()
Андрей Панов




Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (
10 имп./с) и быстрые (
40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (
Нейроны центральной нервной системы разделяются на активирующие (образуют активирующие синапсы) и тормозящие (образуют тормозящие синапсы). Последние в значительной степени представлены интернейронами, или промежуточными нейронами. В коре больших полушарий и гиппокампе они ответственны за формирование гамма-ритмов мозга [15], которые обеспечивают слаженную, синхронную работу других нейронов. Это крайне важно для моторных функций, восприятия сенсорной информации, формирования памяти [9], [11].
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Потенциал действия
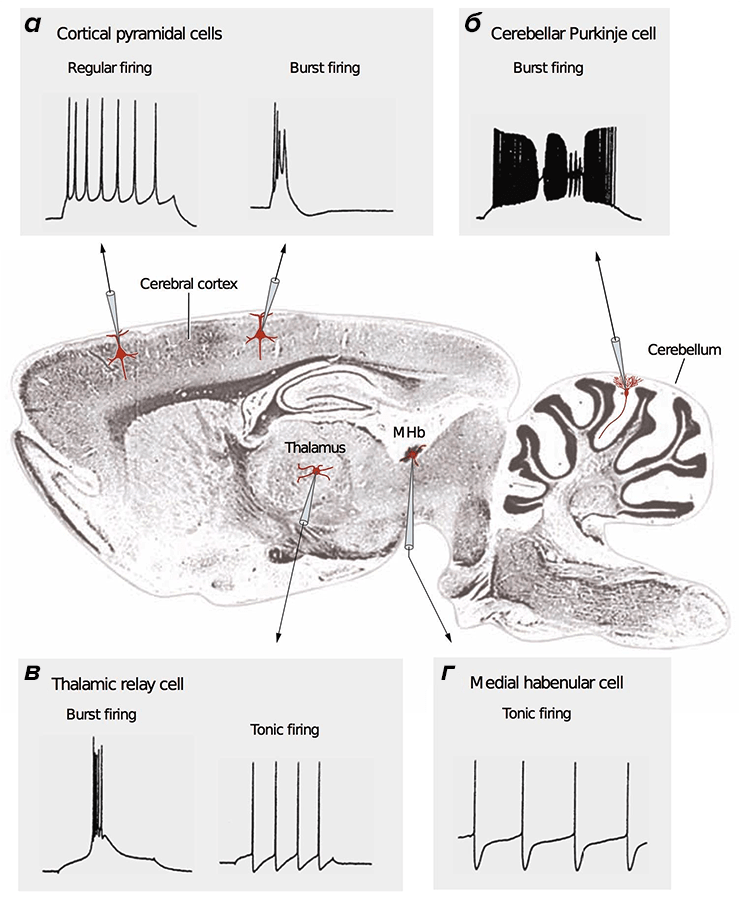
Рисунок 2. Разные типы нейронов генерируют различные сигналы. В центре — продольный срез мозга млекопитающего. Во вставках представлены разные типы сигналов, зарегистрированные методами электрофизиологии [15], [38]. а — Кортикальные (Cerebral cortex) пирамидальные нейроны могут передавать как низкочастотные сигналы (Regular firing), так и короткие взрывные, или пачечные, сигналы (Burst firing). б — Для клеток Пуркинье мозжечка (Cerebellum) характерна только пачечная активность на очень высокой частоте. в — Релейные нейроны таламуса (Thalamus) имеют два режима активности: пачечный и тонический (Tonic firing). г — Нейроны средней части поводка (MHb, Medial habenula) эпиталамуса генерируют тонические сигналы низкой частоты.
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
- Мембрана и ионы. Плазматическая мембрана нейрона поддерживает неравномерное распределение веществ между клеткой и внеклеточной средой (рис. 3б) [31–33]. В числе этих веществ есть и маленькие ионы, из которых для описания ПД важны К + и Nа + .
Ионов Na + внутри клетки мало, снаружи — много. Из-за этого они постоянно стремятся попасть в клетку. Напротив, ионов К + много внутри клетки, и они норовят из нее выйти. Самостоятельно ионы этого сделать не могут, потому что мембрана для них непроницаема. Для прохождения ионов через мембрану необходимо открывание специальных белков — ионных каналов мембраны.
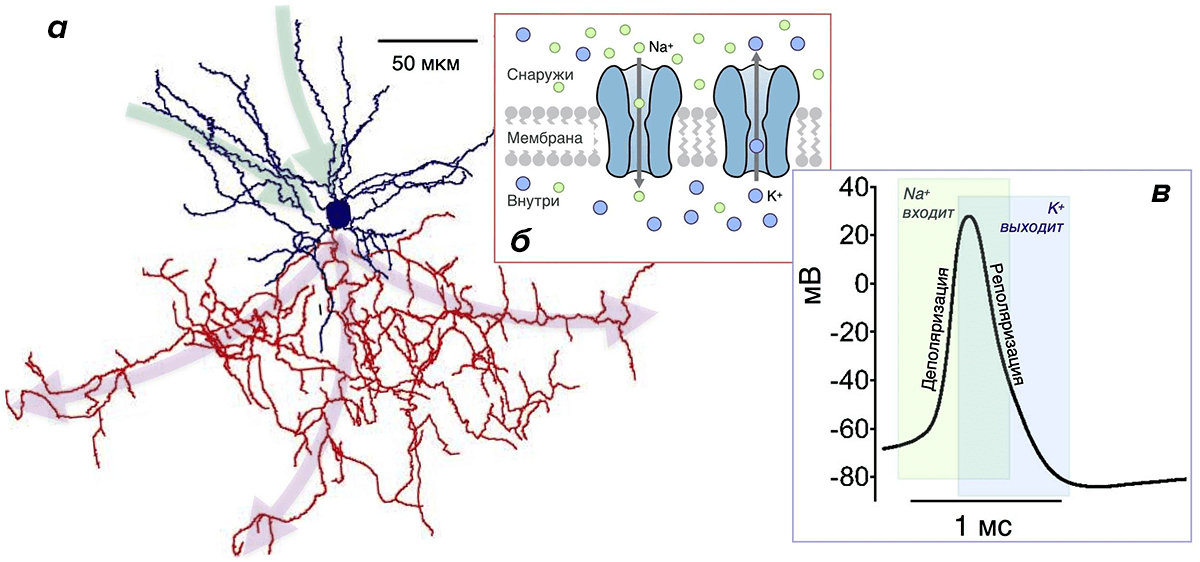
Рисунок 3. Нейрон, ионные каналы и потенциал действия. а — Реконструкция клетки-канделябра коры головного мозга крысы. Синим окрашены дендриты и тело нейрона (синее пятно в центре), красным — аксон (у многих типов нейронов аксон разветвлен намного больше, чем дендриты [8], [11], [35]). Зеленые и малиновые стрелки указывают направление потока информации: дендриты и тело нейрона принимают ее, аксон — отправляет ее к другим нейронам. б — Мембрана нейрона, как и любой другой клетки, содержит ионные каналы. Зеленые кружки — ионы Na + , синие — ионы К + . в — Изменение мембранного потенциала при генерации потенциала действия (ПД) нейроном Пуркинье. Зеленая область: Na-каналы открыты, в нейрон входят ионы Na + , происходит деполяризация. Синяя область: открыты К-каналы, К + выходит, происходит реполяризация. Перекрывание зеленой и синей областей соответствует периоду, когда происходит одновременный вход Na + и выход К + .
ПД — это относительно сильное по амплитуде скачкообразное изменение мембранного потенциала.
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
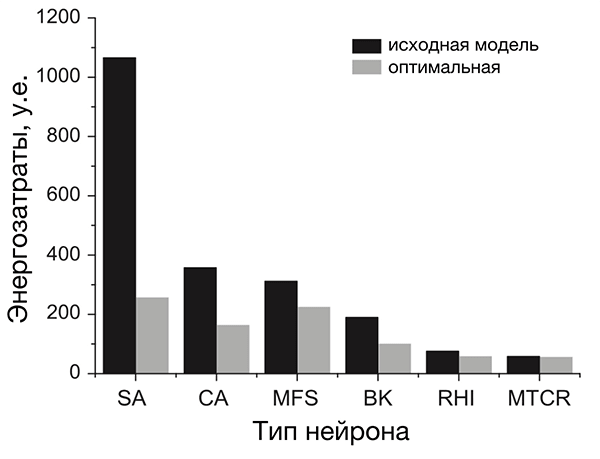
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Нейроны несут ответственность за передачу информации по всему организму. Используя электрические и химические сигналы, они помогают координировать все необходимые функции жизни. В этой статье мы объясняем, что такое нейроны и как они работают.
Короче говоря, наша нервная система обнаруживает, что происходит вокруг нас и внутри нас; она решает, как мы должны действовать, изменять состояние внутренних органов (например, изменения сердечного ритма), и позволяет нам думать и помнить, что происходит. Для этого она полагается на сложную сеть – нейроны.
Было подсчитано, что в мозге насчитывается около 86 миллиардов нейронов; для достижения этой огромной цели развивающийся плод должен создавать около 250 000 нейронов в минуту.
Каждый нейрон связан с еще 1000 нейронами, создавая невероятно сложную сеть связи. Нейроны считаются основными единицами нервной системы.
Нейроны, иногда называемые нервными клетками, составляют около 10% головного мозга; остальное состоит из глиальных клеток и астроцитов, которые поддерживают и питают нейроны.
Как выглядят нейроны?
Нейроны можно увидеть только с помощью микроскопа и можно разделить на три части:
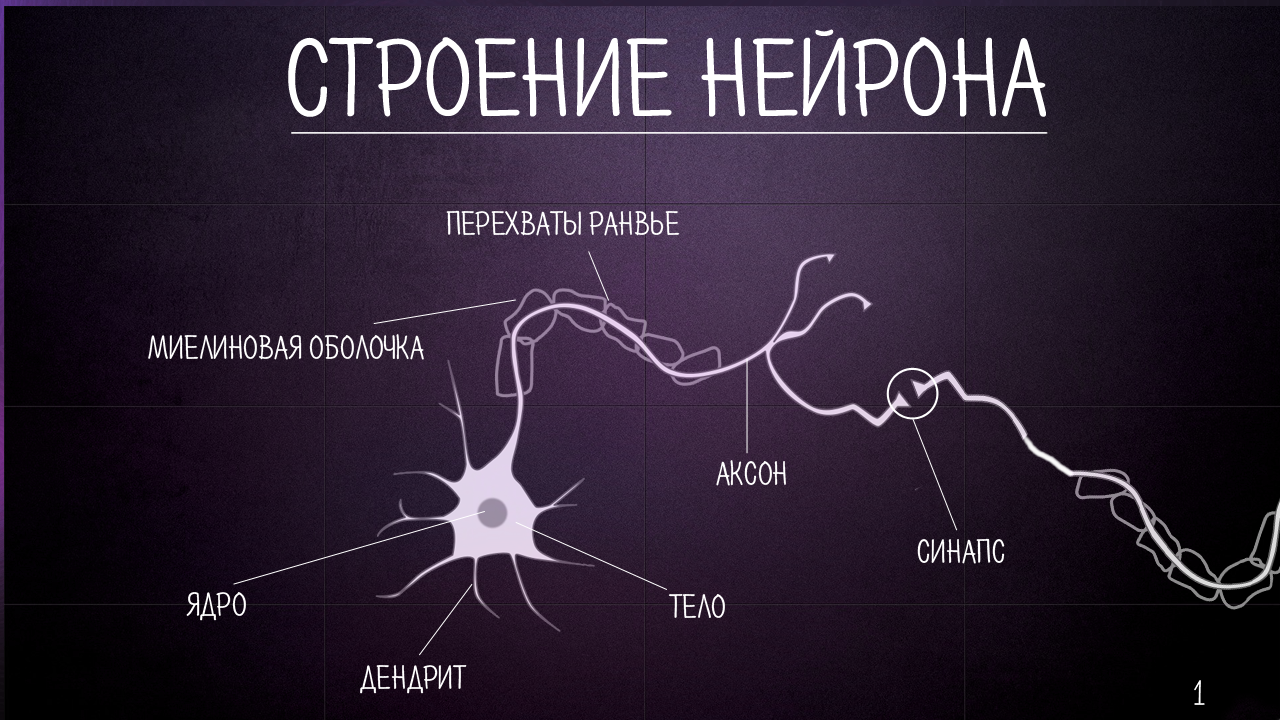
Как дендриты, так и аксоны иногда называют нервными волокнами.
Аксоны сильно различаются по длине. Некоторые из них могут быть крошечными, тогда как другие могут иметь длину более 1 метра. Самый длинный аксон называется ганглием дорсального корня (ГДК), кластером тел нервных клеток, который переносит информацию с кожи в мозг. Некоторые из аксонов в ГДК путешествуют от пальцев до мозга, до 2 метров в высоком человеке.
Типы нейронов
Нейроны можно разделить на типы по-разному, например, по соединению или функции.
Соединение
Эфферентные нейроны – они принимают сообщения от центральной нервной системы (головного и спинного мозга) и доставляют их клеткам в других частях тела.
Афферентные нейроны – принимают сообщения от остальной части тела и доставляют их в центральную нервную систему (ЦНС).
Интернейроны – эти передают ретрансляционные сообщения между нейронами в ЦНС.
Функция
Сенсорные – переносят сигналы от органов чувств к ЦНС.
Реле – переносит сигналы из одного места в другое в ЦНС.
Мотор – переносит сигналы от ЦНС к мышцам.
Как нейроны передают сообщение?
Если нейрон получает большое количество входов от других нейронов, эти сигналы складываются до тех пор, пока они не превысят определенный порог.
Как только этот порог будет превышен, нейрон запускается, чтобы послать импульс вдоль его аксона – это называется потенциалом действия.
Потенциал действия создается движением электрически заряженных атомов (ионов) через мембрану аксона.
Нейроны в состоянии покоя более отрицательно заряжены, чем окружающая их жидкость; это называется мембранным потенциалом. Это обычно -70 милливольт (мВ).
Когда тело клетки нерва получает достаточное количество сигналов, чтобы вызвать его действие, часть аксона, ближайшего к клеточному телу, деполяризуется – мембранный потенциал быстро поднимается, а затем падает (примерно через 1000 секунд). Это изменение вызывает деполяризацию в разрезе аксона рядом с ним и т. д. пока подъем и падение заряда не пройдут по всей длине аксона.
После того, как каждый раздел был задействован, он переходит в краткое состояние гиперполяризации, где его порог понижен, а это означает, что он, маловероятно будет запущен снова, сразу.
Чаще всего это калий (K+) и натрий (Na+) ионы, которые генерируют потенциал действия. Ионы движутся и выходят из аксонов через потенциал-зависимые ионные каналы и насосы.
Это краткий процесс:
- Открываются каналы Na+, позволяющие Na+ проникать в клетку, делая ее более положительной.
- Как только клетка достигает определенного заряда, каналы K+ открываются, что позволяет K+ вытекать из клетки.
- Затем каналы Na+ закрываются, но каналы K+ остаются открытыми, позволяя положительному заряду покинуть клетку. Мембранный потенциал падает.
- Когда мембранный потенциал возвращается в состояние покоя, каналы K+ закрываются.
- Наконец, натрий-калийный насос переносит Na+ из клетки и K+ обратно в клетку, готовую к следующему потенциалу действия.
Миелин
Большинство аксонов покрыто белым восковым веществом, называемым миелином.
Это покрытие изолирует нервы и увеличивает скорость движения импульсов.
Миелин создан клетками Шванна в периферической нервной системе и олигодендроцитами в ЦНС.
В миелиновом покрытии имеются небольшие промежутки, называемые узлами Ранвье. Потенциал действия перескакивает из зазора в зазор, что позволяет значительно ускорить движение сигнала.
Рассеянный склероз вызван медленным разрушением миелина.
Как работают синапсы
Нейроны связаны друг с другом и тканями, чтобы они могли передавать сообщения; однако они физически не соприкасаются – всегда существует разрыв между клетками, называемый синапсом.
Синапсы могут быть электрическими или химическими. Другими словами, сигнал, который переносится из первого нервного волокна (пресинаптический нейрон) в следующий (постсинаптический нейрон), передается электрическим сигналом или химическим.
Химические синапсы
Как только сигнал достигает синапса, он вызывает высвобождение химических веществ (нейротрансмиттеров) в промежуток между двумя нейронами; этот промежуток называется синаптической щелью.
Нейротрансмиттер диффундирует через синаптическую щель и взаимодействует с рецепторами на мембране постсинаптического нейрона, вызывая ответ.
Химические синапсы классифицируются в зависимости от высвобождаемых ими нейротрансмиттеров:
Глутаматергический – высвобождает глутамин. Они часто возбуждающие, что означает, что они, скорее всего, вызовут потенциал действия.
ГАМКергические – высвобождает ГАМК (гамма-аминомасляная кислота). Они часто ингибируют, что означает, что они уменьшают вероятность того, что постсинаптический нейрон будет задействован.
Холинергический – высвобождает ацетилхолин. Они обнаружены между моторными нейронами и мышечными волокнами (нервно-мышечный переход).
Адренергический – высвобождает норадреналин (адреналин).
Электрические синапсы
Электрические синапсы встречаются реже, но встречаются в ЦНС. Каналы, называемые щелевыми соединениями, прикрепляют пресинаптические и постсинаптические мембраны. В щелевых переходах пост и пресинаптические мембраны сближаются друг с другом, чем в химических синапсах, что означает, что они могут передавать электрический ток напрямую.
Электрические синапсы работают намного быстрее, чем химические синапсы, поэтому их обнаруживают в местах, где необходимы быстрые действия, например, в оборонительных рефлексах.
Химические синапсы могут вызывать сложные реакции, но электрические синапсы могут давать только простые ответы. Однако, в отличие от химических синапсов, они двунаправленные – информация может поступать в любом направлении.
В двух словах
Нейроны являются одним из самых увлекательных типов клеток в организме человека. Они необходимы для каждого действия, которое выполняет наше тело и мозг. Именно сложность нейронных сетей дает нам наши личности и наше сознание. Они отвечают за самые основные действия и самые сложные. От автоматических рефлекторных действий до глубоких мыслей о Вселенной, нейроны покрывают все это.
Передача информации в нервной системе
Передача информации в нервной системе
Электрические сигналы, обеспечивающие функционирование нервных клеток, опосредованы потоком ионов через водопроницаемые поры клеточной мембраны. Эти поры, образованные трансмембранными белками, называются ионными каналами. К настоящему времени разработаны высокочувствительные методы, позволяющие зарегистрировать и измерить ионные токи, протекающие через одиночные ионные каналы.
Некоторые ионные каналы избирательно проницаемы только для катионов, тогда как другие проводят только анионы. Катионные каналы могут быть высоко избирательными по отношению к одному иону, например натрию. Ионные каналы совершают переходы между открытым и закрытым состоянием и имеют, как правило, характерное время открытого состояния. Их вклад в ионный ток через клеточную мембрану определяется относительным количеством времени, которое они находятся в открытом состоянии.
Открытие канала регулируется различными механизмами. Некоторые из этих механизмов физические, такие как растяжение мембраны или изменения мембранного потенциала. Другие механизмы химические, включающие связывание активных молекул (лигандов) с активным центром, который располагается либо с внеклеточной, либо с внутриклеточной стороны канала.
Важным свойством каналов, в дополнение к кинетике открытия и закрытия, является способность открытого канала проводить ионный ток. Один из способов, которым ионы могут проникать через открытый канал, является простая диффузия. Другой способ – взаимодействие ионов с внутриканальными центрами связывания и перескакивание внутри водной поры от одного центра к другому. В любом случае движение иона через канал является пассивным и определяется градиентом концентрации и градиентом электрического потенциала на мембране.
Количество тока, проходящего через открытый канал по электрическому градиенту, зависит от проницаемости канала для данного типа ионов. Величина тока также зависит от концентрации ионов в устьях канала. Эти два фактора, проницаемость и концентрация, определяют проводимость канала.
Передача импульса в нервной системе опосредуется изменениями мембранного потенциала. В сенсорных нейронах адекватный стимул, такой как прикосновение, звук, свет, вызывает локальную деполяризацию (делая мембранный потенциал менее негативным) или гиперполяризацию (мембранный потенциал становится более негативным). Подобным же образом нейротрансмиттеры в синапсах вызывают деполяризацию или гиперполяризацию постсинаптической клетки. Потенциалы действия, представляющие собой короткие деполяризационные сигналы большой амплитуды, проводят по отросткам нейрона информацию из одного отдела нервной системы в другой.
Все эти изменения мембранного потенциала вызваны движением ионов через клеточную мембрану. Например, направленное внутрь клетки движение положительно заряженных ионов натрия снижает общий отрицательный заряд мембраны или, другими словами, вызывает деполяризацию. Наоборот, результатом движения положительно заряженных ионов калия из клетки является рост общего отрицательного заряда, то есть гиперполяризация. Гиперполяризация может быть обусловлена также движением внутрь клетки отрицательно заряженных ионов хлора.
Как движутся ионы через клеточную мембрану и чем их движение регулируется? Главным путем для быстрого перемещения ионов внутрь клетки и из нее являются ионные каналы. Ионные каналы представляют собой встроенные в мембрану молекулы белка, которые образуют поры, проницаемые для ионов. Ионные токи регулируются через открытие и закрытие этих ионных каналов. Знание механизмов работы ионных каналов позволяет понять, как генерируются электрические сигналы.
Свойства ионных каналов. Клеточная мембрана нервной клетки
Клеточные мембраны состоят из жидкой фазы липидов и встроенных в липиды белковыхмолекул. Молекулы липидов организованы в двухслойную мембрану (бислой) толщиной около 6 нм. Полярные гидрофильные головки липидов обращены к поверхностям мембраны, а гидрофобные хвосты вытянуты к середине бислоя. Липиды плохо пропускают воду и практически непроницаемы для ионов. Белковые молекулы частично погружены в слой липидов, либо с внеклеточной, либо с цитоплазматической стороны. Некоторые белки целиком пронизывают мембрану. Именно пронизывающие мембрану (трансмембранные) белки образуют ионные каналы. Основные ионы, участвующие в генерации электрических сигналов, такие как калий, натрий, кальций или хлор, движутся через ионные каналы пассивно благодаря градиенту концентраций и электрическому потенциалу мембраны.
Другие трансмембранные белки служат в качестве насосов и переносчиков, обеспечивающих транспорт веществ через клеточную мембрану против электрохимических градиентов. Транспортные механизмы поддерживают ионный состав цитоплазмы, удаляя или возвращая те ионы, которые прошли клеточную мембрану по их электрохимическим градиентам. Они также выполняют важную функцию переноса через клеточные мембраны субстратов метаболических реакций, таких как глюкоза и аминокислоты
Для ионных каналов функционально важными являются переходы между открытым и закрытым состояниями. Эти переходы совершаются практически моментально. С другой стороны, при системном изучении поведения любого ионного канала мы обнаружим, что время открытого состояния варьирует случайным образом. Иногда канал открыт только одну миллисекунду или даже меньше, хотя в следующий раз он может быть открыт на гораздо более продолжительное время. Тем не менее, каждый канал имеет характерное среднее время открытого состояния (т), и все вариации происходят вокруг этого среднего показателя.
Некоторые ионные каналы открываются достаточно часто даже в покое. Иными словами, вероятность нахождения таких каналов в открытом состоянии в неактивированной клетке относительно высока. Большинство таких ионных каналов проницаемо для калия или хлора. Они важны для генерации мембранного потенциала покоя. Остальные ионные каналы при этом закрыты, то есть вероятность нахождения их в открытом состоянии очень низка. Активация этих каналов адекватным стимулом резко увеличивает вероятность открытия. Этот же стимул может деактивировать ионные каналы, бывшие активными в покое. Важно помнить, что активация или деактивация канала означает возрастание или снижение вероятности открытия канала, но не увеличение или уменьшение времени открытого состояния (т) канала.
Помимо активации и деактивации, ионный ток через каналы регулируется двумя другими факторами. Первый фактор заключается в том, что ионный канал переходит в новое конформационное состояние, в котором обычный активирующий стимул не способен вызвать открытие канала. Для ионных каналов, активируемых деполяризацией, такое состояние называется инактивацией. Для каналов, отвечающих на химические стимулы, это состояние известно как десенситнзация. Второй механизм – блок открытого канала. Такое случается, когда, например, крупная молекула (такая как токсин) связывается с ионным каналом и физически закупоривает пору. Другим примером может служить блокирование некоторых катионных каналов ионами магния. В этом случае ионы магния сами не проникают через ионный канал, но связываются с каналом в области его устья и тем самым мешают проникновению других катионов.
Некоторые каналы специфически отвечают на физические изменения в клеточной мембране нейрона. Наиболее яркими представителями этой группы являются потенциал-активируемые каналы. Примером может служить чувствительный к потенциалу натриевый канал, который отвечает за регенеративную деполяризацию, лежащую в основе генерации потенциала действия. К этой группе относятся также механочувствительные ионные каналы, которые отвечают на механическое воздействие на клеточную мембрану. Рецепторы растяжения, содержащие ионные каналы такого рода, найдены в механорецепторах кожи.
Другие ионные каналы открываются тогда, когда химические агенты активируют связывающие центры на молекуле канала. Такие лиганд-активируемые ионные каналы подразделяются на две подгруппы, в зависимости от того, являются ли активные центры внутриклеточными или внеклеточными. Каналом, отвечающим на внеклеточную активацию, является катионный канал постсинаптической мембраны в скелетной мышце. Этот канал активируется нейротрансмиттером ацетилхолином, освобождающимся из двигательного нервного окончания. Открытие ацетилхолин-активируемого ионного канала позволяет ионам натрия войти в клетку, вызывая деполяризацию мышечного волокна.
Лиганд-активируемые каналы, отвечающие на внутриклеточные стимулы, включают каналы, чувствительные к местным изменениям концентрации специфических ионов. Например, кальций-активируемые калиевые каналы активируются локальным повышением концентрации внутриклеточного кальция. Такие каналы играют важную роль в реполяризации клеточной мембраны во время завершения потенциала действия. Помимо ионов кальция, типичными представителями лигандов, активирующих ионные каналы с цитоплазматической стороны мембраны, являются циклические нуклеотиды. Циклический ГМФ, например, отвечает за активацию натриевых каналов в палочках сетчатки. Такой тип канала играет принципиальную роль в работе зрительного анализатора.
Эта классификация не является достаточно строгой. Например, кальций-активируемые калиевые каналы чувствительны также к изменению потенциала, а некоторые потенциал-активируемые ионные каналы чувствительны к внутриклеточным лигандам.
Для измерения ионных токов через одиночные каналы первоначально был предложен непрямой метод анализа мембранного шума. Затем был разработан способ прямой регистрации одиночных ионных каналов с помощью метода, который называется пэтч-кламп (patch-clamp). В совокупности эти подходы дали прямые ответы на вопросы, касающиеся функции ионных каналов, как то: какой заряд проходит через одиночный канал? как долго канал остается открытым? как время нахождения ионного канала в открытом или закрытом состоянии зависит от мембранного потенциала?
Таким образом, пэтч-кламп метод предоставляет новые уникальные возможности для изучения поведения ионных каналов. Во-первых, изоляция маленького участка мембраны позволяет наблюдать активность всего нескольких ионных каналов, а не тысяч, которые активируются в целой клетке. Во-вторых, высокое сопротивление контакта дает возможность регистрировать даже крайне одиночных ионных каналов и можем провести анализ кинетики каналов.
До разработки пэтч-кламп метода свойства ионных каналов в клеточных мембранах исследовались в экспериментах, в которых для измерения мембранного потенциала или мембранного тока использовались стеклянные микроэлектроды. Использование Лингом и Джерардом в 1949 году стеклянных микроэлектродов для внутриклеточной регистрации ионных токов в живых клетках было не менее важным событием, чем введение пэтч-кламп метода три десятилетия спустя. Этот метод обеспечивал точное измерение мембранного потенциала покоя клетки, потенциала действия, а также ответов на синаптическую активацию мышечных волокон и нейронов.
Метод внутриклеточной регистрации. Острая стеклянная микропипетка, диаметр кончика которой не превышает 0,5 мкм, заполненная концентрированным солевым раствором (например, 3 M KC1), служит электродом и присоединяется к вольтметру для записи потенциала. Момент прокалывания пипеткой клеточной мембраны, приводящий к проникновению ее в клеточную цитоплазму, проявляется мгновенным появлением потенциала, соответствующего мембранному потенциалу покоя. При удачном проникновении в клетку мембрана обхватывает внешнюю поверхность пипетки, благодаря чему цитоплазма остается изолированной от внеклеточной жидкости.
Используя известную из физики технику анализа шума, Катц и Миледи смогли получить информацию о среднестатистическом поведении отдельного ионного канала, активируемого АХ. Позднее подобные эксперименты были проведены на том же объекте Anderson и Stevens. В отличие от предшественников, эти исследователи измеряли мембранный ток, вызванный АХ, что позволило установить величину и продолжительность ионных токов через одиночный канал.
Принципы анализа шума достаточно просты: во-первых, если токи одиночного канала являются большими, суммарный шум также будет большим. Во-вторых, ионные каналы, открывающиеся на относительно длительное время, будут продуцировать низкочастотный шум; наоборот, каналы, открывающиеся на короткое время, будут продуцировать высокочастотный шум. Исследование амплитудно-временных характеристик шумов, активированных АХ в нервно-мышечном синапсе, показало, что через одиночный открытый ионный канал проходит около 10 миллионов ионов в секунду. Кроме того, выяснилось, что значение среднего открытого времени ионного канала составляет от 1 до 2 мс.
Несмотря на широкое вытеснение пэтч-кламп методом, анализ шума до сих пор используется для изучения ионных каналов в клетках, которые не поддаются исследованию с помощью пэтч-клампа, например, в некоторых областях центральной нервной системы. Кроме того, анализ шума является сравнительно быстрым методом для получения информации о свойствах большой популяции каналов и используется в комбинации с пэтч-кламп регистрацией от целой клетки для идентификации типов каналов. Тем не менее, надо понимать, что с помощью анализа шума невозможно получить детальную информацию о поведении одиночного канала, особенно в каналах со сложной кинетикой или при наличии нескольких уровней проводимости канала.
Кинетическое поведение канала, то есть время его нахождения в закрытом и открытом состояниях, может предоставить информацию о механизмах открытия и закрытия канала, а также о константах скоростей этих процессов. С другой стороны, величина тока, проходящего через ионный канал, является прямым отражением того, как быстро проникающие ионы движутся через канал. Ток ионов зависит не только от свойств канала, но также от трансмембранного потенциала. На этом рисунке изображен фрагмент мембраны, который содержит один спонтанно активный ионный канал, проницаемый для калия. Растворы, как в пипетке, так и в ванночке для объекта, содержат одинаковую (150 ммоль) концентрацию ионов калия. Ионы калия через открытый канал могут двигаться в обоих направлениях. Однако поскольку концентрации ионов по обе стороны мембраны идентичны, а трансмембранный потенциал отсутствует, то нет никакого движения ионов ни в одном Пэтч-кламп метод имеет достоинство, которое еще не было упомянуто: мы можем менять потенциал на регистрирующей пипетке и варьировать, таким образом, трансмембранную разность потенциалов. Например, при мембранном потенциале +20 Мв каждое открытие калиевого ионного канала сопровождается током, направленным наружу. Это связано с тем, что положительно заряженные ионы калия двигаются через канал по электрическому градиенту между раствором в пипетке и в ванночке. С другой стороны, когда внутри пипетки создан отрицательный потенциал величиной в -20 мВток направлен в обратном направлении (через открытый канал в пипетку).
Зависимость тока является линейной: ток (I), проходящий через канал, пропорционален потенциалу (V): 
Это формула представляет собой преобразованный закон Ома. Константа 7 называется проводимостью канала. При одном и том же потенциале на мембране канал с высокой проводимостью переносит много тока, канал с низкой проводимостью проводит малый ток.
Проводимость измеряется в сименсах (См). В нейронах трансмембранный потенциал обычно выражается в милливольтах (1 мВ = 10 –3 В), токи одиночных ионных каналов в пикоамперах (1 пА = 10 –12 А), проводимость в пикосименсах (1 пСм = 10 –12 См). потенциал +20 мВ продуцировал ток около 2,2 пА, соответственно проводимость канала (I/V) составила 2,2 пА/20 мВ = 110 пСм
Электрические сигналы в нервной системе генерируются движением ионов через мембрану нервной клетки. Эти ионные токи протекают через водные поры трансмембранных белков, известных как ионные каналы.
Каналы различаются по своей избирательности: некоторые катионные каналы пропускают только натрий, калий или кальций, другие являются менее избирательными. Анионные каналы сравнительно не избирательны для малых анионов, но они пропускают в основном ионы хлора, так как хлор является самым распространенным анионом внеклеточной и внутриклеточной жидкостей.
Крутько В.Н., Славин М.Б., Смирнова Т.М. Математические основания геронтологии.
Реутов В.П. и др. Проблема оксида азота в биологии и медицине и принцип цикличности.
Методология биологии: новые идеи (синергетика, семиотика, коэволюция). Ред. Баксанский О.Е.
Читайте также:





