Тремор ригидность акинезия что такое

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
В узком смысле под гипокинезией подразумевают экстрапирамидное расстройство, при котором несостоятельность движений проявляется в их недостаточной продолжительности, скорости, амплитуде, снижении количества участвующих в них мышц и степени разнообразия двигательных актов.
Начальные стадии паркинсонизма, вопреки распространённому мнению, в высшей степени трудны для диагностики. В некоторых публикация, к сожалению, не совсем точно описываются критерии диагностики синдрома паркинсонизма.
Для диагноза истинного синдрома паркинсонизма необходимо обязательное наличие гипокинезии плюс, по крайней мере, ещё одного из трёх симптомов: мышечной ригидности, тремора покоя низкой частоты или постуральных нарушений.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Основные причины акинетико-ригидного синдрома:
Поскольку примерно 80 % всех случаев синдрома паркинсонизма относятся к идиопатическому паркинсонизму, то есть к болезни Паркинсона, знание современных критериев диагностики болезни Паркинсона уже обеспечивает правильное распознавание этиологии большинства случаев паркинсонизма. Общепринятые критерии диагностики болезни Паркинсона предполагают трёхэтапную диагностику:
- 1-й этап - распознавание синдрома паркинсонизма,
- 2-й этап - поиск симптомов, исключающих болезнь Паркинсона и
- 3-й этап - выявление симптомов, подтверждающих болезнь Паркинсона.
Диагностические критерии болезни Паркинсона (по: Hughes et al., 1992)
Критерии исключения болезни Паркинсона:
- Анамнестические указания на повторные инсульты со ступенеобразным прогрессированием симптомов паркинсонизма, повторные черепно-мозговые травмы или достоверный энцефалит.
- Окулогирные кризы.
- Лечение нейролептиками перед дебютом болезни.
- Длительная ремиссия.
- Строго односторонние проявления в течение более 3-х лет.
- Супрануклеарный паралич взора.
- Мозжечковые знаки.
- Раннее появление симптомов выраженной вегетативной недостаточности.
- Раннее появление выраженной деменции.
- Симптом Бабинского.
- Наличие церебральной опухоли или открытой (сообщающейся) гидроцефалии.
- Негативная реакция на большие дозы Л-ДОФА (если исключена мальабсорбция).
- Интоксикация МФТП (метил-фенил-тетрагидро-пиридин).
Подтверждающие критерии болезни Паркинсона. Необходимо три критерия или больше для достоверного диагноза болезни Паркинсона:
- Одностороннее начало проявлений болезни.
- Наличие тремора покоя.
- Постоянная асимметрия с более выраженными симптомами на стороне тела, с которой началась болезнь.
- Хорошая реакция (70-100%) на Л-ДОФА.
- Прогрессирующее течение заболевания.
- Наличие выраженной дискинезии, индуцированной Л-ДОФА.
- Откликаемость на Л-ДОФА в течение 5 лет и более.
- Длительное течение заболевания (10 лет и более).
Негативные критерии важны тем, что напоминают врачу о необходимости исключения болезни Паркинсона, если больной, например, не откликается на лечение с помощью Л-ДОФА, отличается ранним развитием деменции или ранними постуральными нарушениями и и падениями и т.д.
В силу практической значимости диагноза сосудистого паркинсонизма (часто наблюдается его гипердиагностика) упомянем принципы его диагностики.
Необходимым условием диагностики сосудистого паркинсонизма является наличие сосудистого заболевания головного мозга (гипертоническая болезнь, артериосклероз, васкулит), подтверждённого данными КТ или МРТ (множественные лакунарные инфаркты, реже единичный контралатеральный инфаркт, болезнь Бинсвангера, расширение периваскулярных пространств, амилоидная ангиопатия и др.). Характерно подострое или острое начало заболевания (но может быть и постепенным), флюктуирующее течение, наличие симптомов дисциркуляторной энцефалопатии (пирамидные, псевдобульбарные, мозжечковые, чувствительные, психические нарушения), преобладание симптомов паркинсонизма на нижней половине тела, грубая дисбазия, отсутствие тремора, неоткликаемость на дофасодержащие препараты (как правило).
Болезнь Бинсвангера чаще сопровождается симптомами, лишь напоминающими паркинсонизм, но возможно развитие и истинного синдрома паркинсонизма.
В клинической неврологии синдромальный диагноз предшествует топической и этиологической диагностике. Распознавание синдрома паркинсонизма предполагает прежде всего дифференциальный диагноз с псевдопаркинсонизмом. Псевдопаркинсонизм - условный и собирательный термин, который в данном контексте объединяет группу неврологических и психопатологических синдромов, не имеющих отношения к паркинсонизму, но иногда напоминающих его теми или иными клиническими проявлениями. В качестве таких клинических проявлений могут выступать психомоторная заторможенность, напряжение мышц (stiffness), апраксия ходьбы и некоторые другие неврологические синдромы.
Синдромы психомоторной заторможенности:
- Депрессивный ступор.
- Кататонический ступор.
- Органический ступор.
- Гиперсомния.
- Гипотиреоз.
- Гипо-и гипертиреоз.
- Психогенный паркинсонизм.
Синдромы мышечного напряжения (Stiffness):
Синдромы апраксии ходьбы:
- Нормотензивная гидроцефалия.
- Прогрессирующий супрануклеарный паралич.
- Другие дегенеративно-атрофические процессы в мозге.
- Процессы, ограничивающие пространство (опухоли, субдуральная гематома).
- Посттравматическая энцефалопатия.
- Лакунарное состояние.
- Изолированный синдром апраксии ходьбы.
Синдромы смешанной природы:
- Синдром запертого человека.
- Синдром акинетического мутизма.
- Синдром ригидного позвоночника.
- Синдром болезненной ноги и движущихся пальцев.
- Злокачественный нейролептический синдром.
- Синдром злокачественной гипертермии.
- Идиопатическая сенильная дисбазия.
Во всем мире от болезни Паркинсона (БП) страдает более 1% населения старше 65 лет. Основная причина болезни Паркинсона — гибель нигростриарных нейронов с последующим снижением количества дофамина в полосатом теле. [ 18 F]флюородопа — вещество с умеренной радиоактивностью, которое после внутривенного введения способно к связыванию с дофаминовыми рецепторами полосатого тела. У пациентов с симптомами БП при ПЭТ определяют выраженное снижение связывания [ 18 F]флюородопы с дофаминовыми рецепторами (и, соответственно, снижение числа самих рецепторов).
[Иофлупан-I-123 — это радиофармпрепарат, представляющий собой аналог кокаина, который поглощают нейроны полосатого тела. Его захват можно оценить при помощи однофотонной эмиссионной компьютерной томографии (БРЕСТ) головного мозга; подобный метод исследования помогает обследовать пациентов с подозрением на болезнь Паркинсона]. В результате у пациентов повышается активность полосатого тела, а прямой двигательный путь начинает преобладать над непрямым.
Для появления первых признаков заболевания необходима гибель около 60% нейронов верной субстанции. Задержка в развитии симптомов связана с (а) повышением продукции дофамина оставшимися нейронами; (б) повышением экспрессии дофаминовых рецепторов нейронами полосатого тела (положительная регуляция).
Для болезни Паркинсона (БП) характерны следующие симптомы/признаки: тремор, брадикинезия, ригидность и нарушение постуральных рефлексов. Однако все симптомы одновременно проявляются не у всех пациентов.
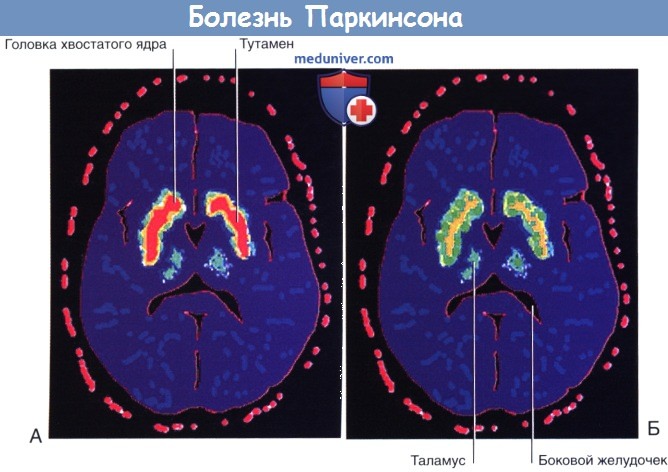
Результаты сканирования головного мозга после внутривенного введения [ 18 F]флюородопы.
Интенсивность поглощения отображена красным (максимальная), желтым, зеленым и синим (минимальная) цветами.
(А) Здоровый человек. (Б) Болезнь Паркинсона.
а) Тремор. Тремор, имеющий частоту 3—6 Гц в одной конечности, — первый симптом болезни у двух третей пациентов. Выраженность тремора не коррелирует с другими двигательными симптомами БП; также тремор не прогрессирует с той же скоростью, что и брадикинезия, ригидность или нарушения походки. Чаще всего тремор сначала появляется в одной из рук, затем в течение 1 года начинает страдать нога с этой же стороны, затем в течение еще трех лет тремор появляется на противоположной стороне. Отчетливо определяют тремор губ и языка, постоянные пронацию и супинацию предплечий, сгибание и разгибание пальцев.
Тремор связан с ритмичным возбуждением нейронов всех пяти клеточных групп прямого пути двигательной петли и нейронов переднего рога спинного мозга. Ниже будет описано, как нарушение аутогенного торможения приводит к проявлению тремора покоя и ригидности.
Небольшой тремор действия обычно можно наблюдать у пациентов с выраженным тремором покоя; как правило, он более выражен на той же стороне, где сильнее проявляется тремор покоя. Сильнее всего тремор действия проявляется в пальцах кисти при полностью вытянутых руках. Одно из его проявлений—нарушение почерка. Следует отметить, что при отсутствии тремора покоя наличие небольшого тремора действия свидетельствует о доброкачественном эссенциаль-ном треморе (см. далее).
Ранее для устранения ригидности прибегали к хирургическому пересечению задних нервных корешков. Это доказывает, что ригидность имеет периферическое чувствительное происхождение. Ригидность также можно устранить путем хирургического разрушения бледного шара или ВЛЯ таламуса. Поскольку при болезни Паркинсона не происходит усиления сгибательных рефлексов, внимание исследователей сосредоточено на афферентных волокнах сухожильного органа Гольджи, отвечающего за аутогенное торможение. Эти афферентные волокна образуют синапсы с тормозными вставочными нейронами 1b, которые активируются во время мышечного сокращения и подавляют активность мотонейронов, иннервирующих эту же мышцу и все гомонимные мышцы (т. е. нервный импульс, возникший в сухожильном органе двуглавой мышцы плеча, будет тормозить нейроны самого бицепса и плечевой мышцы).
У пациентов с болезнью Паркинсона (БП) эндогенное торможение снижено, оно замедляется до такой степени, что начинает смешиваться со стимулами, нисходящими от головного мозга, в результате чего усугубляется тремор. Нарушение торможения также способствует и развитию ригидности, поскольку при болезни Паркинсона во время движения может происходить одновременное сокращение основной мышцы и ее антагониста.
В норме волокна корково-спинномозгового и ретикуло-спинномозгового путей постоянно активируют тормозные вставочные нейроны 1b. При болезни Паркинсона активация первичной двигательной коры за счет ДМО снижена и происходит неравномерно, поэтому и появляются характерные симптомы со стороны руки и кисти. Нарушение работы ретикуло-спинномозгового пути, вероятно, сильнее влияет на состояние мышц нижних конечностей.
От нейронов скорлупы проекции отходят не только к бледному шару, но и к ГАМК-ергическим нейронам, в первую очередь, нейронам СЧЧС. Компактная часть черной субстанции также отдает волокна к сетчатой части. Последняя, в свою очередь, имеет связи с локомоторным центром ствола мозга. Один из ожидаемых вторичных эффектов повышенной активности скорлупы при болезни Паркинсона — торможение нервных импульсов, идущих от локомоторного центра к волокнам ретикуло-спинномозгового пути моста и продолговатого мозга.
Один из ранних симптомов болезни Паркинсона — сложности при письме. Отдельные буквы становятся мелкими и неровными. Нарушение письма, вероятно, связано с одновременным сокращением сгибателей и разгибателей кисти, которое возникает из-за выраженного нарушения супраспинальной активации вставочных нейронов 1а, образующих синапсы с мотонейронами мышц-антагонистов.
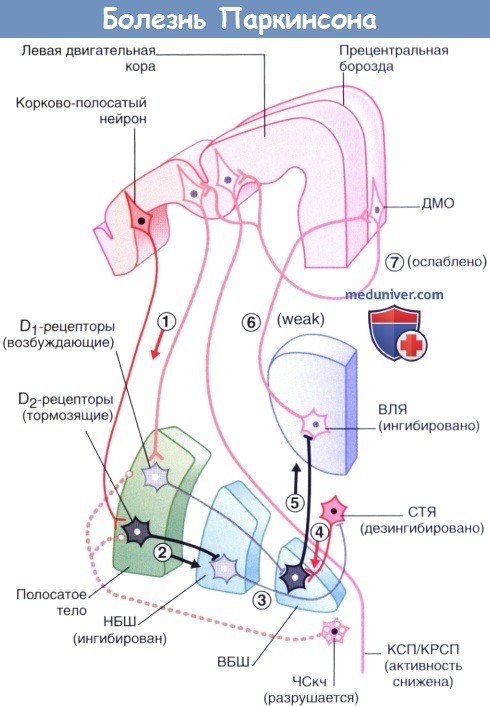
Последствия разрушения пути от компактной части черной субстанции (ЧСкч) до полосатого тела (П) при болезни Паркинсона.
Клинические проявления болезни становятся следствием нарушения тонического возбуждения шипиковых нейронов полосатого тела, экспрессирующих D1-рецепторы, а также следствием нарушения тонического ингибирования нейронов, экспрессирующих D2-рецепторы.
Целостность прямого пути нарушена, активным по умолчанию становится непрямой путь.
(1) Корково-полосатый нейрон активирует ГАМК-ергические нейроны (2) полосатого тела, которые образуют синапсы с нейронами (3) наружного сегмента бледного шара (НБШ).
В результате такого двойного эффекта происходит дезингибирование субталамического ядра (СТЯ).
Нейроны СТЯ влияют на (4) ГАМК-ергические нейроны внутреннего сегмента бледного шара (ВБШ), которые затем воздействуют на (5) вентральное латеральное ядро (ВЛЯ) таламуса, в результате чего снижается передача нервного импульса таламо-корковых волокон, (6) идущих к дополнительной моторной области (ДМО).
Сигналы (7) от ДМО к волокнам корково-спинномозгового и корково-ретикуло-спинномозгового путей (КСП/КРСП) становятся все слабее, в результате чего у пациента появляются сложности с началом движений и их выполнением.
в) Брадикинезия. Под брадикинезией понимают замедление движений. Пациенты жалуются на то, что повседневные действия, например открывание двери, начинают требовать тщательного планирования и сознательного контроля. При электромиографии мышц конечностей определяют снижение начальной электрической активности мышц-агонистов, которая в норме возникает при первом сокращении соответствующих мышц. В норме базальные ганглии начинают контролировать двигательный акт через миллисекунды после того, как премоторная кора и мозжечок подняли частоту генерации потенциала действия нейронами двигательной коры до уровня, необходимого для активации нижних мотонейронов спинного мозга. При болезни Паркинсона нервные импульсы, идущие к мотонейронам спинного мозга, становятся слабее из-за сниженного влияния ДМО.
1. Доброкачественный эссенциапьный тремор, который очень часто принимают за БП, встречают в два раза чаще БП. Сначала это заболевание проявляется лишь небольшим тремором, который лучше всего заметен при полностью вытянутых руках. Позднее появляются дрожание головы (не характерное для болезни Паркинсона) и ортостатический (проявляющийся в положении стоя) тремор туловища. Из-за тремора диафрагмы может развиться вокальный тремор. Иногда доброкачественный эссенциальный тремор называют семейным, поскольку его наследуют по аутосомно-доминантному механизму; чаще всего он проявляется на пятом десятилетии жизни. Эссенциальный тремор, наблюдаемый у пожилых, раньше называли сенильным.
Причина заболевания неизвестна. Леводопа (L-допа, см. далее) неэффективна, хотя у больных с болезнью Паркинсона она облегчает оба вида тремора.
В руководствах по клинической неврологии описаны и другие заболевания со схожей клинической картиной, например прогрессирующий надъядерный паралич и корково-базальная дегенерация.
е) Лечение болезни Паркинсона:
1. Консервативное. Наиболее эффективный метод лечения болезни Паркинсона — прием L-допы. Этот препарат проникает через гематоэнцефалический барьер и затем выжившими нейронами черной субстанции метаболизируется в дофамин. Назначение L-допы эффективно примерно у 75% пациентов, выраженность симптомов снижается на 50% и более. Спустя несколько лет приема у пациентов могут развиваться побочные эффекты терапии, в том числе спонтанные хореиформные движения, вызванные чрезмерной активацией полосатого тела. Спустя год и более, по мере прогрессирующей гибели нейронов черной субстанции, эффективность L-допы начинает снижаться. В этом случае для стимуляции постсинаптических дофаминовых рецепторов полосатого тела можно использовать агонисты дофамина (иногда их применяют в качестве терапии первой линии в надежде уменьшить выраженность или замедлить появление побочных эффектов L-допы).
Антихолинергические препараты снижают активность холинергических вставочных нейронов полосатого тела. Они способны снижать выраженность обоих видов тремора, но необходимые для этого дозы могут вызывать побочные реакции со стороны вегетативной нервной системы.
2. Хирургическое лечение болезни Паркинсона. В настоящее время оптимальным методом хирургического лечения болезни Паркинсона считают высокочастотную (133 Гц) стимуляцию СТЯ посредством имплантируемых электродов. Однако механизм(ы) действия этого способа лечения полностью не установлены. При помощи высокочастотной стимуляции удается уменьшить проявления тремора, брадикинезии и ригидности у пациентов с болезнью Паркинсона. Часто стимуляцию необходимо проводить с двух сторон. Посредством введения электродов в СТЯ можно судить о его когнитивных и поведенческих функциях. Подобные изменения, не относящиеся к двигательной сфере, наблюдают при установке электродов в вентральные отделы СТЯ.
Следовательно, в пределах СТЯ имеются различные функциональные отделы. Другой возможный участок стимуляции при болезни Паркинсона — ножкомостовое ядро. Стимуляцию ВБШ в последнее время используют редко.
К другим методам лечения, эффективность которых только определяют, относят использование черной субстанции плода в качестве трансплантата, введение в полосатое тело факторов роста, генотерапию.
Редактор: Искандер Милевски. Дата публикации: 23.11.2018
Тремор (дрожание) - непроизвольные насильственные ритмичные колебательные движения части тела вокруг фиксированной точки в пространстве, которые вызываются сокращениями групп мышц-антагонистов. Тремор преобладает в структуре непроизвольных движений человека и по локализации относится к гиперкинезам преимущественно стволового уровня. Тремор является полиэтиологическим синдромом и встречается в клинической практике врачей многих специальностей (неврологов, эндокринологов, психиатров и т.д.). Тремор имеет две основные характеристики: частота колебаний и их амплитуда, определяемая величиной смещения части тела вокруг фиксированной точки.
По частоте колебаний дрожание может быть условно разделено на 3 группы:
- низкочастотное (3-5 Гц),
- среднечастотное (5-8 Гц),
- высокочастотное (9-12 Гц).
По амплитуде дрожание делится на:
- низкоамплитудное,
- среднеамплитудное,
- высокоамплитудное.
Выделяют фокальный либо генерализованный тремор, при котором одновременно поражаются конечности, голова, нижняя челюсть, голосовые связки, язык. Подобные нарушения существенно ухудшают качество жизни и адаптацию этих пациентов в обществе.
В клинической работе невролога практическое значение имеет выделение следующих видов тремора: покоя, постурального и кинетического. Тремор покоя (статический тремор) имеет частоту 3-6 Гц и наиболее характерен для болезни Паркинсона или дегенеративных заболеваний ЦНС. Постуральный (антигравитационный) тремор характеризуется частотой 5-9 Гц, выявляется в положении с вытянутыми вперед руками и имеет место при синдроме отмены алкоголя, некоторых лекарственных препаратов, при обменных нарушениях, а также может быть психогенным или физиологическим. Кинетический тремор имеет частотную характеристику 3-10 Гц, подразделяется на тремор сокращения, проявляющийся при изометрическом напряжении мышц (при сжатии кисти в кулак) и интенционный тремор, возникающий при целенаправленном движении конечности (например, при выполнении пальценосовой пробы). Этот тип характерен для тремора Минора, поражения ствола мозга или мозжечка различного генеза (рассеянный склероз, опухоль, гематома). Вариантом кинетического тремора является task-specific tremor (тремор при выполнении определенного действия), появляющийся при выполнении точных мелких движений, таких как застегивание украшений, работа с маленькими деталями и т.п.
Клинические проявления тремора
Клинические проявления тремора полиморфны и встречаются при широком круге неврологических заболеваний. По этиологическому принципу виды тремора подразделяются на:
Физиологические: нормальный и усиленный тремор.
Патологические виды тремора:
- эссенциальный (наследственный и спорадический);
- паркинсонический;
- дистонический;
- мозжечковый (интенционное дрожание);
- тремор Холмса (среднего мозга или рубральный);
- невропатический;
- психогенный.
Физиологический тремор (асимптомное дрожание) встречается у любого здорового человека при волнении, характеризуется частотой 8-12 Гц в руках и менее чем 6,5 Гц в других частях тела. Усиленный физиологический тремор отличается от физиологического большей амплитудой и чаще встречается при гиперадренергических состояниях (эмоциональный стресс, эндокринные нарушения), во время приема ряда лекарственных препаратов или алкоголя. Особенностью данного вида тремора является его значительное уменьшение или полное исчезновение при назначении β-блокаторов.
Патологический тремор. Наиболее распространенной причиной патологического тремора является эссенциальный тремор Минора, частота и степень выраженности которого увеличивается с возрастом. Этот вид может быть как наследственным (аутосомно-доминантный тип наследования с вариабельной пенетрантностью) и, соответственно, проявляться в нескольких поколениях одной семьи, так и манифестироваться спорадически у членов одной семьи. Частота эссенциального тремора составляет 4-11 Гц и зависит от того, какой сегмент тела поражен. Проксимальные сегменты характеризуются низкими частотами, дистальные - более высокими. Наиболее часто поражается голова и/или кисти рук. Для данного вида тремора характерен постуральный и кинетический компонент. Тремор Минора может представлять самостоятельную нозологическую форму, реже - сопровождать различные нарушения движений, например паркинсонизм или фокальную дистонию.
Ортостатический тремор является редким расстройством движения. Характеризуется дрожанием ног в положении стоя и исчезает при ходьбе, сидении или в положении лежа. Отличительной особенностью данного вида тремора является его высокая частота: 14-16 Гц. В положении стоя у пациента может определяться подергивание четырехглавой мышцы бедра.
Дистонический тремор представляет собой дрожание части тела, в которой локализован дистонический синдром. Для данного вида тремора характерна нерегулярная амплитуда и вариабельная частота, часто - подверженность модулирующему влиянию позы.
При треморе Холмса (рубральном треморе) представлены все 3 основных типа дрожания, которые отличаются степенью выраженности. Данный тип возникает при повреждениях среднего мозга (инсульт, ЧМТ, опухоль или рассеянный склероз). Его частота составляет 2-5 Гц.
Мозжечковый (интенционный) тремор является кинетическим и проявляется при выполнении произвольного акта. Его развитие связано с нарушением корригирующего влияния мозжечковых систем на двигательный акт вследствие повреждений, локализующихся в латеральных мозжечковых ядрах или в верхней ножке мозжечка, либо в местах их соединений. При поражении срединных структур мозжечка развивается тремор в руках, голове и туловище. При клиническом осмотре выраженность тремора различается от небольших толчкообразных движений, до крупных, переходящих в мозжечковую хорею или асинергию.
Невропатический тремор имеет место при врожденных или приобретенных невропатиях и клинически напоминает эссенциальный тремор. Причиной дрожания является нарушение проприоцептивной чувствительности. Характерной чертой невропатического тремора является его усиление при выполнении задания (пальценосовой пробы и др.) с закрытыми глазами.
Психогенный тремор - наиболее сложный вид дрожания, поскольку требует исключения его органической природы. Данный вид может быть постуральным, а может проявляться в покое или при движении. Клинически психогенный тремор характеризуется внезапным началом, спонтанной ремиссией, стационарным течением и неклассифицируемыми видами тремора.
Диагностика тремора
Диагностика тремора основана на объективных тестах и инструментальных методах исследования. К широко известным объективным тестам относятся: рисование спирали, наливание воды из чаши, шкалы оценки тремора, тест лабиринта Гибсона. Инструментальные методы исследования включают позитронно-эмиссионную томографию, поверхностную электромиографию (ЭМГ), оптические методики и акселерометрию. Позитронно-эмиссионная томография позволяет с помощью меченых изотопов (F 18 , O 15 ) проследить за изменением уровня регионарного кровотока и оценить локализацию вовлечения нейронов. Поверхностная суммарная ЭМГ регистрирует запись залпов определенной частоты и амплитуды, которые чередуются с участками изолинии. Оптические методики основаны на использовании источника света и регистрирующего устройства.
Современным методом регистрации тремора является акселерометрия. Методика основана на использовании специальных датчиков - акселерометров, измеряющих линейное ускорение, характерное для всех движений (кроме случаев с постоянной скоростью). Получаемые сигналы с помощью аналогово-цифрового устройства преобразуются в цифровые и поступают в компьютер. Специальными программами производится их обработка, что позволяет построить графическую зависимость перемещения датчиков во времени, уточнить частотную и амплитудную характеристику движения.
Лечение тремора
Выделяют этиотропное, патогенетическое и симптоматическое лечение тремора. В современной клинической практике наиболее распространена симптоматическая терапия дрожания, выбор которой зависит от типа тремора.
Препаратами выбора коррекции кинетического тремора являются β-блокаторы, бензодиазепины или вальпроаты. Механизм воздействия β-блокаторов (анаприлин, пропранолол) на дрожание окончательно не изучен. Препарат назначают в начальной дозе 10 мг 3 раза в день, с постепенным повышением до максимальной дозы 240 мг/сут. По данным Koller W. C., пропранолол в дозе 160 мг/сут уменьшает амплитуду тремора на 50-70%. Среди недостатков лечения β-блокаторами - относительно высокая частота отмены лечения (в основном из-за возникновения повышенной утомляемости и брадикардии) и невозможность резкого прекращения их приема. Бензодиазепины (диазепам, клоназепам) воздействуют на тремор за счет своего противосудорожного и миорелаксирующего эффектов. Дозировка подбирается индивидуально и обычно составляет 4-6 мг/сут. Побочными эффектами бензодиазепинов являются головокружение, сонливость, возможное привыкание. Соли вальпроевой кислоты (производные натриевой и кальциевой соли) оказывают влияние на тремор посредством воздействия на обмен гамма-аминомасляной кислоты. Их суточная доза составляет 300-600 мг/сут. Побочные эффекты этих медикаментов - тошнота и диарея.
С целью влияния на тремор покоя применяют антихолинергические препараты, агонисты дофаминовых рецепторов, L-допа-содержащие препараты, амантадины. Антихолинергические препараты (тригексифенидил, бипериден) обладают центральным и периферическим холинолитическим эффектом, могут назначаться в дозировке 1-2 мг 3 раза в сутки. Применяются, прежде всего, у пациентов молодого и среднего возраста. В настоящее время циклодол редко используют в связи с его частыми побочными эффектами (сухость во рту, запоры, задержка мочеиспускания, психотические нарушения). Агонисты дофаминовых рецепторов (мирапекс, проноран, апоморфин) воздействуют на тремор путем прямой стимуляции специфических Д1, Д2, Д3 рецепторов, обеспечивают равномерный синтез и высвобождение дофамина, не индуцируют антиоксидантный стресс. Лечение начинают с малых доз с постепенным наращиванием дозы до 150 мг/сут. В последние годы начал применяться метод введения апоморфина с помощью особой помпы, эффективность которого сопоставима с нейрохирургическим вмешательством. L-допа-содержащие препараты (наком, мадопар, синдопа, синемет) представляют собой метаболические предшественники дофамина. Эффективность их воздействия на дрожание существенно меньше, чем на ригидность и акинезию. Средняя терапевтическая доза составляет 500-750 мг/сут. Увеличение дозы приводит к моторным флюктуациям и дискинезиям. Амантадины (ПК-Мерц, мидантан) с успехом применяются для лечения акинезии и ригидности у пациентов с болезнью Паркинсона и симптоматическим паркинсонизмом. Нам не встретилось работ о влиянии амантадинов на паркинсонический тремор. Поэтому в июне - ноябре 2006 г. на базе 2-го неврологического отделения 5-й городской клинической больницы г. Минска нами проведено клиническое исследование по оценке эффективности инфузионной формы ПК-Мерца на дрожание в комплексном лечении болезни Паркинсона.
На фоне проводимой терапии наряду с регрессом экстрапирамидной ригидности и гипокинезии у 3 пациентов (10%) достигнуто полное исчезновение постурального тремора и тремора покоя. Еще у 6 пациентов (20%) было отмечено исчезновение постурального дрожания и уменьшение тремора покоя. В 16 случаях (53,3%) - одновременное значительное уменьшение тремора покоя и постурального тремора (амплитуда дрожания уменьшилась более чем на 50% согласно данным акселерометрии). Влияния препарата на частоту паркинсонического дрожания во время лечения зафиксировано не было.
Результаты влияния препарата на амплитуду дрожания приведены на рисунке: до лечения амплитуда тремора покоя в исследуемой группе составила: медиана - 272 ед.; 25-й перцентиль - 112 ед.; 75-й перцентиль - 611 ед.; среднее отклонение - 641. После лечения амплитуда тремора достоверно уменьшилась: медиана - 73 ед.; 25-й перцентиль - 29 ед.; 75-й перцентиль - 149 ед.; среднее отклонение - 134 (p
Отсутствие эффекта от всех видов консервативного лечения во всем мире является показанием для нейрохирургического вмешательства. Паллидарная стимуляция и стимуляция субталямического ядра являются в настоящее время наиболее современными хирургическим вмешательствами для уменьшения тремора.
Таким образом, тремор является наиболее частым проявлением гиперкинетического синдрома, обладает существенным клиническим полиморфизмом, затрудняющим его диагностику. Существенную пользу в распознавании тремора приносят инструментальные методы. Одним из современных методов регистрации дрожания является акселерометрия. Подход медика к лечению тремора должен быть дифференцированным, индивидуальным и ступенчатым. В терапии паркинсонического дрожания показано применение инфузионной формы препарата ПК-Мерц. При отсутствии эффекта прибегают к политерапии или нейрохирургическому вмешательству.
Читайте также:


