Тремор тела при бас
Боковой амиотрофический склероз — самая распространенная форма болезни двигательного нейрона, которая является нейродегенеративным заболеванием, поражающим двигательные нейроны в головном и спинном мозге
- Общая информация о болезни
- Виды болезни двигательного нейрона
- ПЛС
- ПМА
- Симптомы БАС
- Причины БАС
- Почему я и факторы риска
- Наследственность
- Причины гибели нейронов
- Подозреваете БАС?
- Диагностика БАС
- Развитие болезни
- Генетические исследования
- Лечение БАС
- Рилузол
- Эдаравон
- Маситиниб (масивет)
- Альтернативное лечение
- Стволовые клетки
Возможно, вы ощущаете сами или наблюдаете у близкого некоторые симптомы, указывающие на болезнь двигательного нейрона, и вас это беспокоит. Ниже приведен список наиболее часто задаваемых вопросов людьми, которые думают, что у них БАС.
- Я чувствую подергивания мышц. Значит ли это, что у меня БАС?
- Я ощущаю покалывание и онемение в ладонях и/или ступнях. Это симптом БАС?
- Я очень устаю, как будто нет энергии, и при этом у меня наблюдаются подергивания мышц. Это БАС?
- Я время от времени спотыкаюсь, и одна из моих ног кажется тоньше другой, следует ли мне обратиться к врачу? В целом я чувствую себя хорошо.
- Мои руки ослабли и потеряли гибкость, мне трудно поворачивать ключ во входной двери. Может ли это быть симптомом БАС?
Фасцикуляции мышц ощущают примерно 70% людей. Иногда подергивания ограничиваются одной частью тела, в других случаях происходят в нескольких областях одновременно. Фасцикуляции могут быть следствием стресса, вирусной инфекции или различных внутренних болезней. Они также могут возникать по неизвестным причинам, и многие люди ощущают их каждый день на протяжении большей части жизни. Подергивания связаны с неврологическим заболеванием только при наличии других симптомов.
Покалывание и онемение могут быть связаны с некоторыми неврологическими заболеваниями, но БАС к ним не относится. Если этот симптом беспокоит постоянно, стоит обратиться к терапевту, который при наличии показаний выдаст направление к неврологу.
БАС действительно может заставит людей чувствовать усталость и сонливость, но данная болезнь обычно сопровождается и другими симптомами. Если дело только в изнеможении и подергивании мышц, то фасцикуляции, возможно, являются ответом тела на усталость. Необходимо проконсультироваться с врачом, он сможет провести обследования для выявления причины плохого самочувствия.
Рекомендуем обратиться к терапевту, который может направить к неврологу, если почувствует, что проблема носит именно неврологический характер. Слабость в ногах не означает что у человека БАС, так как подобный симптом может быть вызван многими заболеваниями.
Слабость в руках, возможно, указывает на неврологическую проблему, но она также может быть следствием преклонного возраста и проблем с суставами или случайного защемления нерва. Если других жалоб нет, следует сходить к терапевту. В случае необходимости он направит к неврологу для проведения обследования.
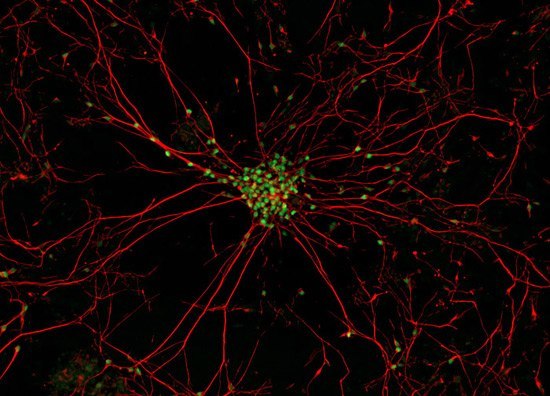
Настоящее фото мотонейрона (двигательного нейрона в передних рогах спинного мозга) - закупорка межсинаптических щелей (зелёные точки) - блокада передачи импульсов через медиаторы (вещества для передачи импульсов) в синапсы (места соединения) отростков нервных клеток.
В центре - тело мотонейрона.
Красные линии -длинные отростки мотонейрона - аксоны и короткие -дендриты.
Причина появления блокады передачи импульсов в межсинаптических щелях учёными мира не найдена. Предположительно - мутация гена,кодирующего фермент передачи этих импульсов через нейромедиаторы - супероксиддисмутазы. (СОД).
Предрасположенность к мутациям гена может иметь наследственный характер по аутосомно-рецессивному типу.
Эндемические (массовые вспышки) случаи этого заболевания зафиксированы у групп военных, живущих в островах на тихом океане. Чаще болеют мужчины от 40 до 60 лет.Следовательно не исключается инфекционная причина развития заболевания.
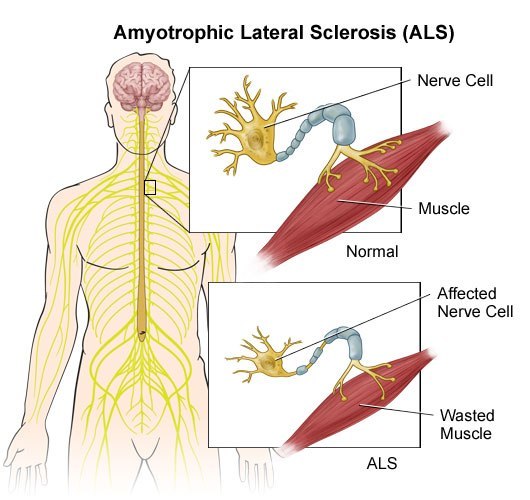
Боковой амиотрофический склероз. (БАС)..
Показано истончение нервных волокон в случае БАС и нарушение иннервации (передачи нервных импульсов) к мышцам. Как следствие - уменьшение работы мышцы и её последующая атрофия. (уменьшение размеров, обратное развитие.)
Блокада передачи нервных импульсов к мышцам (как к поперечно-полосатым которыми мы управляем сами своей волей так и к к гладким, работающим, независимо от нашего сознания, усилий и воли) пищеварительной и дыхательной системы ведёт к смерти из-за невозможности совершать эти жизненно важные моменты работы мускулатуры.
Две статьи из медицинских источников:
1) Теория аксостаза бокового амиотрофического склероза. Аксональная теория бокового амиотрофического склероза
Теория аксостаза основана на анализе патологических процессов, происходящих в аксональном транспорте мотонейронов [Chou S., 1992]. Наибольшими нейронами организма являются двигательные мотонейроны передних рогов спинного мозга и пирамвды Беца. Они должны поддерживать интеграцию дендритов, часто протяженностью более 1 см, и аксон, достигающий 100 см. В аксоне имеются непрерывные потоки, через которые клеточное тело направляет структурные и функциональные белки на периферию и получает обратные сигналы. Ортоградный транспорт бывает 2 видов: а) быстрый — 400 мм в день, идущий в обоих направлениях и транспортирующий связанные с мембраной белки и гликопротеиды, б) медленный — несколько миллиметров в день, транспортирующий сети микрофиламентов, микротрубочек, нейрофиламентов, как компонент "а" (0,1—2 мм в день), а также большой комплекс растворимых белков, как компонент "б" (2—4 мм в день). Ретроградный аксональный транспорт несет эндогенные (аминокислоты, фактор роста нервов) и экзогенные (токсин столбняка, вирус полиомиелита, простого герпеса, бешенства, лектин пероксидазы хрена и др.) субстанции от терминальных аксонов к клеточному телу со скоростью свыше 75 мм в день. Морфологические исследования аксонального транспорта в биоптатах двигательных веточек периферических нервов больных боковым амиотрофическим склерозом выявили уменьшение скорости ретроградного аксонального транспорта и, следовательно, связи терминального аксона с перикарионом [Bieuer A. et al., 1987]. В межреберных нервах больных АБС еще до развития признаков нейрональной дегенерации появляются изменения белков микротрубочек [Binet S. et al., 1988].
Улыраструктурные исследования проксимального аксона и аксонального бугорка мотонейронов переднего рога спинного мозга больных, умерших от бокового амиотрофического склероза [Sasaki S. et al., 1996], показали нарушение быстрого аксонального транспорта. Гладкий эндо-плазматический ретикулум теряет структуру: происходит скопление митохондрий, лизосом, Леви-подобных телец, эозино-фильных и гиалиновых включений, липофусциновых гранул, особенно в аксональном бугорке. Присутствие этих необычных структур является отражением дисфункции аксонального транспорта. Применительно к возможной этиологии АБС еще ранее выдвинута концепция "аксостаза" [Chou S., 1992]. Ней-ротоксические факторы путем ретроградного транспорта избирательно поражают нейрон, создавая феномен "суицидцального транспорта". Ухудшение медленного транспорта в аксоне сопровождается скоплением нейрофиламентов, набуханием проксимального аксона и последующей дистальнои аксональной атрофией, а также вторичной демиелинизацией, характерной для центральной дистальнои аксонопатии или "ретроградного умирания" — "dying back". Определенную значимость в развитии ранних морфологических изменений мотонейронов при АБС имеет теория аутоиммунитета [Smith R. et al., 1996], основанная на появлении антител к зарядам входа кальциевых каналов. Пассивный перенос фракций, содержащих иммуноглобулин, мышам вызывает изменения нервно-мышечных соединений, сходные с таковыми при спорадическом АБС. У животных эти изменения отражают расстройства внутриклеточного Са2+ гомеостаза, и раннее повреждение пластинчатого комплекса в мотонейронах в форме набухания и фрагментации. Иммуноглобулины от больных спорадическим боковым амиотрофическим склерозом вызывают зависимый от Са2+ апоптоз клеток вследствие оксидативных повреждений. Апоптоз, обусловленный иммуноглобулином от указанных больных, регулируется присутствием связанных белков, которые могут модулировать избирательную ранимость нейронов при спорадическом АБС.
2) Боковой амиотрофический склероз
Несмотря на более чем 100-летнее изучение, боковой амиотрофический склероз (БАС) остается фатальным заболеванием центральной нервной системы. Заболевание характеризуется неуклонно прогрессирующим течением с избирательным поражением верхнего и нижнего мотонейронов, что приводит к развитию амиотрофий, параличей и спастичности. До настоящего времени вопросы этиологии и патогенеза остаются невыясненными, в связи с чем не разработаны специфические методы диагностики и лечения этого заболевания. Рядом авторов отмечено повышение частоты встречаемости заболевания среди лиц молодого возраста (до 40 лет).
МКБ-10 G12.2 Болезнь двигательного неврона
ЭПИДЕМИОЛОГИЯ
Боковой амиотрофический склероз дебютирует в возрасте 40 – 60 лет. Средний возраст начала заболевания 56 лет. БАС - болезнь взрослых, и не наблюдается у лиц моложе 16 лет. Несколько чаще заболевают мужчины (отношение мужчины-женщины 1,6-3.0: 1).
БАС является спорадическим заболеванием и встречается с частотой 1,5 – 5 случая на 100 000 населения.
В 90% случаев БАС носит спорадический, а в 10% - семейный или наследственный характер как с аутосомно-доминантным (преимущественно), так и с аутосомно-рецессивным типами наследования. Клинические и патоморфологические характеристики семейного и спорадического БАС практически идентичны.
В настоящее время возраст является основным фактором риска при БАС, что подтверждается нарастанием заболеваемости после 55 лет, и в этой возрастной группе уже не наблюдается различий между мужчинами и женщинами. Несмотря на достоверную связь БАС с возрастом, старение является только одним из предрасполагающих факторов развития патологического процесса. Вариабельность заболевания как в различных возрастных группах, так и среди лиц одного возраста предполагает существование определённых факторов риска: дефицит, или наоборот, наличие определённых нейропротективных факторов, к которым в настоящее время относят: нейростероиды или половые гормоны; нейротрофические факторы; антиоксиданты.
Некоторые исследователи отмечают особо благоприятное течение заболевания у молодых женщин, что подтверждает несомненную роль половых гормонов, в особенности эстрадиола и прогестина, в патогенезе бокового амиотрофического склероза. Подтверждением этому являются: большая частота встречаемости БАС у мужчин до 55 лет (при этом у них отмечается более раннее начало и быстрое прогрессирование заболевания по сравнению с женщинами); с наступлением менопаузы женщины болеют также часто, как и мужчины; единичные случаи заболевания боковым амиотрофическим склерозом во время беременности. К настоящему времени существуют единичные работы по изучению гормонального статуса больных с боковым амиотрофическим склерозом, и ни одной, посвящённой определению концентраций гормонов у молодых пациентов.
Этиология заболевания не ясна. Обсуждается роль вирусов, иммунологических и метаболических нарушений.
В развитии семейной формы БАС показана роль мутации в гене супероксиддисмутазы-1 (Cu/Zn-супероксиддисмутазу, SOD1), 21q22-1 хромосома, выявлен также БАС, связанный с 2q33-q35 хромосомой.
Синдромы, клинически не отличимые от классического БАС, могут возникать в результате:
•опухоли большого затылочного отверстия
•спондилез шейного отдела позвоночника
•артериовенозная аномалия спинного мозга
•бактериальные - столбняк, болезнь Лайма
•вирусные - полиомиелит, опоясывающий лишай
Интоксикации, физические агенты:
•токсины - свинец, алюминий, другие металлы.
Многим знакома ситуация при которой трясёт всё тело, при этом причины непонятные и пугающие. Ощущение внутренней дрожи неприятный процесс, из-за которого у человека возникает дополнительная паника, способная только усугубить положение. У кого-то дрожь возникает довольно редко, а для некоторых людей она становится привычным и частым явлением. Когда тело трясёт по несколько раз в день, следует узнать причины и начать лечение.
Важно! В том случае, когда организм внутренне содрогнулся и тремор продолжается не более нескольких минут, опасности для здоровья нет, но если всему по телу постояннопробегает нервная дрожь, тело трясёт как в лихорадке, необходимо выяснить причину у специалиста.
Внутренняя дрожь в теле и её лечение – этот то важный вопрос, который мы и постараемся осветить в данной статье.
Внутренняя дрожь в теле: причины и симптомы
Наиболее часто встречается тремор в руках, ногах, челюсти, дрожание головы и языка. Если трясёт тело – причины могут быть самые разнообразные.
- При сильном понижении температурного режима, когда человек зябнет от холода, он начинает непроизвольно трястись;
- Высокий адреналин в крови, внутри тела причина трясучки;
- Если человек имеет те или иные заболевания соматического или неврологического свойства, также лихорадочно трясёт тело.
Нейроны, контролирующие мышцы, их тонус, позволяют удерживать тело в определённом положении. Человека начинает трясти, когда происходит сбой, нарушение или болезненное состояние одной из частей этого сложного механизма. Начинает проявляться слабость, трясётся та или иная часть организма независимо от контроля над собой. Тело трясёт и по причине некоторых патологических процессов.
Почему трясёт всё внутри, возможные болезни?
Виды напряжения при дрожи – возможные причины
Обратите внимание! Симптоматика если слегка трясёт тело, обычно проявляется сразу: тревожное состояние, страх в области желудка или внизу живота, дрожь в ногах, замирание сердца и нервозность.
Локализация возбуждения или дрожи осуществляется в самых различных местах, от внутренних органов, до всех конечностей, ищите причину:
Диагностика и способы лечения
Просто так ничего не бывает, и если человек испытывает периодический дискомфорт, мешающий ему нормально жить, следует как можно раньше, выявить этиологию и причину болезни. Отчего трясёт тело и происходит сильное нервное перенапряжение, приводящее к расстройствам в виде гудения, тремора или дрожи поможет понять комплексное обследование.
При неврозе и других отягчающих симптомах пациента направляют:
- На ЭЭГ, УЗИ и ЭКГ – направляет терапевт или кардиолог;
- РЭГ сосудов – сосудистый хирург или лечащий терапевт;
- Эхо – ЭГ, МРТ головного мозга – прерогатива невропатолога;
- На лабораторное подробное исследование анализов крови и мочи.
Может потребоваться помощь гематолога, эндокринолога, психотерапевта, они способны понять причину и устранить её.
Лечебный курс зависит от причины, вызывающей нервное состояние на основе:
- Седативных препаратов;
- Витаминных и минеральных комплексов;
- Антидепрессантов;
- Гормональных средств;
- Психотерапевтических процедур;
- За счёт устранения факторов, вызывающих провокацию, причина дрожи исчезает.
Пустырник, боярышник, валериана, пион и все седативные лекарства являются щадящими народными средствами, когда трясёт тело.
Антидепрессанты показаны, когда трясёт тело, но только после назначения врача при депрессивных состояниях, по причине тревоги и фобии. К ним относятся: Амитриптилин, Флуоксетин, Сертралин, Азафен.
Витамины В, А, С, Д, кальций, селен, магний.
Важно! Занятия спортом, йогой и медитацией служат защитой организма от нервных расстройств.
Тремор (дрожание) - непроизвольные насильственные ритмичные колебательные движения части тела вокруг фиксированной точки в пространстве, которые вызываются сокращениями групп мышц-антагонистов. Тремор преобладает в структуре непроизвольных движений человека и по локализации относится к гиперкинезам преимущественно стволового уровня. Тремор является полиэтиологическим синдромом и встречается в клинической практике врачей многих специальностей (неврологов, эндокринологов, психиатров и т.д.). Тремор имеет две основные характеристики: частота колебаний и их амплитуда, определяемая величиной смещения части тела вокруг фиксированной точки.
По частоте колебаний дрожание может быть условно разделено на 3 группы:
- низкочастотное (3-5 Гц),
- среднечастотное (5-8 Гц),
- высокочастотное (9-12 Гц).
По амплитуде дрожание делится на:
- низкоамплитудное,
- среднеамплитудное,
- высокоамплитудное.
Выделяют фокальный либо генерализованный тремор, при котором одновременно поражаются конечности, голова, нижняя челюсть, голосовые связки, язык. Подобные нарушения существенно ухудшают качество жизни и адаптацию этих пациентов в обществе.
В клинической работе невролога практическое значение имеет выделение следующих видов тремора: покоя, постурального и кинетического. Тремор покоя (статический тремор) имеет частоту 3-6 Гц и наиболее характерен для болезни Паркинсона или дегенеративных заболеваний ЦНС. Постуральный (антигравитационный) тремор характеризуется частотой 5-9 Гц, выявляется в положении с вытянутыми вперед руками и имеет место при синдроме отмены алкоголя, некоторых лекарственных препаратов, при обменных нарушениях, а также может быть психогенным или физиологическим. Кинетический тремор имеет частотную характеристику 3-10 Гц, подразделяется на тремор сокращения, проявляющийся при изометрическом напряжении мышц (при сжатии кисти в кулак) и интенционный тремор, возникающий при целенаправленном движении конечности (например, при выполнении пальценосовой пробы). Этот тип характерен для тремора Минора, поражения ствола мозга или мозжечка различного генеза (рассеянный склероз, опухоль, гематома). Вариантом кинетического тремора является task-specific tremor (тремор при выполнении определенного действия), появляющийся при выполнении точных мелких движений, таких как застегивание украшений, работа с маленькими деталями и т.п.
Клинические проявления тремора
Клинические проявления тремора полиморфны и встречаются при широком круге неврологических заболеваний. По этиологическому принципу виды тремора подразделяются на:
Физиологические: нормальный и усиленный тремор.
Патологические виды тремора:
- эссенциальный (наследственный и спорадический);
- паркинсонический;
- дистонический;
- мозжечковый (интенционное дрожание);
- тремор Холмса (среднего мозга или рубральный);
- невропатический;
- психогенный.
Физиологический тремор (асимптомное дрожание) встречается у любого здорового человека при волнении, характеризуется частотой 8-12 Гц в руках и менее чем 6,5 Гц в других частях тела. Усиленный физиологический тремор отличается от физиологического большей амплитудой и чаще встречается при гиперадренергических состояниях (эмоциональный стресс, эндокринные нарушения), во время приема ряда лекарственных препаратов или алкоголя. Особенностью данного вида тремора является его значительное уменьшение или полное исчезновение при назначении β-блокаторов.
Патологический тремор. Наиболее распространенной причиной патологического тремора является эссенциальный тремор Минора, частота и степень выраженности которого увеличивается с возрастом. Этот вид может быть как наследственным (аутосомно-доминантный тип наследования с вариабельной пенетрантностью) и, соответственно, проявляться в нескольких поколениях одной семьи, так и манифестироваться спорадически у членов одной семьи. Частота эссенциального тремора составляет 4-11 Гц и зависит от того, какой сегмент тела поражен. Проксимальные сегменты характеризуются низкими частотами, дистальные - более высокими. Наиболее часто поражается голова и/или кисти рук. Для данного вида тремора характерен постуральный и кинетический компонент. Тремор Минора может представлять самостоятельную нозологическую форму, реже - сопровождать различные нарушения движений, например паркинсонизм или фокальную дистонию.
Ортостатический тремор является редким расстройством движения. Характеризуется дрожанием ног в положении стоя и исчезает при ходьбе, сидении или в положении лежа. Отличительной особенностью данного вида тремора является его высокая частота: 14-16 Гц. В положении стоя у пациента может определяться подергивание четырехглавой мышцы бедра.
Дистонический тремор представляет собой дрожание части тела, в которой локализован дистонический синдром. Для данного вида тремора характерна нерегулярная амплитуда и вариабельная частота, часто - подверженность модулирующему влиянию позы.
При треморе Холмса (рубральном треморе) представлены все 3 основных типа дрожания, которые отличаются степенью выраженности. Данный тип возникает при повреждениях среднего мозга (инсульт, ЧМТ, опухоль или рассеянный склероз). Его частота составляет 2-5 Гц.
Мозжечковый (интенционный) тремор является кинетическим и проявляется при выполнении произвольного акта. Его развитие связано с нарушением корригирующего влияния мозжечковых систем на двигательный акт вследствие повреждений, локализующихся в латеральных мозжечковых ядрах или в верхней ножке мозжечка, либо в местах их соединений. При поражении срединных структур мозжечка развивается тремор в руках, голове и туловище. При клиническом осмотре выраженность тремора различается от небольших толчкообразных движений, до крупных, переходящих в мозжечковую хорею или асинергию.
Невропатический тремор имеет место при врожденных или приобретенных невропатиях и клинически напоминает эссенциальный тремор. Причиной дрожания является нарушение проприоцептивной чувствительности. Характерной чертой невропатического тремора является его усиление при выполнении задания (пальценосовой пробы и др.) с закрытыми глазами.
Психогенный тремор - наиболее сложный вид дрожания, поскольку требует исключения его органической природы. Данный вид может быть постуральным, а может проявляться в покое или при движении. Клинически психогенный тремор характеризуется внезапным началом, спонтанной ремиссией, стационарным течением и неклассифицируемыми видами тремора.
Диагностика тремора
Диагностика тремора основана на объективных тестах и инструментальных методах исследования. К широко известным объективным тестам относятся: рисование спирали, наливание воды из чаши, шкалы оценки тремора, тест лабиринта Гибсона. Инструментальные методы исследования включают позитронно-эмиссионную томографию, поверхностную электромиографию (ЭМГ), оптические методики и акселерометрию. Позитронно-эмиссионная томография позволяет с помощью меченых изотопов (F 18 , O 15 ) проследить за изменением уровня регионарного кровотока и оценить локализацию вовлечения нейронов. Поверхностная суммарная ЭМГ регистрирует запись залпов определенной частоты и амплитуды, которые чередуются с участками изолинии. Оптические методики основаны на использовании источника света и регистрирующего устройства.
Современным методом регистрации тремора является акселерометрия. Методика основана на использовании специальных датчиков - акселерометров, измеряющих линейное ускорение, характерное для всех движений (кроме случаев с постоянной скоростью). Получаемые сигналы с помощью аналогово-цифрового устройства преобразуются в цифровые и поступают в компьютер. Специальными программами производится их обработка, что позволяет построить графическую зависимость перемещения датчиков во времени, уточнить частотную и амплитудную характеристику движения.
Лечение тремора
Выделяют этиотропное, патогенетическое и симптоматическое лечение тремора. В современной клинической практике наиболее распространена симптоматическая терапия дрожания, выбор которой зависит от типа тремора.
Препаратами выбора коррекции кинетического тремора являются β-блокаторы, бензодиазепины или вальпроаты. Механизм воздействия β-блокаторов (анаприлин, пропранолол) на дрожание окончательно не изучен. Препарат назначают в начальной дозе 10 мг 3 раза в день, с постепенным повышением до максимальной дозы 240 мг/сут. По данным Koller W. C., пропранолол в дозе 160 мг/сут уменьшает амплитуду тремора на 50-70%. Среди недостатков лечения β-блокаторами - относительно высокая частота отмены лечения (в основном из-за возникновения повышенной утомляемости и брадикардии) и невозможность резкого прекращения их приема. Бензодиазепины (диазепам, клоназепам) воздействуют на тремор за счет своего противосудорожного и миорелаксирующего эффектов. Дозировка подбирается индивидуально и обычно составляет 4-6 мг/сут. Побочными эффектами бензодиазепинов являются головокружение, сонливость, возможное привыкание. Соли вальпроевой кислоты (производные натриевой и кальциевой соли) оказывают влияние на тремор посредством воздействия на обмен гамма-аминомасляной кислоты. Их суточная доза составляет 300-600 мг/сут. Побочные эффекты этих медикаментов - тошнота и диарея.
С целью влияния на тремор покоя применяют антихолинергические препараты, агонисты дофаминовых рецепторов, L-допа-содержащие препараты, амантадины. Антихолинергические препараты (тригексифенидил, бипериден) обладают центральным и периферическим холинолитическим эффектом, могут назначаться в дозировке 1-2 мг 3 раза в сутки. Применяются, прежде всего, у пациентов молодого и среднего возраста. В настоящее время циклодол редко используют в связи с его частыми побочными эффектами (сухость во рту, запоры, задержка мочеиспускания, психотические нарушения). Агонисты дофаминовых рецепторов (мирапекс, проноран, апоморфин) воздействуют на тремор путем прямой стимуляции специфических Д1, Д2, Д3 рецепторов, обеспечивают равномерный синтез и высвобождение дофамина, не индуцируют антиоксидантный стресс. Лечение начинают с малых доз с постепенным наращиванием дозы до 150 мг/сут. В последние годы начал применяться метод введения апоморфина с помощью особой помпы, эффективность которого сопоставима с нейрохирургическим вмешательством. L-допа-содержащие препараты (наком, мадопар, синдопа, синемет) представляют собой метаболические предшественники дофамина. Эффективность их воздействия на дрожание существенно меньше, чем на ригидность и акинезию. Средняя терапевтическая доза составляет 500-750 мг/сут. Увеличение дозы приводит к моторным флюктуациям и дискинезиям. Амантадины (ПК-Мерц, мидантан) с успехом применяются для лечения акинезии и ригидности у пациентов с болезнью Паркинсона и симптоматическим паркинсонизмом. Нам не встретилось работ о влиянии амантадинов на паркинсонический тремор. Поэтому в июне - ноябре 2006 г. на базе 2-го неврологического отделения 5-й городской клинической больницы г. Минска нами проведено клиническое исследование по оценке эффективности инфузионной формы ПК-Мерца на дрожание в комплексном лечении болезни Паркинсона.
На фоне проводимой терапии наряду с регрессом экстрапирамидной ригидности и гипокинезии у 3 пациентов (10%) достигнуто полное исчезновение постурального тремора и тремора покоя. Еще у 6 пациентов (20%) было отмечено исчезновение постурального дрожания и уменьшение тремора покоя. В 16 случаях (53,3%) - одновременное значительное уменьшение тремора покоя и постурального тремора (амплитуда дрожания уменьшилась более чем на 50% согласно данным акселерометрии). Влияния препарата на частоту паркинсонического дрожания во время лечения зафиксировано не было.
Результаты влияния препарата на амплитуду дрожания приведены на рисунке: до лечения амплитуда тремора покоя в исследуемой группе составила: медиана - 272 ед.; 25-й перцентиль - 112 ед.; 75-й перцентиль - 611 ед.; среднее отклонение - 641. После лечения амплитуда тремора достоверно уменьшилась: медиана - 73 ед.; 25-й перцентиль - 29 ед.; 75-й перцентиль - 149 ед.; среднее отклонение - 134 (p
Отсутствие эффекта от всех видов консервативного лечения во всем мире является показанием для нейрохирургического вмешательства. Паллидарная стимуляция и стимуляция субталямического ядра являются в настоящее время наиболее современными хирургическим вмешательствами для уменьшения тремора.
Таким образом, тремор является наиболее частым проявлением гиперкинетического синдрома, обладает существенным клиническим полиморфизмом, затрудняющим его диагностику. Существенную пользу в распознавании тремора приносят инструментальные методы. Одним из современных методов регистрации дрожания является акселерометрия. Подход медика к лечению тремора должен быть дифференцированным, индивидуальным и ступенчатым. В терапии паркинсонического дрожания показано применение инфузионной формы препарата ПК-Мерц. При отсутствии эффекта прибегают к политерапии или нейрохирургическому вмешательству.
Болезни нервной системы
Общее описание
Болезнь двигательного неврона (боковой амиотрофический склероз (БАС)) (G12.2) — это идиопатическое нейродегенеративное прогрессирующее заболевание с поражением периферического и центрального нейронов.

Распространенность: 1,5–5 случаев на 100 тысяч человек. Отмечается семейный характер заболевания (аутосомно-доминантное наследование) — 5–10% случаев.
Дебют БАС наблюдается в 40–60 лет. Этиология не выяснена. В семейных случаях заболевания прослежена мутация в гене супероксиддисмутазы-1.
Клиническая картина
Начальные симптомы заболевания:
- мышечная слабость в кистях,
- неловкость при выполнении мелких движений пальцами рук,
- гипотрофии кистей, сокращения мышц,
- нарушение речи, глотания (25%),
- боли при интенсивных сокращениях в мышцах, чаще генерализованные.
Слабость в мышцах постепенно прогрессирует, распространяется на другие отделы конечностей. Неуклонное прогрессирование заболевания отмечается в течение 2–3 лет с постепенным вовлечением всех мышц конечностей, бульбарных мышц, что приводит к летальному исходу.
При неврологическом осмотре выявляют периферические парезы с атрофиями мышц, фасцикуляциями, центральные парезы конечностей, изменение рефлексов с конечностей, патологические знаки, бульбарный синдром, крампи. При вовлечении мышц диафрагмы отмечается парадоксальное дыхание. Особенной чертой БАС является отсутствие трофических нарушений на коже.
Диагностика бокового амиотрофического склероза
- Спондилогенная миелопатия на шейном уровне.
- Патология краниовертебрального перехода.
- Объемные образования спинного мозга.
- Сирингомиелия.
- Прогрессирующие спинальные амиотрофии.
Лечение бокового амиотрофического склероза
- Ингибитор высвобождения глутамата.
- Симптоматическая терапия.
- Анальгетики, антиконвульсанты, миорелаксанты, антихолинэстеразные препараты.
- Лечебная гимнастика.
- Ортопедическая коррекция.
- Гастростома/назогастральный зонд.
Лечение назначается только после подтверждения диагноза врачом-специалистом.
Имеются противопоказания. Необходима консультация специалиста.
- Рилузол (Рилутек) — ингибитор высвобождения глутамата. Режим дозирования: суточная доза для взрослых пациентов, в том числе для лиц пожилого возраста составляет 100 мг/сут. (внутрь по 50 мг каждые 12 ч). Рилузол следует принимать пожизненно, с постоянным контролем печеночных трансаминаз один раз в три месяца.
Рекомендации
Рекомендуется консультация невролога, электронейромиография.
Читайте также:


