Офатумумаб при рассеянном склерозе отзывы
Русское название
Латинское название вещества Офатумумаб
Брутто-формула
Фармакологическая группа вещества Офатумумаб
- Противоопухолевые средства — моноклональные антитела
Нозологическая классификация (МКБ-10)
Код CAS
Характеристика вещества Офатумумаб
Человеческое моноклональное антитело (изотип IgG1).
Фармакология
Фармакодинамика
Механизм действия. Офатумумаб специфически связывается с эпитопом, включающим малую и большую внеклеточные петли молекулы CD20. Антиген CD20 является трансмембранным фосфопротеином, который экспрессируется на всех стадиях дифференцировки В-лимфоцитов, с пре-В-клеток и до зрелых В-лимфоцитов, а также на клетках В-клеточных опухолей, к которым относятся неходжкинские лимфомы (высокий уровень экспрессии CD20 наблюдается в >90% опухолей) и хронический лимфоцитарный лейкоз (XЛЛ) (обычно сопровождающийся более низкой степенью экспрессии CD20). Экспрессированая на поверхности клетки молекула CD20 после связывания с антителом остается на мембране клетки, не удаляется с ее поверхности (шеддинг) и не поступает внутрь клетки (интернализация).
Связывание офатумумаба с расположенным вблизи мембраны специфическим эпитопом молекулы CD20 вызывает связывание и активацию системы комплемента на поверхности клетки, что приводит к развитию комплементзависимой цитотоксической реакции и лизису опухолевой клетки. Офатумумаб вызывает выраженный лизис клеток с высоким уровнем экспрессии молекул системы комплемента. Кроме того, связывание офатумумаба вызывает гибель клеток по механизму антителозависимой клеточной цитотоксичности. Офатумумаб вызывает лизис клеток как с высокой, так и с низкой экспрессией CD20, а также клеток, устойчивых к ритуксимабу.
Фармакодинамические свойства. Уже после первого введения офатумумаба у пациентов со злокачественными заболеваниями крови количество В-клеток в крови снижалось. У пациентов с XЛЛ, устойчивым к ранее проводимому лечению, среднее уменьшение количества В-клеток в крови после первого введения составляло 22%, а после восьмого еженедельного введения — 92%. У большинства пациентов, отвечающих на терапию офатумумабом, количество В-клеток в крови оставалось низким на протяжении всего курса лечения до 15 мес после последнего введения.
У пациентов с XЛЛ, ранее не получавших лечение, медиана снижения количества В-лимфоцитов после первого цикла введения офатумумаба в комбинации с хлорамбуцилом и до начала шестого ежемесячного цикла составила 94 и >99% , при применении только хлорамбуцила аналогичные показатели составили 73 и 97%. Через 6 мес после последнего введения медиана снижения количества В-лимфоцитов составила >99% для офатумумаба в комбинации с хлорамбуцилом и 94% при применении только хлорамбуцила.
У пациентов с ХЛЛ, получавших поддерживающую терапию офатумумабом после ответа на индукцию, среднее снижение количества В-лимфоцитов составляло 61% после первого цикла терапии и 80% перед шестым еженедельным циклом терапии по сравнению с увеличением данного показателя на 32 и 1328 % в тех же временных точках в группе контроля.
Иммуногенность. Белковые ЛС , подобные офатумумабу, обладают иммуногенным потенциалом. В клинических исследованиях были изучены образцы сыворотки крови более чем 550 пациентов с XЛЛ на предмет выработки антител к офатумумабу на протяжении терапии, а также в период от 8 нед до 2 лет после прекращения терапии (метод электрохемилюминесцентного иммуноанализа). Антитела к офатумумабу выявлены менее чем у 1% пациентов с ХЛЛ после окончания терапии офатумумабом.
Фармакокинетика
Сmах офатумумаба в сыворотке крови обычно достигается к концу введения или сразу после него. Фармакокинетика оценена в исследованиях у 215 пациентов с ХЛЛ, устойчивым к ранее проводимому лечению. Среднее геометрическое Сmах офатумумаба в плазме крови после первого введения (300 мг) составило 61 мкг/мл, после восьмого еженедельного введения (седьмое введение в дозе 2000 мг) среднее геометрическое Сmах было равно 1391 мкг/мл, среднее геометрическое AUQ0–∞ составило 463,418 мкг·ч/мл; после двенадцатого введения (четвертое ежемесячное введение в дозе 2000 мг) среднее геометрическое Сmах было равно 827 мкг/мл, а среднее геометрическое AUC0–∞ составило 203,536 мкг·ч/мл. У пациентов с ХЛЛ, ранее не получавших терапию, после лечения офатумумабом и хлорамбуцилом, средние геометрические значения Сmах после первого введения (300 мг), введения 1000 мг на 8-й день, и введения 1000 мг в четвертом ежемесячном цикле составили 52, 241 и 285 мкг/мл соответственно; среднее геометрическое значение AUC0–τ в четвертом ежемесячном цикле составило 65,1 мкг·ч/мл. У пациентов с ХЛЛ, получающих поддерживающую терапию офатумумабом после ответа на индукционную терапию средние геометрические значения Сmах после первого введения (300 мг), введения 1000 мг на 8-й день и введения 1000 мг в четвертом восьминедельном цикле составили 74, 264 и 275 мкг/мл соответственно; среднее геометрическое значение AUC0–τ в четвертом восьминедельном цикле составило 122,782 мкг·ч/мл.
Распределение. Vd офатумумаба невелик. Средний Vd в стационарном состоянии ( Vss ) в различных исследованиях варьировал от 1,7 до 8,1 л, в зависимости от величины и количества доз.
Метаболизм. Офатумумаб — белок, для которого обычный путь метаболизма состоит в разрушении протеолитическими ферментами до пептидов и отдельных аминокислот. В связи с этим специальные исследования биотрансформации офатумумаба не проводились.
Выведение. Выведение офатумумаба осуществляется двумя путями: не связанным с мишенью, как и все прочие молекулы IgG, и опосредованным взаимодействием с мишенью, а именно связыванием с В-клетками. После первого введения наблюдалось быстрое и стойкое уменьшение количества CD20+ В-клеток. В связи с этим при повторном введении офатумумаб связывается со значительно меньшим количеством CD20+ В-клеток, которые доступны для образования комплексов с антителом. В результате при последующих введениях офатумумаба скорость клиренса снижается, а величина T1/2 существенно увеличивается по сравнению с первым введением; при повторных еженедельных введениях AUC и Сmах увеличивались в значительно большей степени, чем это ожидалось для предполагаемого накопления офатумумаба, рассчитанного на основе данных, полученных при его первом введении.
Среднее геометрическое клиренса и T1/2 у пациентов с рецидивирующим или резистентным ХЛЛ составляли 64 мл/ч (от 4,3 до 1122 мл/ч) и 1,3 дня (от 0,2 до 6 дней) после первого введения, 8,5 мл/ч (от 1,3 до 41,5 мл/ч) и 11,5 дня (от 2,3 до 30,6 дня) после четвертого введения, 11,7 мл/ч (от 3,9 до 54,2 мл/ч) и 13,6 дня (от 2,4 до 36 дней) после восьмого введения и 12,1 мл/ч (от 3 до 233 мл/ч) и 11,5 дня (от 1,8 до 36,4 дня) после двенадцатого введения.
У пациентов с ХЛЛ, ранее не получавших лечение, после терапии офатумумабом и хлорамбуцилом средние геометрические значения клиренса и T1/2 офатумумаба составляли 15,4 мл/ч (от 4,1 до 146 мл/ч) и 18,5 дня (от 2,7 до 82,6 дня) после четвертого введения. Средние геометрические значения скорости клиренса и T1/2 у пациентов с ХЛЛ, получавших поддерживающую терапию офатумумабом, составляли 8,1 мл/ч (от 1,8 до 58,5 мл/ч) и 22,6 дня (от 3,7 до 100,9 дня) после четвертого восьминедельного цикла.
Особые группы пациентов
Пожилой возраст (65 лет и старше). По данным популяционного фармакокинетического анализа, у пациентов в возрасте от 21 года до 87 лет не выявлено значительное влияние возраста на фармакокинетику офатумумаба.
Пол. По данным популяционного анализа, пол оказывает умеренное влияние (12%) на центральный Vd офатумумаба с более высокими показателями Сmах и AUC у женщин (52% пациентов). Данные различия не являлись клинически значимыми, в связи с чем коррекция дозы в зависимости от пола не требуется.
Нарушение функции почек. При популяционном анализе у пациентов с Cl креатинина от 26 до 287 мл/мин не выявлено значимое влияние исходного Cl креатинина на фармакокинетику офатумумаба. Не требуется коррекция дозы офатумумаба у пациентов с нарушением функции почек легкой и умеренной степени ( Cl креатинина >30 мл/мин). Ограничено количество данных по фармакокинетике офатумумаба у пациентов с нарушением функции почек тяжелой степени ( Cl креатинина Cl креатинина Ig человека класса IgG, циркулирующие в крови матери, выделяются с грудным молоком; опубликованные данные свидетельствуют о том, что потребление грудного молока не приводит к значительному проникновению материнских антител в кровяное русло ребенка. Риск для новорожденного и младенца не может быть исключен.
Фертильность. Данные о влиянии офатумумаба на фертильность отсутствуют. Исследования фертильности у животных не проводились.
Побочные действия вещества Офатумумаб
Профиль безопасности офатумумаба изучен в клинических исследованиях с участием 1021 пациента с ХЛЛ, 646 из которых получали монотерапию офатумумабом и 375 — офатумумаб в комбинации с химиотерапией. Наиболее часто (61%) встречающимися нежелательными реакциями были реакции, связанные с инфузией, большинство из которых были 1-й и 2-й степени тяжести. Инфузионные реакции 3-й степени тяжести или выше зарегистрированы у 6% пациентов, в 2% случаев развитие таких реакций привело к отмене терапии. Летальных случаев, связанных с развитием инфузионных реакций, не отмечено.
Нежелательные реакции сгруппированы в соответствии с классификацией органов и систем органов MedDRA, в пределах каждой группы перечислены в порядке уменьшения частоты встречаемости.
Для оценки частоты встречаемости использованы следующие критерии: очень часто (>1/10); часто (>1/100, 1/1000, 1/10000, 1 ; нечасто — анафилактические реакции, включая анафилактический шок 1 .
Со стороны обмена веществ и питания: нечасто — синдром лизиса опухоли.
Со стороны сердца: часто — тахикардия 1 ; редко — брадикардия 1 .
Со стороны сосудов: часто — артериальная гипертензия 1 , артериальная гипотензия 1 .
Со стороны дыхательной системы, органов грудной клетки и средостения: часто — боль в области гортани и глотки 1 , одышка 1 , кашель 1 , бронхоспазм 1 , дискомфорт в грудной клетке 1 , заложенность носа 1 , гипоксия 1 ; нечасто — отек легких 1 .
Со стороны ЖКТ : очень часто — тошнота 1 ; часто — диарея 1 ; нечасто — непроходимость тонкой кишки.
Со стороны кожи и подкожных тканей: очень часто — сыпь 1 ; часто — зуд 1 , крапивница 1 , приливы 1 .
Со стороны скелетно-мышечной системы и соединительной ткани: часто — боль в спине 1 .
Общие расстройства и нарушения в месте введения: очень часто — гипертермия 1 ; часто — усталость 1 , озноб 1 , дрожь 1 , гипергидроз 1 , синдром выброса цитокинов 1 .
Инфекционные и паразитарные заболевания: очень часто — бронхит, пневмония, инфекции верхних дыхательных путей; часто — сепсис, в т.ч. нейтропенический и септический шок, герпесвирусные инфекции, в т.ч. опоясывающий лишай, инфекции мочевыводящих путей; частота неизвестна — прогрессирующая многоочаговая лейкоэнцефалопатия.
Пострегистрационные данные
О возникновении указанных ниже нежелательных реакциях сообщалось при применении офатумумаба в пострегистрационном периоде.
Взаимодействие
Офатумумаб не оказывает клинически значимое влияние на фармакокинетику хлорамбуцила или его активного метаболита фенилуксусного иприта. Возможно увеличение риска развития инфекционных заболеваний при одновременном применении офатумумаба с ЛС , обладающими иммуносупрессивной активностью.
Передозировка
В клинических исследованиях случаев передозировки офатумумаба зарегистрировано не было.
Пути введения
Меры предосторожности вещества Офатумумаб
Перед введением офатумумаба необходимо заранее приготовить соответствующее реанимационное оборудование и ЛС , необходимые для купирования реакций гиперчувствительности.
Инфузионные реакции
При введении офатумумаба могут наблюдаться инфузионные реакции, требующие временного прекращения лечения или же его отмены. При проведении премедикации выраженность инфузионных реакций уменьшается, но тем не менее развитие инфузионных реакций возможно, особенно при первой инфузии. Реакции при введении офатумумаба могут включать анафилактические реакции, нежелательные явления со стороны сердца, озноб, кашель, синдром выброса цитокинов, диарею, одышку, усталость, приливы, повышение или снижение АД , тошноту, боль, повышение температуры, сыпь и крапивницу. Случаи развития серьезных нежелательных реакций на введение офатумумаба, включая синдром выброса цитокинов, отмечены несмотря на проведение премедикации. В случае развития серьезной нежелательной реакции на введение следует немедленно прекратить инфузию и провести симптоматическое лечение.
Реакции на введение офатумумаба наиболее часто развиваются в день первого введения, при последующих введениях степень их выраженности уменьшается. У пациентов с нарушением функции легких в анамнезе может быть повышен риск развития осложнений со стороны дыхательной системы на фоне развития инфузионных реакций, в связи с чем во время введения офатумумаба необходимо тщательно наблюдать таких пациентов.
Синдром лизиса опухоли
При применении офатумумаба у пациентов отмечено развитие синдрома лизиса опухоли. Лечение при развитии синдрома лизиса опухоли включает коррекцию нарушения содержания электролитов, контроль функции почек, поддержание водного баланса и симптоматическое лечение.
Прогрессирующая многоочаговая лейкоэнцефалопатия
У пациентов с ХЛЛ, получающих лечение цитотоксическими ЛС , в т.ч. офатумумабом, отмечались случаи развития прогрессирующей многоочаговой лейкоэнцефалопатии, в т.ч. с летальным исходом. При появлении жалоб на развитие неврологической симптоматики или изменение характера неврологических симптомов у пациентов, получающих лечение офатумумабом, необходимо провести обследование для исключения диагноза прогрессирующей многоочаговой лейкоэнцефалопатии. При подозрении на развитие данного состояния лечение офатумумабом следует прекратить и обратиться за консультацией к неврологу.
Нет данных по безопасности вакцинации живыми аттенуированными или инактивированными вакцинами, а также о возможности формирования первичного или вторичного иммунного ответа на них после вакцинации во время лечения офатумумабом. Поскольку при применении офатумумаба количество В-клеток снижается, ответ на вакцинацию может быть ослаблен. В связи с риском развития инфекции после проведения вакцинации у пациентов, получающих терапию офатумумабом, следует избегать вакцинации живыми аттенуированными вакцинами на фоне терапии, а также после ее окончания до момента восстановления количества В-клеток.
Инфицирование или реактивация гепатита В
У некоторых пациентов, получавших ЛС на основе анти-СD20-цитолитических антител, к которым относится и офатумумаб, были зарегистрированы случаи инфицирования вирусом гепатита В (HBV) или его реактивация, приводящие в некоторых случаях к развитию фульминантного гепатита, печеночной недостаточности и летальному исходу. Случаи заболевания были зарегистрированы у пациентов с положительной реакцией на поверхностный антиген гепатита В (HBsAg), а также у пациентов с положительной реакцией на антитела к ядерному антигену вируса гепатита В (anti-HBc), но с отрицательной реакцией на HBsAg. Также реактивацию отмечали у пациентов, у которых инфекция разрешилась (т.е. имеющих отрицательную реакцию на HBsAg, положительную реакцию на anti-HBc и антитела к поверхностному антигену вируса гепатита В (anti-HBs).
Реактивация HBV определяется как резкое увеличение репликации HBV, которое проявляется в виде быстрого повышения количества ДНК HBV в сыворотке крови или HBsAg у пациентов с ранее отрицательной реакцией на HBsAg и положительной на anti-НВс. Реактивация репликации HBV часто сопровождается развитием гепатита, т.е. увеличением активности трансаминаз, и в тяжелых случаях — повышением концентрации билирубина, печеночной недостаточностью и смертельным исходом.
В случае реактивации HBV во время лечения лфатумумабом следует немедленно отменить его применение, а также любые ЛС одновременно проводимой химиотерапии и начать соответствующее лечение. На данный момент нет достаточного количества данных о безопасности возобновления терапии офатумумабом после реактивации HBV. Перед возобновлением терапии офатумумабом у пациентов с разрешением HBV после реактивации необходимо проконсультироваться со специалистом, имеющим опыт лечения гепатита В.
Сердечно-сосудистые заболевания
Необходим тщательный контроль состояния пациентов с заболеваниями сердца. В случае возникновения серьезных или угрожающих жизни нарушений ритма сердца лечение офатумумабом следует прекратить.
Непроходимость кишечника
У пациентов, получавших лечение анти-СD20-моноклональными антителами, в т.ч. офатумумабом, отмечалось развитие непроходимости кишечника. При развитии жалоб на боли в животе, особенно возникающих в начале курса лечения офатумумабом, необходимо провести обследование и соответствующую терапию.
Лабораторное обследование
Во время терапии офатумумабом сообщалось о случаях развития цитопении, в т.ч. длительной нейтропении и нейтропении с поздним началом. Во время лечения необходимо регулярно проводить контроль гемограммы, включая определение количества нейтрофилов; в случае развития цитопении исследование следует проводить чаще. При развитии цитопении необходимо проводить соответствующую терапию.
Влияние на способность управлять транспортными средствами и/или работать с механизмами. Исследования, посвященные влиянию офатумумаба на способность управлять транспортными средствами и работать с механизмами, не проводились. Исходя из фармакологических свойств офатумумаба какое-либо негативное влияние на деятельность такого рода маловероятно. Оценивая способность выполнять действия, требующие быстрого принятия решений, специальных двигательных и когнитивных навыков, необходимо учитывать общее состояние пациента и профиль токсичности офатумумаба.

Ежемесячные подкожные инъекции офатумумаба превосходят Aubagio (терифлуномид) для лечения рецидивирующего рассеянного склероза (RRMS) и вторичного прогрессирующего рассеянного склероза(SPMS), что приводит к снижению частоты рецидивов более чем на 50% и более чем на 90%. Результаты исследования ASCLEPIOS I и II показывают, что снижение активных поражений головного мозга в% по сравнению с Aubagio
Ofatumumab может представлять собой высокоэффективный и более удобный вариант лечения, который может назначаться пациентами в домашних условиях, и, по-видимому, он параллелен инфузиям Ocrevus (ocrelizumab) с точки зрения эффективности. Однако для установления такого сравнения необходим более глубокий анализ, отмечают исследователи.
Novartis, владелец прав на разработку и маркетинг ofatumumab, планирует подать заявку на маркетинг в органы здравоохранения до конца этого года.
Ofatumumab – первое полностью человеческое моноклональное антитело против CD20 – маркер, присутствующий на иммунных B-клетках, которые участвуют в развитии РС. Терапия разрабатывается в виде самостоятельной инъекции 20 мг под кожу под кожу один раз в месяц.
Этот механизм действия идентичен механизму Ocrevus (одобренная терапия РС) и ритуксимаба (терапия, применяемая не по назначению при РС).
Под торговой маркой Arzerra ofatumumab одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для лечения определенных лейкозов; проводятся клинические испытания для проверки его эффективности для других видов рака крови и рецидивирующего РС.
Изначально разработанные датской биотехнологической компанией Genmab и GlaxoSmithKline (GSK), права на офатумумаб были приобретены Novartis в 2015 году.
Испытания по двойной фазе 3 – ASCLEPIOS I ( NCT02792218 ) и II ( NCT02792231 ) – проводятся параллельно для сравнения эффективности и безопасности офатумумаба по сравнению с Aubagio у взрослых пациентов с рецидивирующим РС, включая RRMS и активных пациентов с SPMS. Оба испытания похожи по дизайну и размерам.
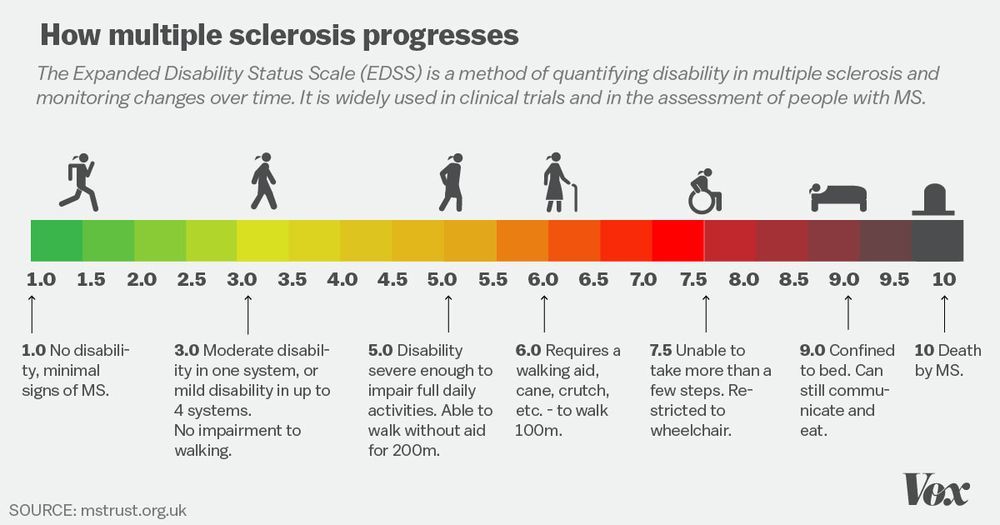
Всего было зарегистрировано 1882 пациента (927 в ASCLEPIOS I и 955 в ASCLEPIOS II), в возрасте 18–55 лет, с нетрудоспособностью по легкой степени ( оценка EDSS 0–5,5). У них также была одна из этих характеристик: по крайней мере, один рецидив в прошлом году, по крайней мере, два рецидива в течение последних двух лет, или положительное МРТ-сканирование с повышением гадолиния (в отношении активных поражений) за год до испытания.
Пациенты были рандомизированы для получения подкожных инъекций офатумамаба 20 мг один раз в месяц (после первоначального режима в дни 1, 7 и 14) или пероральных капсул Aubagio 14 мг один раз в день вместе с подкожными инъекциями плацебо на срок до 30 месяцев (около 2,5). года).
Результаты показали, что эффективность офатумумаба превосходила Aubagio в снижении годовой частоты рецидивов (первичная конечная точка испытаний). У пациентов, получавших офатумумаб, частота рецидивов в годовом исчислении составляла 0,11 у больных с ASCLEPIOS I и 0,10 у пациентов с ASCLEPIOS II по сравнению с показателями 0,22 (ASCLEPIOS I) и 0,25 (ASCLEPIOS II) в группе Aubagio.
Вторичные конечные точки испытаний включали 3- и 6-месячное подтвержденное ухудшение инвалидности, и результаты показали, что лечение офатумумабом значительно снижало оба эти параметра – снижение риска на 34,4% через три месяца и 32,5% через шесть месяцев по сравнению с Aubagio.
Что касается данных МРТ, лечение офатумумабом привело к значительному уменьшению количества гадолиниум-положительных Т1-поражений (активных областей воспаления) в головном мозге по сравнению с Aubagio.
Что касается новых или увеличивающихся поражений T2, их количество также уменьшилось более чем на 80% при лечении офатумумабом по сравнению с Aubagio – 82% относительного снижения ASCLEPIOS I и 84,5% в ASCLEPIOS II.
Команда также измерила уровни сывороточной легкой цепи нейрофиламента (NfL), маркера повреждения нервных клеток. Результаты показали, что у пациентов, получавших фатумумаб, наблюдалось значительное и последовательное снижение уровней NfL в сыворотке с третьего месяца лечения в обоих исследованиях ASCLEPIOS. Напротив, уровни NfL в группе, получавшей Aubagio, не показали значительного снижения, отметил Хаузер.
Нежелательные явления наблюдались у 83,6% пациентов, получавших офатумумаб, и у 84,2% пациентов, получавших лечение Аубагио. Не было никаких существенных различий в частоте инфекций (2,5% атумумаба против 1,8% Аубагио) или злокачественных новообразований (0,5% атумумаба против 0,3% Аубагио), которые были низкими для обеих групп.
Испытания ASCLEPIOS финансировались Novartis.
Мы гарантируем
- Качественную продукцию!
- Отличную поддержку!
- Работаем напрямую с производителя, цены не завышаем!
Контакты
- Телефоны: +7 (495) 203-55-18 или +7 (926) 808-66-34
- Viber (Вайбер): 8 (926) 808-66-34
- WhatsApp (Ватсап): 8 (926) 808-66-34
- E-mail: apteka-gerzena.ru@yandex.ru
- Адрес: г. Москва, Профсоюзная улица, 7/12
Все посылки застрахованы! В случаях утери посылок почтовой службой, посылки гарантированно отправляются повторно (бесплатно). Все препараты лицензированные и сертифицированные!
Работаем с 2014 года, более 2000 тыс отправленных посылок.
- При покупке более 2 упаковок доставка бесплатно.
- Отслеживание посылки по трек-коду.
- Доставка товара по Москве на следующий день или в течение 2-3 часов. Цена доставки при сумме заказа от 6000 руб. составляет 200 руб, при заказе до 6000 руб, стоимость доставки составляет 500 руб. За пределы МКАД по договору с менеджерами.
- Доставка по Московской области до 5 км - 400 руб, 5-15 км - 600 руб. От 15 км и выше по договору с менеджерами.
- Доставка в регионы осуществляется в течение 48 часов в любой город России.
- Страны СНГ 2-3 дня
- Экспресс доставка 1 день
Мы используем специальные термосумки, контейнеры, термоконтейнер с использованием аккумуляторов холода. Строго соблюдаем температурный режим при хранении и перевозки препаратов по стандарту: до 25 градусов, либо от 2 до 8 градусов.
Предлагаем выгодные акции и скидки для вас!
- Мы готовы подарить вам скидку 10%, если вы оплатите сразу! Но не забывайте, вы можете оплатить при получение! Откуда такая скидка? Все достаточно просто - это маркетинг, так работают все без исключения производители по всему миру! Чем больше мы купим, тем больше нам предоставляется скидка. В нашем случае, мы сможем привести на 1 упаковку больше, тем самым все в плюсе! У вас скидка 10%, а нам снизили стоимость закупки всей партии!
- Станьте нашим постоянным клиентов, и получайте скидку "+1%" на последующую поставку товара.
Узнать подробнее про условия доставки, оплаты и получения скидки, вы можете узнать по телефону!
Обойдемся без лишних слов! Наша гарантия, это:
- Оплата при получение - ваши риски минимальны! Но вы должны знать, что мы дарим 10%, если вы вносите предоплату! Первый раз, вы можете оплатить при получение! Убедитесь, что мы надежные поставщики, и уже со второго и далее, оплачивать сразу, тем самым получить скидку!
- У всех препаратов имеются сертификаты в упаковке, что вы можете проверить при получение!
Если, мы вас не убедили, позвоните и задайте вопросы, на которые хотите получить ответ специалиста!
Способ оплаты зависит от двух пунктов:
- Если вы оплачиваете сразу, вы получаете скидку!
- Если при получение, то немного больше!
Уточните подробности по телефону!
По условиям сотрудничества обращайтесь по телефону или пишите на почту apteka-gerzena.ru@yandex.ru
Докторам, клиникам, агентам - мы предлагаем сотрудничество.
Условия сотрудничества:
- Вариант 1 - оптовые поставки.
- Вариант 2 - получение комиссии за приведенного клиента.
- Торговое название препарата: Арзерра (Arzerra).
- Производитель: Novartis Pharma GmbH.
- Действующее вещество: Офатумумаб (Ofatumumab).
- Форма выпуска: концентрат для приготовления раствора для инфузий 100 мг, в упаковке 3X100 мг/1000 мг, в упаковке 50 мл.
При покупке более 2 упаковок доставка бесплатно.
Экспресс доставка в 1 дня, стоимость уточняйте по телефону.

Результаты магнитно-резонансной томографии здорового мозга (слева) и пациента с рассеянным склерозом (справа). Фото: Jessica Wilson/Science Photo Library
Канадские медики сообщили о результатах клинических испытаний радикального подхода к лечению рассеянного склероза стволовыми клетками, пишет New Scientist. Предлагаемый ими метод можно назвать экстремальным. Представьте, что лечение или полностью избавит вас от болезни, или убьёт.
При рассеянном склерозе собственная иммунная система человека атакует организм, нападая на защитную миелиновую оболочку нервных волокон в головном мозге, спинном мозге и зрительном нерве. Очаги болезни постепенно разрастаются. Миелин выполняет роль электрической изоляции для электропроводных нервных волокон. Повсеместное нарушение изоляции приводит к нарушениям в передаче тока по электрической цепи во всём организме. Нервная система постепенно начинает сбоить, человека поражает слепота или паралич, и в конце концов нервная система полностью выходит из строя, что означает смерть.
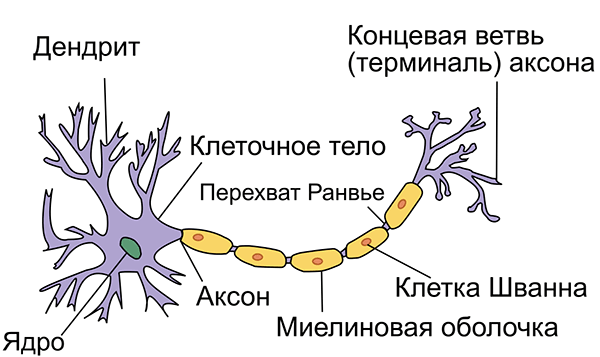
Структура нейрона. Оранжевым цветом показана миелиновая оболочка
Рассеянный склероз возникает в молодом и среднем возрасте (15-40 лет). Причины возникновения заболевания врачам до конца неизвестны, но к настоящему времени обнаружено несколько факторов, которые коррелируют с появлением рассеянного склероза.
- Расстояние от экватора (вероятно, связано со снижением выработки эндогенного и потребления экзогенного витамина D на территориях с меньшим количеством солнечного света), зона высокого риска — регионы севернее 30-й параллели на всех континентах.
- Стресс.
- Курение.
- Вакцинация против гепатита В (несмотря на результаты научного исследования, Всемирная организация здравоохранения опубликовала заявление, что анализ имеющихся сведений не подтверждает гипотезу о том, что вакцинация против гепатита B увеличивает риск развития заболевания).
- Низкий уровень мочевой кислоты.
Главной особенностью болезни является одновременное поражение нескольких различных отделов нервной системы, что приводит к появлению у больных разнообразных неврологических симптомов.
От рассеянного склероза страдает около 20 миллионов человек в мире, чаще женщины, проживающие в более северных странах, таких как Канада и Россия, северные районы США.
Существующие медикаменты могут ослабить частоту или силу атак иммунной системы на миелиновую оболочку нервных клеток, но не устраняют болезнь и не действуют на некоторых пациентов.
Радикальный подход канадских медиков предполагает лечение болезни путём полного уничтожения существующей иммунной системы и её переустановки с помощью стволовых клеток. Стволовые клетки — особый вид клеток в организме, которые способны специализироваться самостоятельно или давать потомство в виде специализированных типов клеток. В данном случае их используют для создания новой иммунной системы.
Такой метод лечения предполагает, что болезнь должна полностью исчезнуть. Иммунная система прекращает атаки на организм. Более того, как показали клинические тесты, с годами организм человека способен перестроиться и устранить повреждения, нанесённые болезнью в предыдущие годы. То есть нервная система самовосстанавливается, так что к пациенту постепенно возвращается утерянные функции.
Несмотря на рискованный подход, результаты клинических испытаний внушают оптимизм. Например, одна из принимавших участие в эксперименте пациенток Дженнифер Молсон (Jennifer Molson) из канадской провинции Онтарио решилась на экспериментальное радикальное лечение 14 лет назад, когда болезнь достигла такой стадии, что девушка находилась под круглосуточным наблюдением врачей в больнице Оттавы, передвигаясь только на ходунках, с тростью или в инвалидном кресле. Когда её отпускали на выходные, то за девушкой ухаживал её парень, и она полностью полагалась на его помощь: он резал ей еду и кормил, одевал её и купал в ванной. То есть Дженнифер уже не могла жить нормальной полноценной жизнью без посторонней помощи. К моменту максимального развития болезни девушка потеряла контроль над мочевым пузырём и кишечником.
Пациенты с настолько тяжёлой формой рассеянного склероза согласятся на любое экспериментальное решение, даже очень рискованное. Поэтому Дженнифер Молсон стала одной из первых, кто принял участие в клинических испытаниях по полной переустановке иммунной системы. В 2002 году врачи начали уничтожать её иммунную систему. Она стала одним из 24 пациентов, которых отобрали для первого клинического теста этого экспериментального метода.
Интересно, что данный метод лечения рассеянного склероза был обнаружен совершенно случайно при лечении больных лейкемией, которые одновременно страдали от рассеянного склероза. Лейкемия (лейкоз) — злокачественное заболевание кроветворной системы, один из методов лечение которой предполагает извлечение клеток костного мозга с дальнейшим уничтожением иммунной системы человека при помощи интенсивной химиотерапии. Образец клеток костного мозга очищают от раковых клеток и возвращают в организм для создания новой, чистой иммунной системы. К удивлению врачей, такой метод перезапуска иммунной системы у некоторых пациентов вылечил не только лейкемию, но и рассеянный склероз.
Сегодня несколько медицинских центров в мире предлагают такое радикальное экспериментальное лечение рассеянного склероза при условии, что пациент страдает от тяжёлой формы заболевания и обычные лекарства не действуют. В случае, если у пациента болезнь средней тяжести, то врачи предлагают более мягкую форму химиотерапии, что уменьшает вероятность излечения заболевания.
Из 24 пациентов, которые приняли участие в канадском клиническом тесте, у 17 человек развитие болезни удалось остановить. Правда, переустановка иммунной системы далась им непросто: химиотерапия сопровождается потерей волос, выпадением ногтей, тошнотой, диареей, она вызывает бесплодие и раннюю менопаузу у женщин. Но самое опасное — это риск инфекции, когда у человека иммунная система полностью отсутствует в первые недели, а потом очень слаба. Именно из-за инфекции одному из пациентов пришлось пересаживать печень, и он умер из-за осложнений трансплантации.
Спустя 18 месяцев после начала лечения Дженнифер Молсон заметила первые физические улучшения, а уже через три года смогла вернуться к работе. К настоящему времени её жизнь полностью вернулась в нормальное русло, болезнь исчезла бесследно, и Дженнифер ничем не отличается от всех остальных здоровых людей. По выходным она катается на лыжах и гребёт на каяке. В будние дни Дженнифер трудится научным сотрудником в той самой больнице Оттавы, где раньше находилась в качестве неизлечимо больного пациента.
Научная работа с результатами клинических тестов в Канаде опубликована 8 июня 2016 года в журнале The Lancet (doi: 10.1016/S0140-6736(16)30169-6, pdf). Это первая в мире научная работа, которая описывает успешное лечение рассеянного склероза с долговременным положительным эффектом без использования специальных медикаментов.
В первой таблице приведены данные о 24 пациентах, которые подверглись процедуре замены иммунной системы между октябрём 2001 года и декабрём 2009 года.
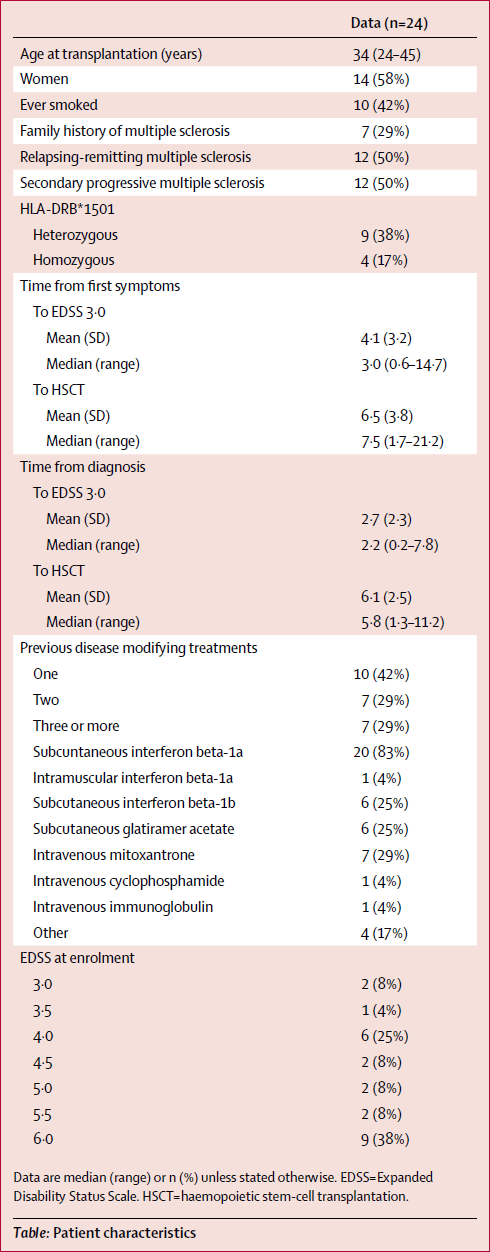
Ни у одного пациента не отмечено рецидивов болезни после лечения стволовыми клетками. Всего проведено 314 процедур МРТ (отмечены штрихами на правой диаграмме), среднее время слежения за пациентами после лечения составляет 6-7 лет. Крестик означает смерть пациента, звёздочка — цензура научного исследования, когда пациент впоследствии получил дополнительное альтернативное, экспериментальное или ненадёжное лечение, так что его исключили из выборки.


Дженнифер Молсон на разных этапах восстановления после лечения
На данный момент реальная смертность при лечении составляет 1% (не 4%, как в этом клиническом тесте на 24 пациентах). Сейчас врачи хотят опробовать другой вариант химиотерапии, который с меньшей вероятностью вызовет осложнения на печень. Возможно, смертность удастся снизить. Можно попробовать и менее радикальные варианты химиотерапии, чтобы найти баланс между эффективностью и токсичностью, говорят эксперты.
Читайте также:


