Атрофия зрительного нерва генетическое заболевание
Известно несколько форм наследственных атрофии зрительного нерва, отличающихся друг от друга клиническими проявлениями, характером функциональных нарушений, временем начала заболевания, типом наследования. Лечение наследственных атрофии зрительного нерва должно быть направлено на улучшение трофики; как правило, оно малоэффективно.
Юношеская наследственная атрофия зрительного нерва - двустороннее заболевание с аутосомно-доминантным типом наследования. Встречается чаще других наследственных атрофии и является наиболее доброкачественной формой. Первые офтальмоскопические признаки появляются в 2—3 летнем возрасте, функциональные нарушения наступают значительно позже (в 7-20 лет). Острота зрения снижается постепенно, длительное время остается достаточно сохранной, составляя 0,1—0,9. Появляются центральные и парацентральные скотомы, увеличивается слепое пятно. Концентрическое сужение поля зрения наблюдается редко. Нарушения цветового зрения, как правило, предшествуют снижению остроты зрения. Сначала снижается чувствительность к синему цвету, затем - к красному и зеленому; может развиться полная цветослепота. Темновая адаптация не изменяется. Электроретинограмма, как правило, в норме. Заболевание может сопровождаться нистагмом и неврологическими нарушениями.
Врожденная, или инфантильная, наследственная аутосомно-рецессивная атрофия зрительного нерва встречается реже, чем доминантная форма, проявляется, как правило, при рождении или в раннем возрасте (до 3 лет). Атрофия двусторонняя, полная, стационарная. Острота зрения резко снижена, поле зрения концентрически сужено. Имеется дисхроматопсия. Электроретинограмма в норме. Обычно наблюдается нистагм. Общие и неврологические расстройства встречаются редко. Заболевание следует дифференцировать от гипоплазии диска, инфантильной формы тапеторетинальной дегенерации.
Атрофия зрительного нерва, связанная с полом, встречается редко, проявляется в раннем возрасте и медленно прогрессирует. Острота зрения снижается до 0,4-0,1. Периферические отделы поля зрения сохранены, слепое пятно несколько увеличено. В ранних стадиях заболевания (в молодом возрасте) электроретинограмма в норме, впоследствии снижается и исчезает волна b. Атрофия зрительного нерва может сочетаться с умеренными неврологическими нарушениями.
Осложненная инфантильная наследственная атрофия зрительного нерва Бера чаще передается по рецессивному типу, реже — по доминантному. Начинается рано — на 3-10-м году жизни, когда внезапно снижается зрение, затем процесс медленно прогрессирует.
В ранних стадиях заболевания наблюдается легкая гиперемия диска. Впоследствии развивается частичная (с поражением височной половины диска) или полная атрофия зрительного нерва. Острота зрения может снижаться до 0,05—0,2; полная слепота, как правило, не наступает. Имеется центральная скотома при нормальных границах периферического поля зрения. Часто сочетается с нистагмом (50%) и косоглазием (75%). Характерно наличие неврологических симптомов; поражается преимущественно пирамидная система, что сближает эту форму с наследственными атаксиями.
Атрофия (неврит) зрительного нерва Лебера. Начинается внезапно и протекает по типу острого двустороннего ретробульбарно-го неврита. Интервал между поражением одного и другого глаза иногда может достигать 1—6 мес. Чаще болеют мужчины (до 80-90% случаев). Заболевание может появляться в возрасте 5-65 лет, чаще — в 13-28 лет. В течение нескольких дней, реже 2 -4 нед, зрение снижается до 0,1 - счет пальцев у лица. Иногда снижению зрения предшествуют периоды затуманивания, лишь в единичных случаях наблюдаются фотопсии. Нередко отмечается никталопия, больные лучше видят в сумерки, чем днем. В начальном периоде заболевания может отмечаться головная боль. В поле зрения выявляются центральные скотомы, периферия чаще сохранена, электроретинограмма не изменена. Характерна дисхроматопсия на красный и зеленый цвета.
Глазное дно может быть нормальным, иногда отмечается легкая гиперемия и небольшая нечеткость границ диска зрительного нерва.
Атрофические изменения появляются через 3—4 мес после начала заболевания, сначала в височной части диска. В поздней стадии развивается атрофия зрительного нерва.
У некоторых больных возникают рецидивы или наблюдается медленное прогрессирование процесса, у ряда больных отмечается некоторое улучшение зрительных функций. Неврологические расстройства возникают редко. Иногда отмечаются отклонения на ЭЭГ, нерезко выраженные признаки поражения оболочек и диэнцефальной области.
У членов одной семьи заболевание большей частью протекает однотипно в отношении времени его начала, характера и степени функциональных нарушений. Тип наследования точно не установлен, более вероятна передача по рецессивному типу, сцепленному с полом.
Оптикоотодиабетичеекий синдром - двусторонняя первичная атрофия зрительного нерва, сопровождающаяся резким снижением зрения в сочетании с глухотой неврогенного генеза, гидронефрозом, пороками развития мочевой системы, сахарным или несахарным диабетом. Развивается в возрасте от 2 до 24, чаще до 15 лет.

Атрофия зрительного нерва – это процесс, при котором связь между мозгом и нервными окончаниями глаза слабеет или вовсе теряется, вследствие чего падает зрение или наступает полная слепота.
Причины возникновения заболевания, тип наследования
Недуг зачастую прогрессирует у пациентов в возрасте от 12 до 25 лет. При этом весомую роль в возникновении заболевания играет наследственный фактор. По клиническим показателям болезнь схожа с двусторонним ретробульбарным невритом.

В течение двух дней развивается внезапная потеря зрения на обоих глазах, иногда острота снижается сперва на одном, а потом и на другом органе.
В течение последующих двух недель качество зрения продолжает падать, а затем останавливается на определённом уровне. Полная слепота появляется относительно редко.
Характерная особенность наследственной оптической нейропатии Лебера — неполная пенетрантность (до 40% у мужчин и 15% у женщин) и высокая частота поражения среди мужчин (они заболевают в 5 раз чаще, чем женщины). Это, возможно, связано с воздействием Х-сцепленного модифицирующего гена, находящегося в районе Xp21.
Наиболее частыми причинами развития недуга считаются:
- инфекционные воспаления ЦНС и зрительных нервов;
- врожденные и приобретенные гидроцефалические патологии;
- онкология черепной коробки;
- церебральный паралич;
- метаболические нарушения;
- интоксикации (свинцом, лекарственными препаратами, ртутью);
- врожденные и генетические патологии зрительного нерва.
Влияние на развитие заболевания оказывают следующие факторы:
- стресс;
- курение и употребление спиртных напитков;
- воздействие токсинов;
- некоторые лекарства и инфекции.
Симптомы наследственной атрофии зрительного нерва Лебера
На начальных стадиях заболевания глазное дно остается без изменений, иногда отмечают лишь некоторую гиперемию сосочков зрительных нервов и размытие границ. При диагностике полей зрения наблюдаются центральные скотомы.

Фото 1. Так выглядит глазное дно при нормальном состоянии органа зрения (слева) и при атрофии зрительного нерва (справа).
Атрофию классифицируют на несколько типов:
- простой (первичный) и вторичный (поствоспалительный или послезастойный) — первый характеризуется обычной потерей зрения, сужением бокового зрительного поля;
- частичный и полный тип — полная или частичная потеря зрения;
- стационарный или прогрессирующий — при первой разновидности процесс потери зрения на какой-то стадии останавливается, а при прогрессирующей форме наблюдается постепенный спад зрительной функции, который может привести к полной атрофии нерва, т. е. к слепоте;
- односторонний и двусторонний тип — поражение одного или двух глаз.
Справка. У большинства пациентов обнаруживают прогрессивное ухудшение зрения в течение месяцев и даже лет, но примерно у 20% больных отмечают улучшение зрения. Известны случаи полного восстановления зрения.
Перечень симптомов атрофии зрительного нерва довольно обширен и зависит от вида патологии. Самые распространённые симптомы всех типов патологии:
- снижение остроты зрения;
- нарушение аккомодации;
- куриная слепота.

В запущенном состоянии болезни к общим симптомам повреждения зрительных путей присоединяются признаки, свидетельствующие о поражении ЦНС. Сюда относятся случаи:
- осложнённой деменции;
- депрессии;
- появления бульбарных симптомов;
- атаксии мозжечкового и спинального типа;
- спастической параплегии.
В таких ситуациях проводят дифференциальную диагностику, чтобы исключить риск возникновения рассеянного склероза, опухоли зрительного нерва или хиазмальной области.
Внимание! Заболевание развивается в молодом возрасте (чаще от 12 до 25 лет), поэтому любые признаки нарушения зрительной функции не должны оставаться без внимания.
Методы диагностики
Симптомы атрофии зрительного нерва появляются не только на первых порах развития недуга, но и в результате получения серьезных травм участков головного мозга, которые ответственны за зрительные функции.
При осмотре пациента врач изучает наличие сопутствующих заболеваний, факты приема фармакологии и контакта с химическими препаратами, пагубные привычки, а также жалобы, которые свидетельствуют о возможных интракраниальных поражениях.
При физикальной форме диагностики офтальмологи определяют присутствие либо отсутствие экзофтальма, исследуют подвижность глазного яблока, тестируют реакцию зрачка на свет, рефлекс роговицы. Обязательно проводят проверку остроты зрения, периметрию, изучение цветовосприятия.
Перечень диагностических мер:
- офтальмоскопия — анализируется степень размытия границы нерва;

Фото 2. Процесс офтальмоскопии: специальный прибор направляет пучок света на глаз, что помогает увидеть глазное дно пациента.
- тест на остроту зрения, определение границы зрительного поля;
- ангиография сосудов головного мозга, питающих нерв;
- выявление повреждённых участков нерва при помощи компьютерной периметрии;
- томография;
- краниографическое исследование;
- ЗВП, определяющее снижение лабильности и увеличение порога чувствительности зрительного нерва;
- при глаукоме измеряют внутриглазное давление;
- обзорная рентгенография орбиты глаза — изучение патологий глазницы;
- флуоресцентная ангиография — осмотр сосудистой сетки сетчатки;
- рентгенография черепа и турецкого седла;
- магнитно-резонансная томография (МРТ) — оценка волокон зрительного нерва;
- анализ крови, подтверждающий или опровергающий наличие воспалительного процесса;
- ИФА и ПЦР-диагностика.
Лечение

Недуг опасен тем, что разрушенное нервное волокно не подлежит регенерации. Эффект от терапии может быть обусловлен только восстановлением функционирования дееспособных на момент воздействия волокон.
Лечение подразумевает нормализацию кровообращения и стимулирование процессов жизнедеятельности в угнетенных нервных волокнах. С этой целью применяются сосудорасширяющие лекарства, препараты, которые улучшают трофические свойства, а также стимулируют ЦНС.
Важно! Лечение недуга более результативно при длительном нахождении лекарственного вещества в зоне повреждения. Для получения максимального эффекта нужны многочисленные инъекции, а это довольно болезненно.
Ирригационная терапия позволит дробно вводить лекарственные средства. Медикаменты поступают через катетер, который устанавливается в ретробульбарное пространство через отверстие в коже в нижнем углу глазницы. Катетер закрывают стерильной пробкой и фиксируют пластырем к коже.
У маленьких детей процесс выполняют под ингаляционным масочным наркозом. У старших — под местным. Лекарственные препараты вводят 5—6 раз в день при помощи прокалывания иглой шприца пробки катетера после предварительной обработки этиловым спиртом. Набор препаратов подбирает врач в зависимости от стадии недуга. Срок лечения 7—10 дней.

Рекомендуется посещать доктора в течение 6 месяцев после полного излечения для исключения возможных рецидивов, а также соблюдать указания врача.
Не помешает гимнастика для глаз, соблюдение рационального режима отдыха, диеты. Прогноз положительный и подразумевает практически полное восстановление зрения. Во время лечения:
- откажитесь от пагубных привычек;
- включите в свой режим дневной сон (хотя бы 30—40 минут);
- избегайте контакта с грязной водой, при попадании инородных веществ в глаза — немедленно продезинфицируйте органы зрения.
Полезное видео
Посмотрите видео, в котором врач-офтальмолог рассказывает об особенностях атрофии зрительного нерва у ребенка.
Самолечение запрещено
Самолечением заниматься категорически запрещено, так как причин, провоцирующих заболевание, множество. Поэтому универсальной методики терапии нет. Каждый конкретный случай недуга разбирается врачом, после чего назначаются лечебные мероприятия.
а) Аутосомно-доминантная атрофия зрительного нерва и сенсоневральная тугоухость. Описано несколько семей с аутосомно-доминантной атрофией зрительного нерва, сочетающейся с глухотой. Во многих из этих семей не наблюдается других системных или неврологических аномалий. В некоторых, но не во всех этих семьях было выявлено носительство мутаций гена ОРА1, которые в других семьях вызывают изолированную нейрооптикопатию. В одной итальянской семье был идентифицирован новый локус хромосомы 16 (16q21-q22), обозначенный ОРА8, предварительные исследования указывают на то, что в патогенезе также может играть роль митохондриальная дисфункция.
В голландской семье, наследующей доминантную атрофию зрительного нерва и глухоту, мутации ОРА1 были исключены, но была выявлена ранее неизвестная миссенс-мутация гена WFS1 хромосомы 4 (4р16.1), в локусе, мутации которого обычно вызывают аутосомно-рецессивный DIDMOAD-синдром, он же синдром Wolfram, характеризующийся синдромальной нейрооптикопатией, сахарным диабетом, несахарным диабетом и тугоухостью. Аналогично в другой семье, наследующей доминантную атрофию зрительного нерва с тугоухостью и нарушением регуляции глюкозы, при анализе мутаций были исключены мутации генов ОРА1, ОРАЗ, ОРА4 и ОРА5, но была выявлена новая миссенс-мутация гена WFS1 (синдрома Wolfram).
Офтальмоплегия и миопатия развиваются в среднем возрасте. Эта патология представляет собой митохондриальное заболевание, развивающееся вследствие ядерных генетических аномалий.
в) Аутосомно-доминантная атрофия зрительного нерва с рано развивающейся катарактой. В двух семьях из Франции наблюдалось наследуемое по аутосомно-доминантному типу сочетание атрофии зрительного нерва и рано развивающейся катаракты. Мутации гена ОРА1 были исключены, но были выявлены патогенные мутации гена ОРАЗ хромосомы 19 (19q13.2-q13.3), локус этих мутаций обычно вызывает синдром Costeff, синдромальную нейрооптикопатию, наследуемую по аутосомно-рецессивному типу. При скрининговых исследованиях на мутации ОРА3 по поводу моносимптомных доминантных атрофий зрительного нерва в различных семьях не удалось выявить какие-либо патогенные варианты ОРАЗ; вероятно, мутации ОРАЗ, вызывающие доминантную атрофию зрительного нерва, встречаются крайне редко.
г) Аутосомно-рецессивная атрофия зрительного нерва в сочетании с прогрессирующей нейродегенерацией и 3-метилглютакониковой ацидурией III типа (синдром Costeff). При этом аутосомно-рецессивном синдроме, чаще всего встречающемся в еврейских семьях Ирака, тяжелая атрофия зрительного нерва сопутствует экстрапирамидным расстройствам, когнитивным нарушениям, повышению в моче уровня 3-метилглютакониковой кислоты и повышению в плазме уровней 3-метилглютаровой кислоты. Вызывающий заболевание ген был локализован на хромосоме 19 (19q13.2—q13.3) и получил название ОРА3.
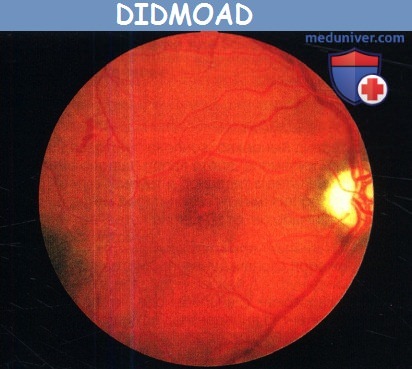
DIDMOAD. Диск зрительного нерва атрофичен,
видны ретинальные кровоизлияния, вызванные сахарным диабетом.
д) Аутосомно-рецессивная атрофия зрительного нерва в сочетании с ювенильным сахарным диабетом, несахарным диабетом и тугоухостью (синдром Wolfram). Этот синдром включает в себя ювенильный сахарный диабет и прогрессирующее ухудшение зрения на фоне атрофии зрительного нерва, почти всегда сопровождающихся несахарным диабетом, нейросенсорной тугоухостью или и тем, и другим (вследствие чего был предложен эпоним DIDMOAD — diabetes insipidus, diabetes mellitus, optic atrophy, deafness, т. e. несахарный диабет, сахарный диабет, атрофия зрительного нерва, глухота).
Сахарный диабет развивается в течение первого или второго десятилетия жизни и обычно предшествует развитию атрофии зрительного нерва. Однако у нескольких пациентов атрофия зрительного нерва и ухудшение зрения являлись первыми проявлениями синдрома. На ранних стадиях заболевания острота зрения может оставаться нормальной, несмотря на легкую дисхроматопсию и атрофию зрительного нерва. На поздних стадиях развивается тяжелое ухудшение зрения. При периметрии выявляются генерализованное сужение и центральные скотомы поля зрения. Всегда развивается тяжелая атрофия зрительного нерва, может наблюдаться маленькая или средних размеров экскавация ДЗН. И ухудшение слуха, и несахарный диабет дебютируют в первом или во втором десятилетии жизни и могут протекать в очень тяжелой форме. У половины пациентов присутствует атония мочевыводящих путей, сопровождающаяся рецидивирующими инфекциями мочевых путей, нейрогенным недержанием и даже смертельными осложнениями.
Другие системные и неврологические нарушения включают в себя атаксию, осевую ригидность, судороги, стартл-миоклонус, тремор, нарушение моторики желудочно-кишечного тракта, нарушение вестибулярных функций, центральное апноэ, нейрогенный коллапс верхних дыхательных путей, птоз, катаракту, пигментную ретинопатию, ирит, снижение слезопродукции, зрачки Adie, офтальмоплегию, недостаточность конвергенции, паралич вертикального взора, нистагм, умственную отсталость, психиатрические нарушения, маленький рост, первичную гонадную атрофию, другие эндокринные аномалии, аносмию, мегалобластную и сидеробластную анемию, аномалии при электроретинографии и повышение содержания белка в цереброспинальной жидкости. При лучевых исследованиях и на вскрытии у некоторых пациентов выявляются обширные атрофические изменения и мальформации развития коры, что указывает на диффузное нейродегенеративное расстройство с преимущественным поражением среднего мозга и моста. Если синдром сопровождается анемией, терапия тиамином может облегчить анемию и снизить потребность в инсулине.
В нескольких семьях методом анализа сцепления удалось локализовать ген синдрома Wolfram на хромосоме 4 (4р16.1), который был обозначен как WFS1; были описаны точечные мутации и делеции этого гена. Продукт данного гена — вольфрамин — белок эндоплазматического ретикулума, участвующий в регуляции уровня внутриклеточного кальция. Идентифицирован второй вызывающий синдром Wolfram ген, локализованный на другом плече хромосомы 4 (4q22-24), он получил обозначение CISD2. У больных наблюдается повышенная кровоточивость и пептические язвы. Нокаут гена CISD2 у мышей вызывает развитие Wolfram-подобного синдрома, сопровождающегося преждевременным старением вследствие поражения митохондрий. В общем, многие из сопутствующих аномалий, описанных при синдроме Wolfram, обычно встречаются у пациентов с предположительно митохондриальной патологией, особенно у больных с синдромами хронической прогрессирующей наружной офтальмоплегии.
На основании этих данных было высказано предположение, что фенотип Wolfram, возможно, представляет собой не специфическую аномалию, а является проявлением различных патогенных ядерных или митохондриальных генетических дефектов, в конечном итоге запускающих общий механизм митохондриальной дисфункции. К тому же большинство случаев синдрома Wolfram классифицировались как спорадические или наследуемые по рецессивному типу, последний вывод делался на основании экспрессии синдрома у сиблингов (что, как сейчас известно, также соответствует и материнскому типу наследования).
е) Спастическая параплегия, атрофия зрительного нерва и нейропатия (синдром SPOAN — spastic paraplegia, optic atrophy, neuropathy). Аутосомно-рецессивное нейродегенеративное заболевание было описано клинически как сочетание непрогрессирующей врожденной атрофии зрительного нерва, дебютирующей в младенческом возрасте спастической параплегии, дебютирующего в детстве прогрессирующего поражения двигательных и чувствительных аксонов, дебютирующей в третьем десятилетии жизни дизартрией, выраженных слуховых стартл-реакций, прогрессирующих контрактур суставов и деформации позвоночника. Выявлено сцепление с хромосомой 11q13, но патогенный ген все еще не установлен.
ж) Врожденная мозжечковая атаксия, умственная отсталость, атрофия зрительного нерва и аномалии кожи (congenital cerebellar ataxia, mental retardation, optic atrophy, skin abnormalities— CAMOS). Непрогрессирующая аутосомно-рецессивная врожденная атаксия в сочетании с атрофией зрительного нерва, тяжелой умственной отсталостью и аномалиями строения кожи; заболевание сцеплено с локусом хромосомы 15 (15q24-q26), но патогенный ген все еще не выявлен.
з) Глухота, дистония и нейрооптикопатия (deafness, dystonia, optic neuropathy—DDON, синдром Mohr-Tranebjaerg). Это Х-сцепленное заболевание манифестирует в старшем детском возрасте сенсоневральной тугоухостью, дистонией и атаксией, после чего в возрасте около двадцати лет наблюдается атрофия зрительного нерва, а до пятидесяти лет развиваются снижение интеллекта и психиатрические нарушения. Прогноз для зрения неблагоприятный, большинство пациентов слепнут в возрасте около сорока лет. Причиной заболевания являются мутации гена TIMM8АХ-хромосомы (Xq22), продукт гена локализуется в межмембранном пространстве митохондрий. Было выявлено нарушение биохимических процессов в митохондриях.
и) Осложненная наследственная инфантильная атрофия зрительного нерва (синдром Behr). Описание синдрома Behr включает в себя манифестирующую в детстве атрофию зрительного нерва, в сочетании с различными нарушениями пирамидного тракта, атаксией, умственной отсталостью, недержанием мочи и полой стопой. Синдром обычно наследуется по аутосомно-рецессивному типу, поражаются представители обоего пола. Ухудшение зрения, от умеренного до тяжелого, обычно развивается в возрасте младше десяти лет, часто сопровождается нистагмом. В большинстве случаев по прошествии периода детства патология не прогрессирует. При лучевых исследованиях выявляются диффузные симметричные изменения белого вещества. У некоторых пациентов с синдромом Behr клиническая картина может напоминать проявления наследственной атаксии. Вероятно, синдром Behr является гетерогенным заболеванием, развивающимся вследствие различных этиологических, в том числе генетических, факторов.
к) Прогрессирующая энцефалопатия с отеком, гипсаритмия и атрофия зрительного нерва (синдром РЕНО — progressive encephalopathy with edema, hypsarrhythmia, optic atrophy). Описаны прогрессирующая энцефалопатия, манифестирующая в первые полгода жизни, вслед за которой развиваются тяжелая гипотония, судороги с гипсаритмией, тяжелая умственная отсталость, гиперрефлексия, транзиторный или персистирующий отек лица и тела, атрофия зрительного нерва. Последняя обычно выявляется на первом или втором году жизни, часто наблюдается нистагм. Дефект метаболизма еще не установлен; вероятно, заболевание наследуется по аутосо-мно-рецессивному типу. Данную патологию можно считать формой синдрома Behr, который, вероятно, представляет собой гетерогенную группу заболеваний.
л) Нейрооптикопатия как проявление наследственных дегенеративных заболеваний или патологии развития. Нейрооптикопатия может сопутствовать различным наследственным дегенеративным заболеваниям или системным нарушениям развития. В таблице ниже перечислены основные проявления наиболее часто встречающихся из них.

Синдром Лебера – это редкое врожденное заболевание, ассоциирующееся с нарушениями зрения. В основе лежит нарушение клеточных органелл, митохондрий. Заболевание встречается у 1 человека на несколько десятков тысяч здоровых людей.
Наследственная оптическая нейропатия Лебера (англ.: Leber optic atrophy = Leber hereditary optic neuropathy, LHON) – это редкое наследственное заболевание, вызывающее нарушения зрения. Болезнь чаще всего встречается в возрасте 27-34 лет, преимущественно поражает мужчин.
Болезнь была впервые диагностирована немецким офтальмологом Альбрехтом фон Граефом в 1858 г, но название получила в честь его ассистента Теодора Лебера, позже описавшего клиническое течение заболевания у 15 пациентов. Атрофия Лебера – первое заболевание, связанное с материнской наследственностью и специфической точечной мутацией в митохондриальной ДНК (мтДНК).
Диагностика болезни затруднена из-за низкой заболеваемости, свидетельствующей о наличии этого расстройства в семье. Для исключения других причин нарушения зрения необходимо офтальмологическое обследование. Целесообразно выполнение генетического исследования для подтверждения мутации.
Патогенез, этиология, причины
Причина болезни Лебера – генетическая мутация в ДНК, происходящая в митохондриях.
Митохондрии – это органеллы в клетках, ответственные за клеточный энергетический обмен. При этой болезни практически исключительно затрагиваются RGB, формирующие зрительный нерв.
Одно из возможных объяснений селективного поражения RGB – их высокая потребность в непрерывной доставке АТФ (аденозинтрифосфата, англ.: ATP). Гистохимические исследования показали повышенное накопление митохондрий в области пластинки cribrosa sclerae, где немиелинизированные нервные волокна выступают из сетчатки, образуя зрительный нерв.
Эта область богата ферментами Na+/K+ATP, что делает локальное нервное ведение чрезвычайно сложным процессом, и может объяснить исключительную уязвимость волокон зрительного нерва. Дефект митохондриального метаболизма приводит к локальному застою аксоплазмы с отеком. В дальнейшем это способствует дегенерации слоя RGB и их аксонов, образующих зрительный нерв.
Вопреки этой теории, фоторецепторы, сохраняющиеся при заболевании, имеют более высокие окислительные потребности, чем RGB. Кроме того, другие митохондриальные заболевания с более тяжелым комплексным расстройством не всегда приводят к развитию атрофии зрительного нерва. Поэтому возможно, что RGB более чувствительны к незначительным отклонениям окислительно-восстановительного потенциала клеток и образованию радикалов кислорода, чем к дефициту АТФ.

Генетика: как, кому и когда передается болезнь

Митохондриальный шаблон наследования синдрома Лебера
Наследственная атрофия зрительных нервов Лебера опосредуется мутацией ДНК в митохондриях, которую человек (преимущественно, мужского пола) всегда получает от матери, поскольку только яйцеклетка передает свои митохондрии зарождающемуся эмбриону (митохондрии отцовской спермы не передаются).
Хотя подавляющее большинство пациентов с болезнью Лебера имеют гомоплазматические мутации, 10-15% мутаций – гетероплазматические. За отличия в межиндивидуальных фенотипах может быть ответственна тканеспецифичная сегрегация. Некоторые исследования показывают, что риск для пациентов минимален, если гетероплазма составляет менее 60%. Сыновья матерей, у которых уровни гетероплазмы ≤80%, с меньшей вероятностью будут страдать от болезни.
Клиническая картина
Проявления нейропатии Лебера:
- внезапное безболезненное поражение обоих глаз;
- снижение остроты зрения;
- скотомы (темные пятна) в поле зрения;
- потеря цветового зрения;
- слепота;
- у женщин иногда наблюдаются симптомы, похожие на рассеянный склероз.
Шел 1994 год. В офтальмологическую клинику обратился 40-летний пациент с проблемой внезапной потери зрения на обоих глазах. При составлении анамнеза врачи определили, что изначально произошла потеря зрения на одном глазу, затем – на втором. Постепенная слепота не сопровождалась болью. Врачам пациент сообщил, что его брат (на 2 года младше) также несколько лет назад ослеп на один глаз.
Пациент прошел ряд обследований. Но все выводы были негативными, кроме выявления нарушения сердечного ритма. Также было исключено большинство офтальмологических диагнозов, которые могли бы объяснить безболезненную и быструю потерю зрения.
Так можно характеризовать клинический случай синдрома Лебера.
Диагностика и исследования
Подозрение на болезнь часто определяется окулистом или неврологом на основании анамнеза, оценки подробного осмотра глаз, состоящего из контроля остроты зрения, поля зрения, контрастной, цветовой чувствительности.
Золотой стандарт лабораторной диагностики – молекулярно-генетический анализ распространенных мутаций, проводимый из образцов крови или мазка из слизистых оболочек щек. Это обследование проводится у пациентов с уже развитыми нарушениями зрения в рамках дифференциальной диагностики синдрома Лебера, или у бессимптомных членов семьи, еще не подвергавшихся сложному диагностическому процессу. Но у бессимптомных пациентов молекулярно-генетическое тестирование не может предсказать развитие заболевания.
Для исключения распространенных мутаций целесообразно рассмотреть секвенирование генов мтДНК, кодирующих субъединицы в митохондриях, выделенных из мышечной биопсии.

Современные методы лечения
Лечение болезни Лебера – сложный процесс. Пациент должен отказаться от курения, максимально сократить употребление алкоголя, чтобы не повредить зрительный нерв. В терапии также используются некоторые витаминные и оксидазоснижающие соединения, но их эффект спорный.
До недавнего времени единственным вариантом облегчить течение болезни Лебера был коэнзим Q10, который посредством сукцинатдегидрогеназы обходит нефункциональный митохондриальный комплекс, увеличивая продукцию АТФ путем окислительного фосфорилирования.
Но это вещество обладает высокой липофильностью, и при пероральном введении его проникновение в митохондрии вызывает сомнения. Эффективность коэнзима Q10 никогда не была продемонстрирована в клинических исследованиях.

В последние годы было проведено несколько исследований для тестирования новых лекарственных средств. Предположительно, они положительно влияют на стабилизацию и восстановление зрительных функций. Особенно перспективны аналоги Убихинона с короткой цепью: Идебенон и α-токотриенолхинон (EPI-743), замещающие функцию дисфункционального комплекса.
Последствия и прогноз
Генетическая мутация приводит к нарушению функции зрительного нерва, вызывает нарушения зрения. Эти расстройства проявляются относительно рано – у старших подростков и молодых людей. Поражаются оба глаза, снижается острота зрения, в поле зрения могут появляться глазные капли с темными пятнами, переходящие в постоянное явление. Многие пациенты практически теряют зрение.
Профилактика
Поскольку атрофия зрительного нерва Лебера – это наследственная болезнь, ее профилактика сложная. В превентивных целях целесообразно вовремя лечить проблемы, способные стать причиной расстройства.
Следующий пункт – избегание любых ЧМТ, глазных травм. Важен также здоровый образ жизни, отказ от курения, потребления алкоголя.
Читайте также:


