Белки связанные с болезнью альцгеймера
С подобными симптомами сталкиваются люди, страдающие болезнью Альцгеймера. Почему возникает и как проявляется эта болезнь? Можно ли ее предотвратить? Давайте в этом разберемся.
Болезнь Альцгеймера: таинственный враг
Это заболевание является наиболее распространенной формой потери памяти, или деменции. Обычно болезнь Альцгеймера диагностируют у людей старше 65-ти лет, однако она может появиться и в более раннем возрасте. Наиболее часто заболевание начинается с расстройства кратковременной памяти, то есть человек легко забывает полученную недавно информацию, и в то же время легко воспроизводит факты и данные, относящиеся к далекому прошлому. Затем и долговременная память тоже расстраивается, появляется ряд других симптомов.
Есть основания соотнести появление болезни в раннем возрасте с мутацией генов. Также генетики полагают, что в группу риска попадают те, чьи близкие родственники страдают болезнью Альцгеймера.
Болезнь Альцгеймера описывали еще античные врачи. Но окончательно сформулировать ее причины, течение и симптоматику смог немецкий психиатр Алоис Альцгеймер лишь в 1901 году. Через шесть лет он опубликовал подробное исследование течения этой болезни у одной из своих пациенток. С тех пор в медицинском мире это заболевание называют его именем.
Первые симптомы возникают за несколько лет до постановки окончательного диагноза. Эта стадия заболевания называется предеменция. Что же указывает на начало болезни? Прежде всего — это расстройство краткосрочной памяти и затруднения с усвоением новой информации. Также тревожным сигналом может стать невозможность сосредоточиться, распланировать свою деятельность, появление проблем с абстрактным и логическим мышлением, забывание значений некоторых слов. Уже на стадии предеменции может возникнуть апатия, которая в дальнейшем сопровождает заболевание. Этот период специалисты нередко называют мягким когнитивным снижением.
На смену предеменции приходит следующая стадия болезни Альцгеймера — ранняя деменция. Снижение памяти прогрессирует, начинает появляться агнозия — нарушение разных видов восприятия (тактильного, зрительного, слухового). Однако при этом сохраняется чувствительность сознания. Часто отмечается нарушение речи, восприятия, исполнительных и двигательных функций. Что касается событий далекого прошлого, очевидных давно воспринятых фактах, хорошо заученных двигательных повседневных функций, то все это в меньшей степени подвергается забвению по сравнению с новой информацией. Словарный запас на ранней стадии деменции сокращается, снижается скорость речи, может нарушиться координация движений, затрудняя выполнение повседневных бытовых действий.
Затем наступает умеренная деменция, при которой перечисленные выше симптомы усугубляются, все больше нарушается координация движений, утрачиваются навыки чтения и письма. Пациент может выполнять элементарные бытовые функции (одеваться, выполнять гигиенические процедуры и т.д.), но со временем ему и в этом потребуется помощь. Начинает нарушаться долговременная память, появляются поведенческие отклонения, которые обычно обостряются вечером: плаксивость, раздражительность, агрессия, может даже появиться тяга к бродяжничеству. Родственники и близкие при этом могут испытывать стресс, поэтому помещение пациентов, страдающих болезнью Альцгеймера, в специальные учреждения часто является решением проблемы.
Последней стадией болезни является тяжелая деменция. В этот период пациент уже полностью зависит от посторонней помощи, его речь состоит из отрывочных фраз, словарный запас сводится к минимуму. Больного обычно не покидает апатия, его мышечная масса истощается, и все необходимые действия он уже не может выполнять без посторонней помощи, вплоть до приема пищи. Неподвижность в большинстве случаев вызывает пневмонию и пролежневые язвы, что и становится причиной смерти.
Указать однозначно причину заболевания невозможно. На сегодняшний день существует три гипотезы возникновения болезни Альцгеймера, причем каждая из них имеет право на существование и по-своему убедительна.
- Холинергическая гипотеза утверждает, что заболевание вызывает снижение синтеза нейромедиатора ацетилхолина, то есть биологически активного вещества, ответственного за нервно-мышечную передачу. Эта теория появилась первой, но сегодня ученые ставят ее под сомнение, так как использование медикаментов, восстанавливающих баланс ацетилхолина, не дает высоких результатов. Однако данная гипотеза послужила созданию ряда методов поддерживающей терапии при болезни Альцгеймера.
- Амилоидная гипотеза базируется на том, что основной причиной заболевания являются отложения бета-амилоидных пептидов — бимолекулярных конструкций белкового типа. В здоровом состоянии они защищают нервные клетки мозга. Срок их жизнедеятельности невелик, и после выполнения своих функций амилоиды уничтожаются белками-чистильщиками — протеазами, превращающими их в безопасные шлаки, от которых организм затем избавляется. Но если этот механизм нарушается, то защитники нервных клеток превращаются в их убийц. Более того, бета-амилоидные пептиды объединяются друг с другом и становятся недоступны для своих уничтожителей-протеаз. Сегодня эта теория активно разрабатывается учеными в мельчайших деталях и уже принесла ряд значительных результатов.
- Тау-гипотеза рассматривает последовательный ряд нарушений, который происходит в связи с отклонениями в структуре тау-белка — белка, ассоциированного с микротрубочками. Предполагается, что нити этого белка объединяются и внутри нервных клеток образуют клубки, что провоцирует дезинтеграцию микротрубочек и коллапс транспортной системы внутри нейрона. Это ведет к нарушению биохимической передачи между клетками, а затем — к их гибели.
Наследственность, как показали исследования, увеличивает вероятность обретения болезни Альцгеймера, но не является основной причиной болезни.
При первых признаках болезни Альцгеймера следует немедленно обратиться к врачу и кардинально пересмотреть свой образ жизни. Отсутствие двигательной активности, интеллектуальной деятельности, общения, недостаток витаминов, пагубные привычки (алкоголь, курение) могут усугубить болезнь и дать толчок к ее стремительному развитию.
Осмотр больного врачом-неврологом, беседа с пациентом и с проживающими с ним родственниками очень важны при диагностике болезни Альцгеймера. Конкретизируют клиническую картину нейропсихологические скрининг-тесты. В ходе их выполнения пациент запоминает слова, читает, выполняет арифметические действия, копирует изображения.
Также при выявлении болезни используют аппаратуру SPECT- и PET-визуализации. Часто назначается анализ спинномозговой жидкости: он показывает содержание амилоидов и тау-белков.
Учеными из Института биологии РАН совместно с исследователями из МГУ и Лондонского королевского колледжа установлено, что процесс превращения пептидов-защитников в пептидов-убийц может запускаться ионами цинка [1] . Есть основания полагать, что это позволит разработать препараты, блокирующие инициализируемую ионами цинка агрегацию бета-амилоидных пептидов.
Кроме того, существует ряд способов облегчить болезнь Альцгеймера, приостановить ее развитие, смягчить симптомы. Эффективность лечения зависит от своевременной диагностики — чем раньше будет обнаружена болезнь, тем результативнее действуют все принимаемые меры.
На данном этапе развития медицины разработан ряд продуктивных поддерживающих терапевтических процедур для пациентов, страдающих болезнью Альцгеймера. При четком соблюдении всех указаний врача можно смягчить течение болезни и сохранить самостоятельность выполнения повседневных навыков и ясность памяти на долгие годы. В борьбе с болезнью Альцгеймера существует два основных направления.
- Медикаментозная терапия позволяет воздействовать на звенья патологического процесса. Поэтому при болезни Альцгеймера назначают препараты, блокирующие холинэстеразу и препятствующие образованию амилоида и бляшек. Это донепезил [2] , ривастигмин [3] и галантамин [4] . Причем ревастигмин назначают и в форме пластыря, который нужно наклеивать на кожу. Перечисленные выше препараты позволяют улучшить память и речь, помогают концентрировать аниманин и ускорить реакции.
Для улучшения мозгового кровообращения и защиты нейронов назначают церебролизин [5] и актовегин [6] . Для снятия возбуждения и борьбы с бессонницей применяют тиоридазин [7] . Для снятия психоэмоционального напряжения больным прописывают глицин [8] .
Однако следует помнить, что лекарства может назначить только врач с учетом симптоматики каждого пациента. - Психосоциальная терапия дополняет медикаментозное лечение. Она позволяет пациентам на ранних стадиях болезни Альцгеймера адаптироваться к заболеванию. Работа с воспоминаниями, общение, выполнение интеллектуальных задач стимулируют работу мозга и положительно влияют на психоэмоциональное состояние пациента. Подобная работа возможна как индивидуально с каждым пациентом, так и в группах.
Таким образом, универсального лекарства от болезни Альцгеймера не существует. Однако улучшить состояние больного и облегчить течение болезни возможно. Для этого важно как можно скорее поставить диагноз и грамотно подобрать курс лечения.
Комментарий для наших читателей дала Мария Литвинова, заместитель генерального директора по медицинской части Senior Group:
P. S. Senior Group входит в государственный реестр поставщиков социальных услуг по Москве и Московской области.
*Лицензия на осуществление медицинской деятельности № ЛО-50-01-009757 выдана в соответствии с Приказом Министерства здравоохранения Московской области от 5 июня 2018 года № 818.
Болезнь Альцгеймера является формой деменции, группы нейродегенеративных заболеваний, вызванных токсическими скоплениями дефектных белков. Известно, что прионы, которые являются "битыми" версиями белков, вызывают некоторые редкие формы деменции. Эти белки содержат ненормально свернутый белок, который заставляет нормально свернутые белки ненормально складываться и превращаться в аномальную форму приона. Эти новые аномально свернутые белки затем вызывают те же изменения в других белках и в конечном итоге образуют бляшки, которые препятствуют синаптической передаче в мозге (синапсы представляют собой химические соединения между соседними нервными клетками). Получающиеся в результате бляшки приводят к повреждению и гибели нервных клеток, что в конечном итоге приводит к нейродегенеративным заболеваниям, таким как деменция. Пациенты с прионными заболеваниями имеют широкий спектр симптомов: от нарушения работы мозга до изменений личности и трудностей с подвижностью.

Первый прионный белок был открыт в 1980-х годах Стэнли Прусинером, доктором медицины, который был старшим автором нового исследования. В его новой работе исследователи объединили два лабораторных теста для измерения уровня прионов в образцах тканей человека. Методы включают новую систему обнаружения Aβ, созданную в лаборатории Прусинера, и анализ на тау-прионы. Эти клеточные анализы могут измерять уровни инфекционных прионов за три дня, что значительно сокращает время, необходимое для проведения такого рода исследований и анализа. Они позволили исследователям быстро рассчитать количество прионов tau и Aβ в образцах мозга после смерти. Для исследования было проанализировано более 100 образцов вскрытой мозговой ткани, взятых у пациентов, умерших от болезни Альцгеймера, среди других типов нейродегенеративных состояний в США, Европе и Азии.
Результаты показали, что в 75 образцах ткани головного мозга людей, которые умерли от болезни Альцгеймера, Aβ и тау-приона, активность была высокой. 11 образцов от людей, которые умерли от церебральной амилоидной ангиопатии (CAA), содержали только прионы Aβ. 10 образцов лобно-височной долевой дегенерации с тау-патологией (FTLD) содержали только тау-прионы.
Читайте также: ВОЗ: головоломки и таблетки не защитят от деменции
Было также обнаружено, что прионные формы тау и Aβ наиболее распространены у пациентов, которые унаследовали заболевание и умерли от него в более молодом возрасте. В резком контрасте с обычными паттернами, наблюдаемыми на пути болезни у пожилых пациентов, было также обнаружено, что прионные формы тау значительно снижались с увеличением возраста, а не увеличивались в более старшем возрасте.
Была обнаружена сильная корреляция между более молодым возрастом и более высоким уровнем тау-прионов. В среднем, у пациентов, которые скончались в возрасте 40 лет, уровни тау-приона в 32 раза выше, чем у пациентов, которые скончались в возрасте 90 лет. Соавтор исследования химик Уильям ДеГрадо принимал участие в разработке и анализе нового исследования. Он описал анализы как-то, что "изменит правила игры", сказав, что:
"Ранее исследование болезни Альцгеймера ступорилось, когда рассматривало сопутствующее повреждение в виде неправильно сложенных мертвых белков, которые образуют бляшки и треугольники. Теперь выясняется, что именно прионная активность связана с болезнью, а не количество бляшек во время вскрытия".
Фото превью: Shutterstock
Встройте "Правду.Ру" в свой информационный поток, если хотите получать оперативные комментарии и новости:
Подпишитесь на наш канал в Яндекс.Дзен или в Яндекс.Чат
Добавьте "Правду.Ру" в свои источники в Яндекс.Новости или News.Google
Также будем рады вам в наших сообществах во ВКонтакте, Фейсбуке, Твиттере, Одноклассниках.
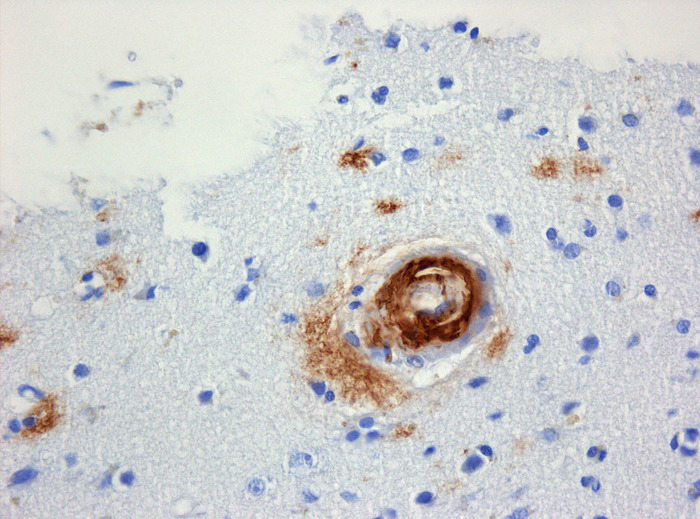
60 лет назад детей с задержкой роста начали лечить гормоном роста, который получали из гипофиза умерших людей. Сейчас ученым удалось раздобыть образцы гормона, который когда-то вводили детям. В них обнаружились белки, вызывающие болезнь Альцгеймера. И исследователи решили проверить, может ли болезнь передаться при трансплантации нервных тканей.
В 1958 году медики придумали, как помочь детям с задержкой развития вырасти быстрее. Им начали вводить донорский гормон роста, который выделяли из гипофиза умерших людей. Процедура действительно способствовала росту детей, но вызывала и побочные эффекты. Как выяснилось через 25 лет, таким образом можно заразить ребенка прионным заболеванием — поражением головного мозга, в ходе которого в нервной ткани и сосудах накапливаются неправильно свернутые белки-прионы.
Самое известное такое заболевание, болезнь Крейцфельда — Якоба, как правило, возникает самопроизвольно, в результате мутаций, или передается при каннибализме.
Три года назад международная группа ученых исследовала фрагменты мозга восьми людей, которые в детстве получали инъекции гормона роста, а в 36—51 год скончались от болезни Крейцфельда — Якоба. И у четверых из них, кроме прионных белков, нашли скопления бета-амилоида — белка, который характерен для болезни Альцгеймера, а у больных прионными заболеваниями обычно не встречается. При этом никаких внешних симптомов, характерных для болезни Альцгеймера, у пациентов при жизни не было. И оставалось непонятным, откуда бета-амилоид возник в мозге пациентов и связано ли это как-то с их прионной болезнью. Но совсем недавно тем же ученым удалось раздобыть и проанализировать остатки гормона роста, который вводили этим людям десятки лет назад.
Теперь у нас есть официальные доказательства того, что болезнь Альцгеймера может быть заразна на белковом уровне.
Эта поучительная история призывает нас тщательнее относиться к подбору донора в операциях, связанных с нервной системой, и, вероятно, поможет нам подробнее разобраться в происхождении болезни Альцгеймера.
![]()
Наши внутренние войска: антитела - что было дальше?
В предыдущем посте я сделал обзор антител или, по-научному, иммуноглобулинов. Пришло время разобраться, какие бывают антитела, как они обезвреживают врага и зачем нужны разные типы иммуноглобулинов. И снова вашим нейронам придется напрячь свои связи, так как пост не самый легкий. Надеюсь, своим объяснениями я никого не сподвигну уйти в профессию "с пониженной социальной ответственностью" (это к комменту) :)
Какие такие антитела?
Несмотря на прошлый пост, давайте немного всколыхнем память и уточним, что такое антитела. Это особые белки, вырабатываемые иммунными клетками B-лимфоцитами. За глобулярную (шаровидную) структуру эти белки называют глобулинами. А за то, что они вырабатываются иммунными клетками, их прозвали иммуноглобулинами.
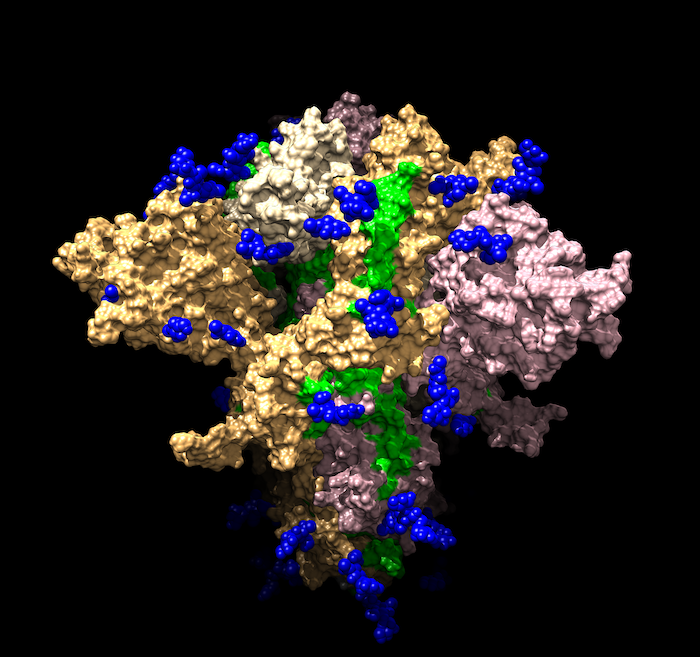
На картинке - модель спайк-белка SARS-CoV-2 (источник). Спайк-белки (S-protein) - это как раз те белки-шипы, которые создают ореол короны вокруг коронавируса. S-протеины обеспечивают проникновение вируса в клетку. Зеленым подсвечены эпитопы (антигенные детерминанты) - участки антигена, с которыми может связаться антитело. Если антитело свяжет белок, то вирус не сумеет проникнуть в клетку.
Каждый B-лимфоцит вырабатывает свой уникальный набор антител.
А все вместе лимфоциты могут синтезировать от нескольких миллионов до нескольких миллиардов различных вариантов иммуноглобулинов. Правда, установить, с каким количеством антигенов способно связаться одно антитело, практически невозможно. Антитело может связаться с узким кругом антигенов, что зависит от химических свойств и совпадения поверхностей антигенсвязывающего центра антитела и активной части антигена (эпитопа).
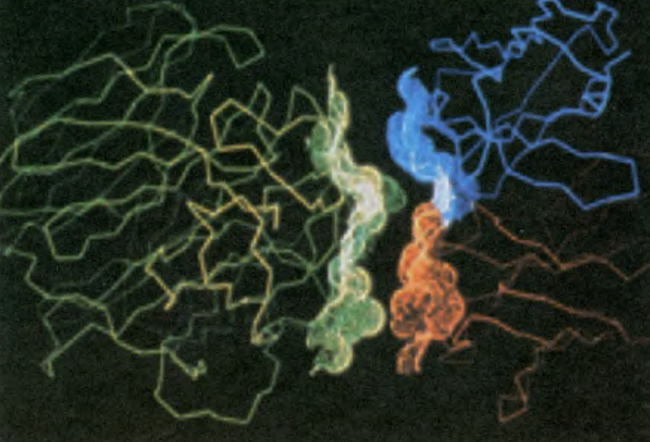
Компьютерная модель взаимодействия антигена вируса гриппа с антителом (антиген слева, антитело справа). Как видите, их поверхности комплементарны, то есть соответствуют друг другу.
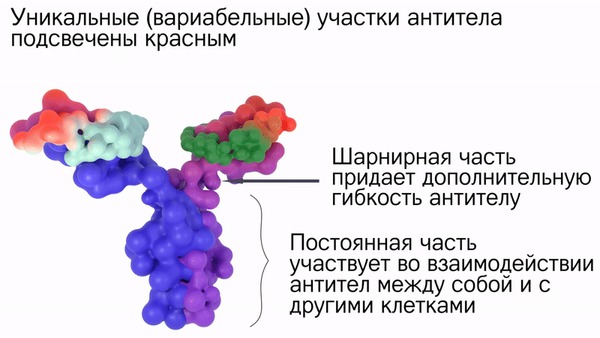
Иммуноглобулин не простой белок, он состоит из двух пар других белков (полипептидов), которые называют цепями. Большие тяжелые цепочки полипептидов называют H-цепи (Hard), легкие - L-цепи (Light).

Отдельные фрагменты антитела связаны между собой дисульфидными связями (связь между двумя атомами серы). Буквой С обозначили не изменяющиеся участки антитела (constant), буквой V - уникальные изменяющиеся участки (variable).
Вариабельная часть антитела (“усы”) содержит антигенсвязывающий центр - тот участок иммуноглобулина, который схватит антиген за его выступающую часть (за эпитоп).
Противоположный конец антитела (Fc-фрагмент, Fragment crystallizable) нужен для кооперации с другими участниками иммунного ответа: с макрофагами, нейтрофилами,
Ещё раз о силе и слабости антител
Также важно понимать, что несколько разных антител (от разных лимфоцитов) могут с разной силой связываться с антигеном. Вообще, антиген и антитело склеиваются не навсегда, и этот союз может распадаться, что зависит от различных химических характеристик. Чем быстрее комплекс антиген-антитело распадется, тем хуже, ведь тогда носитель антигена сможет продолжить своё подлое дело. Для определения силы связи иммуноглобулина с эпитопом придумали термин аффинность. Этот показатель выражается в молях, и чем он меньше, тем лучше. То есть аффинность 10М лучше (сильнее) 100М. А на самом деле, эти значения гораздо меньше - от 10 в минус 7 степени до 10 в минус 11.
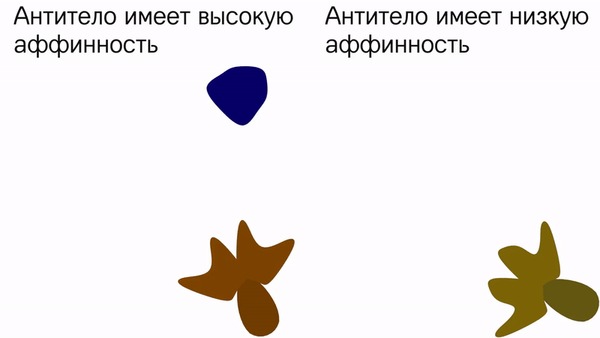
Ещё выделяют понятие специфичности антитела. Чем более узкий круг антигенов может связать антитело, тем оно специфичнее. Идеальная специфичность - это когда антитело может связать только одну конкретную молекулу. Но в жизни идеал не достижим, и обычно антитело может связать несколько очень похожих антигенов. Низкая специфичность означает, что иммуноглобулин способен связаться со многими антигенами (условно многими), но эти связи достаточно слабые. То есть низкая специфичность означает слабую аффинность, и наоборот - высоко специфичные антитела имеют сильную аффинность. Иммуноглобулины с низкой специфичностью подобны дружинникам - они могут быстро схватить почти любого нарушителя, но не сумеют его долго удержать. А вот высокоспецифичные антитела похожи на отряд специального назначения - их меньше, их нужно дольше обучать, зато действуют они быстро и эффективно.
Как антитела убивают врагов
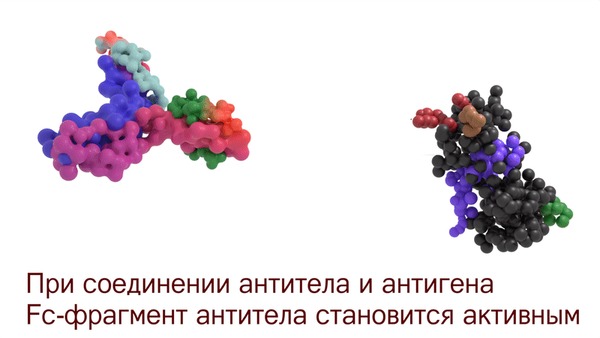
Антитела защищают наш организм с помощью нескольких механизмов. Чтобы остальные участники иммунитета узнали, когда антитело связалось с антигеном, существует специальный механизм. Иммуноглобулин, который прилип к антигену, изменяет свой Fc-фрагмент таким образом, что к нему могут присоединиться лейкоциты и некоторые иммунные белки. Без активации антигеном антитело никому не даст потрогать свой Fc-фрагмент.
Непосредственно связывая вредную молекулу, антитела могут нейтрализовать действие яда и токсинов. Связанный яд не сможет проникнуть в наши клетки или воздействовать на рецепторы. Конечно, если доза токсина большая, и поступил он быстро, то антитела не спасут (не успеют). Антитела против ядов и токсинов можно вводить в виде лекарств. К примеру, противостолбнячная и противодифтерийная сыворотки содержат готовые антитела против токсинов столбняка и дифтерии. Кстати, за разработку этих сывороток немецкий иммунолог Эмиль фон Беринг получил Нобелевскую премию. Какие ещё примеры есть? Сыворотки против яда гадюки или каракурта содержат, как вы догадываетесь, антитела против этих ядов. Антирабический иммуноглобулин вводят против бешенства (в случае укуса больным животным). Получают такие антитела путем иммунизации животных (животным вводят токсин, и у них вырабатывается иммунитет с антителами).
Анимация иллюстрирует, как антитело связывает токсин, и связанный токсин не может проникнуть в клетку.
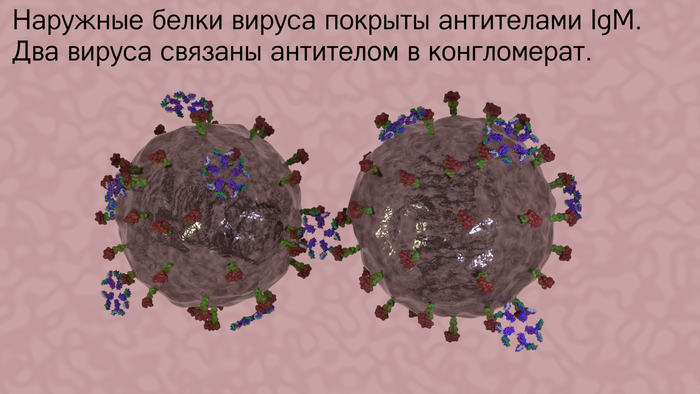
Антитела, прилипшие к вирусу, блокируют его патогенную (болезнетворную) активность, не позволяя проникнуть внутрь клетки (вирусы могут жить только внутри клеток). Кроме того, антитела могут связывать несколько вирусных частиц в единый конгломерат и делать врага более уязвимым. Противовирусные антитела также можно вводить больным в виде сыворотки. Например, против вируса Эбола была изобретена сыворотка ZMapp на основе антител (с использованием генной инженерии). Для лечения новой коронавирусной инфекции применяют сыворотку из крови больных, переболевших COVID-19. Обратите внимание, что это не вакцинация, а пассивная иммунизация (иммунитет не вырабатывается, а получается извне).
Тандем антиген-антитело называют иммунным комплексом (ИК). К Fc концу антитела может присоединиться фагоцит и проглотить этот комплекс. Фагоциты ужасно возбуждаются, когда встречают связанные антитела. Внутри фагоцита ИК переварится внутриклеточными ферментами. Также к свободному концу активного антитела может прицепиться один из белков комплемента (группа белков врожденного иммунитета). А комплемент, в свою очередь, может прилипнуть к эритроциту. Эритроцит транспортирует иммунные комплексы в селезенку и печень, где макрофаги расщепляют антиген-антитело. Да, эритроциты тоже участвуют в иммунитете.
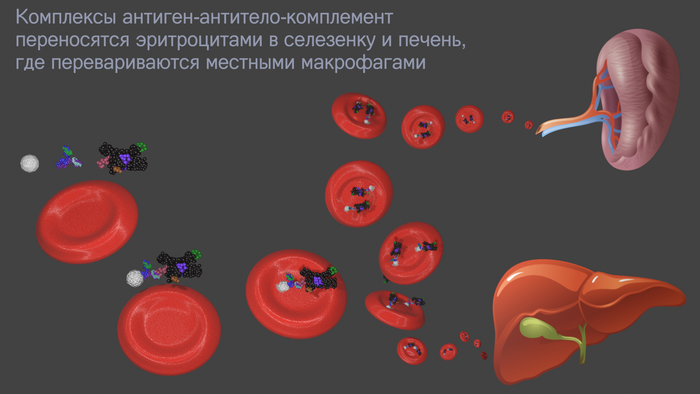
Циркулирующие иммунные комплексы могут оказывать повреждающее действие на организм (например, если их слишком много или присутствуют иммунные дефекты). Оседая в разных тканях (особенно в сосудах), ИК вызывают локальное повреждение органа (например, гломерулонефрит, некоторые артриты).
Антитела, облепившие бактериальную клетку, активируют макрофаги и нейтрофилы. Эти клетки как бы цепляются за Fc фрагмент антитела и начинают фагоцитировать микробную клетку. Кроме того, антитела, облепившие опухолевые клетки, активируют цитотоксическую (клеткоубийственную) активность особых лимфоцитов - натуральных киллеров. Как вы уже знаете, антитело умеет связываться и с комплементом. Но в случае бактерий активированный комплемент способен формировать поры в микробной клетке, в результате чего та погибает. Ещё антитела могут склеивать бактериальные клетки между собой, нарушая процесс их жизнедеятельности.
Типы антител
В зависимости от структуры Н-цепей выделяют 5 классов (изотипов) молекул иммуноглобулинов - IgM, IgG, IgA, IgD и IgE. Кроме разницы в строении тяжелых цепей, растворимые формы иммуноглобулинов M и A представлены пентамером и димером. “Мер” здесь означает повторяющуюся часть, а приставки “ди” - два и “пента” - пять. То есть IgM состоит из пяти повторяющихся молекул, а IgA - из двух. Остальные антитела называются мономерами (“моно” - один).
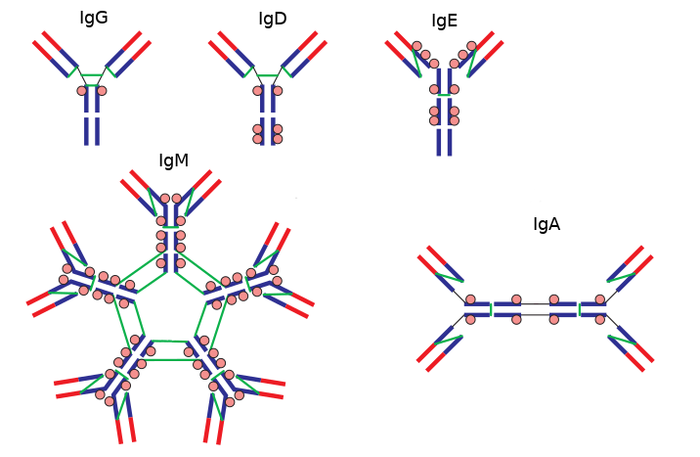
В процессе иммунного ответа B-лимфоциты способны переключать синтез иммуноглобулинов с одного класса на другой, например, с IgM на IgG. При этом вариабельная часть остается той же.
Но зачем нам нужны эти пресловутые классы? Ведь антитела и так до безумия уникальные, к чему природа придумала ещё и изотипы. Разберем отдельно, что делает каждый класс иммуноглобулинов.
IgM - первое антитело, которое начинает вырабатывать B-лимфоцит в ответ на инфекцию. Более того, с этого иммуноглобулина начинается жизнь зрелого лимфоцита - это его аттестат зрелости. IgM вырабатывается при первичной встрече с инфекционным агентом. Это происходит, примерно, на 3 - 4 день от начала инфекции. Антитело имеет слабую аффинность и низкую специфичность, зато у IgM аж десять антигенсвязывающих центров, что, в конечном итоге, дает ему неплохие шансы на сдерживание врага. Иногда десять слабых рук прочнее держат, чем две сильные. Наибольшее количество IgM вырабатывается к 4 - 6 дню, а снижается концентрация к 10-му дню. Антитела этого класса призваны максимально быстро реагировать на новую инфекцию, пусть и с низкой аффинностью. Повышение IgM к конкретному возбудителю свидетельствует об остром инфекционном процессе (заболел впервые, разгар болезни). Кроме того, в крови всегда присутствует небольшое количество IgM, которое вырабатывается в ответ на обычные антигены, поступающие с поверхности кожи и слизистых оболочек. Именно антитела класса M отвечают за развитие гемотрансфузионного шока при переливании не подходящей группы крови. Молекулы IgM большого размера, они не проникают через плаценту и не попадают в кровь плода (поэтому не страшно, если у плода и мамы разные группы крови). IgM обладает самой высокой способностью активировать комплемент. Достаточно одной молекулы IgM на поверхности бактерии, чтобы запустить активацию комплемента.
IgG - вырабатываются вслед за иммуноглобулинами класса М. Это более специфичные антитела, аффинность их гораздо выше. Чтобы синтезировать антитела, максимально подходящие к конкретному антигену, каждый B-лимфоцит начинает производить антитела, чуть-чуть отличающиеся друг от друга. Лимфоцит как бы ищет подходящую конфигурацию, и, в конце концов, получает антитело с максимальной аффинностью к данному антигену. Это процесс называется созреванием аффинности. Подробнее о нем я расскажу в следующем посте. Для выработки таких высокоспецифичных антител нужно время, поэтому IgG начинает вырабатываться позже (пик достигается на 10 - 14 день). Среднее время жизни этого антитела до 2х месяцев (но может быть и больше). Небольшое количество антител может сохраняться в течение всей жизни. При повторной встрече с антигеном (повторная инфекция) клетки памяти B-лимфоциты начинают сразу вырабатывать IgG в больших количествах, что позволяет не допустить развитие болезни. Повышение IgG свидетельствует о недавней первичной инфекции или о повторном инфицировании после ранее перенесенной болезни (в том числе после вакцины). Например, повышение IgG против глистов говорит о повторной инвазии возбудителя (то есть человек опять заразился). Эти иммуноглобулины единственные проникают через плаценту в кровь и обеспечивают иммунитет плода и новорожденного малыша до 2 - 3 месяцев. Но и эти же антитела отвечают за развитие резус-конфликта (IgG резус-отрицательной матери атакует эритроциты резус-положительного плода).
IgA называют секреторным антителом. Секретом обозначают жидкость, выделяемую определенными клетками (например, слюна - секрет, вырабатываемый слюнными железами). Антитела класса A плавают в крови, а также присутствуют в слюне, слезах, молоке и на слизистых оболочках. Эти антитела усиливают защитные свойства пищеварительного тракта, дыхательных, половых и мочевыделительных путей. Они тоже вырабатываются после IgM и достигают пика на 5 - 6 день; живут около 12 дней. IgA не умеет связываться с комплементом и бактериальными клетками, но предохраняет слизистые оболочки от бактериальных токсинов, а также от вирусов. У детей первых месяцев жизни IgA отсутствует или мало вырабатывается, основную часть малыши получают с молоком матери. Кстати, молоко матери содержит все виды антител, а также цитокины, которые помогают ребенку формировать иммунную систему.
IgE присутствует в крови в очень малых количествах. Его основная дислокация - в слизистых желудочно-кишечного тракта и в бронхах и легких. Эти антитела участвуют в противогельминтном иммунитете. Облепливая яйца паразитов и тела взрослых особей, IgE активирует эозинофилы, которые выделяют различные токсические вещества. IgE принимает непосредственное участие в аллергиях немедленного типа (крапивница, анафилактический шок, аллергический насморк и другие). IgE активирует базофилы и тучные клетки, задача которых обеспечить приток крови и миграцию других лейкоцитов к месту воспалительных событий. Срок жизни - около четырех суток, на базофилах и тучных клеток могут находиться до двух недель.
IgD долгое время оставался темной лошадкой, да и сейчас его функция до конца не ясна. В настоящее время известно, что он участвует в распознавании антигена и помогает активировать B-лимфоцит.
На этом, пожалуй, стОит закончить. В следующем посте я планирую рассказать о развитии B-лимфоцитов и о том, как получается такое громадное многообразие антител. Всем доброго здоровья и хороших высокоспецифичных антител!
Читайте также:


