Билирубиновая энцефалопатия билирубиновая интоксикация
Билирубиновая энцефалопатия (именуемая также ядерной желтухой) - состояние, характеризующееся гибелью мозговых клеток вследствие токсического влияния на них высокой концентрации билирубина (непрямой фракции). Подобное состояние наиболее часто встречается у новорожденных и требует немедленного лечения, в противном случае может привести к инвалидизации и даже гибели пациента.
Этиология болезни
Возможные причины билирубиновой энцефалопатии у новорожденных следующие:
- гемолитическая болезнь (резус- либо групповая несовместимость мамы и малыша);
- сахарный диабет у матери;
- сепсис новорожденного;
- травматизация ребенка при родах с формированием обширных гематом;
- токсоплазмоз (внутриутробное заражение);
- желтуха у недоношенных деток.
Под влиянием какого-либо из перечисленных процессов непрямой билирубин (то есть непереработанный гепатоцитами) в большом количестве выбрасывается в кровь, оказывая нейротоксическое воздействие на мозговые ткани.
Патоморфологические признаки
Поверхность головного мозга имеет бледно-желтый оттенок. Срез препарата выявляет характерную желтую окраску мозговых структур (мозжечка, гиппокампа, таламуса, ствола и других). Однако непрокрашенные области также претерпевают патологические изменения.
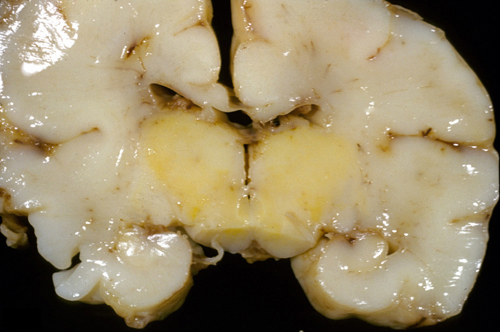
В пораженных областях вследствие гибели нейронов формируется глиоз и происходит атрофия нервной ткани. При этом патоморфологическая картина сходна с таковой при гипоксическом поражении, а значит, с большой долей вероятности можно предполагать, что несвязанный билирубин, повреждая клеточные мембраны, приводит к нарушениям утилизации кислорода в мозговых тканях. А гипоксическое повреждение приводит к еще большему увеличению чувствительности нейронов к токсическим эффектам билирубина.
То есть, ядерная желтуха (билирубиновая энцефалопатия) - это не только изменение окраски мозговых структур под действием билирубина. Это также целый ряд патологических специфических процессов, происходящих на уровне клетки.
Билирубиновая энцефалопатия у взрослых
Причины поражения мозговых структур билирубином у взрослых кроются в тяжелых декомпенсированных патологиях печени (циррозы, гепатиты).
Недуг у взрослых развивается постепенно и сопровождается нарастанием неврологической симптоматики. При этом на первый план выходят нарушения психики и двигательной активности, проявляющиеся бессонницей, когнитивными изменениями, понижением активности и так далее.
Клинические проявления
Чаще всего первые признаки патологии возникают у доношенных деток на 2-5 сутки, а у недоношенных - на 7 сутки. Но присутствие гипербилирубинемии может приводить к развитию недуга в течение всего времени новорожденности (до 28 суток).
Ранние симптомы такой энцефалопатии неспецифичны и могут совпадать с таковыми при гипогликемии, сепсисе, внутричерепных кровоизлияниях, гипоксии и других патологических острых состояниях новорожденного.
Как правило, первыми признаками начинающегося поражения мозга становятся снижение сосательного рефлекса, сонливость, пропадание рефлекса Моро. По мере ухудшения (прогрессирования) болезни пропадают сухожильные рефлексы, нарушается дыхание, возникает опистотонус, большой родничок напряжен, лицевые мускулы и мышцы конечностей судорожно подергиваются, ребенок пронзительно кричит.
Затем появляются судороги, сопровождающиеся резким разгибанием ручек и поворотом кистей, сжатых в кулачки, вовнутрь.
Дальнейшая активность процесса часто приводит к гибели, в другом случае состояние ребенка улучшается, и развитие соответствует норме. Однако к году вновь возникает ригидность мускулов, опистотонус и гиперкинезы. Ко второму году жизни судороги и опистотонус исчезают, однако непроизвольные беспорядочные движения, сочетающиеся с гипотонией либо ригидностью мускулов сохраняются и приобретают устойчивый характер.
В трехлетнем возрасте билирубиновая энцефалопатия у детей обретает стойкий и четкий характер, что проявляется тугоухостью на звуки с высокой частотой, хореоатетозом, судорогами, дизартрией, косоглазием, олигофренией, экстрапирамидными нарушениями. Иногда встречается атаксия, гипотония и пирамидные расстройства.
При легком течении билирубиновой энцефалопатии последствия могут проявляться в виде тугоухости, умеренных либо легких нарушений двигательной координации, синдрома гиперактивности в сочетании с нарушенным вниманием (минимальная мозговая дисфункция). Такие симптомы могут сочетаться либо присутствовать по отдельности. При этом энцефалопатия может быть не диагностирована вплоть до поступления в школу.
Стадийность процесса
Патология имеет четыре стадии развития:
- Симптомы билирубиновой энцефалопатии неспецифичны: присутствует слабость, рвота, монотонный безэмоциональный крик. Тонус мышц и аппетит снижены.
- Появляются симптомы энцефалопатии, конечности малыша согнуты, разогнуть их при этом невозможно, подбородок приведен к груди, ребенок неестественно вскрикивает. В некоторых случаях возможна гипертермия и эпизоды апноэ.
- Состояние больного (чаще 10-12 сутки жизни малыша) заметно улучшается, однако явление это не связано с выздоровлением, напротив - процесс прогрессирует. Скованность мышц отступает, отсутствуют судороги.
- Развивается на 2 месяце жизни малыша. Симптоматика нарастает. Присутствуют признаки, сходные с таковыми при церебральном параличе. Ребенок значительно отстает в психоэмоциональном и физическом развитии.
Диагностические мероприятия
Гипербилирубинемия может расцениваться как физиологическая только в случаях исключения абсолютно всех патологических факторов ее появления. Беря во внимание тот факт, что гипербилирубинемия наиболее часто является следствием гемолитических либо физиологических причин, обследование пациента должно включать следующие анализы:
- исследование крови (общее) с обязательным вычислением количества ретикулоцитов и микроскопией кровяного мазка;
- проба Кумбса (непрямая и прямая);
- выяснение групповой и резус-принадлежности крови матери и малыша;
- определение количества непрямого и прямого билирубина;
Увеличение содержания в пуповинной крови билирубина, наличие симптомов желтухи в первые сутки жизни, если уровень неконъюгированной фракции более 34 мкмоль/л указывают на присутствие патологической желтухи.
В некоторых случаях могут назначаться при билирубиновой энцефалопатии МРТ, УЗИ и КТ.
Терапия состояния
Терапией ядерной желтухи у малышей (вне зависимости от ее стадии) занимается детский невропатолог. Как правило, таких деток госпитализируют.
Лечение недуга у взрослого также проводится в условиях стационара под постоянным контролем врача.
Лечение заболевания заключается в ликвидации причин гипербилирубинемии и восстановлении нормальной концентрации билирубина в крови. В качестве лечения при этом используется фототерапия.
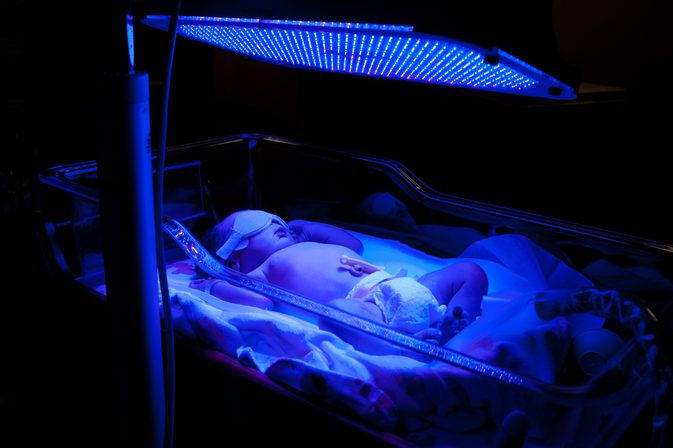
Под влиянием излучения токсичный непрямой билирубин трансформируется в особый изомер, который легко выводится почками и печенью и при этом не связывается с кровяными альбуминами. В случаях, когда концентрация билирубина под влиянием фототерапии не понижается, назначается переливание плазмы.
Если предыдущие методики оказались неэффективными, либо симптоматика стремительно нарастает, пациенту назначаются прямые переливания крови.
Применяемые препараты
Если по каким-то причинам прямое переливание невозможно, назначаются лекарства, влияющие на синтез и трансформацию билирубина ("Протопорфирин").
Вследствие того, что ядерная желтуха - результат токсического воздействия билирубина на нейроны, в лечении ее всегда применяются нейропротекторы.
При наличии показаний назначается противосудорожное лечение.
В случае гемолитической болезни с наличием прямой положительной реакции Кумбса эффективны внутривенные вливания иммуноглобулина.
Частота возникновения, последствия и прогнозы
Согласно данным аутопсии, ядерная желтуха возникает у новорожденных в любом гестационном возрасте при отсутствии адекватной терапии гемолитической болезни и концентрации билирубина свыше 25-30 мг.
Частота возникновения недуга у недоношенных деток с гипербилирубинемией варьируется от 2 до 16 %. Более точные цифры определить невозможно вследствие большого разнообразия симптомов болезни.
Присутствие выраженного неврологического симптомокомплекса является неблагоприятным прогностическим признаком. Так, летальность при этом доходит до 75 %, а 80 % выживших пациентов имеют двусторонний хореоатетоз, сопровождающийся мышечными непроизвольными сокращениями. Кроме того, достаточно часто встречаются осложнения в виде глухоты, олигофрении и спастической тетраплегии.
Детки с гипербилирубинемией в анамнезе должны быть обязательно обследованы на предмет глухоты.
Несмотря на улучшение диагностики, ядерная желтуха все же имеет место. Встречается информация о возникновении ее на фоне гипербилирубинемии без наличия каких-либо причин. А потому специалисты рекомендуют проводить обязательный контроль билирубина на 1-2 день жизни всем новорожденным, дабы выявить пациентов с высокой вероятностью развития тяжелой гипербилирубинемии и, как следствие, энцефалопатии.
Профилактические меры
Важно обязательное исследование концентрации билирубина в случае возникновения желтухи в первый день жизни, а при наличии гипербилирубинемии - исключение развития гемолитической болезни.
Обязателен контроль состояния младенца в течение 3 суток после выписки, особенно это касается недоношенных (до 38 недель) деток, которые были выписаны из родильного отделения до наступления 2 суток жизни.
Частота наблюдения обуславливается возрастом, при котором малыш был выписан, и присутствием факторов риска. Некоторых деток наблюдают в течение суток. Спрогнозировать риски можно, оценив уровень почасового прироста билирубина.
Билирубиновая энцефалопатия возникает в результате воздействия непрямого билирубина на центральную нервную систему.
- Преходящая гипербилирубинемия
- Когда норма становится патологией?
- Почему развивается патологическая гипербилирубинемия?
- Причины гемолиза
- Нарушенная конъюгация билирубина
- Клиническая картина
- Профилактика билирубиновой энцефалопатии
Временное увеличение концентрации билирубина в крови в течение первых нескольких дней после появления на свет развивается у многих малышей и считается нормой. У недоношенных и у части доношенных новорожденных возникают признаки желтухи (при превышении порога в 70 мкмоль/л).

Желтуха новорожденных может быть физиологической или патологической
Преходящая гипербилирубинемия
В отсутствие всякой патологии, билирубин в крови повышается в связи с рядом особенностей протекания физиологических процессов в организме новорождённых, а именно:
- Сравнительно небольшим сроком жизни эритроцитов с фетальным гемоглобином.
- Физиологической полицитемией.
- Общим преобладанием катаболических процессов над анаболическими.
- Сниженной функциональной активностью печени, замедлением захвата и выведением ею билирубина.
- Поступлением части крови от кишечника напрямую в нижнюю полую вену (мимо печени).
При подобном физиологическом состоянии важной задачей для врачей является наблюдение за младенцем и быстрое оказание помощи ребенку в случае, если оно примет характер патологии.
Когда норма становится патологией?
Таким образом, физиологическая желтуха, появившись спустя примерно сутки после родов, нарастает на протяжении нескольких дней и начинает угасать к концу первой недели жизни ребенка. В случае если все протекает нормально, кожа новорожденного на это время приобретает оранжевый оттенок, но при этом кал и моча сохраняют свой обычный цвет, печень и селезенка младенца не увеличиваются, а общее состояние остается удовлетворительным.
Если же желтуха появляется раньше или позже, стремительно нарастает, продолжается слишком долго (более 1 недели), сопровождается расширением границ селезенки и печени или утяжелением состояния ребенка в целом, то это признак патологической гипербилирубинемии.
Почему развивается патологическая гипербилирубинемия?
В основе данного явления лежат следующие причины:
- избыточная продукция билирубина в случае повышенного разрушения клеток крови (гемолиза);
- сниженный захват билирубина клетками печени ─ гепатоцитами, что говорит об их неполноценной работе;
- нарушение выделения билирубина в кишечник и его выведения;
- сочетание плохого захвата билирубина гепатоцитами и замедленного его выведения.
Билирубиновая энцефалопатия, возникающая у новорожденных, представляет собой ситуацию, опасную для здоровья и жизни ребенка. Ее причиной чаще всего становится усиленный гемолиз или устойчивое нарушение захвата непрямого билирубина клетками печени.

Резус-конфликт возникает, когда у матери отрицательный резус, а ребенок наследует положительный резус от отца
Наиболее часто встречающимися причинами развития гемолиза у детей на первой неделе жизни являются:
- различия крови матери и ребенка по белкам, находящимся на поверхности эритроцитов (AB0, Rh);
- аномалии строения эритроцитарных мембран, а также ошибки строения цепей гемоглобина (талассемии);
- применение некоторых медикаментов (высокие дозировки викасола);
- некоторые врожденные болезни инфекционного генеза (сифилис, цитомегаловирусная инфекция, краснуха и т.п.);
Для того, чтобы из непрямого билирубина, обладающего токсическими свойствами, образовался обезвреженный непрямой, должна беспрепятственно пройти реакция связывания билирубина в клетках печени ─ гепатоцитах.
Последствие нарушения данного процесса ─ так называемая, конъюгационная желтуха. Такое состояние возникает при ряде наследственных заболеваний: синдроме Жильбера и т.д.
Клиническая картина

Клиническая картина билирубиновой энцефалопатии складывается из четырех следующих друг за другом периодов заболевания
Течение билирубиновой энцефалопатии состоит из 4 фаз:
Возникновение билирубиновой энцефалопатии должно быть вовремя предупреждено, если же оно все-таки наступило, то помощь ребенку должна быть оказана в скором порядке еще в течение первой фазы заболевания.
При появлении билирубиновой энцефалопатии основным методом лечения является как можно более скорое обменное переливание крови.

Заменное переливание крови является эффективным способом удаления из организма новорожденного токсичных продуктов гемолиза
Профилактика билирубиновой энцефалопатии
Врачи сразу, при появлении на свет малышей, выделяют детей, у которых в высокой степени возможно развитие гемолитической болезни, в особую группу риска. К ним относят, прежде всего, малышей, чья кровь несовместима с материнской по эритроцитарным антигенам.
У них в крови определяют количество непрямого билирубина, гемоглобина, фиксируют ее групповую принадлежность и резус-фактор.
По результатам проведенных анализов, малышей принимают решение наблюдать, использовать фототерапию или переходить к более решительным действиям. Билирубин, под действием света синих люминесцентных ламп, меняет свою структуру и утрачивает свою токсичность.

Облучение тела новорожденного с помощью флюоресцентной лампы
Если у ребенка концентрация непрямого билирубина в крови нарастает со скоростью более 6,8 мкмоль/л/час (несмотря на проводимое лечение), то врач имеет право назначить применение препаратов, содержащих человеческий иммуноглобулин. При необходимости может быть назначен повторный курс. В крайнем случае, прибегают к обменному переливанию крови.
Если же ребенок рождается уже с признаками гемолитической болезни (бледная желтушная кожа, отечность, увеличенные печень и селезенка), не дожидаясь результатов лабораторных исследований, переходят к переливанию крови.
Таким образом, билирубиновая энцефалопатия новорожденных является состоянием, которое несет существенную угрозу для здоровья и жизни малыша, поэтому все усилия врачей должны быть направлены на его профилактику, своевременное выявление и оказание необходимой помощи.
Острая билирубиновая энцефалопатия (ОБЭ) и ядерная желтуха (ЯЖ) – не синонимы, а острая и хроническая стадии одного состояния, развитие которого можно иногда предсказать, а усугубление предотвратить.
Почему это важно:
Оценка состояния по общему билирубину, ранняя выписка, недооценка факторов риска приводят к гиподиагностике этих состояний, позднему началу лечения и последующей инвалидизации.
Краткое содержание: ОБЭ протекает в течение первой недели жизни имеет три фазы, представляющие собой последовательное утяжеление симптомов.
- 1 фаза (3-5 дней): гипотония, слабый рефлекс Моро, затруднения при кормлении.
- 2 фаза (вариабельно) : ступор, возбудимость, альтернирующий гипертонус экстензоров, опистотонус, мозговой крик
- 3 фаза – (после 1 нед) : гипотонус , спазм пронаторов, “заходящее солнце”, лихорадка, нарушения кормления, апноэ, ДН, судороги, кома.
Вероятность летального исхода ОБЭ составляет 21%, его причиной обычно являются дыхательная недостаточность и рефрактерные судорожные приступы.
Если симптомы были купированы на 1-2 фазе ОБЭ, дальнейшего прогрессирования в ЯЖ не происходит. Однако при достижении 3 фазы картина ЯЖ развивается в 84% случаев.
1 фаза ЯЖ протекает до 1 года – с гипотонией, гиперрефлексией, задержкой развития. Вторая фаза начинается со 2 года жизни и представляет собой тетраду резидуальных явлений – нарушения слуха, зрения, аномалии зубов и экстрапирамидные нарушения. Данные симптомы могут иметь разную выраженность. Нередко слуховую нейропатию принимают за сенсоневральную тугоухость, однако при ЯЖ страдают ядра слухового нерва в стволе, а волосковые клетки интактны. Характерным признаком зрительных нарушений считают “напуганный вид” ребенка – сочетание паралича взора вверх и лицевой дистонии.Для патологии зубов характерно гипоплазия эмали и ее прокрашивание в зеленый цвет. Экстрапирамидные нарушения представлены дистонией, атетозом, хореей. Когнитивная сфера остается относительно сохранной. В качестве возможных механизмов развития ОБЭ и ЯЖ рассматривают нейровоспаление, перекисное окисление липидов, эксайтотоксичность и истощение запаса Выявленные факторы риска можно разделить на группы в зависимости от влияния на звенья патогенеза:
- Сепсис, недоношенность, лихорадка, ацидоз, действия некоторых ЛС приводят к нарушению связывания билирубина с альбумином;
- Гемолиз, связанный с гемолитической болезнью новорожденного, сепсисом и дефицитом Г6ФД являются причиной повышенного уровня свободного билирубина;
- Генетические факторы (дефицит Г6ФД), недоношенность, сепсис, гиперосмолярность, гиперкапния, азотемия обуславливают высокую проницаемость ГЭБ и усиленное проникновение свободного билирубина в нейроны.
В связи с гиподиагностикой ОБЭ и ЯЖ, авторы предлагают использование шкал BIND (bilirubin-induced neurologic dysfunction scale – базовая) и M-BIND (расширенная) для оценки ОБЭ и две шкалы KSD toolkits для диагностики ЯЖ. Первые включают в себя оценку сознания, мышечного тонуса и характера плача (в BIND-M – дополнительно глазодвигательные нарушения) и позволяют характеризовать ОБЭ как стертую, умеренную или выраженную. KSD toolkit состоит из двух частей – первая позволяет определить ЯЖ как возможную, вероятную или достоверную, а вторая – определяет тип (моторная или слуховая) и выраженность ЯЖ. BAER (brainstem auditory evokes response) – АСВП (акустические стволовые ВП) – позволяют выявить нарушения слуха, которые коррелируют с уровнем ОБ, а также оценивать эффективность лечения в динамике.
На МРТ при ОБЭ в Т1-взвешенных изображениях отмечают гиперинтенсивный сигнал от бледного шара и субталамических ядер, в то время при ЯЖ те же области обычно гиперинтенсивны и в Т2-ВИ.
По мнению авторов, определение степени гипербилирубинемии по общему билирубину (ОБ) недостаточно адекватно отражает тяжесть поражения, так как не оценивает саму токсическую фракцию. Уровень свободного билирубина может быть значительным и при невысоких значениях ОБ – в связи с гипоальбуминемией, ацидозом, действием ЛС и другими состояниями. Поэтому необходимо ориентироваться на совокупные данные нескольких диагностических методов. Для лечения в настоящее время применяются фототерапия, заместительное переливание крови, ВВИГ и фенобарбитал, который в последнее время используют все реже в виду его токсичности. Нормальный уровень ОБ у новорожденных – 100-200 мкмоль/л, 300 мкмоль/л – пограничное состояние, рекомендуется наблюдение и при наличии факторов риска – начало лечения , 400 мкмоль/л – показание к началу терапии.
Резюме: ОБЭ и ЯЖ являются континуумом, а не одним заболеванием. ОБЭ представляет собой острую фазу, переходу в хроническую- ЯЖ – способствует реализация факторов риска, таких как сепсис, недоношенность, генетическая предрасположенность и другие. Настороженность и правильная интерпретация минимальных симптомов ОБЭ, раннее начало терапии позволяют предотвратить трансформацию в ЯЖ и избежать инвалидизации.
Билирубиновая энцефалопатия – тяжелое поражение головного мозга у новорожденных, вызванное воздействием на его структуры непрямого билирубина.
Причины и механизмы развития
Основной причиной билирубиновой энцефалопатии бывает гемолитическая болезнь новорожденных, возникающая вследствие несовместимости материнской крови с кровью ребенка по группе или резус-фактору. Кроме того, возможны следующие причины желтухи у новорожденных:
- конъюгационная (временная, переходящая) желтуха недоношенных;
- сепсис;
- гипотиреоз (недостаточность функций щитовидной железы);
- обширные синяки (например, последствия родовой травмы), геморрагии;
- наследственные желтухи;
- токсоплазмоз;
- сахарный диабет у матери.
При высокой концентрации (свыше 0,1-0,2 г/л) непрямого билирубина (то есть токсичного билирубина, не обработанного печенью) повышается проницаемость гематоэнцефалического барьера, препятствующего попаданию в мозг опасных для него веществ. Происходит поражение тканей мозга, преимущественно подкорковых ядер, а также структур мозжечка. При этом нарушается обмен веществ в тканях мозга, причем поражение происходит как токсичным билирубином, так и собственными иммунными клетками, проникшими за защитный барьер.
Клиническая картина
Типичная картина складывается из четырех следующих друг за другом периодов заболевания.
В первую фазу преобладают неспецифические симптомы отравления: слабость, вялость, сниженный тонус скелетных мышц, снижение аппетита вплоть до полного отказа от еды, отрыжка, рвота, монотонный крик.
Во вторую фазу появляются характерные для ядерной желтухи симптомы: ребенок занимает вынужденное положение тела: конечности согнуты в суставах и не разгибаются, пальцы рук плотно сжаты в кулак. Попытка привести подбородок ребенка к его груди оканчивается резким болезненным криком.
Периодически возникают судороги, возможны эпизоды резкого возбуждения, сопровождающиеся криком. Лицо ребенка постоянно подергивается или вообще не выражает никаких эмоций. Возможны эпизоды остановки дыхания и повышенной температуры тела. Симптомы со временем ухудшаются.
Третья фаза называется также периодом ложного благополучия: неврологическая симптоматика может полностью исчезнуть, уменьшается зажатость мышц, прекращаются судороги. Такой картине, как правило, соответствует середина второй недели жизни новорожденного.
В четвертый период заболевания, начинающийся на втором-четвертом месяце жизни, вся неврологическая симптоматика возвращается и усугубляется. Появляются парезы и параличи, нарушения слуха, разворачивается картина детского церебрального паралича, наблюдается явная задержка нервно-психического и физического развития.
Профилактика и лечение
Для предупреждения повреждения мозга у новорожденных в родильных домах берут анализы крови на непрямой билирубин. При высоких цифрах назначают препараты, ускоряющие вывод билирубина из крови, а также используют другие способы лечения (например, билирубин можно разрушать специальными ультрафиолетовыми лампами).
Новорожденным с высокими цифрами билирубина, входящим в группу риска (с родовыми травмами, незрелым и недоношенным, с обширными повреждениями мягких тканей во время родов, ранним появлением желтухи, тяжелой формой гемолитической болезни и т.п.), может быть назначено заменное переливание крови или внутривенное введение плазмы.
Все дети, перенесшие тяжелую желтуху, должны находиться под наблюдением детского невролога. После лечения билирубиновой интоксикации, как правило, требуется длительная реабилитация.
Прогноз для жизни зависит от тяжести протекающего заболевания. Возможна остаточная неврологическая симптоматика.
Наибольший интерес вызывает вопрос нейротоксичности билирубина и возникновения билирубиновой энцефалопатии. Первое патоморфологическое описание желтушного окрашивания ядерных масс мозга новорожденных детей, у которых желтуха появилась сразу после рождения, сделано в 1875 году. В процессе изучения данной патологии выдвигались различные гипотезы о механизмах повреждающего действия билирубина на мозг новорожденных, влекущее за собой возникновение билирубиновой энцефалопатии. Отложения кристаллов практически нерастворимого в водных средах билирубина при данном заболевании обнаруживают не только в головном мозгу (палеокортекс, базальные ядра, субталамические ядра, продолговатый мозг, мозжечок), но и в стенке дыхательных путей, стенке желудочно-кишечного тракта, селезенке, почках, надпочечниках, семенных железах, костном мозгу. Это позволяет рассматривать билирубиновую энцефалопатию как проявление общей билирубиновой интоксикации организма. Здесь уместно было бы предположить, что нарушение собственно барьерной функции ГЭБ может являться следствием повреждения мембранных структур астроцитов и эндотелиоцитов билирубином, который относится к токсическим продуктам метаболизма. Спорным является вопрос о роли печени в нарушении проницаемости ГЭБ при гемолитической болезни. Наличие отчетливых морфологических изменений при нарушении детоксирующей роли печени впервые отметил Zammora (отек, вакуолизация, конечные разветвления астроцитарных отростков при экспериментальном выключении печени крыс из кровотока). Причиной билирубиновой интоксикации может быть дефект микросомальной ферментной системы гепатоцитов, катализирующей конъюгацию билирубина, а также конъюгацию различных иных субстанций алифатического, ароматического и/или стероидного ряда, способных тоже оказывать токсическое действие на организм. В результате многочисленных исследований было установлено, что связанный с сывороточным альбумином билирубин в клетки мозга не проникает, однако следует отметить, что каждая молекула альбумина может связать две молекулы непрямого билирубина, но первую очень прочной связью, а вторую рыхло. Непрямой билирубин в кислой форме находится в рыхлой связи с альбумином и токсичен для мозга.
В последние годы в некоторых работах было предложено определять соотношение билирубин/альбумин вместо определения концентрации билирубина и альбумина отдельно. Тем самым предполагалось достигнуть лучших результатов в прогнозировании и предотвращении билирубиновой энцефалопатии путем оптимизации показаний для заменного переливания крови. Однако существенных результатов эти исследования не дали. Общеизвестно, что существуют факторы, способствующие нарушению связывающей билирубин способности альбумина, а также вещества-лиганды, конкурирующие за места прочного связывания на альбумине (асфиксия, ацидоз, неэстерифицированные жирные кислоты, лекарственные вещества и т.д.).
Гипоксия предрасполагает к развитию билирубиновой энцефалопатии в первую очередь из-за угнетения активности системы глюкоронил-трасферазы. Известно, что митохондрии мозга, равно как и других органов и тканей, содержат билирубиноксидантную систему, окисляющую в присутствии кислорода билирубин. В связи с тем, что процесс гипоксии вызывает повреждение митохондрий и инактивацию оксидаз, может нарушиться механизм окисления билирубина, попадающего в капиллярные субстанции. Этот механизм в норме "срабатывает" у новорожденных в случае достаточной ферментативной активности, тогда как гипоксия нарушает этот процесс. Сочетание желтухи с гипоксией особенно опасно из-за повышенной чувствительности нервных клеток к гипоксии, когда недостаток кислорода вызывает локальный тканевый ацидоз, который может существовать еще некоторое время после коррекции рН крови. Наибольшее значение в патогенезе билирубиновой энцефалопатии имеет проницаемость ГЭБ, который является сложной регуляторной поверхностью, четко контролирующей прохождение веществ через стенку сосудов мозга в клетки мозга. Патоморфологи диагностируют ядерную желтуху не ранее 36 часов после рождения. Таким образом, изменения ЦНС, возникшие в первые 36 часов жизни, могут быть обратимыми. При ядерной желтухе в первую очередь прокрашиваются базальные ганглии: хвостатое ядро, скорлупа, бледный шар. Могут повреждаться также кора мозга, мозжечок, подбугровая область, аммонов рог, ядра продолговатого мозга и мозжечка. Интенсивное поражение ядер дна 4-го желудочка может быть причиной смерти новорожденного. На дне 4-го желудочка чаще прокрашиваются боковые отделы в области кохлеарных и вестибулярных ядер. Значительно реже желтушность находят в зрительном бугре и других отделах мозга. Особенно редуцированы пирамидные клетки 3-го слоя коры, двигательной области спинного мозга и стволовой части головного мозга. После 6-7-го дня жизни ребенка интенсивность острых изменений нейронов снижается, выявляются поля опустошения во многих отделах мозга с последующим развитием глиоза. Нарушается формирование мозга и всего организма ребенка. В клинической картине билирубиновой энцефалопатии наблюдается следующая триада симптомов: гиперкинетическая форма ДЦП, дефект слуха и умственная недостаточность. К сопутствующим проявлениям заболевания относятся ограничение взора вверх, желтушное окрашивание и дефект зубной эмали, дизартрия.
Читайте также:


