Что такое генерация нервного импульса
Генерация - нервный импульс
Генерация нервного импульса представляет собой динамический процесс, сопровождающийся структурными изменениями в возбудимой мембране. Эти изменения проявляются как изменения ионной проницаемости, а также реакционноспособ-ности функциональных групп к специфичным реагентам. [2]
Генерация нервного импульса вызывается перемещением ионов через мембрану нервной ( или другой возбудимой) клетки. Схематически система, ответственная за генерацию импульса, может быть представлена в виде двух отсеков, ргзде-ленных мембраной. [3]
Исследование генерации нервного импульса и его распространения в аксоне - старая и традиционная проблема биофизики / Уже Гельмгольц измерял скорость распространения нервного возбуждения / В настоящее время решены важные физические задачи, относящиеся к функции аксона. Напротив, современное состояние науки позволяет лишь формально моделировать работу центральной нервной системы и мы еще далеки от понимания физической природы высших ее функций - памяти и мышления. [4]
Проблема генерации нервного импульса в ответ на раздражение аксона исследовалась экспериментально и теоретически во множестве работ. Эта проблема уже затрагивалась в § § 4.1 и 4.2. Трудности ее изучения в значительной мере связаны с отсутствием прямой информации о соответствующих молекулярных процессах. Приходится строить теоретические и полуэмпирические модели, основанные на косвенных данных, полученных в опытах, в которых мембраны подвергаются различным физическим и химическим воздействиям. [5]
Возможность возникновения концентрационных колебаний была показана в выдающихся исследованиях механизма генерации нервного импульса ( Hodgkjn, Huxley, 1952; Ходжкин, 1965) и внутриклеточной регуляции синтеза ферментов ( Mono. [6]
Следовательно, корреляция спайковой активности отдельных нейронов не зависит от самого механизма генерации нервных импульсов . Поэтому должен существовать специальный механизм, осуществляющий вязь спайковых разрядов соседних нейронов. Скорее всего, функцию этого механизма эффективно выполняет микроструктура медленных потенциалов, возникающих на контактах между нейронами. Таким образом, маловероятно что устойчивое состояние и дискретные нейронные процессы являются взаимосвязанными процессами и отражают друг друга. Правила преобразования, которые позволяют перекодировать один процесс в другой, должны быть определены эмпирически для каждого из тех условий, которые интересуют исследователей. На данном этапе исследования любые общие утверждения относительно типов таких преобразований являются, вероятно, преждевременными. [7]
Во-первых, это любые триггерные, пороговые процессы переключения системы из одного режима в другой, например, генерация нервного импульса или сокращение мышцы. [8]
Чем значительнее емкость конденсатора, тем больше зарядов абсорбируется, до тех пор пока не достигается деполяризация, необходимая для генерации нервного импульса . [10]
Мы не в состоянии пока ответить на вопросы, каким образом фотовозбуждение единственной молекулы пигмента может вызвать прохождение тока через синапс на отдаленном конце рецепторной клетки и как благодаря ничтожно малой энергии всего лишь одного фотона могут осуществляться значительные перемещения заряда, необходимые для генерации нервного импульса . Считают, что молекулы пигментов каким-то образом контролируют ионные каналы через внутренние мембраны рецепторных клеток. Фотовозбуждение молекулы пигмента вызывает изменение ее конфигурации или заряда. В результате этого открывается канал и возникает поток ионов, который вызывает поляризацию клетки и таким образом стимулирует синапс. Затем ионные насосы должны получить энергию для восстановления нормального распределения ионов. Такой механизм может объяснить необходимое усиление и быстроту реакции на относительно большом расстоянии. [11]
Na и К 1; т, п и h - безразмерные нормированные величины, характеризующие плотность открытых каналов; т носит название натриевой активации; h - натриевая инактивация; п - калиевая активация; jt - неидентифицированный ток утечки; J0 - внешний ток, с помощью которого можно управлять режимом мембраны и вызывать генерацию нервных импульсов . [12]
Это неравновесное распределение ионов поддерживается специальными механизмами, встроенными в мембрану. Однако для генерации нервного импульса происхождение разности концентраций несущественно, важно только наличие этой разности. [13]
Модель описывает генерацию стандартного сигнала в ответ на малое, но конечно 1 внеш. Модель ( 5) используют при описании генерации нервного импульса , возникновения биол. [14]
Потенциал покоя
Разность зарядов достигается за счёт разности концентраций ионов внутри и снаружи клетки. Внутри концентрация ионов калия высокая, а натрия - низкая, а снаружи - наоборот. Эта разность достигается за счёт работы Натрий-Калиевой АТФазы. В состоянии покоя нейрона калиевые каналы открыты, а натриевые закрыты. Катионы калия выходят в зону меньшей концентрации (из клетки) и создают избыточный положительный заряд снаружи клетки. Разность зарядов мембраны в состоянии покоя называется потенциалом покоя, а разность зарядов при любом состоянии аксона называется мембранным потенциалом. Когда мембранный потенциал (МП) клетки равен потенциалу покоя(ПП), натриевые каналы закрыты.
Потенциал действия. Генерация нервного импульса
Электрические свойства мембраны нейронов и других возбудимых клеток (например, мышечных) позволяют этим клеткам генерировать и передавать потенциалы действия (если их генерируют нейроны, то они называются также нервные импульсы). Потенциалы действия обычно возикают на дендритах или на теле нейрона, а затем передаются по аксону. Ключевую роль в генерации и передаче нервных импульсов играют свойства каналов наружной мембраны клетки. Как только МП станет достаточно отличаться от ПП, т.е. изменится до нужной величины - порога, происходит возбуждение. Здесь действует принцип "всё или ничего": если раздражающий фактор не способен изменить МП до порога, то возбуждения нет, а если способен, то возбуждение происходит. При возбуждении нейрона открываются натриевые каналы, и ионы натрия устремляются внутрь клетки, уменьшая отрицательный заряд внутренней стороны мембраны. Это уменьшение мембранного потенциала называется деполяризацией. Ионы натрия будут входить в клетку, пока внутренняя сторона мембраны не станет положительно заряженной относительно внешней стороны. Мембрана перезарядится (+ станет внутри, а - снаружи) После перезарядки мембраны натриевые каналы закрываются, и данный участок аксона определённое время не может возбуждаться. Этот период называется рефрактерностью. После закрытия натриевых каналов, ионы Калия устремляются наружу, уменьшая отрицательный заряд наружной стороны мембраны, пока внешняя сторона не станет положительно заряжена относительно внутренней. Мембрана перезарядится до исходного состояния. Этот этап называется реполяризацией. Все изменения мембранного потенциала от деполяризации до реполяризации называется потенциалом действия, или нервным импульсом. Схема движения нервного импульса по аксону:
+ и - - заряды мембраны
А- Внутренняя среда клетки
В- Внешняя среда
Г- Направление движения Нервного импульса
Д- Возбуждённый участок
Нервный импульс может двигаться только вперёд, так как все задние участки аксона находятся в состоянии рефрактерности. На каждом участке нейрона нервный импульс возникает заново. На рисунке показана схема движения импульса без использования миелиновых оболочек . Скорость движения такого импульса достаточно невелика - приблизительно 3 м/сек. Для ускорения импульса используются w:глиальные клетки, и скорость импульса приблизительно равна 100 м/сек. Глиальные клетки окружают аксон по всей его длине и образуют оболочки - электроизоляторы - миелиновые оболочки, но оставляют небольшие участки нейрона - перехваты Ранье - открытыми. В центральной нервной системе миелиновую оболочку образуют олигодендроциты, а в периферической – леммоциты. Миелиновая оболочка образуется из отростка тела глиальной клетки, лишенного цитоплазмы. Многократно обмотанного вокруг аксона, то есть миелиновая оболочка состоит из многочисленных слоёв мембраны глиальной клетки. Нервный импульс не может двигаться по участкам, покрытыми миелиновыми оболочками, поэтому нервному импульсу приходится "перепрыгивать" от одного перехвата Ранье к другому. Далее нервный импульс достигает синапса и вызывает открытие кальциевых каналов. Ионы кальция входят внутрь клетки, и это приводит к слиянию пузырьков с нейромедиаторами с пресинаптической мембранной. Нейромедиаторы попадают в синаптичскую щель, и воздействуют на белки – рецепторы постсинаптической мембраны.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Нервная система человека выступает своеобразным координатором в нашем организме. Она передаёт команды от мозга мускулатуре, органам, тканям и обрабатывает сигналы, идущие от них. В качестве своеобразного носителя данных используется нервный импульс. Что он собой представляет? С какой скоростью работает? На эти, а также на ряд других вопросов можно будет найти ответ в этой статье.
Чем является нервный импульс?
Исследование строения и работы
Впервые прохождение нервного импульса было продемонстрировано немецкими учеными Э. Герингом и Г. Гельмгольцем на примере лягушки. Тогда же и было установлено, что биоэлектрический сигнал распространяется с указанной ранее скоростью. Вообще, такое является возможным благодаря особенному построению нервных волокон. В некотором роде они напоминают электрический кабель. Так, если проводить параллели с ним, то проводниками являются аксоны, а изоляторами – их миелиновые оболочки (они являют собой мембрану шванновской клетки, которая намотана в несколько слоев). Причем скорость нервного импульса зависит в первую очередь от диаметра волокон. Вторым по важности считается качество электрической изоляции. Кстати, в качестве материала организмом используется липопротеид миелин, который обладает свойствами диэлектрика. При прочих равных условиях, чем больше будет его слой, тем быстрее будут проходить нервные импульсы. Даже на данный момент нельзя сказать, что эта система полноценно исследована. Многое, что относится к нервам и импульсам, ещё остаётся загадкой и предметом исследования.
Особенности строения и функционирования
Где они создаются?
Типы клеток
- Рецепторные (чувствительные). Ими кодируются и превращаются в нервные импульсы все температурные, химические, звуковые, механические и световые раздражители.
- Вставочные (также называются кондукторными или замыкательными). Они служат для того, чтобы перерабатывать и переключать импульсы. Наибольшее их число находится в головном и спинном мозге человека.
- Эффекторные (двигательные). Они получают команды от центральной нервной системы на то, чтобы были совершены определённые действия (при ярком солнце закрыть рукой глаза и так далее).
Каждый нейрон имеет тело клетки и отросток. Путь нервного импульса по телу начинается именно с последнего. Отростки бывают двух типов:
- Дендриты. На них возложена функция восприятия раздражения расположенных на них рецепторов.
- Аксоны. Благодаря им нервные импульсы передаются от клеток к рабочему органу.
Интересный аспект деятельности
О потенциале действия
Как всё работает в мозгу?
Работа нейромедиаторов
Когда они передают нервные импульсы, то существует несколько вариантов, что произойдёт с ними:
- Они будут диффундированы.
- Подвергнутся химическому расщеплению.
- Вернутся назад в свои пузырьки (это называется обратным захватом).
В конце 20-го века сделали поразительное открытие. Ученые узнали, что лекарства, что влияют на нейромедиаторы (а также их выброс и обратный захват), могут изменять психическое состояние человека коренным образом. Так, к примеру, ряд антидепрессантов вроде "Прозака" блокируют обратный захват серотонина. Есть определённые причины считать, что в болезни Паркинсона виноват дефицит в головном мозге нейромедиатора дофамина.
Если кратко, то они могут работать с тысячами нейромедиаторов, которые посылаются их соседями. Детали относительно обработки и интеграции данного типа импульсов нам почти не известны. Хотя над этим работает много исследовательских групп. На данный момент получилось узнать, что все полученные импульсы интегрируются, а нейрон выносит решение – необходимо ли поддерживать потенциал действия и передавать их дальше. На этом фундаментальном процессе базируется функционирование головного мозга человека. Ну что ж, тогда это неудивительно, что мы не знаем ответа на эту загадку.
Некоторые теоретические особенности
Где же создаются нервные импульсы?
Откуда они начинают свой путь? Ответ на этот вопрос может дать любой студент, который прилежно изучал физиологию возбуждения. Есть четыре варианта:
- Рецепторное окончание дендрита. Если оно есть (что не факт), то возможным является наличие адекватного раздражителя, что создаст сначала генераторный потенциал, а потом уже и нервный импульс. Подобным образом работают болевые рецепторы.
- Мембрана возбуждающего синапса. Как правило, такое возможно только при наличии сильного раздражения или их суммирования.
- Триггерная зона дентрида. В этом случае локальные возбуждающие постсинаптические потенциалы формируются как ответ на раздражитель. Если первый перехват Ранвье миелинизирован, то они на нём суммируются. Благодаря наличию там участка мембраны, которая обладает повышенной чувствительностью, здесь возникает нервный импульс.
- Аксонный холмик. Так называют место, где начинается аксон. Холмик – это наиболее частый создать импульсов на нейроне. Во всех остальных местах, которые рассматривались ранее, их возникновение гораздо менее вероятное. Это происходит из-за того, что здесь мембрана имеет повышенную чувствительность, а также пониженный критический уровень деполяризации. Поэтому, когда начинается суммирование многочисленных возбуждающих постсинаптических потенциалов, то раньше всего на них реагирует холмик.
Пример распространяющегося возбуждения
Вспомните сводки из новостей прошлого лета (также это скоро можно будет услышать опять). Пожар распространяется! При этом деревья и кустарники, которые горят, остаются на своих местах. А вот фронт огня идёт всё дальше от места, где был очаг возгорания. Аналогичным образом работает нервная система.
Часто бывает необходимо успокоить начавшееся возбуждение нервной системы. Но это не так легко сделать, как и в случае с огнем. Для этого совершают искусственное вмешательство в работу нейрона (в лечебных целях) или используют различные физиологические средства. Это можно сравнить с заливанием пожара водой.
Благодаря непрерывной работе мембранных ионных насосов между внутренним содержимым невозбужденной клетки и внешней средой постоянно поддерживается разность потенциалов. Этот параметр можно измерить введением электрода в крупные нервные клетки, диаметр которых у кальмаров, например, может достигать 1 мм. Определяемая величина называется потенциалом покоя и достигает в невозбужденных клетках (-60) — (-70) мВ (минус указывает на то, что внутренняя поверхность мембраны электроотрицательна по отношению к внешней). Потенциал покоя характеризует состояние динамического равновесия в перемещении ионов натрия и калия через мембрану.
Механизм передачи нервного импульса состоит в следующем. Повышение проводимости мембраны в конкретном локусе для ионов натрия и деполяризация взаимно усиливают друг друга. В результате быстрого перемещения ионов натрия на внутреннюю поверхность мембраны исходный потенциал (-70 мВ) падает до нуля, а затем достигает значения (+20) — (+40) мВ. Таким образом, в данном локусе мембраны создается область положительного заряда и в местной цепи возникает ток между этим активным участком и отрицательно заряженной областью, находящейся непосредственно перед ним. Отличительной особенностью мембран нервных клеток, очень быстро проводящих нервные импульсы, является наличие миелиновой оболочки, которая выполняет роль изолятора. Благодаря этой оболочке плазматическая мембрана контактирует с содержащей Na + внеклеточной жидкостью лишь в определенных точках — перехватах Ранвье, и деполяризация мембраны происходит только в области этих перехватов. Так как нервная клетка покрыта изолятором — миелином, распространение области электрического тока до следующего перехвата осуществляется в основном через цитоплазму клетки. Дойдя до очередного перехвата, ток снижает мембранный потенциал в этой области, в ней происходит деполяризация и повышается проницаемость для ионов натрия, т.е. возникает потенциал действия. Так, в виде волны деполяризации потенциал действия распространяется по мембране в одном направлении.
Восстановление поляризации происходит в результате выхода из аксона ионов К + . Пока реполяризация не закончится, перехват не может возбудиться снова, а к тому времени, когда перехват будет способен к ответу, импульс уже уйдет по мембране слишком далеко, чтобы снова открыть в рассматриваемом перехвате аксона натриевые каналы. По этой причине импульс распространяется по мембране нервной клетки только в одном направлении. Реполяризация заканчивается после того, как АТР-азы, задействованные в активном транспорте ионов, восстановят нормальное соотношение концентраций Na + и К + в перехвате.
Амплитуда потенциала действия постоянна для каждой нервной клетки и не уменьшается по мере движения по мембране, так как изменение в каждой точке мембраны происходит за счет локального запаса энергии в виде ионного градиента, хотя и запускается изменением в соседнем перехвате.
Передача нервного импульса между нейронами и от нейронов к мышечным клеткам происходит в нервных окончаниях (синапсах) с помощью сигнальных веществ — медиаторов. Одним из наиболее распространенных нейромедиаторов (синтезируются нервными клетками) является ацетилхолин. Выделение ацетилхолина синаптическими мембранами служит сигналом для генерирования нервного импульса в расположенной по соседству нервной клетке. Осуществляется это с помощью ацетилхолиновых рецепторов, которые представляют собой трансмембранные комплексы из пяти субъединиц, формирующие проницаемый для ионов Na + и K+ каналы.
Участки для специфического присоединения ацетилхолина расположены на внеклеточной части a-субъединицы рецептора и их связывание приводит к формированию в центре комплекса трансмембранного канала, который открывается на короткое время для прохождения ионов натрия и калия. Открывание и закрывание канала происходит в результате аллостерического изменения в заряженных участках полипептидных цепей рецептора. Перемещение ионов через мембраны изменяет потенциал покоя нервной или мышечной клетки, что стимулирует открывание потенциал-управляемых Na + -каналов, и возникает потенциал действия.
Ацетилхолиновый рецептор может связывать различные лекарственные вещества, например никотин, который в малых дозах активирует ацетилхолиновые рецепторы, а в больших — угнетает их. Кроме этого, многие нейротоксины змей способны взаимодействовать с ацетилхолиновым рецептором и нарушать его функционирование. Известно также явление конкурентного ингибирования ацетилхолина при связывании с рецептором ядом кураре (растительный алкалоид), которым южно-американские индейцы пропитывали наконечники для стрел.
86 миллиардов нейронов. Blue Brain Project – это вычислительная часть, а Human Brain – это больше фундаментальная часть, где работают над сбором научных данных о принципах работы мозга и созданием единой модели. Чтобы прикоснуться к этой науке и попробовать самим сделать нечто подобное, хотя и в значительно меньших масштабах, была написана эта заметка.
Но в них не рассматривались вопросы вычислительной нейробиологии, или по-другому вычислительной нейронауки, включающей в себя компьютерное моделирование электрической активности нейронов, поэтому я решил восполнить этот пробел.
Возбудить нейрон можно, например, воткнув в него микроэлектрод и подав ток внутрь нейрона, но в живом мозге возбуждение обычно происходит путем синаптического воздействия. Как уже было сказано, нейроны соединяются друг с другом с помощью синапсов, образующихся в местах контакта аксона одного нейрона с дендритами другого. Нейрон, от которого идет сигнал, называется пресинаптическим, а тот к которому идет сигнал – постсинаптическим. При возникновении импульса на пресинаптическом нейроне, он выделят в синаптическую щель нейротрансмиттеры, которые открывают натриевые каналы на постсинаптическом нейроне, а дальше происходит цепь описанных выше событий, приводящих к возбуждению. Кроме возбуждения нейроны могут и тормозить друг друга. В случае если пресинаптический нейрон тормозный, то он выделят в синаптическую щель тормозный нейротрансмиттер открывающий хлорные каналы, а так как снаружи хлора больше, то хлор течет внутрь нейрона из-за чего отрицательный заряд на внутренней стороне мембраны увеличивается (не забываем, что ионы хлора в отличии от натрия и калия заряжены отрицательно), вгоняя нейрон в ещё более неактивное состояние. В таком состоянии нейрон труднее возбудить.
Где a, b, c, d, k, Cm различные параметры нейрона. Vm — это разность потенциалов на внутренней и внешней стороне мембраны, а Um — вспомогательная переменная. I — это внешний постоянный приложенный ток. В данной модели наблюдаются такие характерные для нейронов свойства как: генерация спайка в ответ на одиночный импульса внешнего тока и генерация последовательности спайков с определённой частотой при подаче на нейрон постоянного внешнего тока. Isyn — сумма синаптических токов от всех нейронов, с которыми связан этот нейрон.
В случае если на пресинаптическом нейроне генерируется спайк, на постсинаптическом происходит скачок синапического тока, который экспоненциально затухает с характерным временем.
Итак, мы приступаем к самому интересному. Пора закодить на компьютере виртуальный кусок нервной ткани. Для этого будем численно решать систему дифференциальных уравнений, задающих динамику мембранного потенциала нейрона. Для интегрирования будем использовать метод Эйлера. Кодить будем на С++, рисовать с помощью скриптов написанных на Python с использованием библиотеки Matplolib, но у кого нет Питона могут рисовать с помощью Exel.
Нам понадобятся двумерные массивы Vms, Ums размерности Tsim*Nneur для хранения мембранных потенциалов и вспомогательных переменных каждого нейрона, в каждый момент времени, Tsim это время симуляции в отсчетах, а Nneur количество нейронов в сети.
Связи будем хранить в виде двух массивов pre_con и post_con размерности Ncon, где индексами является номера связей, а значениями являются индексы пресинаптических и постсинаптических нейронов. Ncon — число связей.
Так же нам понадобится массив для представления переменной, модулирующей экспоненциально затухающий постсинаптический ток каждого синапса, для этого создаем массив y размерности Ncon*Tsim.
Как уже было сказано, информация кодируется во временах возникновения импульсов, поэтому создаем массивы для сохранения времен их возникновения и индексов нейронов где они возникли. Далее их можно будет записать в файл, с целью визуализации.
Разбрасываем случайно связи и задаем веса.
Установка начальных условий для нейронов и случайное задание внешнего приложенного тока. Те нейроны для которых внешний ток превысит порог генерации спайков, будут генерировать спайки с постоянной частотой.
Основная часть программы с интегрированием модели Ижикевича.
Полный текст кода можно скачать тут. Код свободно компилируется и запускается хоть под виндой с Visual Studio 2010 Express Edition или MinGW, хоть под GNU/Linux c GCC. После завершения работы программа сохраняет растр активности, времена и индексы возникновения нервных импульсов, и осциллограммы среднего мембранного потенциала в файлах rastr.csv и oscill.csv, соответственно. Можно их прямо в Exelе и нарисовать. Либо с помощью прикрепленных мною питоновских скриптов, но для их работы нужна библиотека Matplotlib. Для тех у кого GNU/Linux установить из репозиториев пакет python-matplotlib не составит труда, пользователям же Windows придется вручную скачать отсюда последовательно пакеты numpy, scypy, pyparsing, python-dateutil и matplotlib.
Рисование растра активности — plot_rastr.py
Рисование среднего мембранного потенциала — plot_oscill.py
Вот что получается при моделировании 1 секунды активности 125 нейронов. Мы наблюдаем периодическую активность на частоте
- 3653
- 2,3
- 1
- 7
![]()
Олег Жуков
![]()
Анна Петренко![]()
Андрей Панов




Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (
10 имп./с) и быстрые (
40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (
Нейроны центральной нервной системы разделяются на активирующие (образуют активирующие синапсы) и тормозящие (образуют тормозящие синапсы). Последние в значительной степени представлены интернейронами, или промежуточными нейронами. В коре больших полушарий и гиппокампе они ответственны за формирование гамма-ритмов мозга [15], которые обеспечивают слаженную, синхронную работу других нейронов. Это крайне важно для моторных функций, восприятия сенсорной информации, формирования памяти [9], [11].
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Потенциал действия
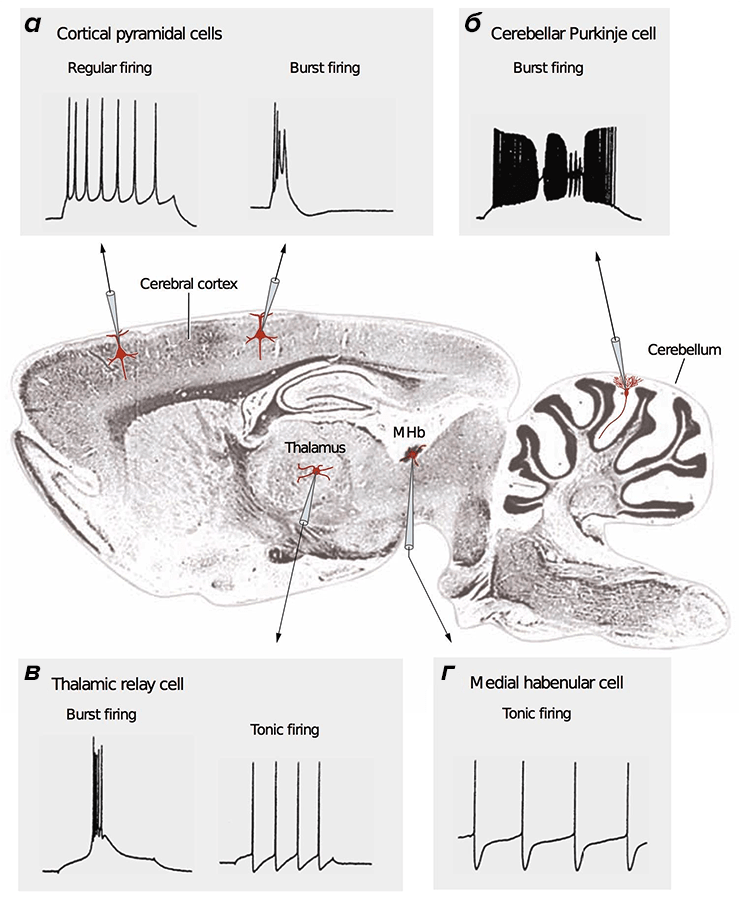
Рисунок 2. Разные типы нейронов генерируют различные сигналы. В центре — продольный срез мозга млекопитающего. Во вставках представлены разные типы сигналов, зарегистрированные методами электрофизиологии [15], [38]. а — Кортикальные (Cerebral cortex) пирамидальные нейроны могут передавать как низкочастотные сигналы (Regular firing), так и короткие взрывные, или пачечные, сигналы (Burst firing). б — Для клеток Пуркинье мозжечка (Cerebellum) характерна только пачечная активность на очень высокой частоте. в — Релейные нейроны таламуса (Thalamus) имеют два режима активности: пачечный и тонический (Tonic firing). г — Нейроны средней части поводка (MHb, Medial habenula) эпиталамуса генерируют тонические сигналы низкой частоты.
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
- Мембрана и ионы. Плазматическая мембрана нейрона поддерживает неравномерное распределение веществ между клеткой и внеклеточной средой (рис. 3б) [31–33]. В числе этих веществ есть и маленькие ионы, из которых для описания ПД важны К + и Nа + .
Ионов Na + внутри клетки мало, снаружи — много. Из-за этого они постоянно стремятся попасть в клетку. Напротив, ионов К + много внутри клетки, и они норовят из нее выйти. Самостоятельно ионы этого сделать не могут, потому что мембрана для них непроницаема. Для прохождения ионов через мембрану необходимо открывание специальных белков — ионных каналов мембраны.
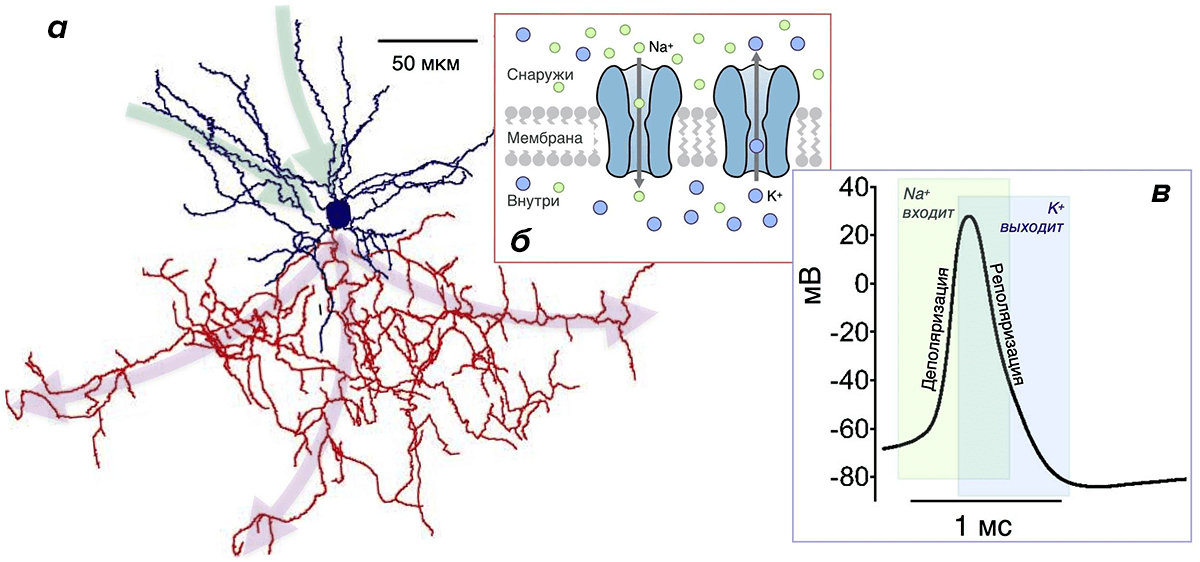
Рисунок 3. Нейрон, ионные каналы и потенциал действия. а — Реконструкция клетки-канделябра коры головного мозга крысы. Синим окрашены дендриты и тело нейрона (синее пятно в центре), красным — аксон (у многих типов нейронов аксон разветвлен намного больше, чем дендриты [8], [11], [35]). Зеленые и малиновые стрелки указывают направление потока информации: дендриты и тело нейрона принимают ее, аксон — отправляет ее к другим нейронам. б — Мембрана нейрона, как и любой другой клетки, содержит ионные каналы. Зеленые кружки — ионы Na + , синие — ионы К + . в — Изменение мембранного потенциала при генерации потенциала действия (ПД) нейроном Пуркинье. Зеленая область: Na-каналы открыты, в нейрон входят ионы Na + , происходит деполяризация. Синяя область: открыты К-каналы, К + выходит, происходит реполяризация. Перекрывание зеленой и синей областей соответствует периоду, когда происходит одновременный вход Na + и выход К + .
ПД — это относительно сильное по амплитуде скачкообразное изменение мембранного потенциала.
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
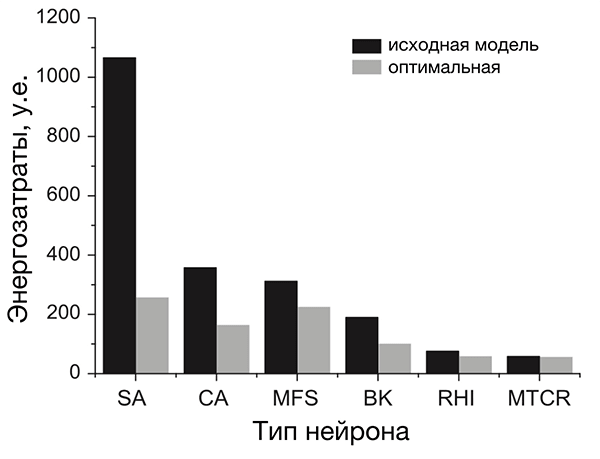
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Читайте также:





