Цинк и болезнь паркинсона

Цена:
Авторы работы:
Научный журнал:
Год выхода:
БИОХИМИЯ, 2014, том 79, вып. 5, с. 501 - 508
РОЛЬ ИОНОВ ЦИНКА И МЕДИ В МЕХАНИЗМАХ ПАТОГЕНЕЗА БОЛЕЗНЕЙ АЛЬЦГЕЙМЕРА И ПАРКИНСОНА
2 Московский государственный университет им. М.В. Ломоносова, НИИ физико-химической биологии им. А.Н. Белозерского, 119992 Москва, факс: (495)939-3181, электронная почта: isaev@genebee.msu.ru
Поступила в редакцию 07.10.13 После доработки 21.01.14
Дисбаланс ионов цинка (/п2+) и меди (Си2+) в центральной нервной системе вовлечен в патогенез многих нейродегенеративных заболеваний, таких как мультисистемная атрофия, боковой амиотрофический склероз, болезни Крейтцфельдта—Якоба, Вильсона—Коновалова, Альцгеймера (БА), Паркинсона (БП). Последние две разновидности церебральной патологии являются наиболее распространенными возрастными заболеваниями, в механизмах патогенеза которых нарушения гомеостаза /п2+ и Си2+ играют важную роль. В данном обзоре предпринята попытка суммировать и систематизировать имеющиеся в настоящее время данные исследований по этой проблеме. Рассмотрены взаимодействия /п2+ и Си2+ с АРР, бета-амилоидом (Абета), белком тау, металлотионеинами, 08К3бета и их роль в генерации свободных радикалов при БА и БП. Проведенный анализ литературы позволяет заключить, что основные патогенетические факторы БА и БП (окислительный стресс, нарушение структуры и агрегация белков, дисфункция митохондрий, энергетический дефицит), которые инициируют каскад реакций, приводящих, в конечном счете, к дисфункции нейронных сетей, опосредуются дисбалансом /п2+ и Си2+.
КЛЮЧЕВЫЕ СЛОВА: ионы меди, ионы цинка, болезнь Альцгеймера, болезнь Паркинсона, митохондри-ально-адресованные антиоксиданты.
В патогенезе многих нейродегенеративных заболеваний, к которым относят мультисистем-ную атрофию, боковой амиотрофический склероз, болезни Крейтцфельдта—Якоба, Вильсона-Коновалова, Альцгеймера, Паркинсона, важная роль отводится дисбалансу ионов различных металлов и, в первую очередь, цинка и меди [1]. В индустриально развитых странах болезнь Альцгеймера (БА) и болезнь Паркинсона (БП) являются самыми распространенными возрастными нейродегенеративными заболеваниями,
Принятые сокращения: БА — болезнь Альцгеймера; БП — болезнь Паркинсона; АФК — активные формы кислорода; NMDA — N-метил-В-аспартат; GABA — гамма-аминомасляная кислота; Абета — бета-амилоид; MPTP — 1-метил-4-фенил-1,2,3,6-тетрагидропиридин; 6-OHDA — 6-гидроксидопамин; MPP(+) — 1-метил-4-фенилпиридин; GSK3бета — гликоген синтаза киназа 3-бета; АСН — аль-фа-синуклеин.
* Адресат для корреспонденции.
терапия которых в настоящее время является симптоматической и не способна обеспечить остановку развития патологических процессов [2]. Поэтому исследование механизмов патогенеза БА и БП с целью поиска новых мишеней для создания эффективных нейропротекторных лекарственных средств является актуальным направлением современной экспериментальной и клинической неврологии. В последние годы показано, что в эти механизмы вовлечены ионы цинка и меди, однако их участие в патогенетических процессах в настоящее время трактуется неоднозначно [3, 4]. Известно, что в норме 2п2+ и Си2+ являются структурными элементами большого количества белков. Без этих металлов невозможна жизнедеятельность клеток организма и нормальная работа клеточных орга-нелл, так как 2п2+ входит в состав молекул ряда транскрипционных факторов, а Си2+ является необходимым компонентом цитохром с-окси-
дазы — фермента, который катализирует конечный этап переноса электронов на кислород в процессе окислительного фосфорилирования в митохондриях. Кроме того, оба этих металла содержатся в молекуле такого важнейшего анти-оксиданта, как супероксиддисмутаза, а Си2+ входит в состав церулоплазмина, белка плазмы крови, вовлеченного в механизмы ряда проок-сидантных и антиоксидантных реакций. С другой стороны, ионы меди необходимы для нормальной реализации процессов памяти и обучения, так как в гиппокампе в глутаматергических синапсах при нейрональной деполяризации они высвобождаются из синаптических везикул в синаптическую щель, где их концентрация достигает 0,015 мМ, и они могут инактивировать ММБА-комплекс, тем самым предохраняя нейроны от эксайтотоксического действия глутама-та [5, 6].
Для нормального функционирования нервной системы особое значение имеет 2и2+, значительные запасы которого содержатся в синап-тических везикулах глутаматергических нейронов и достигают там миллимолярных концентраций. Выброс глутамата из везикул в синапти-ческую щель происходит совместно с ионами цинка, где они взаимодействуют с ММБА- и ОАБА-рецепторами, регулируя проницаемость ионных каналов и модулируя тем самым как возбуждающую, так и тормозную синаптичес-кую передачу [7]. В отличие от синаптических везикул, содержание 2и2+ в цитоплазме нейронов очень низкое и измеряется в пикомолях, а его большая часть связана с белками металлотио-неинами. Цинксодержащие нейроны находятся в основном в коре и лимбических структурах головного мозга, поэтому полагают, что 2и2+ может играть важную роль в поведении и эмоциях [8].
Поддержание гомеостаза 2и2+ и Си2+ в мозге очень важно, и отклонения от него могут быть фатальными для нейронов [9—12]. Нарушение регуляции этого гомеостаза играет одну из первостепенных ролей в механизмах патогенеза многих нейродегенеративных заболеваний, в том числе болезней Альцгеймера и Паркинсона.
Болезнь Альцгеймера (БА) — нейродегенера-тивное заболевание с прогрессирующей картиной когнитивных нарушений, которое сопровождается дегенерацией синапсов и значительной потерей нейронов в коре головного мозга и холинергических базальных ядрах. В настоящее время предполагается, что основными триггера-
ми этих нарушений являются бета-амилоид (Абета) и гиперфосфорилированный внутриклеточный белок тау, накопление которых сопровождается дисбалансом вне- и внутриклеточного содержания и распределения ионов цинка и меди, а, возможно, также и железа. Роль цинка в развитии БА в настоящее время оценивается неоднозначно. Например, связываясь с Абета, 2и2+ экранирует участки протеолитического расщепления молекулы и, тем самым, ингиби-рует деградацию Абета с участием металлопро-теаз. В то же время, цинк подавляет активность гамма-секретаз, которые принимают участие в образовании Абета [12]. Ионы цинка при БА взаимодействуют с Абета и накапливаются внутри амилоидных бляшек. Захват цинка бляшками и олигомерами Абета приводит к снижению внутринейронного уровня цинка, а в некоторых случаях — к его избытку в близлежащих к амилоидным бляшкам нейронах [9]. Связываясь с тау-белком, 2и2+ индуцирует его агрегацию и формирование внутриклеточных нейрофибрилляр-ных клубков, что в дальнейшем приводит к нарушению транспортной системы нейрона и ухудшению когнитивных функций [13, 14].
Как было отмечено выше, в головном мозге цинк является синаптическим модулятором такого важнейшего нейромедиатора, как глутамат, и, таким образом, участвует в механизмах когнитивных процессов. Уровень синаптического везикулярного цинка контролируется специфическим белком, цинковым транспортером-3 (2иТ3). Показано, что при БА в коре головного мозга пациентов в возрасте 73 ± 13 лет уровень 2иТ3 снижен на 36% по сравнению со здоровыми людьми [9]. По этой причине, а также в результате связывания 2и2+ олигомерами Абета происходит значительное ослабление взаимодействия синаптического цинка с его постси-наптическими мишенями. Нарушение передачи сигналов ионами цинка приводит к снижению экспрессии постсинаптических мишеней, таких как МЯ2Б (субъединицы ММБА-подтипа глута-матного рецептора), и ухудшению когнитивных функций [15]. Следует отметить, что в сыворотке крови пациентов с БА содержание 2и2+ значительно снижено [15, 16], хотя другими авторами [17] отмечено увеличение его содержания в цереброспинальной жидкости. Некоторый дефицит 2и2+ распространен и у пожилых людей, но в настоящее время еще недостаточно данных, чтобы заключить, полезны ли добавки цинка для профилактики и лечения БА, и являются ли дефицит цинка или его избыток факторами риска развития БА [18].
Роль меди в патогенезе БА в настоящее время гораздо менее ясна, чем роль цинка, хотя об-
наружено, что ионы меди, как и ионы цинка, колокализованы в мозге с бляшками Абета [19]. В одном из ранних исследований показано повышение уровня меди в сыворотке крови пациентов с БА [20]. Более того, достоверное повышение уровня меди было показано и в цереброспинальной жидкости [17], тогда как в гиппо-кампе и амигдале обнаружено его снижение [21]. Однако позднее были опубликованы данные, что при БА у пациентов с низким содержанием меди в плазме крови когнитивные нарушения выражены сильнее, чем у больных со средним ее содержанием [22].
Одним из белков, влияющих на уровни меди и цинка в мозге при БА, является Абета, который способен связывать ионы этих металлов, причем цинк конкурирует с медью за места связывания [23]. Медь, связанная с Абета, становится более токсичной для нейронов, причем степень цитотоксичности комплекса медь-Абе-та прямо коррелирует с уровнем меди [12]. Если цинк при связывании с Абета большей частью способствует образованию фибрилл, то при связывании меди с амилоидом образуются олиго-меры, которые могут проникать внутрь клеток. Предполагается, что токсичность меди при БА опосредована ингибированием цитохром с-ок-сидазы ионами меди, связанными с Абета, и их способностью стимулировать фосфорилирова-ние и агрегацию тау-белка [12]. Бревер [24] предполагает, что в сочетании с потреблением пищи с высоким содержанием жира медь может быть важным фактором риска развития БА. Однако показано, что возрастание внутриклеточной концентрации меди в клетках линии SH-SY5Y вызывает дозозависимое ингибирование про-апоптотического белка GSK3бета посредством фосфорилирования [25], а связывание медихе-латором на фоне окислительно
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
- МИТОХОНДРИАЛЬНО-АДРЕСОВАННОЕ ПРОИЗВОДНОЕ ПЛАСТОХИНОНА АНТИОКСИДАНТ SКQR1 ОКАЗЫВАЕТ ПОЛОЖИТЕЛЬНОЕ ВЛИЯНИЕ НА ПАМЯТЬ КРЫС
ИСАЕВ Н.К., КАПАЙ Н.А., ОЛЬШАНСКИЙ А.С., ПОПОВА О.В., СКРЕБИЦКИЙ В.Г., СТАВРОВСКАЯ А.В., СТЕЛЬМАШУК Е.В., ХАСПЕКОВ Л.Г., ЯМЩИКОВА Н.Г. — 2015 г.
ЗОРОВ Д.Б., ИСАЕВ Н.К., КАПАЙ Н.А., ПОПОВА О.В., СКРЕБИЦКИЙ В.Г., СКУЛАЧЕВ В.П., СТЕЛЬМАШУК Е.В. — 2011 г.
Мы гордимся тем, что наши ценности неизменны:
- продукция высокого качества
- безопасный и надежный бизнес
- профессиональный сервис
Мы гордимся тем, что наши ценности неизменны:
- продукция высокого качества
- безопасный и надежный бизнес
- профессиональный сервис
Вопрос: почему многие люди обращаются к натуральным средствам лечения болезни Паркинсона?
Ответ: и не только Паркинсона.
Дело все в той же проблеме, о которой уже говорилось: многие высочайше утвержденные программы лечения в последние десятилетия стали неэффективными.
И в то же время известно множество фактов успешного излечения натуральными средствами после того, как официальная медицина оказалась бессильной.
- ускорить лечение и повысить его эффективность;
- избавиться от побочных эффектов, неизбежных при длительном применении медикаментозных препаратов;
- получить уверенность в положительном результате лечения и избежать инвалидности;
- избавиться от стресса, связанного с хроническими заболеваниями.
И надеются, что то, что не под силу медицине, сможет сделать Природа.
Еще в Аюрведе для лечения тремора и конвульсий применялась бархатная фасоль атмагупта. Семена атмагупты являются природным источником L-допы.
Педаний Диоскорид, Гиппократ, Аристотель и Плиний применяли душицу при нервных расстройствах и параличах, а Серапион Дамасский (9-й век н.э.) пользовал паралитиков мазью из тридцати пяти компонентов, куда входили ладан, розмарин, кипарис, кардамон, перец, мирра, мандрагора и лягушки. Заметьте, кроме мандрагоры, все перечисленные составляющие обладают антимикробными и антиоксидантными свойствами.
Лягушки, кстати, тоже, это не описка. Учёные сейчас работают над выделением из лягушачьей кожи мощных антибиотиков, способных побеждать самые устойчивые инфекции.
Ибн-Сина, кроме растительных препаратов, применял при лечении также минеральные ванны, а в средние века в Европе для снятия судорог и дрожания конечностей применялись шалфей, полынь, черника и омела.
В лучших современных парафармацевтиках (биодобавках, содержащих растительные экстракты) используются не только последние научные разработки, но и многовековой опыт целителей, плюс все это помножено на современные высокие технологии. В результате мы имеем высокую концентрацию действующих веществ, высокую степень чистоты, максимальное усвоение, оптимальный состав, длительное хранение без потери лечебных свойств и удобство применения. И в конечном итоге – высокую эффективность действия и низкую стоимость. Без балды.
И в любом случае, есть ли у вас консультант, нет ли, обязательно сами изучите все, что сможете найти о своей проблеме и способах ее решения с помощью натуральных средств. При наличии Интернета это пара пустяков. Требуется только посидеть за компьютером, собрать максимум информации, а потом отделить зерна от плевел. И никакой врач или консультант вам тогда не навешает лапши.
Чтобы облегчить вам эту задачу, я приведу краткую информацию о натуральных веществах, которые играют важную роль в патогенезе и лечении болезни Паркинсона.
Головной мозг потребляет микроэлементы в больших количествах и накапливает многие из них. Недостаток микроэлементов в мозге может вызвать стрессовые состояния, головную боль, дисбаланс нейромедиаторов, повышенную возбудимость, апатию, депрессию, тревожность, снижение умственной работоспособности.
Марганец. Участвует в защите нейронов от воздействия перекисных кислородных радикалов (входит в состав марганецсодержащего антиоксидантного фермента Mn-СОД).
Медь. Принимает участие в передаче нервных импульсов. При недостатке меди возникают поражения нервной системы, заторможенность движений и депрессии.
Йод. Основной фактор функции щитовидной железы. При недостатке йода происходит замедление метаболизма и ограничение умственных способностей, возникают условия для размножения паразитов.
Хром. При недостатке хрома нарушается обмен сахаров и снабжение мозга глюкозой. Это может вызывать нейропатии и расстройства высшей нервной деятельности.
Селен. Важный атиоксидант, который необходим для синтеза ферментов системы глутатиона.
Нарушения деятельности нервной системы могут быть связаны с избыточным накоплением тяжелых металлов - алюминия, свинца, кадмия.
Кадмий (поступает в организм из табачного дыма, автомобильных выхлопов, водопроводной воды) нарушает детоксикационную функцию печени, почек, лёгких, что приводит к накоплению токсических веществ в крови. При этом сильнее всего страдает мозг.
Свинец (автомобильные газы). Избыток свинца вызывает головные боли, тремор, галлюцинации, потерю памяти, сосудистые поражения.
Алюминий (алюминиевая фольга в упаковке продуктов, водопроводная вода) нарушает детоксикационную функцию почек. Следствием накопления алюминия в мозгу могут быть апатия, потеря памяти, деменция, энцефалопатия, мышечные подергивания и судороги, болезнь Альцгеймера.
Натуральный витамин С с биофлавоноидами является антиоксидантом, а также участвует в производстве допамина из тирозина.
Натуральный комплекс витамина Е, содержащий смесь природных токоферолов, можно найти в каждом из пищевых продуктов. Диета, богатая витамином Е, может снизить риск болезни Паркинсона. Особенно богаты витамином Е орехи, семена, зародыши пшеницы, шпинат и другие зеленые листовые овощи.
Натуральный витамин D. Точно установлено, что у больных паркинсонизмом в организме понижен уровень витамина D. Однако пока достоверно не известно, вызывает ли болезнь Паркинсона снижение уровня витамина D или, наоборот, дефицит витамина D приводит к болезни Паркинсона.
Витамины группы В. Исследователи из Erasmus Medical Center (Роттердам) на материале 5289 человек установили, что люди, употреблявшие пищу, богатую витамином B6, заболевают болезнью Паркинсона в два раза реже тех, кто принимает мало витамина В6.
Исследовалось также эффективность приема витамина В12 и фолиевой кислоты, однако какого-либо заметного влияния на течение заболевания обнаружить не удалось. Хотя в некоторых предлагаемых схемах лечения болезни Паркинсона предлагается начинать с приема метилцианкобаламина – витамина B12. Попробуйте, хуже не будет, тем более что витамины группы В следует принимать в комплексе, так как они привыкли работать только в команде.
Одна из причин дегенеративных заболеваний связана с окислением жирных кислот, входящих в состав клеточных мембран. Это окисление вызывается воздействием свободных радикалов и приводит к нарушению обменных процессов в клетке и накоплению токсических веществ.
Клетки нервной ткани особенно богаты липидами. Прием ненасыщенных жирных кислот помогает восстановить липидный состав клеточных мембран и восстановить нормальную работу мембранных механизмов.
Ненасыщенные жирные кислоты Omega-3 (ЭПК и ДГК, присутствующие в рыбьем жире) и особенно Omega-6 (ГЛК, входящая в состав масла ослинника) обеспечивают эластичность и проницаемость клеточных оболочек, а значит, нормальный обмен между клеткой и внешней средой и защиту клетки от проникновения паразитов.
Гинкго билоба. Улучшает микроциркуляцию в сосудах мозга и питание нервных клеток. Еще в 1989 году сообщалось об успешном применении стандартизированного экстракта гинкго при паркинсонизме.
Зеленый чай содержит 2% до 4% кофеина, который влияет на мышление и умственную деятельность, повышает диурез и улучшает передачу нервных импульсов, что важно при болезни Паркинсона. Стимулирующая роль кофеина, как полагают, заключается в увеличения производства нейромедиаторов.
Имеются также сообщения о том, что мангостин может помочь замедлить развитие болезни Паркинсона, глаукомы, и болезни Альцгеймера.
Глутатион. Центральная фигура антиоксидантной системы организма. Дефицит глутатиона связан с такими заболеваниями, как рак, рассеянный склероз, СПИД, болезни Альцгеймера и Паркинсона, атеросклероз, мужское бесплодие и катаракта.
Коэнзим Q10. Обладает мощными антиоксидантными свойствами, необходим для выработки клеточной энергии и способен стимулировать эндогенный синтез допамина. Прием коэнзима Q10 замедляет развитие болезни Паркинсона. По данным разных авторов, суточные дозы 300-1200 мг коэнзима Q10 уменьшали симптомы болезни Паркинсона на 44%.
Мелатонин. Если допамин является биохимическим аналогом света, то мелатонин - биохимическим аналогом темноты. У больных паркинсонизмом ночная выработка мелатонина резко снижается. Применение мелатонина в рамках комплексной терапии при болезни Паркинсона улучшает ночной сон, повышает бодрость в дневное время, а также способствует некоторому повышению двигательных возможностей.
Мелатонин - сильный антиоксидант, его антиоксидантная активность выше, чем у глутатиона, витаминов Е, С и других антиоксидантов. Он также регулирует активность ферментов, участвующих в синтезе допамина и серотонина.
Никотинамид-адениндинуклеотид.(NADH или коэнзим 1). NADH имеет решающее значение для преобразования пищи в энергию. В мозгу NADH стимулирует выработку допамина допаминэргическими нейронами. NADH является одним из самых мощных антиоксидантов мозга.
Лецитин. Относится к фосфолипидам. Известно, что при дефиците допамина падает уровень фосфолипидов в клетках мозга. Лецитин улучшает передачу нервных импульсов. Прием соевого лецитина в течение 3-5 месяцев существенно улучшает показатели мозговой активности.
Альфа-липоевая кислота. Универсальный антиоксидант, восстанавливает все остальные антиоксиданты, в том числе глутатион. Играет также определенную роль в детоксикации тяжелых металлов, особенно в головном мозге.

Если вы хотите использовать натуральные средства только как дополнение к медикаментозному лечению болезни Паркинсона, по-видимому, наиболее перспективным выбором здесь будет прием антиоксидантов. В первую очередь это коэнзим Q10, глутатион и липоевая кислота.
Хорошим натуральным источником глутатиона и липоевой кислоты служит антиоксидантный комплекс Mega q-Protect. Он также содержит экстракты гинкго билоба, зеленого чая и черники, натуральный токофероловый комплекс и ряд других антиоксидантов, создающих прекрасный синергический эффект.
Коэнзим Q10 тоже в него входит, но для терапевтического эффекта содержащаяся в комплексе доза недостаточна, поэтому следует дополнительно принимать препарат Super Co Q10 Plus или Mega Co Q10 Plus.
Следует также придерживаться диеты, включающей здоровые продукты, содержащие антиоксиданты – фрукты, овощи, ягоды. В пищевых продуктах глутатиона содержится недостаточно, но вы можете получить из пищи вещества, необходимые для выработки глутатиона печенью – аминокислоты глутамин, цистеин и глицин. Их источником являются брокколи, цветная капуста и кресс-салат.
Темно окрашенные ягоды, такие как черника, голубика, черная смородина, содержат антоцианы, которые являются эффективными антиоксидантами. А вот употребление молочных продуктов следует резко сократить.
Полная же схема лечения болезни Паркинсона должна обязательно включать в себя следующие этапы.
1. Вывод из организма тяжелых металлов, отравляющих нервную систему, особенно свинца и ртути. Это наиболее распространенные виды загрязнений, так как свинец содержится в автомобильном выхлопе, а ртуть в последнее время все чаще обнаруживается в различных сортах рыбы, даже в лососе, особенно выращенном в садках.
Эффективным средством для выведения тяжелых металлов является прием комплекса хелатных минералов Power Mins, так как содержащиеся в нем кальций, магний и цинк замещают атомы тяжелых металлов. Кроме того, он восполняет дефицит селена, возникающий при избытке тяжелых металлов.
2. Иммуноповышение. При болезни Паркинсона идеальным препаратом является ImmunAid, который содержит Кошачий коготь (Uncaria tormentosa). Как вы знаете, Кошачий коготь эффективно борется с микоплазменной инфекцией, поэтому ImmunAid является также прекрасным дополнением к антипаразитарной программе.
3. Основой антипаразитарной программы является ParaProteX – многокомпонентный препарат широкого спектра действия. Он эффективен и против трихомонады, и против токсоплазмы, а в комбинации с Иммунэйдом прекрасно поборет и микоплазму.
Чем еще хорош Парапротекс – одновременно с уничтожением паразитов, он выводит выделяющиеся при их гибели токсины, дополнительно стимулирует иммунную систему и компенсирует убыль витаминов и минеральных элементов, частично удаляемых вместе с токсинами.
В зависимости от степени зараженности трихомонадой (об этом вам скажет диагностика), прием Парапротекса следует дополнять такими препаратами, как Ocean 21, ProbioBalance или Garlic Max (см. схему применения ParaProteX).
Необходимо также принимать натуральные источники аминокислот – например, пчелиное маточное молочко, препараты, содержащие BCAA, глутамин и креатин. Маточное молочко, к тому же, является уникальным природным источником ацетилхолина, необходимого для прохождения нервных импульсов.
5. Восстановление митохондриальной функции с помощью дыхательных ферментов - коэнзима Q10, мелатонина, витаминов группы В и витамина С. Мелатонин является регулятором гормонального равновесия в организме и балансирует выработку допамина и серотонина, а витамины группы В и витамин С участвуют в выработке энергии и многих ферментных процессах.
Это, как вы понимаете, базовая схема, и она может корректироваться в зависимости от конкретных обстоятельств и течения заболевания. Так, при серьезном нарушении гормонального баланса, например, дисфункции щитовидной железы, перед иммуноповышением и антипаразитарной программой следует восстановить работу эндокринной системы, так как при гормональном дисбалансе ни о каком повышении иммунитета не может быть и речи.
Например, Power Mins в своем составе содержит йод, Ocean 21 действует также и на многих паразитов, биофлавоноиды, входящие в состав многих растительных комплексов, проявляют также эстрогенподобное действие, и т.д.
Все лечение болезни Паркинсона должно проводиться на фоне приема антиоксидантов. Выбор, опять же, за вами. Идеальным комплексом является Mega q-Protect, но при приеме коэнзима Q10 и мелатонина его можно отменить, уменьшить дозу, перейти на q-Protect или мультивитамины, так как они содержат антиоксидантные комплексы, а Super Mega 50 – также и глутатион. Мультивитамины, кстати, полезно принимать во время всего лечения.
Важен также прием магния, который необходим для работы нервных синапсов. Специально для неврологических проблем разработан комплекс MagneZi B6, который содержит также цинк и витамин B6. Следует только учитывать, что магний работает в паре с кальцием, поэтому при проблемах с костями (остеопороз, артрит, ревматизм) лучше принимать комплекс Calcium Magnesium Plus (содержит магний, кальций и витамин D), или чередовать прием MagneZi B6, Calcium Magnesium Plus и Mega B Complex (Stress Management B-Complex).
Для завершения лечения полезно принимать экстракт мангостина, сила которого в том, что он способен восстанавливать биоэнергетику поврежденных клеток, а значит, возрождать организм после перенесенного заболевания. Содержащиеся в нем ксантоны, к тому же, являются одними из самых сильных антиоксидантов, поэтому пить сок мангостина полезно на любом этапе лечения, и при любой болезни.
Биодобавки в большинстве случаев не являются антагонистами лекарственных препаратов, поэтому, если вы пока что не можете отказаться от леводопы, вы можете продолжать прием этого препарата во время программы, до тех пор, пока не почувствуете, что потребность в нем снижается. А это может случиться уже на первых этапах, и уж точно после антипаразитарной терапии.
Внимание! Многие источники сообщают, что леводопа плохо уживается с витамином В6, поэтому учитывайте это, если вы планируете принимать В-комплекс.
И в заключение, если вы решите воспользоваться этой программой, вы сможете сравнить свои успехи с результатами Мохаммеда Али, которого как раз где-то в это время должны начать лечить стволовыми клетками. Вы даже в лучшей ситуации, так как методика, которой собираются лечить Али в израильской клинике (кстати, тоже официально не утвержденная) опробована только на крысах, а не на людях. К тому же Мохаммеду придется выложить приличные деньги, никоим образом не сравнимые со стоимостью лечения БАД.
Вряд ли Мохаммед Али ничего не слышал о натуральном лечении. Его проблема, скорее всего, заключается в том, что он хочет получить за свои деньги все самое лучшее. А лучшие врачи, как известно, любят лечить долго и дорого.
Каков же будет результат? Как говорится, вскрытие покажет.
Внимание! Эта статья представляет собой обзор интернет-публикаций на тему о лечении болезни Паркинсона. Она может быть использована врачами при выборе методов дополнительной терапии. Данная статья не является руководством для самолечения при болезни Паркинсона.
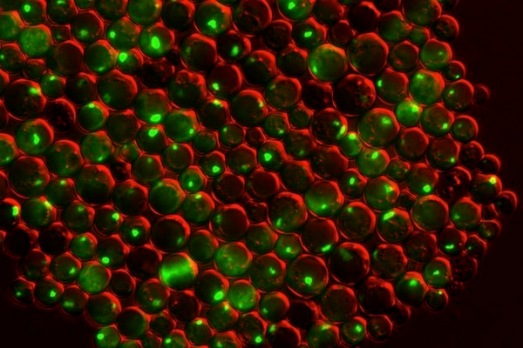
Зеленые пятна сверху – скопления белков внутри дрожжевых клеток с дефицитом как цинка, так и белка, предотвращающего образование агрегатов. Ученые Висконсинского университета в Мэдисоне изучают, как дефицит цинка может способствовать развитию заболеваний. (Фото: Colin MacDiarmid and David Eide/ The Journal of Biological Chemistry )
Ученые Висконсинского университета в Мэдисоне ( University of Wisconsin-Madison ) провели исследование, которое, если его результаты будут воспроизведены на человеческом организме, позволяет признать деструктивную роль дефицита цинка в развитии таких нейродегенеративных заболеваний, как болезнь Альцгеймера и болезнь Паркинсона , причина которых связывается с дефектными белками, образующими скопления в головном мозге.
Структура белка – это его всё. Правильный фолдинг позволяет одним белкам переносить атомы или молекулы, другим – обеспечивать жизненно важную для клетки внутреннюю архитектуру, третьим – выявлять вторгшиеся бактерии и атаковать их. При нарушении структуры – из-за высокой температуры или химических взаимодействий – белки перестают выполнять свои функции и могут начать образовывать агрегаты, что является признаком болезни Паркинсона и болезни Альцгеймера.
Ионы необходимого организму металла цинка играют одну из ключевых ролей в организации и поддержании правильной структуры белков. Американские ученые открыли еще один стрессовый фактор, снижающий стабильность белков и вызывающий их агрегацию,– нехватку этого элемента.
Для простоты эксперименты проводились на дрожжах Saccharomyces cerevisiae – одноклеточных грибах. Дрожжи могут приспособиться как к дефициту, так и к избытку цинка. Гомеостатический и адаптивный ответы на дефицит цинка регулируются в их клетках транскрипционным фактором Zap1 . Один из генов-мишеней Zap1 кодирует пероксиредоксин Tsa1 – белок с функцией как пероксидазы, так и шаперона.
В исследовании, только что опубликованном в он-лайн издании журнала The Journal of Biological Chemistry , Колин Мак-Дайермид (MacDiarmid) и Дэвид Эйде (David Eide) показали, что, удерживая белки в растворе, Tsa1 предотвращает события, которые в противном случае могут стать причиной гибели клетки.
Клетки с низкой концентрацией цинка вырабатывают белки, противостоящие стрессу. Одним из таких белков является Tsa1.
Ученым известно, что пероксиредоксин Tsa1 может снижать уровень вредных оксидантов в клетках, которым не хватает цинка: он может избавлять их от опасных активных форм кислорода, повреждающих белки. Но у него есть и совершенно другая функция – шаперона, предотвращающего их агрегацию. Как следует из результатов экспериментов, функция шаперона более важна.
Если значение этого открытия для медицины еще предстоит оценить, то явное сходство между дрожжевыми и человеческими клетками отрицать нельзя.
Читайте также:







