Электростимуляция спинного мозга при миелопатии
Общие сведения
Миелопатия спинного мозга — это тяжелый соматический синдром, обобщающий различные по этиологическому признаку поражения спинного мозга, сопутствующий многочисленным патологическим процессам и проявляющийся нейродегенеративными изменениями в отдельных спинномозговых сегментах имеющий, как правило, хроническое течение.
Миелопатия всегда возникает вследствие различных патологических нарушений в организме (осложнение дегенеративно-дистрофических заболеваний позвоночника, травм и опухолей позвоночного столба, патологий сосудистой системы, токсического воздействия, соматических заболеваний и инфекционных поражений).
В зависимости от этиологического фактора, т.е. от заболевания, ставшего предпосылкой развития миелопатии, при постановке диагноза указывается эта болезнь/патологический процесс, например, сосудистая, диабетическая, компрессионная, алкогольная, вертеброгенная, ВИЧ-ассоциированная миелопатия и др., то есть таким образом указывается на происхождение синдрома (природу поражения спинного мозга). Очевидно, что при разных формах миелопатии спинного мозга лечение будет существенно отличаться, поскольку необходимо воздействие на основную причину, которая вызвала соответствующие изменения. По МКБ-10 миелопатия кодируется G95.9 (Болезнь спинного мозга неуточненная).
Достоверно точной информации о частоте встречаемости в целом миелопатии нет. Существует лишь информация о некоторых наиболее распространенных причинах ее формирования. Так в США ежегодно происходит от 12 до 15 тысяч травм спинного мозга, а у 5%-10% пациентов со злокачественными опухолями существует высокая вероятность метастазов в эпидуральное пространство позвоночника, что является причиной более 25 тысяч случаев миелопатии в год.
Некоторые виды миелопатии являются относительно редкими (сосудистая миелопатия), другие (цервикальная спондилогенная миелопатия) встречается у почти 50% лиц мужского пола и 33% у женщин в возрасте после 60 лет, что обусловлено выраженностью дегенеративных изменений в структурах позвоночного столба и нарастание проблем со стороны сосудистой системы, характерных для людей пожилого возраста. Наиболее часто поражается шейный и поясничные отделы позвоночника и значительно реже встречается миелопатия грудного отдела позвоночника.
Патогенез
Патогенез развития миелопатии существенно различается в зависимости от заболевания, вызвавшего тот или иной вид миелопатии. Во множестве случаев патологические процессы, лежащие в основе развития заболевания, локализуются вне спинного мозга и рассмотреть их в пределах одной статьи не представляется возможным.
Классификация
В основу классификации положен этиологический признак, в соответствии с которым выделяются:
- Вертеброгенная (дискогенная, компрессионная, спондилогенная) — может быть обусловлена, как травмами позвоночника (посттравматическая), так дегенеративными изменениями в позвоночном столбе (смещение позвонков, остеохондроз, спондилез с выраженным разрастанием остеофитов, стеноз спинномозгового канала, грыжа межпозвоночного диска и др.).
- Дисциркуляторная (ишемическая) — сосудистая, атеросклеротическая, дисциркуляторная, развивается вследствие медленно прогрессирующей хронической недостаточности (ишемии) спинномозгового кровообращения.
- Инфекционная — развивается под воздействием патогенной микрофлоры (энтеровирусы, вирус герпеса, бледная трепонема) и часто является следствием септицемии, пиодермии, остеомиелита позвоночника, СПИДа, болезни Лайма и др.
- Миелопатии, вызванные различного рода интоксикациями и физическими воздействиями (токсические миелопатии; лучевая миелопатия).
- Метаболическая — обусловлена метаболическими расстройствами и осложнением эндокринных заболеваний.
- Демиелинизирующая. В ее основе лежат патологические процессы, вызывающие разрушение (демиелинизацию) миелиновой оболочки нейронов, что приводит к нарушению процессов передачи импульсов между нервными клетками спинного и головного мозга (рассеянный склероз, болезнь Бало, болезнь Канавана и др.).
По локализации патологического процесса выделяется:
- Миелопатии шейного отдела позвоночника (син. цервикальная миелопатия).
- Миелопатии грудного отдела позвоночника.
- Миелопатии поясничного отдела.
Причины
К основным причинам развития миелопатий относятся:
- Компрессия (сдавливание), возникающая в результате травм позвоночника со смещением позвоночных сегментов, спондилолистеза, спондилеза, первичной/метастатической опухоли спинного мозга, эпидурального абсцесса и гематомы, субдуральной эмпиемы, грыжи межпозвонкового диска, туберкулезного спондилита, подвывиха в атлантоаксиальном сочленении, вторичного спаечного процесса и др.
- Нарушение кровообращения в спинном мозге, обусловленное вышеперечисленными причинами, так и различного рода сосудистой патологией, которая формирует медленно прогрессирующую хроническую недостаточность кровоснабжения: атеросклероз, эмболии, тромбозы, аневризма, венозный застой, развивающимся вследствие сердечно-легочной/сердечной недостаточности, сдавление венозных сосудов на различных уровнях позвоночника.
- Воспалительные процессы с локализацией в спинном мозге, обусловленные патогенной микрофлорой, травмой или в силу других обстоятельств (спинальный арахноидит, туберкулез, болезнь Бехтерева, миелит и др.).
- Нарушение процессов метаболизма в организме (гипергликемия при сахарном диабете).
Несмотря на многообразие причин, основной предпосылкой формирования миелопатии принято считать прогрессирующий длительно протекающий остеохондроз (вертеброгенная, дискогенная, компрессионная, дегенеративная миелопатия).
Симптомы
Симптомы миелопатии варьируют в широком диапазоне в зависимости от причин заболевания, уровня поражения, тяжести состояния, характера патологического процесса (острый/хронический). К общим симптомам относятся:
- Постоянный/возникающий при движении интенсивный болевой синдром в спине ноющего/тупого характера.
- Онеменение верхних/нижних конечностях, слабость, нарушения мелкой моторики (при застегивании одежды, письме и др.).
- Снижение в различной степени температурной и болевой чувствительности, появление дисфункции тазовых органов (мочеиспускания).
- Развитие сочетанных спастических парезов и параличей, вызывающих нарушения походки.
Из всего многообразия видов миелопатий рассмотрим лишь несколько, наиболее часто встречающихся в тех или иных отделах позвоночника.
Шейная спондилогенная миелопатия относится к одной из частых причин дисфункции спинного мозга нетравматического характера у людей старшего возраста с развитием спастического тетра- и парапареза. Ведущим патофизиологическим механизмом этого заболевания является ишемия спинного мозга, обусловленная его компрессией с нарастающими дегенеративными процессами структур шейного отдела позвоночного столба (фото ниже).
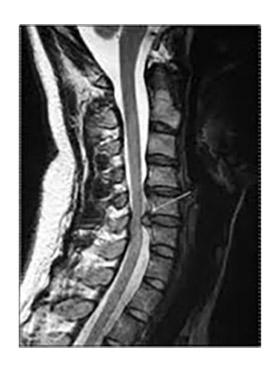
Симптомы отражают нарушения функции верхнего мотонейрона, поражение задних столбов спинного мозга и пирамидных трактов. Градация выраженности нарушения во многом определяется конкретным механизмом развития миелопатии. Так, при компрессионном характере поражении шейного отдела отмечается сочетанность нижнего спастического парапареза и спастико-атрофического пареза рук.
При этом, характерно их изолированное проявление или преобладание расстройств двигательных над чувствительными. Основными жалобами являются: боль в руках с латеральной/медиальной стороны, затруднения при выполнении тонких движений, парестезии в руках, слабость и неловкость в ногах, нарушение походки, развитие нейрогенного мочевого пузыря.
Пирамидный синдром характеризуется несимметричным спастическим тетрапарезом в руках, что обусловлено поражением глубоких пирамидных проводников, отвечающих за верхние конечности. Атрофический синдром проявляется слабостью в мышцах верхних конечностей, атрофиями и фибриллярными подергиваниями, низкими сухожильными рефлексами верхних конечностей.
Цервикальная миелопатия при сосудистом варианте развития миелопатии (сосудистая миелопатия шейного отдела) характеризуется более выраженными и распространенными по длиннику двигательными спинальными сегментарными расстройствами, сочетающихся с ишемией структур входящих в бассейн кровоснабжения передней спинальной артерии (фасцикуляция мышц, отсутствие/снижение рефлексов на руках, амиотрофии).
Наиболее часто встречается дискогенная миелопатия поясничного отдела напрямую обусловленная повреждением межпозвоночного диска, являющейся одним из осложнений остеохондроза позвоночника у пациентов в возрасте после 45 лет и характеризуется хроническим течением. Реже причиной дискогенной миелопатии являются травмы позвоночника и для такой патологии характерно крайне острое течение.
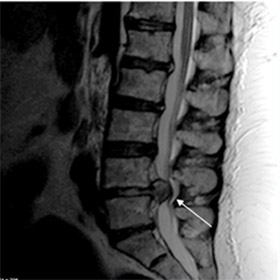
Развитие заболевания обусловлено дегенеративными изменениями в межпозвоночном диске, которые приводят к растяжению/разрыву фиброзного кольца диска и к отрыву его периферических волокон от тел позвонков. Как следствие происходит смещение диска в заднелатеральном направлении, что и приводит к компрессии спинного мозга и прилегающих кровеносных сосудов (фото ниже).
В симптоматике дискогенной поясничной миелопатии наиболее часто встречаются интенсивная радикулярная боль, парезы дистальных отделов ног, снижение мышечной силы ног, нарушение функции органов таза и снижение чувствительности в сакральных сегментах.
Дискогенная миелопатия может осложняется спинальным инсультом (острым расстройством кровообращения) с развитием синдрома трансверзального поражения спинного мозга, для которого характерны сочетание спинальных параличей нижних конечностей с тазовыми нарушениями и глубокой циркулярной гипестезией.
Анализы и диагностика
В основе диагностики миелопатий мануальный осмотр, проверка чувствительности/рефлексов в определенных точках и инструментальные методы исследования, включающие:
- Обзорную/прицельную рентгенографию позвоночного столба в нескольких проекциях.
- Электронейрограмму.
- Компьютерную томографию.
- Магнитно-резонансную томографию.
- Контрастные методы исследования (дискография, пневмомиелография, миелография, веноспондилография, эпидурография).
При необходимости (подозрение на отравление тяжелыми металлами, дефицит витамина В12) назначаются лабораторные исследования. При подозрении на инфицирование проводится спинномозговая пункция.
Лечение
Поскольку миелопатия является обобщенным термином универсальное (стандартизованое для всех случаев) лечение отсутствует, и лечебная тактика определяется в каждом конкретном случае в зависимости от причин, лежащих в основе развития миелопатии. Из общих при принципах лечения можно отметить:
- Для купирования болевого синдрома, уменьшения отека и снижения воспалительного процесса назначаются нестероидные противовоспалительные препараты (Индометацин, Ибупрофен, Ортофен, Диклофенак, Мелоксикам и др.). При сильно выраженной боли, обусловленной сдавлением нервных корешков, назначаются стероидные гормоны (Преднизолон, Дексаметазон и др.).
- Для снятия спазма мышц и уменьшения ощущений назначаются миорелаксанты (Мидокалм, Сирдалуд, Баклосан, Толперизон).
- С целью защиты тканей от гипоксии и нормализации метаболизма используются Актовегин, Церебролизин, Пирацетам и др.
- При наличии инфекции назначаются антибактериальные препараты с учетом чувствительности возбудителя заболевания.
- При необходимости — препараты, восстанавливающие хрящевую ткань (Глюкозамин с хондроитином, Алфлутоп, Артифлекс Хондро, Румалон и др.).
- При ишемической миелопатии назначаются сосудорасширяющие препараты (Папаверин, Кавинтон, Но-Шпа, и нейропротекторы (Глицин, Луцетам, Гамма-аминомасляная кислота, Ноотропил, Гаммалон и др. Для нормализации кровообращения в мелких сосудах и реологических свойств крови — Трентал, Танакан, Пентоксифиллин.
- Для укрепления иммунитета назначаются витаминно-минеральные комплексы или витамины В1 и В6.
Похожие темы научных работ по клинической медицине , автор научной работы — Шапкова Е. Ю.
ФИЗИОТЕРАПИЯ, БАЛЬНЕОЛОГИЯ и РЕАБИЛИТАЦИЯ
Эффективность локальной и общей магнитотерапии при различных клинических формах остеоартроза
В. Д. Гордеева, Е. В. Владимирский, Е. В. Рыболовлев,
Н. Л. Владимирская
ГБОУ ВПО "ПГМА им. акад. Е.А.Вагнера", ЗАО "Курорт Ключи"
Остеоартроз (OA) — одно из наиболее распространенных заболеваний человека. В Европе ОА страдает около 12% населения. Заболеваемость ОА в России в 2001 г. составила 1574,4 на 100 000 населения, в 2005 г. — на 20% больше. Чаще наблюдается моно- и олигоартроз, в 1/3 случаев — полиостеоартроз с поражением более трех суставов.
Изучена эффективность магнитотерапии у больных с различными клиническими формами OA. 1-ю группу составили 56 больных (43 женщины и 13 мужчин в возрасте от 31 года до 70 лет) гонартрозом 2—3-й рентгенологической стадии по Келлгрену— Лоуренсу без явлений синовита. Лечение проводили на курорте Ключи Пермского края. 25 больных получили комплексное лечение, включающее сероводородные ванны, аппликации иловой сульфидной грязи и процедуры локальной магнитотерапии от аппарата "Магнитер".
Группу сравнения составили больные ОА (n = 31), получавшие бальнеогрязелечение. В нее вошли 18 больных OA с явлениями полиостеоартроза, 11 женщин и 7 мужчин в возрасте от 31 года до 70 лет. Этим больным проводили общую магнитотерапию с помощью аппарата "Колибри-Эксперт". В исследовании использовали модифицированную станфордскую анкету оценки здоровья, суммарный индекс Womac с оценкой симптомов по визуальной аналоговой шкале, с помощью угломера определяли объем движений в суставах, болезненность суставов оценивали по Сперанскому (ПБЧ), проводили рентгенологическое и ультразвуковое исследование суставов, определяли уровень С-реактивного белка и
сиаловых кислот в сыворотке крови. Состояние вегетативной нервной системы оценивали с помощью кардиоинтервалографии (КИГ), изучали адаптационные реакции организма по Л. Х. Гаркави и соавт. Исследование проводили до и после лечения.
Анализ эффективности лечения в 1-й группе показал следующее: интегральный показатель выраженности боли в 1-й подгруппе (включение локальной магнитотерапии) уменьшился на 60%, а в подгруппе сравнения — лишь на 52,6%, при этом полное исчезновение болей в 1-й подгруппе наблюдалось в 1,8 раза чаще. В этой когорте больных выявлена более значительная положительная динамика ПБЧ, интегрального индекса Womac, адаптационных реакций по тесту Гаркави, умеренное повышение тонуса симпатической нервной системы по данным КИГ.
Таким образом, для лечения моно- и олигоартрозов целесообразно использовать локальную магнитотерапию, при полиостеоартрозе предпочтительнее общая магнитотерапия с помощью аппарата "Колиб-ли-Эксперт". При проведении общей магнитотерапии обнаружена более выраженная положительная динамика адаптационных реакций и показателей состояния ВНС.
Электростимуляция спинного мозга для восстановления движений при вертеброгенных миелопатиях
ФГБУ "Санкт-Петербургский НИИ фтизиопульмонологии" Минздрава России, Санкт-Петербург
Электростимуляция (ЭС) спинного мозга (СМ) используется преимущественно с противоболевой и противоспастической целью, а ее применение для восстановления двигательных функций остается ограниченным. Цель нашей работы — представить методики и анализ результатов применения ЭС шейного и поясничного утолщений СМ для восстановле-
ния движений при верхних и нижних плегиях верте-брогенной этиологии.
Материал и методы исследования
Лечебная ЭС поясничного утолщения проведена 54 пациентам, шейного утолщения — 26 (возраст 9 мес — 46 лет). Для восстановления движений
ФИЗИОТЕРАПИЯ, БАЛЬНЕОЛОГИЯ и РЕАБИЛИТАЦИЯ
ног использовали метод ЭС поясничного утолщения СМ с эффектом вызова шагоподобных движений ног. Воздействия частотой 3—5 Гц, с силой стимула 1,4—1,8 от величины двигательного порога прикладывали к средней части поясничного утолщения (проекция позвонков ThXII—L:).
Параметры стимуляции подбирали, добиваясь координированных поочередных движений обеих конечностей. Для восстановления движений рук, кисти и пальцев ЭС частотой 0,5—2,0 Гц прикладывали к шейному утолщению, оказывая сначала общее, затем — адресное воздействие на мотонейроны пораженных сегментов (уровень позвонков CV—Th:). Для адресного миотомного воздействия анод располагали на брюшке парализованной мышцы, катод — на уровне иннервирующего ее спинального сегмента. При поражении нескольких мышечных групп или тотальном поражении мышц руки выбирали приоритетные группы мышц (мишени) и воздействовали на них последовательно частотой 1 Гц при низком и 3 Гц при повышенном тонусе мышц.
Продолжительность процедур при воздействии на шейное утолщение составила 40—60 мин, на поясничное — 60—90 мин. При обеих методиках ЭС СМ осуществляли эпидурально, в том числе с помощью стимуляторов, имплантируемых на постоянной основе, или чрескожно, с сопоставимым двигательным эффектом. ЭС-лечение дополняли регулярной двигательной активностью: тредмил-терапией при нижних плегиях и движениями кисти и пальцев рук — при верхних. Эффект ЭС оценивали клинически (шкалы Frankel, ASIA, Ashwоrth), двигательные эффекты документировали видео- и ЭМГ-регистрациями при естественных и вызванных движениях.
Результаты и обсуждение
При ЭС шейного утолщения улучшение движений рук разной степени достигнуто у всех пациентов. Восстановление возбудимости и увеличение силы паретичных мышц наблюдалось в разные сроки и составляло от 1—2 баллов мышечной силы до полного восстановления двигательной функции. Положительная неврологическая динамика наблюдалась не во всех миотомах, возможно, из-за необратимых изменений СМ. При невозможности восстановления функции миотома стимулировали формирование функциональной компенсации за счет сохранных миотомов.
При ЭС поясничного утолщения среди пациентов с исходно полными плегиями (тип А и В по Frankel) восстановление способности к самостоятельному передвижению (тетрапедальная ходьба) достигнуто у 2/3 пациентов, в том числе бипедальная ходьба у 1/3; у 1/3 больных прогресс ограничился уменьшением мышечных атрофий без возможности самостоятельной инициации движений. Все пациенты с неполными плегиями (тип С и D) восстановили или улучшили ходьбу, прирост силы мышц составил 14—18 баллов по ASIA, снижение гипертонуса мышц — 1—2 балла по Ashwоrth. Дисперсионный анализ (ANOVA) прироста силы мышц по ASIA и по шкале функциональности движений подтвердил высокую эффективность метода (р = 0,001) для пациентов c полными и неполными плегиями, зависимость результата лечения от продолжительности ЭС СМ (р = 0,001) и отсутствие статистической зависимости между результатом лечения и возрастом пациента.
Представленные методики ЭС шейного и поясничного утолщений позволяют осуществлять физиологичные, селективные и анатомически обоснованные электровоздействия на мотонейроны и интернейроны СМ. Методики высокоэффективны, специфичны для восстановления движений рук и ног при параличах вертеброгенной этиологии, не имеют возрастных ограничений. Они могут осуществляться с помощью эпидуральной либо чрескожной электростимуляции стационарно и/или амбулаторно. Применение имплантируемых стимуляторов позволяет сокращать сроки стационарного лечения и осуществлять продолжительную либо хроническую ЭС СМ в домашних условиях.
Широкое внедрение методов ЭС СМ для восстановления движений при вертеброгенных миелопа-тиях лимитируется отсутствием стандарта, системы обучения и сертификации специалистов, а также дефицитом доступных стационарных и имплантируемых стимуляторов. Появление на российском рынке наряду с используемыми для противоболевой и противоспастической стимуляции имплантируемыми системами Medtronic (США) доступных по цене стимуляторов НейСи-3М (НПП "ВЭЛ", Киев), а также планируемое создание отечественного производства стимуляторов и учебного центра могут отчасти решить эти проблемы.
Оптимизация электротерапии больных с дорсопатиями по результатам динамической сегментарной диагностики
ООО "Спектрально-динамические системы", Минск, Беларусь
Нарушение симпатического вегетотрофического тельной степени способствует прогрессированию обеспечения тканей позвоночного столба является патологических процессов в позвоночнике. При на-важным звеном патогенеза дорсопатий и в значи- рушении микроциркуляции в позвоночно-двигатель-
- Все
- А
- Б
- В
- Г
- Д
- И
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- Ф
- Х
- Ц
- Э
- Факторы риска
- Симптомы
- Диагностика
- Методы лечения
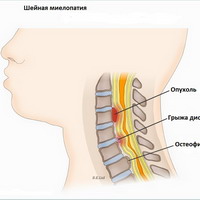
Миелопатия может быть вызвана травмой спинного мозга (перелом или вывих позвонков), грыжей межпозвоночного диска (межпозвонковый диск оказывает компрессионное воздействие на спинной мозг), остеоартрозом позвоночника (спондилез) или объемными поражениями, такими как опухоли. Миелопатия также может быть клиническим проявлением инфекционных или воспалительных процессов, а также нарушений кровообращения в сосудах спинного мозга о (спинальный инсульт). Синдром, который является результатом компрессии спинного мозга с одной стороны спинного мозга на уровне 10 грудного позвонка и сопровождающийся спастическим парезом на стороне повреждения спинного мозга и потерей проприорецепции и болевой и температурной чувствительности на противоположной стороне - называется Броун-Секаровским синдромом и тоже считается разновидностью миелопатии. Причинами миелопатии могут быть также вирусы, иммунные реакции, недостаточность кровообращения в сосудах спинного мозга. Кроме того миелопатия может развиться вследствие демиелинизации (потери нервным волокном защитной оболочки) или как реактивное осложнение на такие прививки как оспа, корь, ветрянка.
Факторы риска
Миелопатия вследствие травмы или заболевания может произойти в любом возрасте как у мужчин, так и у женщин. Степень нарушения функций зависит от уровня поражения спинного мозга.
Чаще всего первичные опухоли спинного мозга встречаются у людей в возрасте от 30 до 50 лет.
Травмы спинного мозга чаще встречаются у мужчин в возрасте от 15 до 35 лет.
Шейная спондилогенная миелопатия является наиболее распространенным повреждением спинного мозга в лиц в возрасте 55 лет и старше. Повышенный риск развития шейной спондилогенной миелопатии имеют люди, которые подвержены повторяющимся травмам - работа связана с переносом тяжестей или занятия такими видами спорта, как гимнастика. Пациенты с наличием сосудистых заболеваний подвержены большему риску закупорки спинальных артерий. Также у пациентов с рассеянным склерозом возможно развитие симптомов миелопатии.
Заболеваемость: Точной информации о частоте миелопатии на сегодняшний день нет. Тем не менее, информация о некоторых распространенных причинах миелопатии существует. К примеру, в США происходит от 12 до 15 000 травм спинного мозга ежегодно. Считается, что у 5% - 10% пациентов с раком велика вероятность роста опухолей в эпидуральное пространство, что приводит к более 25000 случаям миелопатии в год, из них 60% будет возникать в грудном отделе позвоночника, и 30% в пояснично-крестцовом отделе позвоночника.
Распространенность шейной спондилогенной миелопатии составляет 50% среди мужчин и 33% женщин в возрасте старше 60 лет.
Различные опухоли могут привести к компрессии спинного мозга, но первичные опухоли спинного мозга встречаются достаточно редко.
Симптомы и диагностика
История болезни: симптомы миелопатии варьируют в зависимости от причин, тяжести состояния, и является ли состояние являющейся причиной миелопатии острым или хроническим. В случае, когда причиной являются опухоли спинного мозга, компрессия или травмы могут быть боли (которые также могут иррадиировать в руки или ноги), нарушения чувствительности или движений, и / или контрактуры с одной, или с противоположной стороны тела. Если причиной является остеоартрит, могут быть жалобы на боли и болезненность, снижение амплитуды движений в позвоночнике, слабость, возможны деформации позвоночника. Миелопатия может также проявляться нарушением функции мочевого пузыря или кишечника или потерей чувствительности или онемением в области гениталий. Инфекции, вызывающие миелопатию, могут вызвать повышение температуры, покраснение, припухлость, повышенную болезненность. Если у человека синдром Броун-Секара, то может быть спастический паралич на стороне повреждения спинного мозга и потеря проприорецепции и боль, чувство жара на другой стороне тела.
Стандартный неврологический осмотр может выявить заболевания, связанные с компрессией корешков (например, шейная радикулопатия) или наличие спастичности в ногах. Клонусы мышц могут быть признаками расстройств верхнего двигательного нейрона в спинном мозге. Изучение рефлекторной активности позволяет отметить изменения рефлексов (которые могут быть повышенными или сниженными в зависимости от причины), а также потери или изменения чувствительности. Проверка сенсорной чувствительности (от нижних конечностей до лица) может быть необходима для определения уровня нарушений чувствительности. Кроме того, полезно определение активности брюшных рефлексов, что также позволяет уточнить уровень поражения. Также может быть паралич и / или уменьшение чувствительности в различных частях тела. Возможно также снижение объема произвольных движений. Оценка функции прямой кишки тоже имеет важную роль в диагностике миелопатии.
Диагностические методы зависят от истории заболевания и физикального обследования. Рентгенография, денситометрия, компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) спинного мозга может обнаружить повреждения в пределах или вблизи спинного мозга. Лабораторные исследования могут быть назначены, чтобы исключить другие возможные причины (например, дефицит витамина В12 или отравления солями тяжелых металлов). Повышенное количества белых кровяных телец (лейкоцитов) предполагает наличие инфекции (менингит или остеомиелит позвоночника). Повышенная скорость оседания эритроцитов крови (СОЭ) может быть признаком воспаления, инфекции или опухоли. Спинномозговая пункция может быть проведена для получения спинномозговой жидкости (ликвора) для лабораторных исследований при подозрении на менингит или рассеянный склероз. Другие диагностические процедуры могут включать биопсию костной ткани или мягких тканей, а также посев культуры крови и цереброспинальной жидкости.
Лечение
Лечение зависит от причины миелопатии. Для перелома или вывиха позвонков - обезболивающие (анальгетики), тракция, иммобилизация в течение нескольких недель, и реабилитационная терапия (физиотерапия, ЛФК, массаж). Хирургическое лечение для исправления деформации позвоночника может включать в себя удаление части поломанного позвонка и / или фиксация отломков позвонков. Анальгетики, НПВС, (стероиды), и, возможно, физиотерапия может быть использована для лечения проблем связанных с артритом. Лекарственные препараты для лечения рассеянного склероза могут быть полезными, в том числе новые лекарственные препараты или стероиды. Инфекции требуют применения препаратов для устранения инфекции (антибиотики), для снижения температуры (жаропонижающие), и, возможно, противовоспалительные препараты (стероиды), чтобы минимизировать воспаление. Для лечения миелопатии в результате компрессии спинного мозга может потребоваться операция по удалению опухоли или грыжи межпозвонкового диска (ламинэктомия).
Прогноз зависит от причины миелопатии и наличия стойкого повреждения нервных структур. Тракция и иммобилизация могут привести к полному выздоровлению, если не было повреждения спинного мозга. Полное излечение возможно и при инфекциях. При хронических заболеваниях таких, как артрит или остеопороз, эффект от лечения может быть временным или если заболевание прогрессирует, то возможно стойкая потеря трудоспособности вплоть до инвалидной коляски Травма спинного мозга или компрессия может привести к необратимым изменениям в спинном мозге, включая потерю чувствительности в различных частях тела, а также потерю произвольных движений в конечностях. Восстановление после удаления опухоли зависит от остаточного повреждения и если это раковая опухоль, то от метастазирования. Восстановление после удаления грыжи диска (дискэктомия) дает хороший результат, но только если спинной мозг не подвергся необратимым изменениям в результате компрессии. Осложнениями миелопатии может быть зависимость от обезболивающих, постоянная нарушение чувствительности и / или произвольных движений, деформации позвоночника и нарушения функции мочевого пузыря и кишечника.
Использование материалов допускается при указании активной гиперссылки на постоянную страницу статьи.
Применение эпидуральной электростимуляции спинного мозга
Клиническое применение эпидуральной электростимуляции спинного мозга (ЭССМ) ведёт свой отсчёт с 1967 года, когда Shealy попытался с её помощью купировать фантомные, некурабельные болевые синдромы.
В дальнейшем Cook A.W. в 1973 году показал, что у больных с болевым синдромом и моторными дисфункциями применение ЭССМ вызывает не только уменьшение болей, но и оказывает положительный эффект на восстановление моторных нарушений при различных заболеваниях (рассеянный склероз, церебральный паралич, неполная посттравматическая миелопатия).
В России работами Лившица А.В (1976-1990), Канделя Э.И. (1986) и Нинеля В.Г. (1994) методика популяризирована для лечения спастико-болевого синдрома у больных с полным и неполным повреждением спинного мозга.
На сегодня работами Huang (2004), Катунян П.И. (2003) уточняются механизмы поражения спинного мозга при различных заболеваниях (например, роль рецепторов NMDA, апоптоз, нейротрофические факторы).
Используются принципиально новые технологии : трансплантация нейрональных и модифицированных стволовых клеток, введение в зону повреждения мозга веществ с возможностью максимального переноса кислорода - перфторан, эритропоэтин.
На этом фоне применение эпидуральной электростимуляции представляется простой и эффективной методикой восстановления функций спинного мозга с учётом выявления генераторов локомоторной активности (Шапков Ю.Т., Шапкова Е.Ю., 1994).
Целью работы исследователей из Екатеринбурга является сопоставление клинических и электронейромиографических данных при проведении временной эпидуральной электростимуляции спинного мозга на различных уровнях.
Материалом для исследования послужили 13 пациентов с миелопатией различной этиологии : 5 - с цервикальной компрессионно-ишемической миелопатией, 4 - с миелорадикулоишемией на уровне поясничного утолщения вертеброгенного генеза (после удаления грыж диска на поясничном уровне), 1 - с последствием цервикальной травмы, 2 - е последствием спинальной торакальной травмы, 1 - е последствием огнестрельного ранения на поясничном уровне. Все больные были разделены на две группы: с полным и неполным поражением спинного мозга (11).
11 пациентов с неполным поражением спинного мозга имели двигательный дефицит в виде нижнего парапареза и тетрапарез от двух до четырёх баллов, спастический гипертонус до 3- х баллов по Ашфорду, различной степени нарушения функции тазовых органов, нарушения различных видов чувствительности, координации и пространственного чувства, умеренные - до 5-ти баллов по визуальной аналоговой шкале - болевые синдромы. Период после начала заболевания был от месяца до 8-ми лет.
Электростимуляции шейного отдела
Методика состояла из стандартизированной перкутанной имплантации электродов для эпидуральной электростимуляции шейного или поясничного утолщений и (или) к повреждённому корешку спинного мозга.
Имплантация осуществлялась под местной анестезией в рентген-операционной с использованием электронно- оптического преобразователя "Philips300", иглы Тоухе 18G, провода- электрода временного индифферентного ПЭВИ-3. В ряде случаев имплантация осуществлялась во время открытой операции в область переднего либо заднего эпидурального пространства.

Сразу после имплантации на операционном столе проводилась тестовая стимуляция двумя способами: между электродами выше и ниже утолщения, и между центральным электродом на уровне утолщения и периферической двигательной точкой. Если вызывались четкие сокращения мышц, импульс проходил по зоне болевого синдрома, то коррекции установки электрода не требовалось.
Стимуляция проводилась на аппарате собственной конструкции с компьютерным интерфейсом с индивидуальным подбором параметров тока по электромиографии и электродиагностике: частота - 0,5-50 Гц, продолжительность импульса - 0,05 мс до 1-2 мс, сила тока до 20 мА, модуляция - 1:2, форма тока от экспоненты до прямоугольного.
Проводилось до 20 процедур электростимуляции, продолжительностью до 40 минут, с обязательной сменой полярности и использованием точек для лечения нарушения функции тазовых органов.
Электронейромиография (ЭНМГ) с определением СПИ, Н-рефлекса и М-ответа, и игольчатой методики проводилась до, на 2-е сутки после имплантации и после окончания курса электростимуляции, обычно через 3 и 6 месяцев на аппарате "Nicolett-Viking". У ряда больных через 3 и 6 месяцев курс ЭЭСТ повторяли.
Результаты и их обсуждение. Клинически у всех пациентов получили улучшение двигательной функции в среднем на 0,5 балла, снижения уровня спастики на 1-2 балла по шкале Ашфорда, улучшение контроля над мочеиспусканием и дефекацией, уменьшение чувствительного сегментарного дефицита и улучшение координации.
Причём, чем дольше период от начала заболевания до лечения, тем хуже был результат. Электромиографические показатели полностью подтверждали клинические данные. Это наиболее ярко было выражено у пациентов с патологией шейного отдела спинного мозга.
Выводы:
- Эпидуральную электростимуляцию необходимо выполнять под контролем ЭНМГ и выяснять соотношение Н-рефлекса к М-ответу после 1-го сеанса, после чего производить коррекцию параметров тока, выполнять ЭНМГ-контроль в конце лечения, через 3 и 6 месяцев после лечения.
- Выполнение ЭЭСТ по двум выше описанным методикам со сменой полярности и использованием "тазовых точек" улучшает эффективность метода по сравнению со стандартной методикой.
- Наиболее достоверными ЭНМГ признаками улучшения проводимости спинного мозга являются: исчезновение фасцикуляций, увеличение амплитуды М-ответа произвольного сокращения в 1,5-2 раза, появление или увеличение Н-рефлекса, увеличение отношения Н/М не менее 25% (Нинель В.Г., 1994г.).
- Восстановление функции шейного отдела спинного мозга происходит под воздействием ЭЭСТ быстрее и эффективнее, а грудного - по сравнению с предшествующими - значительно хуже и неполно, эффекты менее долговременны, что соответствует данным литературы.
- Использование ЭЭСТ в активной нейрохирургической реабилитации пациентов с миелопатией различной этиологии является простым, дешёвым и эффективным методом лечения. Единственным недостатком методики является возможность присоединения инфекции через 1,5-2 недели после временной имплантации. Данное обстоятельство вынуждает искать новые методы имплантации для электростимуляции.
Читайте также:



