Гормон который превращает стволовые клетки в нервные
Окситоцин называют “гормоном любви”, “общественным гормоном”, “гормоном нежности”, или “гормоном счастья”. Безусловно, он оказывает мощное воздействие на наши взаимоотношения с другими людьми, а новейшие исследования показывают, что нехватка гормона окситоцина связана с целым рядом хронических проблем со здоровьем. Существуют и другие гормоны, которые влияют на настроение и безопасное старение, и поэтому мы всегда стремимся сохранять равновесие многочисленных гормонов. Узнайте больше о том, как сбалансировать прогестерон, окситоцин, тестостерон, эстроген, кортизол и щитовидный гормон: Программа ЗАЩИТЫ.
Окситоцин – гормон любви.
Женщины, которые способны многократно испытывать оргазм во время секса, имеют намного более высокие уровни окситоцина в крови и ощущают более сильный оргазм. Окситоцин может помочь женщине сделаться более открытой для сексуальных отношений, а с соответствующим стимулированием - способствовать даже более лёгкому возбуждению. Некоторые пациентки сообщают об увеличении количества многократных оргазмов (обычно в течение 3 часов с момента приёма окситоцина).
Нехватка окситоцина и заболеваемость.
Симптомы и болезни, связанные с дефицитом окситоцина, перечислены ниже:
- Менопауза и хирургическая менопауза
- Продолжительные стрессовые ситуации
- Снижение функции щитовидной железы
- Угнетенное состояние
- СПИД
- Цитомегаловирусная инфекция
- Рассеянный склероз
- Фибромиалгия
- Хроническое употребление опиоидов
- Болезнь Паркинсона
- Синдром Прадера-Вилли
- Чувство одиночества
- Тревожные расстройства
- Определённые формы шизофрении
- Аутизм
С возрастом производство нашего собственного гормона окситоцина снижается.
Гормоны - это сложный предмет. Производство окситоцина в наших телах - также непростой процесс. Окситоцин помогает нам устанавливать контакт с другими индивидами, и снижение его уровня после менопаузы подробным образом рассмотрено в книге “Женский мозг”, опубликованной доктором Луанн Брайзендайн. Это снижение уровня окситоцина может внести напряжение в отношения с партнёрами, и исследование указывает на факт, что данное отклонение может вызвать множественные проблемы со здоровьем.
Другие гормоны благоприятствуют созданию окситоцина в вашем организме. Гормоны эстроген и дофамин (нейротрансмиттер головного мозга, уровень которого уменьшается у людей с болезнью Паркинсона), и гормоны щитовидной железы сокращаются в производстве с возрастом, а ведь все эти гормоны дают толчок развитию синтеза окситоцина. Число нервных окончаний в головном мозге, которые формируют выработку окситоцина, не уменьшается с возрастом, но эти наиболее важные стимуляторы для создания окситоцина сокращаются по мере того как вы стареете.
Аутизм и нехватка гормона окситоцина.
Видео: Лечение аутизма Окситоцином от Жоржа Д. Флекаса, доктора медицины, магистра здравоохранения в Невада центре.
Гормон окситоцина необходим для создания привязанности.
Ваша матушка вырабатывала окситоцин, когда кормила вас грудью. Она также производила окситоцин, когда слышала ваш плач. Следует беспокоиться об установленных имплантатах для увеличения груди, потому что они наносят ущерб связям между сосками и головным мозгом, и это может привести к снижению способности формировать окситоцин.
Другие факторы, которые препятствуют вашему телу оставаться в состоянии изготавливать окситоцин, включают стресс, использование лекарственных препаратов на основе опия, и даже эмоции страха и гнева. В прошлом считалось, что окситоцин имеет важное значение только в процессе родоразрешения, когда мать при рождении младенца производит окситоцин, чтобы стимулировать сократительную деятельность матки. В 1963 году, в ходе одной из первых медицинских конференций по окситоцину в Южной Америке, был сделан доклад о том, что окситоцин повседневно влияет на ваше кровообращение. Как высокое кровяное давление, так и мигренозные головные боли одновременно сопряжены с низким уровнем гормона окситоцина.
Окситоцин, здоровое старение и стволовые клетки.
Окситоцин даёт сигналы стволовым клеткам, чтобы те стали клетками сердца. Что интересно, сердце является символом любви, и окситоцин, будучи гормоном любви, превращает ваши стволовые клетки в сердечные. Он также стимулирует стволовые клетки в вашем костном мозге, создавая новую костную ткань. Окситоцин может также помочь вам уменьшить риск рака молочной железы путём подавления определённых клеточных линий рака молочных желёз.
Гормон окситоцина и тестостерон.
Окситоцин помогает регулировать выработку тестостерона и делает тестостерон более активным посредством его преобразования в дигидротестостерон (ДГT), который примерно в 4 раза активнее тестостерона. ДГT затем преобразуется в другой гормон, который, являясь “мужским” гормоном, ведёт себя как “женский”, потому что он активирует рецептор эстрогенов, 3-альфа-диол. Эти рецепторные нейроны являются особым типом эстрогеновых рецепторов, известных под именем рецептор к эстрогену бета. Рецептор к эстрогену бета является предметом постоянного изучения, так как при активации он проявляет противораковые свойства в молочной железе и простате. Оба гормона, эстроген (эстрадиол) и детский ДГT 3-альфа-диол, усиливают производство окситоцина в головном мозге. Таким образом, формы как эстрогена, так и тестостерона влияют на уровни окситоцина в головном мозге, и это является одной из причин, почему комплексный подход к гормонозаместительной терапии имеет важное значение.
“Эндокринный компонент стрессовой реакции регулируется глюкокортикоидами и половыми стероидами. Тестостерон подавляет функционирование гипоталамо-гипофизарно-надпочечникового (ГГН) осевого органа; однако механизмы, с помощью которых он это делает, изучены недостаточно. Подходящей мишенью мужского полового гормона является ген окситоцина (OXTR), учитывая, что он тоже угнетает активность ГГН. Внутри паравентрикулярного ядра гипоталамуса нейроны синергического окситоцина, играющие активную роль в упорядочивании стрессовой реакции, не отражают андрогенные рецепторы, но отражают эстроген-рецептор-альфа (ЭР-альфа), который связывает метаболит дигидротестостерона 3-альфа, 17-альфа-диол (3-альфа-диол).”
Окситоцин и снижение функции щитовидной железы.
Окситоцин продемонстрировал поддержание функции щитовидной железы посредством улучшения импорта йода в тиреоидные клетки. Йод необходим для производства гормонов щитовидной железы. Фактически, количество йода в гормоне щитовидной железы определяет её функционирование. Как окситоцин, так и пролактин стимулируют импорт йода через йодистый натрий по системе взаимосвязанного переноса через клеточную мембрану двух растворов в одном направлении.
Окситоцин как гормон коры надпочечников.
Лечение Окситоцином (т.е. подъязычным окситоцином) снижает уровни гормона стресса (кортизола). Исследование указывает на то, что генетика играет некоторую роль в том, как ваш организм справляется со стрессом. В зависимости от вашей наследственности, окситоцин может оказывать сильное влияние на то, как окружающие люди смогут помочь вам справляться со стрессом. В 2011 году исследование в рамках Трудов Национальной академии наук показало, что “генетическая вариация окситоцина в системе снижает эффективность положительного социального взаимодействия как защитный буфер против стрессового жизненного опыта.”
Ещё одно исследование 2011 года в журнале Северо-Американского общества климактерического периода (NAMS) установило, что культура также играет значительную роль в том, как мы ведём себя в стрессовой ситуации, основываясь на нашей наследственности и уровне окситоцина. Исследователи сравнили различные генотипы по окситоцину в Корее и Соединённых Штатах и обнаружили, что женщины с одинаковыми генотипами ведут себя по-разному в зависимости от их культуры. Женщины в Соединённых Штатах скорее склонны искать социальную поддержку во время стресса, если они относятся к определённому генотипу по окситоцину. В Корее такой же окситоциновый генотип не предрекает этого.
“Эти выводы показывают, что OXTR rs53576 является чувствительным к участию со стороны общественного окружения, в особенности в части культурной нормы эмоционального стремления к социальной поддержке. Эти открытия также указывают на то, что психологическое потрясение и культура являются важными регуляторами, которые формируют поведенческий результат, связанный с генотипами OXTR.”
В дополнение к этому, наша окситоциновая наследственность определяет, насколько щадящее действие оказывает стресс на нашу жизнь. Недавно проведённое исследование 2013 года, опубликованное в журнале о Гормональных факторах и поведении, продемонстрировало, что у некоторых людей их окситоциновая наследственность позволяла им использовать благотворительную деятельность как способ справиться со стрессом. Пожалуй, это объясняет, как некоторые врачи борются со стрессом, оказывая помощь другим на ежедневной основе, и почему генетика некоторых врачей может сделать их менее легко подверженными напряжению за счёт того, что им приходится держать жизни других людей в своих руках.
“Результаты показали, что милосердное поведение создаёт защитную зону связи между стрессовым событием и впервые выявленным недомоганием среди личностей с AA/AG генотипами, имеющими вариант rs53576 гена рецептора окситоцина (OXTR), но не среди тех, кто относится к GG генотипу. Эти результаты приводят к выводу, что окситоциновая функция может в значительной степени влиять на здоровье и может помочь объяснить зависимость между просоциальным поведением и здоровьем. В более широком смысле, эти выводы приводят в соответствие значение гормонов, характеризующих поведение заботливого лица, для системы охраны здоровья и хорошего самочувствия.”
Нехватка гормона окситоцина и потеря веса.
Окситоцин (Oxt) может быть важным фактором в похудении. Исследования показали, что окситоцин влияет на уровни сахара в крови. В 2011 году исследование, проведённое на мышках (просим прощения у детишек), заключавшееся в лечении с помощью инъекций окситоцина, заставило мышей есть меньше и терять избыточный жир. Эти мыши были уже явно тучными из-за переедания до начала терапии, и они стали менее толстыми сразу после 13 дней лечения, не смотря на получение такого же набора продуктов питания. Их кровяное давление оставалось одинаковым в течение всего лечения. Исследователи сделали заключение, что “периферийная терапия Окситоцином предоставляет новый терапевтический подход для лечения ожирения и гиперфагии [булимии].”
Гормональная терапия окситоцином.
Окситоцин используется для лечения ряда состояний здоровья, а также для поддержания безопасного старения. Окситоцин - это рецептурный препарат, который можно принимать в виде назального спрея, в виде подъязычной таблетки или пастилки, местно, и в виде инъекций. В нашей практике мы полагаем подъязычную форму наиболее удобной. Окситоцин можно класть под язык в виде специального препарата, и он, растворяясь, попадает непосредственно в ток кровообращения.
Вспомогательный окситоцин может быть весьма полезным, если вы испытываете нехватку окситоцина. Поиск причин дефицита окситоцина также важен. Наследственные факторы, гормональный дисбаланс, как и дефицит питательных веществ - всё это потенциальные причины снижения уровня окситоцина. Тьерри Эртог, доктор медицины, издал несколько книг о гормональной терапии, а так же написал книгу “Страстный секс и долгая жизнь – невероятное приключение окситоцина”.
В 2011 году исследователи опубликовали статью по менопаузе с выводом о возможности лечения вагинальной атрофии посредством локального лекарственного воздействия окситоцином. Вагинальная атрофия - это одна из главных причин возникновения боли во время секса у женщин в постменопаузе. Окситоцин применялся в высоких дозах во внутрь влагалища, и большая часть женщин испытывала улучшение по симптомам. “Местное лечение окситоцином улучшает самочувствие женщин при вагинальной атрофии в постменопаузе.”
Окситоцин исследуют в Китае при лечении головной боли. В 2013 году опубликовано исследование по нейропептидам, согласно которому испытатели обнаружили, что окситоцин (OXT), распылённый в нос, может облегчать головную боль. В отчёте сказано, “данные показывают что интраназальный OXT, который доставляется к центральной нервной системе через обонятельную область, может снимать человеческую головную боль, и OXT может быть потенциальным лекарством для облегчения головной боли посредством интраназального введения.”
Этот перевод мне заказали и не оплатили с адреса Катерина Черепкова .
МОСКВА, 15 мая — РИА Новости. Британские биологи обнаружили, что гормон активин управляет развитием клеток мозга в зародыше мыши и может превращать "заготовки" нейронов из эмбриональных стволовых клеток в соединительные нервные клетки, пригодные для лечения эпилепсии, аутизма и шизофрении, говорится в статье, опубликованной в журнале Nature Communications.
За последние два десятилетия биологи научились превращать стволовые клетки во "взрослые" ткани костей, мускулов, кожи и нервной системы. Культуры "стволовых" нейронов могут стать лекарством от болезней Альцгеймера, Паркинсона и других нейродегенеративных заболеваний. Для получения таких культур ученые пытаются выделить из стволовых клеток биологически активные молекулы, заставляющие их превращаться в различные типы нервных клеток.
Группа биологов под руководством Тристана Родригеза (Tristan Rodriguez) из Имперского колледжа Лондона (Великобритания) обнаружила, что одним из таких веществ является активин — гормон роста, управляющий менструальным циклом женщин и сперматогенезом мужчин, а также влияющий на множество других процессов в организме человека и животных.
Родригез и его коллеги заметили, что будущий мозг зародыша мыши содержит в себе множество клеток, выделяющих и поглощающих молекулы активина. Ученые вырастили несколько зародышей грызунов из эмбриональных стволовых клеток и извлекли из них клетки-предшественники нейронов.
Биологи обработали полученную культуру "заготовок" нейронов при помощи активина и проследили, как будут вести себя клетки через несколько дней после добавления гормона.
По словам ученым, появление небольшого количества активина привело к превращению практически всех предшественников нервных клеток так называемого типа Nestin в соответствующие им взрослые нервные клетки. Другие виды "заготовок" нейронов не прореагировали на появление гормона и не развивались в полноценные нервы.
Убедившись в действенности гормона, исследователи изучили его действие, непрерывно наблюдая за состоянием культуры клеток в течение суток. Как утверждают авторы статьи, активин начинает действовать уже через шесть часов после появления его молекул в питательной жидкости — к этому моменту часть "заготовок" уже успела превратиться в "взрослые" нервные клетки.
Данные клетки обладали всеми свойствами нормальных нейронов и по своим электрофизическим характеристикам ничем не отличались от них. Кроме того, добавление активина заставляло нейроны "запомнить" свою будущую роль и передвигаться в ту часть развивающегося мозга, где они должны находиться в организме новорожденного детеныша и взрослой особи.
Авторы статьи проверили жизнеспособность новых нейронов, вставив их в двигательную кору мозга мыши. Через месяц нервные клетки успешно интегрировались в мозг грызуна, исполняя роль вставочных нейронов, повреждение которых является одной из причин аутизма, шизофрении и эпилепсии.
Затем биологи попытались провести аналогичные эксперименты с человеческими стволовыми клетками, полученными из эмбрионов и из "перепрограммированных" клеток соединительной ткани. Во всех случаях клетки вели себя так же, как и "заготовки" нейронов мыши.
Родригез и его коллеги полагают, что их методика управления развитием стволовых клеток поможет медикам разработать терапии, позволяющие излечить некоторые нейродегенеративные заболевания.
- 2360
- 1,9
- 0
- 8
![]()
Антон Чугунов![]()
Андрей Панов![]()
Ольга Волкова
- Иммунология
- Медицина
- Наука из первых рук
- Нейробиология
- Нейродегенерация
- Стволовые клетки
- Эмбриология

Стволовые клетки взрослого организма
Стволовые клетки (СК) находятся в организме в строго определенных местах, которые, благодаря окружающим клеткам и внеклеточному матриксу [1], обеспечивают правильное функционирование стволовых клеток. Такие места называются клеточной нишей [2]. В костном мозге есть два типа СК: кроветворные, способные дифференцироваться во все клетки крови, и мезенхимные (МСК), дающие начало костной, хрящевой и жировой тканям и составляющие важную часть стромы кроветворения (ниши кроветворной СК), но ни при каких обстоятельствах не способные дифференцироваться в клетки крови.
Ниже в иерархии стоят олигопотентные клетки-предшественницы — родоначальницы только нескольких линий клеток крови, таких как общие миелоидные предшественники (дающие моноциты, мегакариоциты, эритроциты) и общие лимфоидные предшественники (дающие В-, Т- и НК-клетки ).
Еще более низкую ступень в иерархии занимает отдел уни- и бипотентных клеток-предшественниц, способных дифференцироваться только в одном или двух направлениях.
Большой медицинский потенциал сподвиг Бигильдеева А.Е. с соавторами досконально изучить этот тип клеток при помощи генетического штрихкодирования клеточных популяций [6]. При извлечении МСК из костного мозга [7] в каждую клетку вносят метку — небольшой уникальный фрагмент ДНК, который встраивается в геном клетки и потому будет находиться в геномах всех ее потомков. Анализ этих меток после роста в чашке Петри позволяет определить, потомки каких клеток размножились сильнее, а каких — не оставили потомков.
Оказалось, что популяция МСК гетерогенна и представлена множеством клеточных клонов (потомков одной исходной клетки), различающихся по способности к делению и дифференцировке. При многократном пересеве культуры ее клональный состав значительно меняется из-за ухода потомков клеток, не способных к долгому размножению. МСК с высокой способностью к размножению чаще выявляются на ранних этапах культивирования вне организма, и в поликлональной популяции МСК содержится лишь небольшое количество таких клеток. В связи с этим в подходах регенеративной медицины, требующих активного размножения клеток, рекомендуется применять МСК ранних пассажей (то есть те, что жили в чашке Петри недолго). Благодаря подобным исследованиям становится ясно, что хранить в замороженном виде МСК в больших количествах невозможно: для этого придется их долго культивировать, и они могут утратить требуемые стволовые свойства. Тут можно обратиться к более ранним стволовым клеткам, каких во взрослом организме уже не остается.
Эмбриональные стволовые клетки
Некоторые стволовые клетки функционируют не просто в особом месте организма, но и в строго определенное время. Тотипотентностью — способностью дифференцироваться во все клетки организма и экстраэмбриональные ткани — обладает только зигота, но уже после нескольких делений это свойство утрачивается навсегда. На стадии бластоцисты происходит первая специализация клеток эмбриона: выделяются клетки трофобласта (наружный слой, который затем образует экстраэмбриональные ткани) и клетки внутренней клеточной массы, из которых разовьется весь организм (рис. 1). Последние при культивировании в чашке Петри называются эмбриональными стволовыми клетками (ЭСК). Впервые удалось вывести этот тип клеток в культуру в 1981 году [8]. Добавляя в культуральную среду определенные белки — факторы роста, — удается долго поддерживать ЭСК в недифференцированном плюрипотентном состоянии. ЭСК активно размножаются, сохраняя при этом свои свойства, что позволяет получать большое количество клеток для исследовательских задач и для применения в медицине.
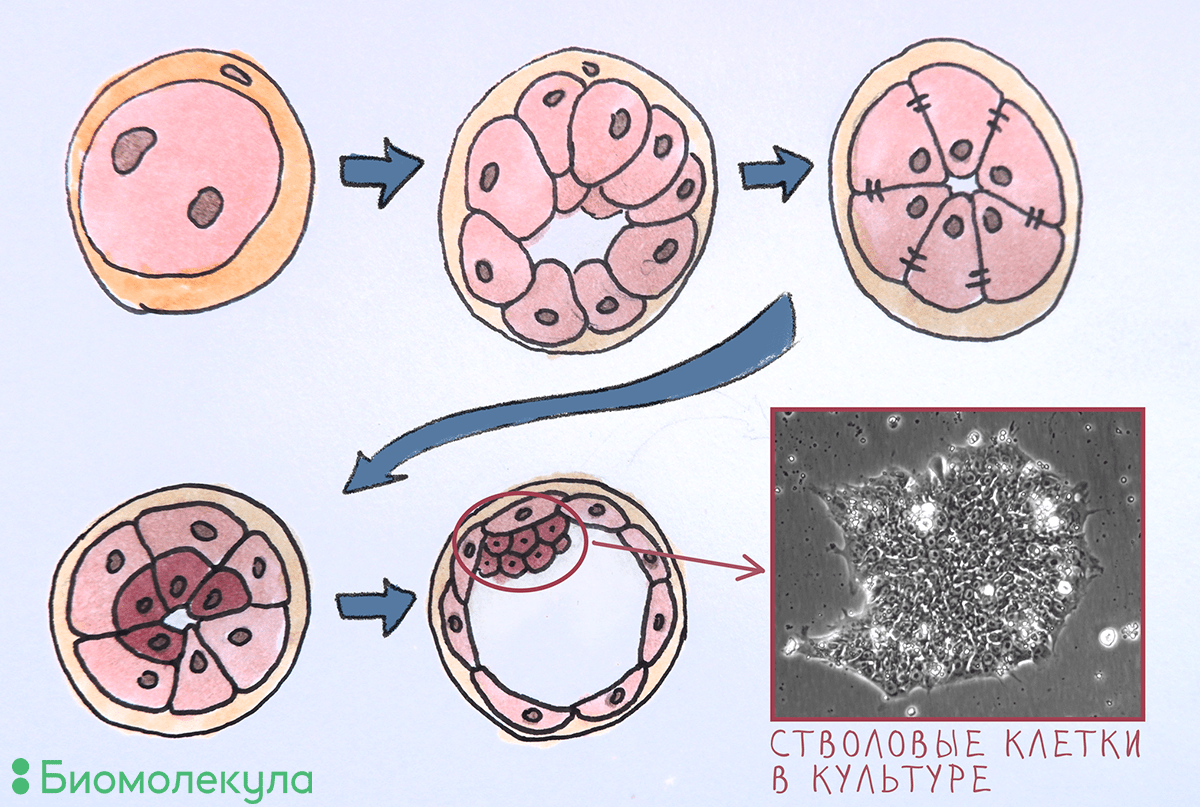
Рисунок 1. Первые пять дней развития эмбриона человека. 1 — Оплодотворение; 2 — деление (дочерние клетки называются бластомерами); 3 — компактизация (образование плотных контактов между бластомерами); 4 — дифференцировка на внутренний и внешний слои; 5 — образование полости (бластоцеля), внешнего слоя клеток (трофобласта) и внутренней клеточной массы, которую можно извлечь для культивирования в чашке Петри и получить таким образом ЭСК (фото автора статьи).
Существуют разные протоколы перепрограммирования — как со вставкой ДНК прямо в геном клетки (подходят только для исследовательских целей), так и не оставляющие следов в геноме (подходят и для медицинского применения ИПСК). Получение ИПСК с помощью доставки репрограммирующих факторов в вирусных векторах (например, лентивирусных, относящихся к тому же семейству вирусов, что и ВИЧ), которые встраиваются в геном клетки, широко распространено в лабораторной практике ввиду высокой эффективности, методологической простоты и дешевизны.
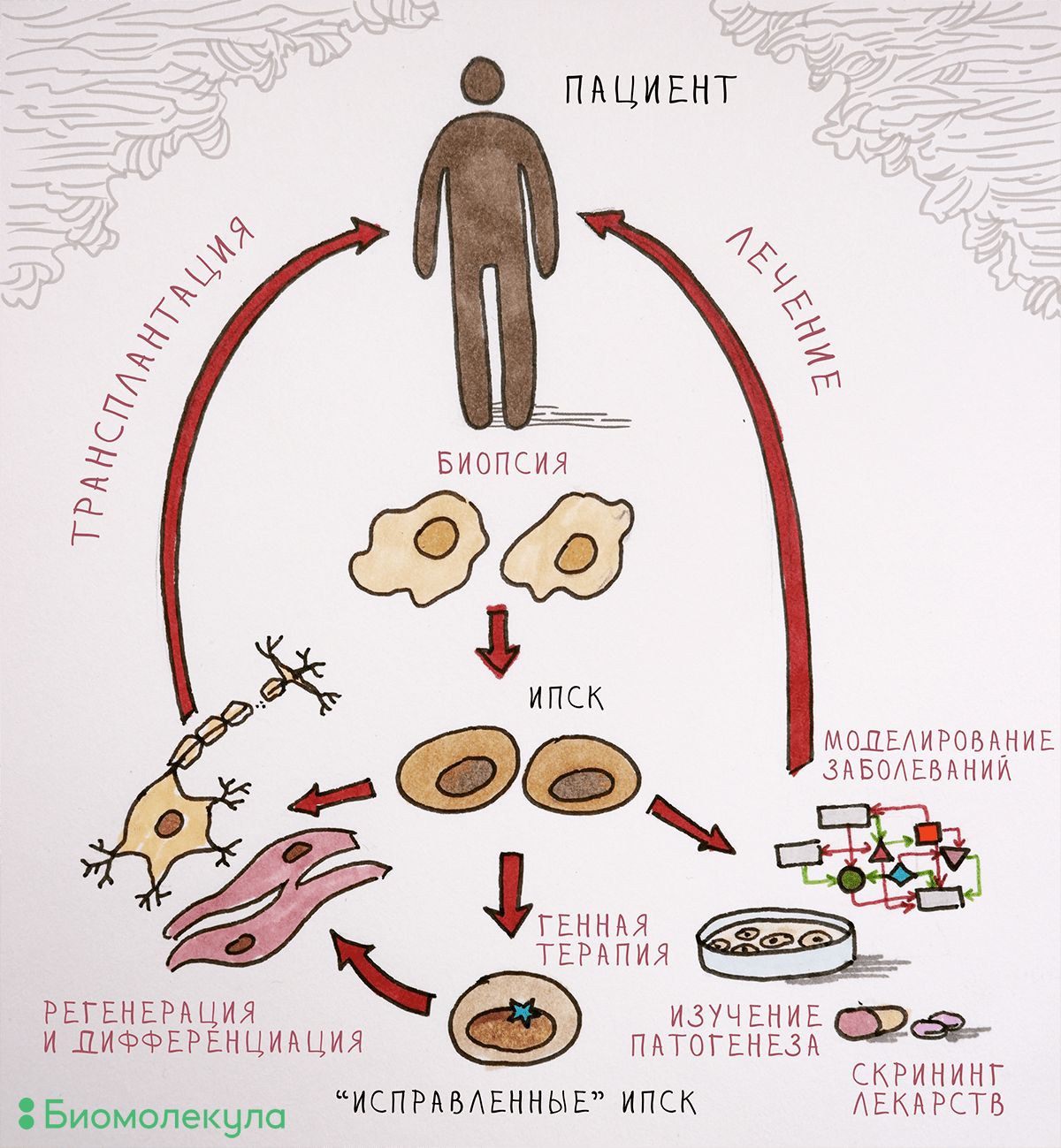
С одной стороны, проблема решается прочно укоренившейся в мире практикой клинических исследований, доказывающих эффективность и оправданность применения разрабатываемых лекарств на людях . С другой стороны, заметно помочь в разработке препаратов могут модели заболеваний на основе ИПСК, несущих связанные с развитием той или иной болезни мутации, из клеточного материала пациентов с установленным диагнозом. ИПСК представляют собой практически бесконечный источник клеточного материала и могут превращаться в любой тип клеток взрослого организма, в том числе в предшественников нейронов, зрелые нейроны и кардиомиоциты. Разработка таких моделей наследственных заболеваний позволит изучать функции продуктов мутантных генов в клетке и механизмы развития патологии. Дифференцированные производные ИПСК можно использовать для скрининга новых лекарственных препаратов (рис. 2).
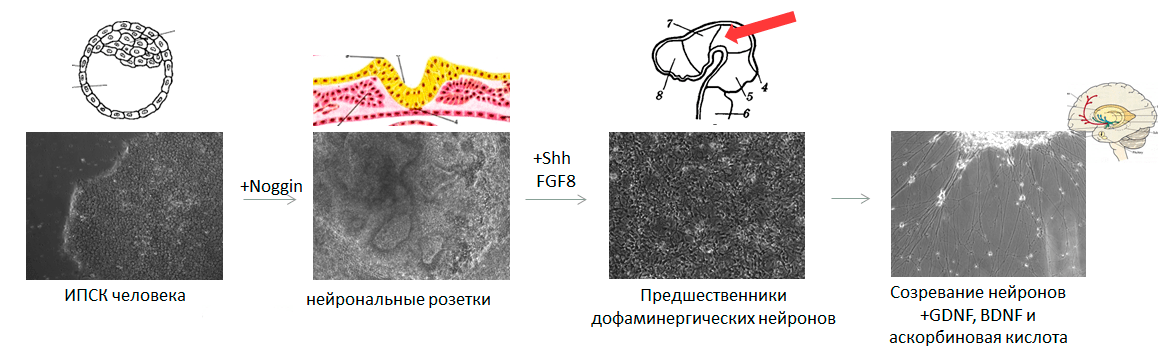
Для создания модели заболевания на основе ИПСК необходимо превратить их в тот тип клеток, который повреждается при изучаемой патологии. Наиболее востребованы модели нейродегенеративных и кардиологических заболеваний, ведь в этих случаях поврежденные ткани напрямую не доступны исследователям. Для запуска дифференцировки в нужную сторону необходимо воспроизвести в чашке Петри те же условия, с которыми клетка сталкивается в организме. Рассмотрим, как можно получить клетки нервной системы — нейроны, производящие дофамин (а именно они погибают при болезни Паркинсона [14], [15]).
Тут мы должны слегка углубиться в эмбриологию, ведь нужно будет имитировать все изменения в окружении клетки, происходящие от стадии бластоцисты до формирования головного мозга. Придется учитывать и механические воздействия на клетку, и своевременное появление определенных белков — факторов дифференцировки, — и их концентрацию, и состав солей в окружающей клетку среде, и особенности поверхности, к которой клетка прикреплена.
Перед запуском ИПСК в дифференцировку важно убедиться, что клетки растут в оптимальной плотности: они должны занимать почти всю площадь чашки Петри. Это необходимо, чтобы на старте превращения клетки давили друг на друга ровно так, как это происходит на первом этапе формирования нервной системы эмбриона — при развитии нервной трубки. Клетки, которые находятся на дне нервной бороздки, испытывают давление из-за активного размножения соседних клеток и изгибания самой бороздки в трубку, а клетки, расположенные сверху, наоборот, испытывают растяжение и превращаются в нервный гребень. Из нервного гребня впоследствии развивается множество типов клеток, в том числе и волосяные луковицы, а из клеток, находящихся на дне нервной бороздки, образуется центральная нервная система (рис. 3).

Рисунок 3. Последовательные стадии развития нервной системы (ранние этапы). Первоначально будущие клетки нервной системы изменяют форму и характерным образом располагаются друг относительно друга — получается нервная пластинка. Затем она изгибается, превращаясь в нервную бороздку, где на клетки действуют механические силы. Наконец, нервная бороздка замыкается в нервную трубку. Красные стрелки показывают механические силы, действующие на клетки. Нейрональные розетки — аналог нервной трубки в чашке Петри. Увеличение 100× (фото автора статьи).
Поскольку при нейродегенеративных заболеваниях, в том числе и при болезни Паркинсона, гибнут именно зрелые нейроны у взрослых людей, а не их размножающиеся предшественники, для моделирования болезни правильно брать как раз зрелые нейроны, чтобы с большей достоверностью повторить развитие патологических процессов. С другой стороны, можно изучать особенности дифференцировки нейронов и выяснять, что и как на эту дифференцировку влияет. Аналогичные подходы можно применить при получении кардиомиоцитов — клеток сердца, изучать которые прямо в организме тоже непросто.
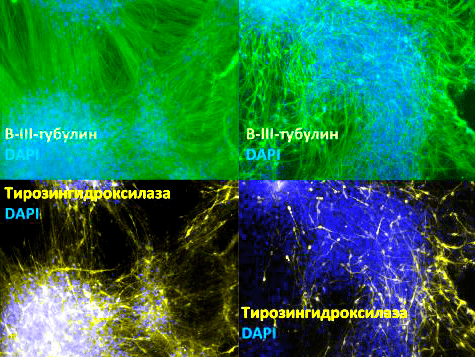
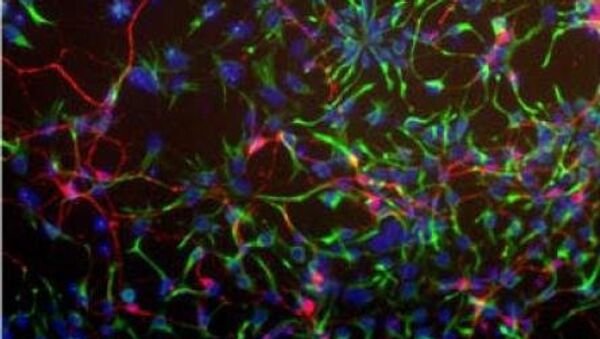
Рисунок 5. Зрелые нейроны, полученные путем дифференцировки из клеток-предшественниц. Различные структуры нейронов флуоресцентно окрашены: бета-III-тубулин (присутствует во всех типах нейронов; окрашен зелёным), тирозингидроксилаза (фермент, участвующий в синтезе дофамина; характерен для нейронов, выделяющих дофамин; окрашен желто-зеленым), ядра клеток (окрашены синим). Увеличение 100×.
фотография из диссертации автора статьи [18]
Получение ИПСК от пациента и их последующая направленная дифференцировка в кардиомиоциты открывают новые возможности для изучения патогенеза наследственных сердечно-сосудистых заболеваний, в частности гипертрофической кардиомиопатии, от которой до сих пор не разработано эффективного лечения. При этом заболевании утолщаются стенки левого желудочка и межжелудочковой перегородки, развиваются сердечная недостаточность и аритмия, возрастает риск внезапной сердечной смерти. Гипертрофическая кардиомиопатия — одна из самых распространенных сердечно-сосудистых патологий: 1 случай на 500 человек. Елена Дементьева с коллегами создала модель этого заболевания на основе пациентспецифичных ИПСК [19]. Исследовав геном пациента с гипертрофической кардиомиопатией, коллектив обнаружил мутацию R326Q в гене MYBPC3, кодирующем миозин-связывающий белок С. Этот белок расположен в саркомере и играет важную роль в сокращении кардиомиоцита. ИПСК пациента и здорового донора (в качестве контроля) превратили в клетки сердца, которые воспроизводили такие признаки гипертрофической кардиомиопатии, как нарушение динамики потоков ионов кальция и их повышенное внутриклеточное содержание.
Таким образом, описанная клеточная модель для изучения гипертрофической кардиомиопатии представляет собой кардиомиоциты, полученные в результате направленной дифференцировки ИПСК пациента с этой болезнью.
3D-дифференцировка: миниорганы в пробирке
Исследования последних лет, связанные с созданием 3D-органоидов (Еремеев А.В. с соавторами [20]) из ЭСК или ИПСК, существенно облегчили исследования в области моделирования органогенеза человека in vitro и стали мощным инструментом для исследования механизмов развития патологий сложных органов, равно как и разработки новых подходов к их терапии. В последние годы были созданы многоклеточные органоиды мозга человека [21], толстой кишки [22], почек, сетчатки, печени. Разумеется, пока 3D-модели многоклеточных органов на основе 2D-культур имеют свои ограничения и лишь условно имитируют их сложную архитектонику [23], [24].
Применение плюрипотентных стволовых клеток в медицине
Для решения проблем, выявленных в предыдущей серии трансплантаций, запустили TRANSEURO — клиническое исследование в Европе, в ходе которого в 2014–2016 годах 11 пациентам трансплантировали предшественников нейронов, вырабатывающих дофамин. Однако из-за источника клеток — эмбрионов человека — возникли как этические, так и чисто технические трудности, связанные с получением фетального материала и невозможностью его стандартизации для клинического применения. Из-за сбоев в поставке ткани для трансплантации из 90 запланированных операций по подсадке таких клеток осуществили только 20, и на данный момент проект остановлен. Для того чтобы обойти эти сложности, активно разрабатывают эффективные методы дифференцировки ЭСК и ИПСК для дальнейшего их применения в клинической практике.
В качестве альтернативы Киотский университет запустил проект Stock, нацеленный на создание банка разных линий ИПСК, типированных по иммунологическим параметрам совместимости (как это делается при пересадке органов). Было подсчитано, что 50 линий ИПСК, специально отобранных по этому принципу, позволят охватить 73% населения Японии. Но не стόит забывать, что развитию иммунного ответа могут способствовать и клетки врожденной иммунной системы, такие как макрофаги и естественные киллеры.
Клеточная терапия с использованием стволовых клеток различного происхождения набирает обороты в мировой практике. Такой подход клеточной терапии, как пересадка костного мозга, уже давно прижился в клинической практике. Терапия МСК не всегда дает хорошие результаты. Однако в случае реэпителизации поврежденных кожных покровов (например, при синдроме диабетической стопы) эффективность применения МСК уже показана в клинических исследованиях [28].
В клинику готовы войти и производные плюрипотентных стволовых клеток (ЭСК и ИПСК). Полученные из ЭСК олигодендроциты [29] и клетки поджелудочной железы [30], производящие инсулин, находятся на финальных этапах клинических испытаний. В случае олигодендроцитов был заявлен 15-летний срок наблюдения за пациентами после подсадки клеток в спинной мозг. Этот срок еще не истек, но негативных последствий для пациентов до сих пор не обнаружено. Начались клинические исследования клеточных продуктов для терапии таких сложных и тяжелых заболеваний, как дистрофия сетчатки и болезнь Паркинсона [31]. Многие исследования направлены на то, чтобы уменьшить или полностью исключить иммуносупрессию при пересадке дифференцированных производных ЭСК и ИПСК. Благодаря стволовым клеткам перед нами открывается огромное поле возможностей, но впереди еще большее поле научной работы.
Читайте также:





