Холинергическая передача в цнс
Медиатор ацетилхолин - сложный эфир четвертичного аминоспирта холина и уксусной кислоты. Синтезируется в цитоплазме окончаний холинергических нервов при участии холинацетилазы и депонируется в везикулах. Изменение потенциала мембраны нервного окончания, вызываемого импульсом, приводит к поступлению в цитоплазму ионов кальция, которые, активируя кальмодулин, вызывают высвобождение медиатора из везикулы и выброс его в синаптическую щель. Ацетилхолин связывается с холинорецепторами постсинаптической мембраны и гидролизуется (разрушается) внутрисинаптической ацетилхолинэстеразой (истинной холинэстеразой). В плазме крови имеется другая холинэстераза, называемая ложной или псевдохолинэстеразой (бутирилхолинэстераза). Последняя образуется в печени и, поступая в кровь, легко разрушает соединения, представляющие собой низкомолекулярные сложные эфиры, в том числе ацетилхолин и некоторые лекарства, например, новокаин, дикаин, дитилин, атропин и др.
Взаимодействие ацетилхолина с холинорецепторами изменяет проницаемость постсинаптических мембран для ионов. Ионы натрия входят, а калия выходят из клетки, мембранный потенциал снижается (деполяризация), клетка возбуждается; в нейроне возбуждение в виде потенциала действия распространяется по аксону. Почти одновременно ацетилхолин разрушается, и рецепторы освобождаются, полярность мембраны восстанавливается (реполяризация), нормализуется содержание натрия и калия - за счет работы натрий-калиевого насоса избыток натрия выходит из клетки в обмен на калий.
Холинорецепторы неоднородны, они проявляют неодинаковую чувствительность к различным веществам. Выделяют холинорецепторы, реагирующие на мускарин (яд гриба мухомора) - их называют М-холинорецепторы (мускариночувствительные), и Н- холинорецепторы (никотиночувствительные), они возбуждаются малыми дозами никотина.
М-холинорецепторы локализованы в мембранах:
1) клеток, иннервируемых постганглионарными парасимпатическими волокнами (проводящая система сердца, глаз, железы внешней секреции, гладкомышечные клетки, в том числе бронхов и желудочно-кишечного тракта);
2) клеток потовых желез, иннервируемых постганглионарными симпатическими волокнами холинергического типа;
3) нейронов некоторых отделов центральной нервной системы (кора головного мозга, ретикулярная формация и др.).
1) в нейронах симпатических и парасимпатических ганглиев;
2) в синокаротидных клубочках (расположены в месте деления сонных артерий);
3) в хромаффинных клетках мозгового слоя надпочечников;
4) в клетках скелетных мышц;
5) в нейронах некоторых отделов ЦНС. Лекарственные вещества, действующие подобно ацетилхолину, называют холиномиметиками (от греческого mimeticos -подражающий) и подразделяют на:
1) М- и Н-холиномиметики (возбуждающие и М-, и Н-холинорецепторы);
2) М-холиномиметики (возбуждающие М-холинорецепторы);
3) Н-холиномиметики (возбуждающие Н-холинорецепторы); Лекарственные средства, блокирующие холинорецепторы - холиноблокаторы, или холинолитики (от греч. lyticos -разрушающий) включают:
1) М- и Н-холинолитики - блокирующие М- и Н-холинорецепторы;
2) М-холинолитики - блокирующие М-холинорецепторы;
3) Н-холинолитики - блокирующие Н-холинорецепторы.
Большинство холинергических средств имеет общие с ацетилхолином особенности химической структуры - именно поэтому связываются с холинорецептором. Они являются основаниями, эфирами и содержат третичные или четвертичные атомы азота. Соединения третичного азота не диссоциируют, хорошо растворимы в жирах. легко всасываются в желудочно-кишечном тракте, проникают через гематоэнцефалический барьер и поэтому могут оказывать действие на центральную нервную систему. Четвертичные азотсодержащие соединения имеют четырехвалентный азот, у которого три валентности прочно связаны, а четвертая может образовывать ионную связь с анионами, например, кислот. Эти соединения плохо растворимы в жирах, практически не всасываются в пищеварительном тракте, гематоэнцефалический барьер не проходят, а значит не влияют на головной и спинной мозг. Для них характерны, в основном, периферические эффекты.
Холинергическая система мозга участвует в таких функциях, как:
Ø память (кора головного мозга, гиппокамп),
Ø регуляция сложных двигательных реакций, в частности механизма инициации движений, двигательных стереотипов и т.д. (базальные ганглии),
Ø регуляция уровня бодрствования и внимания (ретикулярная формация ствола мозга, холинергические структуры переднего мозга).
Поражение холинергической передачи в периферической нервной системе, в частности нервно-мышечных синапсах, связано с симптомами усталости или слабости мышц. Полагают, что в основе этого заболевания лежит аутоиммунный процесс: организм вырабатывает аутоантитела, которые блокируют функцию холинорецепторов.
Полагают, что ацетилхолин оказывает только фоновый возбуждающий эффект на кортикальные функции. Он не может, как показали эксперименты, напрямую стимулировать разряды пирамидных клеток, а только повышает их чувствительность к другим возбудительным входам посредством активации мускариновых рецепторов.
Холинергические ретикулярные ядра ствола имеют проекции и к дофаминергическим нейронам вентральной тегментальной области, активирующие Н-холинорецепторы, в результате чего увеличивается дофаминергическая передача. Возбуждение Н-холинорецепторов, приводящее к повышению активности этих нейронов, лежит в основе привыкания и психической зависимости к никотину при курении.
Регуляция когнитивных процессов. В ЦНС ацетилхолин вовлекается в процессы, связанные с обучением и памятью. Поражение холинергических структур септогиппокампальной области, как и инъекции в эти структуры холинергических антагонистов, приводят к дисфункции запоминания и пространственной памяти. Инъекции же холинергических агонистов в эти регионы оказывают положительное влияние на обучение и память.
Регуляцию когнитивных процессов связывают с активацией как мускариновых, так и никотиновых холинорецепторов. Введение антагонистов М-холинорецепторов увеличивало количество проб при выработке инструментального условного рефлекса у крысы.
Но наиболее существенные доказательства роли ацетилхолина в когнитивных процессах дают исследования болезни Альцгеймера, характеризующейся поражением холинергических нейронов базальных ядер. Повышение холинергических функций при введении антихолинэстеразных веществ или агонистов М-холинорецепторов в эти структуры помогает сохранить мнестические функции на ранней стадии этой болезни.
Центральные М-холинолитики амизил и метамизил эффективно защищают слизистую желудка, сердечную мышцу от рефлекторной дистрофии. Известно, что гипофизарно-адреналовая система весьма чувствительно реагирует на нанесение животному чрезвычайного раздражения, при котором происходит максимальное ее возбуждение с выбросом в кровь большого количества кортикостероидов. Это приводит к нарушению трофики желудка, сердца, т.е. к нейрогенным дистрофиям. Блокируя М-холинергические синапсы активирующей ретикулярной формации ствола мозга, метамизил снимает возбуждающие эффекты на гипофизарно-адреналовую систему. Таким образом, уменьшением активирующего влияния ретикулярной формации на вышележащие центры, в частности на центры гипоталамической области, объясняется защитное действие центральных М-холинолитиков на развитие нейрогенных дистрофий.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Содержание
В холинергической передаче важнейшую роль играют два фермента, отвечающие соответственно за синтез и расщепление ацетилхолина — холинацетилтрансфераза и ацетилхолинэстераза (АХЭ).
Этот фермент катализирует последнюю реакцию синтеза ацетилхолина — соединение холина с ацетил-КоА (Wu and Hersh, 1994; Parsons et al., 1993). Первичная структура холинацетилтрансферазы была установлена с помощью молекулярного клонирования. Ее иммуногистохимическое определение — ценный метод, позволяющий выявлять тела и отростки холинергических нейронов.
Ацетил-КоА, используемый для синтеза ацетилхолина, образуется либо из пирувата путем его окислительного декарбоксилирования (многостадийной реакции, катализируемой пируватдегидрогеназным комплексом), либо из ацетата. В последнем случае под действием фермента ацетил-КоА-синтетазы ацетат соединяется с АТФ с образованием связанного с ферментом ациладенилата (ацетил-АМФ), и далее в присутствии КоА происходит трансацетилирование и синтез ацетил-КоА.
Как и другие нейрональные белки, холинацетилтрансфераза синтезируется в теле нейрона. Затем она переносится по аксону в окончания. В последних имеется множество митохондрий, в которых образуется ацетил-КоА. Холин захватывается из внеклеточной жидкости путем активного транспорта. Ацетилхолин синтезируется в цитоплазме и затем депонируется в синаптических пузырьках. Существуют ингибиторы холинацетилтрансферазы, в том числе с умеренной активностью. Однако их фармакологический эффект невелик, частично из-за того, что лимитирующей реакцией в синтезе ацетилхолина служит захват холина.
Захват холина из внеклеточной жидкости осуществляется с помощью двух разных систем — высоко- и низкоаффинной. Высокоаффинная система (константа Михаэлиса 1—5 мкмоль/л) имеется только в холинергических нейронах; ее активность зависит от концентрации Na+ во внеклеточной среде, и она блокируется гемихолинием. Концентрация холина в плазме составляет около 10 мкмоль/л, и поэтому она не ограничивает транспорт холина в нейрон. Большая часть холина, образующегося при гидролизе ацетилхолина под действием АХЭ, захватывается обратно в пресинаптическое окончание. Недавно методом молекулярного клонирования была установлена структура высокоаффинного переносчика холина, выделенного из пресинаптических окончаний. Оказалось, что он отличается от переносчиков других медиаторов, но сходен с Na+-3aвисимым переносчиком глюкозы (Okuda et al., 2000).
Синтезируемый ацетилхолин переносится в синаптические пузырьки. Этот перенос осуществляется системой, в которой используется энергия электрохимического градиента для протонов. Везамикол в микромолярных концентрациях блокирует перенос в пузырьки ацетилхолина. Гены холинацетилтрансферазы и переносчика ацетилхолина располагаются в одном и том же локусе (ген переносчика локализован в 1-м интроне гена холинацетилтрансферазы). Поэтому экспрессия обоих этих генов регулируется одним и тем же промотором (Eiden, 1998). АХЭ. Непременным условием эффективной холинергической передачи в нервно-мышечных и некоторых межнейронных синапсах является быстрая инактивация ацетилхолина. Так, в нервно-мышечном синапсе его удаление должно быть буквально, по словам Дейла, молниеносным — иначе ацетилхолин будет диффундировать и активировать рецепторы соседних мышечных волокон.
С помощью современных биохимических методов удалось установить, что гидролиз ацетилхолина АХЭ в нервно-мышечном синапсе занимает меньше 1 мс. Действие же холина на N-холинорецепторы в этом синапсе в 10_3— 10
5 раз слабее, чем действие ацетилхолина.
АХЭ обнаруживается не только в холинергических синапсах, но и в других структурах холинергических нейронов (дендритах, теле, аксонах). Ее концентрация особенно высока в области постсинаптической мембраны нервно-мышечных синапсов.
В глиальных клетках ЦНС и мантийных глиоцитах в низкой концентрации содержится псевдохолинэстераза (бутирилхолинэстераза, холинэстераза); в центральных и периферических нейронах она почти отсутствует. Псевдохолинэстераза обнаруживается главным образом в печени (где она в основном и образуется) и в плазме. Возможно, она выполняет рудиментарную физиологическую функцию — гидролиз эфиров холина, содержащихся в растительной пище. АХЭ и псевдохолинэстераза различаются по скорости гидролиза ацетилхолина и бутирилхолина и по реакции на избирательные ингибиторы. Почти все фармакологические эффекты ингибиторов АХЭ обусловлены подавлением активности именно этого фермента и, как следствие, накоплением эндогенного ацетилхолина в холинергических синапсах и окружающих тканях. У млекопитающих АХЭ и псевдохолинэстераза кодируются разными генами. Разнообразие строения АХЭ обусловлено альтернативным сплайсингом РНК (Taylor et al., 2000).
Выше мы уже упоминали о том, что между различными холинергическими синапсами существуют значительные отличия, касающиеся строения этих синапсов, распределения АХЭ и холинорецепторов, временных параметров синаптической передачи и т. п. Так, в скелетной мышце нервно-мышечный синапс занимает лишь небольшой участок на мышечном волокне, и эти синапсы расположены довольно далеко друг от друга — на соседних волокнах. Напротив, в верхнем шейном ганглии на несколько кубических миллиметров ткани приходится около 100 000 нейронов, и пресинаптические окончания образуют здесь сложную и густую сеть с постсинаптическими дендритами.
Скелетные мышцы. Раздражение двигательного нерва вызывает выделение ацетилхолина в перфузат, оттекающий от соответствующей мышцы; с другой стороны, введение ацетилхолина непосредственно в снабжающие мышцу артерии приводит к ее сокращению. Минимальное количество ацетилхолина (10
17 моль), способное вызвать типичный потенциал концевой пластинки при микроионофоретической аппликации на область концевой пластинки диафрагмы крысы, равно тому количеству этого медиатора, которое выделяется из одного пресинаптического окончания при раздражении диафрагмального нерва (Kmjevic and Mitchell, 1961).
Соединение ацетилхолина с N-холинорецептором постсинаптической мембраны приводит к немедленному и выраженному повышению проницаемости этой мембраны для катионов. Это обусловлено тем, что активация N-холинорецептора сопровождается открыванием связанного с этим рецептором канала. Время пребывания канала в открытом состоянии составляет около 1 мс, и при этом через канал проходит примерно 50 000 ионов Na+ (Katz and Miledi, 1972). В результате открывания множества таких каналов развивается местный деполяризующий потенциал — потенциал концевой пластинки, который, в свою очередь, запускает потенциал действия. Последний вызывает сокращение мышцы. Подробнее все эти процессы и влияние на них средств, блокирующих нервно-мышечные синапсы, описаны в гл. 9.
После перерезки и дегенерации двигательного соматического нерва либо постганглионарных вегетативных волокон реакции денервированных органов возникают в ответ на значительно меньшие дозы медиатора (и некоторых фармакологических средств). Это явление было названо повышением чувствительности денервированных структур. В скелетной мышце при этом N-холинорецепторы появляются за пределами концевой пластинки — сначала рядом с ней, а затем на всей сарколемме. Эмбриональные мышечные волокна до прорастания в них нервных волокон также чувствительны к ацетилхолину на всей своей поверхности. Таким образом, иннервация мышцы приводит к подавлению экспрессии гена N-холинорецептора в ядрах, лежащих в отдалении от синапсов, и, напротив, к повышению экспрессии этого гена (и генов, кодирующих другие синаптические белки) в субсинаптических ядрах (Sanes and Lichtman, 1999).
Внутренние органы. Передача стимулирующих или тормозных сигналов от вегетативных нервов к внутренним органам обусловлена активацией М-холинорецепторов (см. ниже). Эти рецепторы, в отличие от N-холинорецепторов, связаны не с ионными каналами, а с G-белками. В отличие от скелетных мышц и нейронов, у гладких мышц и структур проводящей системы сердца (синусового узла, предсердных пучков, АВ-узла, пучка Гиса с его ножками и волокон Пуркинье) имеется собственная — автоматическая — электрическая и механическая активность. Эта активность не запускается, а лишь модулируется нервными воздействиями. В отсутствие последних в гладкомышечных клетках возникают волны деполяризации и — иногда — потенциалы действия; и те, и другие передаются от клетки к клетке, но значительно медленнее, чем распространяются импульсы по аксонам или волокнам скелетных мышц. Потенциалы действия в гладких и сердечной мышцах возникают в результате ритмичных колебаний мембранного потенциала — спонтанной деполяризации. В гладких мышцах ЖКТ область зарождения возбуждения (ведущий водитель ритма, или пейсмекер) постоянно смещается. В сердце же этой областью в норме всегда является синусовый узел; если же его активность подавляется, то функцию ведущего водителя ритма берут на себя другие структуры проводящей системы.
Аппликация ацетилхолина (в концентрации 0,1—1 мкмоль/л) на изолированные гладкие мышцы кишечника вызывает снижение мембранного потенциала (то есть он становится менее отрицательным) и повышение частоты потенциалов действия; тонус мышц при этом возрастает. Очевидно, это действие ацетилхолина, опосредованное активацией М-холинорецепторов, обусловлено повышением натриевой и, иногда, кальциевой проницаемости. Кроме того, в кальцийсодержащем растворе ацетидхолин может вызвать сокращения некоторых гладких мышц, полностью деполяризованных в результате повышения внеклеточной концентрации К+. Таким образом, ацетилхолин повышает трансмембранные ионные потоки и вызывает выход в цитоплазму кальция из внутриклеточных депо.
В структурах проводящей системы сердца (в частности, в синусовом узле) раздражение холинергических нервов или прямая аппликация ацетилхолина вызывает снижение частоты потенциалов действия, обусловленное гиперполяризацией и замедлением скорости спонтанной деполяризации. Эти эффекты частично обусловлены избирательным повышением калиевой проницаемости (Hille, 1992).
Вегетативные ганглии. Механизмы холинергической передачи в вегетативных ганглиях в основном такие же, как в скелетных мышцах. Потенциалы действия в постганглионарных волокнах можно вызвать введением в ганглий очень небольших количеств ацетилхолина. ВПСП в постганглионарных нейронах возникает в результате активации N-холинорецепторов, непосредственно связанных с ионными каналами (как и в скелетных мышцах). Некоторые другие медиаторы, или так называемые нейромодумторы, снижают либо повышают чувствительность постганглионарных нейронов к ацетилхолину — видимо, меняя мембранный потенциал тел или дендритов этих нейронов. Подробнее передача возбуждения в вегетативных ганглиях рассматривается в гл. 9.
Большое количество работ было посвящено возможной роли пресинаптических холинорецепторов в холинергической и нехолинергической передаче и действии ряда лекарственных средств. На симпатических сосудосуживающих нервах, видимо, присутствуют пресинаптические М-холинорецепторы (Steinsland et al., 1973). Их активация сопровождается снижением выброса норадреналина в ответ на нервные импульсы. Физиологическая роль этих рецепторов не ясна, ведь холинергическая иннервация сосудов выражена слабо, а поскольку ацетилхолин быстро гидролизуется тканевыми и плазменными эстеразами, маловероятно, чтобы он, подобно адреналину, играл роль гормона.
Введение эфиров холина приводит к расширению сосудов. Точек приложения у этих веществ несколько; к ним относятся холинорецепторы тормозных синапсов на пресинаптических симпатических окончаниях и холинорецепторы на сосудах, расположенные вне синапсов. Сосудорасширяющее действие ацетилхолина возможно только при неповрежденном эндотелии. Активация М-холинорецепторов эндотелия приводит к выделению из него N0 (эндотелиального фактора расслабления сосудов). Диффундируя от эндотелия к гладким мышцам, N0 вызывает их расслабление, а следовательно, расширение сосудов (Furchgott, 1999).
Сэр Генри Дейл впервые показал, что различные эфиры холина могут оказывать эффекты, сходные с таковыми либо никотина, либо мускарина (Dale, 1914). Было также обнаружено, что последствия раздражения парасимпатических нервов воспроизводятся мускарином. Это позволило Дейлу предположить, что медиатором вегетативной нервной системы служит ацетилхолин либо какой-либо другой эфир холина. Кроме того, отметив двоякое действие ацетилхолина, он ввел термины никотиноподобный и мускариноподобный для обозначения соответствующих эффектов.
Дальнейшие доказательства наличия двух типов холинорецепторов были получены в опытах с применением тубокурарина и атропина. Оказалось, что эти вещества блокируют соответственно никотиноподобный и мускариноподобный эффекты ацетилхолина. Дейл имел дело лишь с неочищенными алкалоидами Amanita muscaria и Nicotiana tabacum, структуры которых в то время были не известны, однако его классификация холинорецепторов действительна и по сей день — хотя и дополнилась представлениями о нескольких подтипах N- и М-холинорецепторов.
Ацетилхолин и некоторые другие вещества активируют оба типа холинорецепторов; другие же стимуляторы и блокаторы действуют избирательно на один из них. Молекула ацетилхолина способна легко деформироваться; по непрямым данным, при связывании с N- и М-холинорецепторами ее конформация различна.
N-холинорецепторы непосредственно связаны с ионными каналами. Активация этих рецепторов всегда вызывает кратковременное (около 1 мс) открывание соответствующих каналов, повышение натриевой и кальциевой проницаемости и деполяризацию — ВПСП или потенциал концевой пластинки. Что же касается М-холинорецепторов, то они принадлежат к суперсемейству рецепторов, сопряженных с G-белками. Реакции на активацию М-холинорецепторов гораздо медленнее, они могут быть как стимуляторными, так и тормозными и не обязательно связаны с изменениями ионных проницаемостей.
Первичная структура различных подтипов N-холинорецепторов (Numa et al., 1983; Changeux and Edelstein, 1998) и М-холинорецепторов (Bonner, 1989; Caulfield and Birdsall, 1998) была установлена на основании данных о строении соответствующих генов. Оказалось, что эти два типа холинорецепторов принадлежат к белкам разных семейств — что не удивительно, учитывая различия в их фармакологических свойствах и функции.
N-холинорецепторы — это пентамеры, состоящие из гомологичных субъединиц. Существуют несколько типов таких субъединиц. В состав каждого пентамерного N-холинорецептора могут входить субъединицы разных типов — но не более 4 типов, так как а-субъединиц обязательно должно быть две. Участки связывания ацетилхолина образуются в местах стыков а-субъединиц с соседними субъединицами. Стенки ионного канала образованы трансмембранными а-спиральными структурами субъединиц (Changeux and Edelstein, 1998; см. также гл. 9 и 12). Структура и свойства М-холинорецепторов описаны в гл. 2 и 7.
Уже давно было известно, что многие стимуляторы и блокаторы действуют только на N-холинорецепторы либо скелетных мышц, либо вегетативных ганглиев — а значит, эти рецепторы различаются. Эти различия были подтверждены и с помощью молекулярного клонирования. Оказалось, например, что N-холинорецепторы скелетных мышц включают субъединицы 4 типов. Структура этих рецепторов соответствует формуле а2р8у или а2рбе: у рецепторов эмбриональных или денервированных мышц имеется субъединица у, у нормальных мышц взрослого — е. Замена субъединицы у на субъединицу I сопровождается некоторым изменением избирательности рецептора к лиганду, но важнее, видимо, то, что такая замена может влиять на скорость обновления рецепторов или их локализацию в клетке. Нейрональные N-холинорецепторы также представляют собой пентамеры. Субъединицы нейрональных N-холинорецепторов очень разнообразны. Они подразделяются на типы а и β; в свою очередь, тип а в нервной системе млекопитающих включает 8 подтипов (а2—а9), а тип β — 3 подтипа (β2—β4)- Не все сочетания этих субъединиц образуют функционирующие рецепторы, но тем не менее число вариантов таких рецепторов слишком велико для того, чтобы различать их на основании сродства к лигандам. В частности, функционирующими рецепторами служат гомоолигомерные пентамеры субъединиц а7, а8 и а9. Особенности N-холинорецепторов скелетных мышц, периферических вегетативных и центральных нейронов приведены в табл. 6.2. Подробнее структура, функция, распределение и подтипы N-холинорецепторов рассматриваются в гл. 9.
С помощью молекулярного клонирования были выделены 5 подтипов М-холинорецепторов. Как и подтипы N-холинорецепторов, они различаются по локализации и фармакологическим свойствам. Все М-холинорецепторы сопряжены с G-белками (см. ниже и табл. 6.2).
В течение нескольких десятилетий исследовались многие М-холиноблокаторы, но только полученный в 1970-х гг. пирензепин обладал способностью подавлять желудочную секрецию соляной кислоты в концентрациях, не оказывающих иных эффектов. Эти данные, исследование эффектов других стимуляторов и блокаторов, а затем клонирование кДНК М-холинорецепторов привели к разделению этих рецепторов на 5 подтипов, обозначаемых M1—М5 (Bonner, 1989).
Холинорецепторы подтипа М, обнаруживаются в вегетативных ганглиях и некоторых железах, М2 — в миокарде и, возможно, в гладких мышцах, М3 и М4 — в гладких мышцах и железах. В ЦНС имеются рецепторы всех 5 подтипов. Во многих тканях содержатся одновременно рецепторы нескольких подтипов. То же касается и интрамуральных парасимпатических ганглиев.
Как уже говорилось, М-холинорецепторы сопряжены с G-белками, и поэтому их стимуляция приводит к изменению активности ряда внутриклеточных белков. Соединение лигандов с рецепторами подтипов М]( М3 и М5 приводит к активации белков Gq и G11. Это, в свою очередь, вызывает повышение активности фосфолипазы С, гидролизу мембранных фосфолипидов — фосфатидилинозитолполифосфатов — и образованию инозитолполифосфатов. Некоторые из последних — главным образом ИФ3 — вызывают выход Са2+ из эндоплазматического ретикулума. Таким образом, активация рецепторов этих подтипов отвечает за такие кальцийзависимые процессы, как сокращение гладких мышц и секреция (Berridge, 1993; см. также гл. 2). Второй продукт гидролиза фосфатидилинозитолполифосфатов — ДАГ — в присутствии Са + активирует протеинки-назу С. Этот механизм отвечает за модуляцию клеточных функций (в том числе запускаемых ИФ3) и за отсроченные реакции на ацетилхолин (Dempsey et al., 2000).
Рецепторы подтипов М2 и М4 сопряжены с белками Gj и G11. Их активация приводит к ингибированию аденилатциклазы, открыванию калиевых каналов (в частности, в сердце) и в некоторых клетках к снижению вероятности открывания медленных кальциевых каналов. Функциональные последствия этих эффектов наиболее изучены на сердце: именно ингибирование аденилатциклазы и открывание калиевых каналов, видимо, ответственны за отрицательные хронотропный и инотропный эффекты ацетилхолина.
Активация М-холинорецепторов может приводить и к другим событиям, в частности активации гуанилатциклазы и образованию арахидоновой кислоты. Обычно эти процессы вторичны по отношению к иным внутриклеточным реакциям.
Холинергические синапсы представляют собой место, в котором происходит контакт двух нейронов или нейрона и эффекторной клетки, получающей сигнал. Синапс состоит из двух мембран – пресинаптической и постсинаптической, а также из синаптической щели. Передача нервного импульса осуществляется посредством медиатора, то есть вещества-передатчика. Происходит это в результате взаимодействия рецептора и медиатора на постсинаптической мембране. В этом заключаются основные функции холинергического синапса.
Медиатор и рецепторы
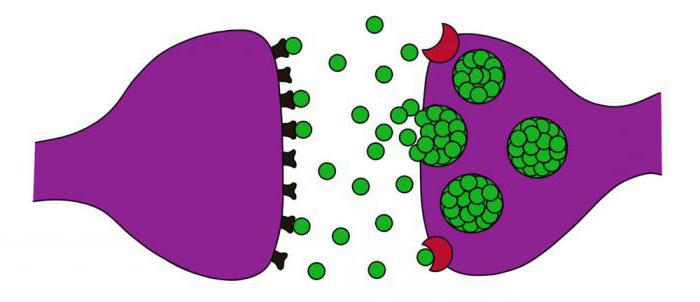
В парасимпатической НС медиатором является ацетилхолин, рецепторами – холинорецепторы двух типов: Н (никотин) и М (мускарин). М-холиномиметики, обладающие прямым типом действия, могут стимулировать рецепторы на мембране постсинаптического типа.
Синтез ацетилхолина осуществляется в цитоплазме нейронных холинергических окончаний. Он образуется из холина, а также ацетилкоэнзима-А, который имеет митохондриальное происхождение. Синтез происходит под действием цитоплазматического энзима холинацетилазы. В синаптических пузырьках происходит депонирование ацетилхолина. В каждом из таких пузырьков может находиться до нескольких тысяч ацетилхолиновых молекул. Нервный импульс провоцирует высвобождение молекул ацетилхолина в синаптическую щель. После этого он вступает во взаимодействие с холинорецепторами. Строение холинергического синапса уникально.
Строение
По данным, которые имеются у биохимиков, холинорецептор нервно-мышечного синапса может включать 5 белковых субъединиц, которые окружают ионный канал и проходят сквозь всю толщу мембраны, состоящей из липидов. Пара молекул ацетилхолина вступает во взаимодействие с парой α-субъединиц. Это приводит к тому, что открывается ионный канал и постсинаптическая мембрана деполяризуется.
Виды холинергических синапсов
Холинорецепторы по-разному локализованы и так же по-разному чувствительны к воздействию фармакологических веществ. В соответствии с этим различают:
- Маскариночувствительные холинорецепторы – так называемые М-холинорецепторы. Мускарин представляет собой алкалоид, присущий ряду ядовитых грибов, к примеру мухоморам.
- Никотиночувствительные холинорецепторы – так называемые Н-холинорецепторы. Никотин представляет собой алкалоид, содержащийся в листьях табака.
Их расположение
Первые располагаются в постсинаптической мембране клеток в составе эффекторных органов. Расположены они у окончаний постганглионарных парасимпатических волокон. Помимо этого они также есть в нейронных клетках вегетативных ганглиев и в коре головного мозга. Установлено, что М-холинорецепторы различной локализации гетерогенны, что обуславливает различную чувствительность холинергических синапсов к веществам фармакологической природы.

Виды в зависимости от расположения
Биохимики различают несколько видов М-холинорецепторов:
- Расположенные в вегетативных ганглиях и в ЦНС. Особенностью первых является то, что они локализованы вне синапсов – М1-холинорецепторы.
- Расположенные в сердце. Некоторые из них способствуют снижению высвобождения ацетилхолина – М2-холинорецепторы.
- Расположенные в гладких мышцах и в большей части эндокринных желез – М3-холинорецепторы.
- Расположенные в сердце, в стенках легочных альвеол, в ЦНС – М4-холинорецепторы.
- Расположенные в ЦНС, в радужной оболочке глаза, в слюнных железах, в мононуклеарных кровяных клетках – М5-холинорецепторы.
Воздействие на холинорецепторы
Большая часть эффектов, оказываемых известными фармакологическими веществами, влияющими на М-холинорецепторы, связана с взаимодействием этих веществ и постсинаптических М2- и М3-холинорецепторов.
Рассмотрим классификацию средств, стимулирующих холинергические синапсы, ниже.
Н-холинорецепторы располагаются в постсинаптической мембране нейронов ганглиев у окончаний каждого из преганглионарных волокон (в парасимпатических и симпатических ганглиях), в синокаротидной зоне, в мозговом слое надпочечников, в нейрогипофизе, в клетках Реншоу, в скелетных мышцах. Чувствительность различных Н-холинорецепторов неодинакова к веществам. Например, Н-холинорецепторы в структуре вегетативных ганглиев (рецепторы нейтрального типа) имеют значительные отличия от Н-холинорецепторов в скелетных мышцах (рецепторы мышечного типа). Именно такая их особенность позволяет избирательно блокировать ганглии специальными веществами. Например, курареподные вещества способны блокировать нервно-мышечную передачу.
Пресинаптические холинорецепторы и адренорецепторы участвуют в регуляции процесса высвобождения ацетилхолина в синапсах нейроэффекторной природы. Возбуждение этих рецепторов будет угнетать высвобождение ацетилхолина.
Ацетилхолин взаимодействует с Н-холинорецепторами и изменяет их конформацию, повышает уровень проницаемости постсинаптической мембраны. Ацетилхолин оказывает возбуждающий эффект на ионы натрия, которые проникают затем внутрь клетки, а это приводит к тому, что постсинаптическая мембрана деполяризуется. Изначально возникает локальный синаптический потенциал, который достигает определенной величины и начинает процесс генерации потенциала действия. После этого местное возбуждение, которое ограничено синаптической областью, начинает распространяться по всей клеточной мембране. Если происходит стимуляция М-холинорецептора, то при передаче сигнала значительную роль играют вторичные мессенджеры и G-белки.
Ацетилхолин действует в течение весьма короткого времени. Это обусловлено тем, что он стремительно гидролизуется под действием фермента ацетилхолинэстеразы. Холин, который образуется в процессе гидролиза ацетилхолина, в половине объема будет захвачен пресинаптическими окончаниями и транспортирован в цитоплазму клетки для последующего биосинтеза ацетилхолина.
Вещества, которые воздействуют на холинергические синапсы
Фармакологические и разнообразные химические вещества способны воздействовать на множество процессов, которые связаны с синаптической передачей:
- Процесс синтеза ацетилхолина.
- Процесс высвобождения медиатора. К примеру, карбахолин способен усиливать процесс выделения ацетилхолина, а ботулиновый токсин может препятствовать процессу высвобождения медиатора.
- Процесс взаимодействия между ацетилхолином и холинорецептором.
- Гидролиз ацетилхолина энзиматической природы.
- Процесс захвата холина, образованного в результате гидролиза ацетилхолина, пресинаптическими окончаниями. К примеру, гемихолиний способен угнетать нейроновый захват и транспортировку холина в цитоплазму клетки.
Классификация
Средства, стимулирующие холинергические синапсы, способны оказывать не только этот эффект, но и холиноблокирующий (угнетающий) эффект. В качестве основы для классификации подобных веществ биохимики используют направленность действия этих веществ на различные холинорецепторы. Если придерживаться такого принципа, то вещества, оказывающие влияние на холинорецепторы, можно классифицировать следующим образом:
- Вещества, которые оказывают влияние на М-холинорецепторы и Н-холинорецепторы: к холиномиметикам относятся ацетилхолин и карбахолин, а к холиноблокаторам – циклодол.
- Средства антихолинэстеразного характера. К ним относятся салицилат физостигмина, прозерин, гидробромид галантамина, армин.
- Вещества, которые влияют на холинергические синапсы. К холиномиметикам относятся гидрохлорид пилокарпина и ацеклидин, к холиноблокаторам – сульфат атропина, матацин, гидротартрат платифиллина, бромид ипратропия, гидробромид скопаламина.
Мы подробно рассмотрели средства, влияющие на холинергические синапсы.
Читайте также:


