Имидазолиновые рецепторы центральной нервной системы
Описание
Генерация имидазолиновых рецепторов представлена двумя подтипами: I1-имидазолиновые и I2-имидазолиновые рецепторы. Центральные I1-имидазолиновые рецепторы расположены в ростральном вентролатеральном отделе продолговатого мозга, отвечающем за тонический и рефлекторный контроль над симпатической нервной системой. Периферические I1- и I2-имидазолиновые рецепторы найдены на мембранах эпителиальных клеток почечных канальцев и хромаффинных клеток надпочечников, в окончаниях симпатических нервов, поджелудочной железе, жировой ткани, плаценте. Есть основания предполагать, что имидазолиновые рецепторы относятся к семейству нейроцитокиновых рецепторов. Эндогенным лигандом имидазолиновых рецепторов является декарбоксилированный аргинин — агмантин. К агонистам I1-имидазолиновых рецепторов относятся моксонидин и рилменидин.
Возбуждение I1-имидазолиновых рецепторов в вентролатеральном отделе продолговатого мозга приводит к подавлению активности симпатических преганглионарных нейронов промежуточной зоны спинного мозга, что сопровождается угнетением активности симпатической нервной системы с уменьшением высвобождения катехоламинов из окончаний симпатических нейронов, уменьшением симпатической импульсации к сосудам и сердцу. Проявляется это снижением тонуса резистивных сосудов, снижением АД и ОПСС , умеренным уменьшением ЧСС , уменьшением выделения адреналина из мозгового вещества надпочечников, улучшением электрической стабильности миокарда, уменьшением агрегации тромбоцитов. Отчасти антигипертензивное действие моксонидина и рилменидина связано также со стимуляцией α2-адренергических рецепторов на мембранах нейронов в ядрах солитарного тракта. При длительном применении уменьшаются конечный систолический и диастолический объемы левого желудочка, легочное сосудистое сопротивление, гипертрофия левого желудочка. Не нарушают физиологической реакции, проявляющейся изменением ЧСС в ответ на физическую нагрузку. В терапевтических дозах практически не влияют на сократимость миокарда, сердечный выброс, сердечные электрофизиологические индексы, почечный кровоток, характеристики клубочковой фильтрации и объем фильтрационной фракции.
Активация периферических I1-имидазолиновых рецепторов приводит в адреномедуллярных клетках надпочечников к уменьшению выделения адреналина из мозгового слоя, в почках — к уменьшению выделения ренина, снижению концентрации альдостерона и ангиотензина II, к уменьшению реабсорбции натрия и воды, в окончаниях симпатических нервов — к ингибированию высвобождения норадреналина в синаптическую щель.
Через центральные I1-имидазолиновые и через периферические I1- и I2-имидазолиновые рецепторы опосредуются также следующие эффекты: увеличение глюкозозависимого высвобождения инсулина и переноса глюкозы внутрь клеток, и, как следствие, снижение гипергликемии, улучшение энергетического обеспечения тканей за счет усиления аэробного окисления глюкозы и увеличения синтеза гликогена, уменьшение продукции лактата, повышение чувствительности к глюкозе тканей мозга, усиление липолиза, повышение чувствительности к понижению АД и гипоксии/гиперкапнии каротидных клубочков. В почках замедляется развитие гломерулосклероза, тубулярной атрофии, кортикального интерстициального фиброза и клеточной инфильтрации в коре почек. Агонисты I1-имидазолиновых рецепторов практически не влияют на бронхиальное сопротивление у больных с АГ и сопутствующей бронхиальной астмой. Агмантин осуществляет и вазодилатирующее действие, оказывая опосредованное триггерное воздействие на фермент, катализирующий образование эндотелиального релаксирующего фактора.
У пациентов молодого возраста, страдающих артериальной гипертензией, нормализуют абсолютные цифры АД , причем при стабильном гипертензионном синдроме существенно снижается суточная вариабельность АД и увеличивается степень его ночного снижения. При артериальной гипертензии I–II степени у пожилых больных обеспечивается оптимальное снижение АД в дневное и ночное время, наблюдается обратное развитие гипертрофии левого желудочка, уменьшается патогенное влияние АГ на функционирование префронтальных структур мозга, что проявляется в улучшении памяти и параметров мышления. У больных сахарным диабетом наблюдается улучшение микроциркуляции: увеличение скорости кровотока, уменьшение числа интраваскулярных агрегатов, снижение инсулинрезистентности тканей и уровня гликемии.
Моксонидин и рилменидин быстро и практически полностью абсорбируются в ЖКТ . Связываются с белками плазмы приблизительно на 8%, метаболизируются в незначительной степени с образованием метаболитов с низкой специфической активностью. Основной путь выведения – через почки в неизмененном виде. На фоне нарушения функции почек выведение замедляется и коррелирует с величиной клиренса креатинина (при почечной недостаточности требуется коррекция режима дозирования). При недостаточности функции печени удлиняется Т1/2 .
Гипотензивный эффект не ослабевает при длительном применении, а внезапная отмена не сопровождается развитием рикошетной гипертензии.
Взаимно усиливают эффект других гипотензивных препаратов (вазодилататоров, мочегонных) и депримирующих средств (алкоголь, транквилизаторы, барбитураты, нейролептики), трициклические антидепрессанты ослабляют гипотензивный эффект. Не рекомендуется одновременное применение с ингибиторами МАО .
Терапия агонистами I1-имидазолиновых рецепторов сопровождается развитием ряда побочных эффектов: сонливость или бессонница, астения, головная боль, головокружение, слабость при физических нагрузках, чувство страха, депрессия, судороги, сердцебиение, похолодание конечностей, ортостатическая гипотензия, приливы, сухость во рту, боль в эпигастрии, диарея, тошнота, запор, периферические отеки, расстройства половой функции, кожные высыпания, зуд.
Наиболее часто встречается сухость во рту, которая носит легкий и умеренный характер, дозозависима, появляется через 2–3 ч после приема препарата, уменьшается или проходит в процессе лечения. Головная боль, головокружение, нарушение сна носят, как правило, легкий характер и проходят в течение 2–3 нед терапии, не требуя коррекции дозы или отмены препарата.
Основными противопоказаниями для назначения агонистов I1-имидазолиновых рецепторов являются: гиперчувствительность, синдром слабости синусного узла, нарушение синоатриальной и AV проводимости II–III степени, брадикардия менее 50 ударов в мин, тяжелые нарушения ритма сердца, сердечная недостаточность (IV функциональный класс по NYHA), нестабильная стенокардия, выраженные нарушения функции печени и почек, нарушения периферического кровообращения (облитерирующий атеросклероз сосудов нижних конечностей с синдромом перемежающейся хромоты, болезнь Рейно), болезнь Паркинсона, депрессивные состояния, эпилепсия, глаукома, беременность, кормление грудью (на время лечения следует прекратить прием препаратов, т.к. они проникают в грудное молоко), подростковый и детский возраст (отсутствует достаточный клинический опыт).
Во время лечения исключается употребление алкоголя. Не рекомендуется (особенно в начале лечения) работа с механизмами, требующая повышенного внимания и быстрых физических и психических реакций.
В статье будет представлена характеристика агонистов имидазолиновых рецепторов.
Лекарственные средства, которые ослабляют центральные части симпатического контроля системы сердца и сосудов, занимают значимое место среди современных антигипертензивных препаратов.
Функциональная специфика и локализация рецепторов
Рецепторы имидазолиновые принято делить на две основные группы, называющиеся I1 и I2.
Классификация, их значение и функциональные особенности составляют основу множества научных исследований.
I1-рецепторы размещаются в нейронных мембранах ствола головного мозга, почках, клетках вещества мозга надпочечников, тромбоцитах и поджелудочной железе. Как раз-таки с преимущественным рецепторным возбуждением такого типа связывается влияние современных гипотензивных средств. Рецепторы I2 типа локализуются в нейронах коры больших полушарий, тромбоцитах, клетках печени и почек. Их значение как предполагаемого объекта фармакологического влияния пока исследовано в меньшей степени.
Рассмотрим механизм действия агонистов имидазолиновых рецепторов.
Механизм действия
Главная мишень для гипотензивных препаратов – это имидазолиновые центральные рецепторы I1 типа, которые располагаются на вентролатеральном ростральном участке продолговатого мозга. Активация их приводит к уменьшению тонуса двигательного центра сосудов, снижению активности симпатических нервов, из-за чего происходит ослабление выброса из адренергических нейронов норадреналина. Дополнением к этому механизму выступает уменьшение производства надпочечниками адреналина, в которых также есть имидазолиновые рецепторы I1. Результатом такого воздействия становится уменьшение тонуса резистивных сосудов, усиление электрической стабильности миокарда и брадикардия.

Помимо прочего, имидазолиновые рецепторы размещаются на мембранах митохондрий эпителия канальцев и в почках.
Стимуляция их (большинство исследователей считает, что данные рецепторы относятся к I1 типу), которая приводит к подавлению реабсорбции натрия ионов и диуретическому влиянию, тоже вовлекается в активацию гипотензивного эффекта. Способствует этому и уменьшение производства ренина, которое обусловлено отчасти снижением симпатических влияний.
При возбуждении в в клетках β-островков Лангерганса железы поджелудочной I1-рецепторов вызывает повышенную секрецию инсулина, отвечающую на углеводную нагрузку и вызывающую гипогликемическое воздействие.
Рассмотрим наиболее эффективные агонисты имидазолиновых рецепторов.
Лекарственное средство почти не воздействует на α-адренорецепторы и выборочно возбуждает I1 имидазолиновые рецепторы продолговатого мозга. Тонус иннервации симпатической в результате уменьшается, из-за чего снижается общее периферическое сосудистое сопротивление и в меньшей мере – сила и частота сокращений сердца. Объем выброса сердца практически неизменен. Снижается потребность в кислороде у миокарда. Экспериментально доказано такое действие моксонидина, как кардиопротекторное. Он плавно и эффективно снижает диастолическое и систолическое давление, уменьшает степень ангиотензина-II, норадреналина и альдостерона в крови, активность ренина. Важная черта моксонидина – это предотвращение развития и снижение существующей уже у пациента гипертрофии миокарда.
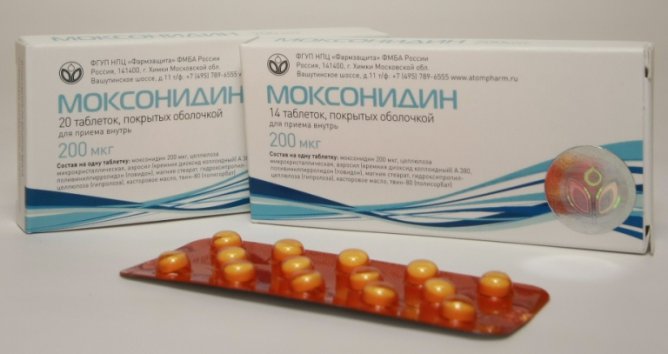
Помимо прочего, препарат обладает сопутствующим действием гипогликемическим, обусловленным возбуждением имидазолиновых панкреатических рецепторов. Заключается оно в повышении доставки глюкозы в клетки, более сильном синтезе гликогена. Также установлено гиполипидемическое влияние моксинидина.
Последний отлично всасывается в тракте желудка и кишечника (примерно 90%). Через почки выводится преимущественно в неизмененной форме (через печень в меньшей степени), однако отсутствует существенная кумуляция даже при средней и легкой степени недостаточности почек. Гипотензивный эффект этого агониста имидазолиновых рецепторов продолжается около суток. Не регистрируются привыкание к моксонидину и возникновение синдрома отмены.
Показания данного средства
Каковы показания у агониста имидазолиновых рецепторов? Если лечение плановое, начальное количество моксонидина равно 0,2 мг утром раз в сутки (внутрь после или во время приема пищи). При недостаточной эффективности через две недели дозировка увеличивается до 0,4 мг по утрам либо по 0,2 мг вечером и утром. Максимальное разовое количество – 0,4 мг, за сутки – 0,6 мг. Если нарушена выделительная почечная функция, разовая дозировка – 0,2 мг, за сутки (если делить на два приема) – максимум 0,4 мг. Лекарство особенно полно и быстро всасывается также при приеме его под язык, успешно моксонидин используется при гипертонических кризах сублингвально (однократно 0,4 мг в измельченном виде), в соединении с блокаторами каналов кальция или самостоятельно, в особенности с исрадипином.
Данные Никитиной А.Н. свидетельствуют о том, что при этом через 20 минут происходит уменьшение, а через час – исчезновение шума в голове и головной боли, гиперемии лица. Давление систолическое постепенно снижается примерно на 19-20%, на 14-15 – диастолическое, на 8-10 – ЧСС.
При терапии моксонидином нужно постоянно осуществлять контроль давления.
Побочные симптомы
Этот агонист имидазолиновых рецепторов редко вызывает головокружение, ортостатическую гипотензию. Сухость в полости рта незначительная, бывает только у 7-12 % пациентов. В редких случаях отмечается небольшое седативное влияние.
Противопоказания
Атриовентрикулярная блокада второй-третьей степени, синдром слабости синусового узла, брадикардия (ниже 50 ударов в минуту), четвертая степень недостаточности кровообращения, тяжелая недостаточность почек, нестабильная стенокардия, болезнь Рейно, возрастная категория до 16-ти лет (в настоящее время отсутствует опыт использования препарата для лечения подростков и детей), облитерирующий эндартериит, лактация, паркинсонизм, беременность, эпилепсия, глаукома и психическая депрессия.
Как данный селективный агонист центральных имидазолиновых рецепторов взаимодействует с другими средствами?
Взаимодействие с прочими веществами
Повышает влияние прочих гипотензивных препаратов и может с ними сочетаться. При одновременном приеме β-адреноблокаторов и моксонидина желательно отменять первым адреноблокатор. Реже клофелина способствует усилению действия спиртных напитков, снотворных и седативных препаратов, однако лучше избегать таких сочетаний. Отлично сочетается со средствами мочегонными. Может повысить влияние гипогликемических лекарств.
Ниже описан еще один агонист имидазолиновых I1-рецепторов.
Средство, представляющее производное оксазозина, обладает повышенной избирательностью взаимного действия с имидазолиновыми I1-рецепторами и в мозге, и на периферии. Гемодинамическое строение гипотензивного эффекта в основном связано с уменьшением периферического сосудистого сопротивления в целом. Монолечение рилменидином дает возможность эффективного контроля давления у 70% пациентов с гипертензией. Обычно гипотензивный эффект достигается быстро и плавно, поддерживается стабильно в течение суток благодаря длительности, достигающей суток.
Агонист имидазолиновых рецепторов по антигипертензивному эффекту не хуже тиазидовых диуретиков, ингибиторов ангиотензинпревращающего фермента, β-адреноблокаторов, при этом отличаясь отличной переносимостью и небольшим количеством побочных эффектов. Рекомендуется использование при недостаточной эффективности указанных выше средств. Нужно сказать о метаболической нейтральности рилменидина – благоприятное воздействие на функциональное почечное состояние, снижение микроальбуминарии, отсутствие отрицательных изменений обмена липидов и углеводов.
Полностью и быстро всасывается при употреблении внутрь, нет эффекта первого прохождения препарата через печень. Рилменидин метаболизируется слабо, преимущественно выводится с мочой, его концентрация у пациентов, пользующихся препаратом дольше года, почти стабильна.
В каких случаях показан?
Гипертензия артериальная, включая пожилых пациентов, при почечной недостаточности, сахарном диабете, креатининовом клиренсе как минимум 15 мл в минуту.
Препарат чаще назначается по одной таблетке (1 мг) раз в день перед приемом пищи. Если гипотензивный эффект недостаточен в течение месяца лечения, желательно увеличить дозировку до двух таблеток в сутки (утром и вечером). Терапия может быть длительной, до нескольких месяцев. При этом отмена должна быть постепенной.
Редко из-за рилменидина снижается настроение, нарушается сон и сердцебиение, появляются дискомфорт эпигастрия и астения. В единичных ситуациях регистрируются диарея или запоры, зуд, сыпь на коже, похолодание ног и рук. Сухость во рту практически не отмечается.
Противопоказания к использованию рилменидина
Беременность, тяжелая недостаточность почек, лактация, тяжелая депрессия. Особая осторожность должна быть при назначении препарата пациентам, которые недавно перенесли инфаркт миокарда или нарушение кровообращения мозга.
Взаимодействие с прочими веществами
Невозможно совмещение рилменидина с антидепрессантами, имеющими разный механизм влияния, - трициклические и ингибиторы МАО (в первом случае ослабляется гипотензивное действие). Нужно избегать сочетания препарата со спиртными напитками.

В заключение нужно сказать, что между разными селективными агонистами имидазолиновых рецепторов I1, несмотря на подобие фармакодинамики, есть значительные отличия. Учитывая опыт использования данных лекарственных средств, более широкое их внедрение в практику – это значительный резерв усиления безопасности и эффективности терапии артериальной гипертензии, в особенности при сопровождении ее сахарным диабетом.
Мы рассмотрели, как работают препараты-агонисты имидазолиновых рецепторов.
Первые представления о наличии рецепторных сайтов, отличных от альфа 2-адренорецепторов, появились в начале восьмидесятых годов. Bousquet et al. (1981, 1984) поставили задачу выяснить, действительно ли эффект аго-нистов адренергических рецепторов связан с активацией именно альфа 2-адренорецепторов. Авторы обнаружили, что медленная билатеральная инъекция клонидина в небольших дозах в латеральное ретикулярное ядро продолговатого мозга приводит к гипотензии и брадикардии.
В то же время, при введении нормотензивным котам в латеральное ретикулярное ядро продолговатого мозга альфа-метилнорадреналина артериальное давление не изменяется, а клонидиноподобное соединение St-587 вызывает дозозависимый гипотензивный эффект. Таким образом, результаты проведенных экспериментов свидетельствовали о том, что селективные агонисты альфа 2-адренорецепторов (а именно этими свойствами и обладает альфа-метилнорадреналин) не оказывают свое действие в области латерального ретикулярного ядра продолговатого мозга, в то время как производные имидазо-лина (к этим соединениям по химической структуре и относятся клонидин и его дериваты) вызывают гипотен-зию, влияя именно на эту структуру. На основании этих экспериментов и появилось первое предположение о возможности существования непосредственно имидазолиновых (imidazoline-preferring) рецепторов. В дальнейшем было показано (Bousquet et al., 1989 а), что не только альфа-метилнорадреналин, но и сам норадреналин не оказывают гипотензивного эффекта при введении в латеральное ретикулярное ядро.
На основании своих исследований Bousquet et al. (1989, б) утверждают, что ни эндогенные лиганды аль-фа-адренорецепторов, ни другие фенилалкиламины не вызывают гипотензию при введении в латеральное ретикулярное ядро потому, что в этом ядре локализованы не адренорецепторы, а имидазолиновые рецепторы.
Dominiak (1994) сформулировал ряд требований, которым должна соответствовать структура, чтобы ее считали рецептором. К этим требованиям относятся:
а) установление последовательности аминокислот в специфическом рецепторном белке;
б) фармакологические эффекты активации рецептора должны быть специфическими и эти эффекты должны предотвращаться блокаторами рецептора;
в) обязательным должно быть наличие эндогенных ли- гандов.
На основании анализа этих требований автор приходит к выводу о локализации имидазолиновых рецепторов в вентролатеральной части продолговатого мозга у крысы, быка и человека. Имидазолиновые рецепторы представляют собой популяцию, чувствительную к клонидину и не чувствительную к катехоламинам, и она представляет собой 20-30% [ЗН] клонидин-связывающего сайта в латеральном ретикулярном ядре быка и 100% в ядре человека.
Утверждается, что лигандом имидазольных рецепторов является не катехоламин и не пептид. Альфа 2-адренорецепторы и имидазолиновые рецепторы отличаются по анатомическому распределению, молекулярным свойствам и радиолигантному связыванию (Leh-mannetal., 1989).
Zonnenchein et al. (1990), отметили общность фармакологических свойств адрено- и имидазольного рецепторов и высказали предположение, что открытие К-каналов агонистами альфа 2-адренорецепторов является путем, который может участвовать и в функционировании агонистов имидазолиновых рецепторов.
Lanier et al. (1993) считают, что существуют, по крайней мере, три субтипа так называемых имидазолин/ гуанидиновых рецептивных сайта, которые отличаются по способности связываться с лигандом, молекулярной массе и тканевому распределению. Гетерогенность имидазолиновых рецепторов была выявлена и в мозге человека (Escriba et al., 1994).
В дальнейшем (Evans, Haynes, 1994) было выявлено 12 субтипов имидазолиновых рецепторов. Функционально имидазолиновые рецепторы разделяются на два типа. Для первого типа рецепторов (11 тип) характерно связывание с клонидином и идазоксаном (более подробное описание этого соединения представлено ниже), а •для 12 типа - связывание с идазоксаном и отсутствие связывания с клонидином (Bousquet et al., 1998).
Естественно, потому, что гипотензивный эффект клонидиноподобных групп реализуется через II тип рецепторов. Greney et al. (1994) первыми выделили и описали белок из мозга человека, идентифицируемый как белок имидазолинового рецептора, и установили, что его масса равен 43 KDa. Этот белок отличается тем, что связывается с клонидином.
До настоящего времени предпринимаются попытки идентифицировать эндогенный лиганд имидазолиновых рецепторов. Atlas, Burstein (1984, а) показали, что вещество (названное клонидин замещающей субстанцией), выделенное из мозга теленка, специфически связывается с альфа-адренергическими рецепторами мозга и тромбоцитами.
В отличие от клонидина и других агонистов альфа 2-адренорецепторов, это соединение не изменяет базаль-ный уровень аденилатциклазы в тромбоцитах, оно термостабильно и не разрушается протеолитическими ферментами. Это соединение конкурирует как с агонистами, так и с антагонистами альфа 2-адренорецепторов и не является катехоламином (Atlas, Burstein, 1984 б).
Исследование биологических свойств клонидин-замещающей субстанции показало, что это соединение при внутримозговом введении вызывает снижение артериального давления, причем гипотензия уменьшается, если животным предварительно разрушить латеральное ретикулярное ядро продолговатого мозга (Meeley et al, 1986).
Bousquet et al. (1986) высказали предположение, что клонидин замещающая субстанция является эндогенным конкурентом клонидина. По своей химической структуре это соединение не является пептидом, содержит группу NHI и имеет молекулярную массу 587,8±2 дальтона (Atlas et al., 1987). Естественно, что дальнейшие исследования были направлены на выяснение биологических свойств клонидин замещающей субстанции.
В исследованиях, проведенных на разных видах животных, Bousquet et al. (1987) установили, что клонидин замещающая субстанция препятствует связыванию меченого клонидина с мембранами клеток.
Соединения в латеральное ретикулярное ядро продолговатого мозга кошек - место гипотензивного действия клонидина, по мнению авторов, приводит к увеличению среднего артериального давления. Гипертен-зия возникает и при инфузии соединения в вертебраль-ную артерию, причем инфузия клонидин- замещающей субстанции предотвращает гипотензивное действие самого клонидина.
У крыс интрацистернальное введение клонидин-замещающей субстанции также повышает артериальное давление и предотвращает гипотензивный эффект клонидина. В результате проведенных исследований авторы делают заключение, что субстанция представляет собой эндогенный некатехоламинергический лиганд рецепторов, включенных в гипотензивное действие клонидина.
По мнению Dontenwill et al. (1988), молекула эндогенного лиганда имидазольных рецепторов содержит аминоимидазолин или гуанидиновую часть. Bousquet et al. (1989 в) считают что эндогенным лигандом является эндазолин.
Фермент, синтезирующий агматин (аргинин декар-боксилаза), присутствует в мозгу. Авторы делают заключение, что именно агматин, синтезируемый локально, является эндогенным агонистом имидазольных рецепторов, некатехоламинергическим агонистом альфа 2 адренорецепторов и может выступать в качестве ней-ромедиатора.
Подробный анализ кандидатов на роль эндогенного лиганда, связывающегося со всеми подклассами ими-дазолиновых рецепторов, был проведен Reis et al. (1995). Авторы отметили, что, подобно клонидину, клонидин-замещающая субстанция сокращает аорту и угнетает агрегацию тромбоцитов, действуя как агонист альфа 2 адренорецепторов.
В то же время, в отличие от клонидина, субстанция сокращает гладкие мышцы желудка и усиливает высвобождение катехоламинов из хромаффинных клеток надпочечников - т. е. вызывает эффекты, приписываемые активации имидазольных рецепторов.
Авторы указывают, что распределение и биологические эффекты агматина и клонидин-замещающей субстанции различны. Piletz et al. (1995) также считают, что агматин является эндогенным лигандом II рецепторов, но не клонидин-замещающей субстанцией.
В дальнейшем (Reis, Regunathan, 1999) приходят к заключению, что агматин является эндогенным лигандом альфа 2-адрено- и имидазолиновых рецепторов и имеет способности эндогенного нейропередатчика. Последнее основывается на ряде признаков: агматин локально синтезируется в мозге, накапливается в нейронах с избирательным распределением в центральной нервной системе.
Он связан с небольшими пузырьками в аксонных терминалях, которые, по крайней мере в гиппокампе, образуют синапсы с пирамидальными клетками; высвобождается из синаптосом кальцийзависимым механизмом; может инактивироваться агматиназой в синап-тосомах; может инактивироваться избирательным обратным захватом; оказывать системное действие при введении в желудочки мозга.
В то же время, агматин не аналогичен клонидин-замещающей субстанции и, вероятно, является одним из многочисленных лигандов имидазолиновых рецепторов. Агматин накапливается в нейронах и окончаниях аксона и высвобождается при их деполяризации.
У бодрствующих кроликов Head et al. (1997) исследовали кардиоваскулярные эффекты агматина и его взаимодействие с агонистом альфа 2-адренорецепторов клонидином и блокатором альфа 2-адренорецепторов 2-метоксиидазоксаном. Одновременно исследовалось взаимодействие агматина с агонистом имидазольных рецепторов моксонидином и антагонистом - эфароксаном.
Исследования показали, что введенный в четвертый желудочек агматин в малых дозах (0.01-10 мкг/кг) не снижает артериальное давление, но вызывает дозо-зависимую брадикардию. Введенный в больших дозах (100 мкг/кг) агматин повышал артериальное давление и приводил к тахикардии. Эти результаты были противоположны тем, которые наблюдались при введении клонидина и моксонидина.
В случае, когда агматин (10 мкг/кг) вводился после клонидина, гипотензивный эффект последнего сохранялся, но брадикардия усиливалась. Эфароксан и 2-ме-токсиидазоксан в дозах, не изменяющих показатели гемодинамики, предотвращали урежение сокращений сердца, вызываемое агматином.
На основании своих исследований авторы приходят к заключению, что агматин не является эндогенным лигандом имидазольных рецепторов. Sun et al. (1995) вообще высказывают предположение, что агматин является семейством молекул.
Агматин подвергается разрушению ферментом агматиназой в путресцин. Агматин, по-видимому, не является селективным агонистом только адренергичес-ких и имидазольных рецепторов, так как, одновременно, может блокировать глютаматные (подтип N-метил-d-аспартата) рецепторы (Reis, Regunathan, 1998). Показано, что введение ингибиторов диамин оксидазы увеличивает концентрацию агматина (Holt, Baker, 1995).
В 1981 году Dabire et al. (1981) описали вновь синтезированное соединение, по химической структуре представляющее собой (imidazolinyl-2)-2-benzodioxane 1-4 (170150).Это соединение, названное впоследствии идазоксаном, обладает способностью блокировать альфа 2-адренорецепторы. Клонидин-замещающая субстанция конкурирует с идазоксаном за связывание с ими-дазольными рецепторами.
Имидазолиновые рецепторы обнаружено не только на теле нервных клеток, но и в окончаниях симпатических везикул. Считается (Gothert, Molderings, 1991), что имидазольные рецепторы на постганглионарных симпатических нервах регулируют высвобождение но-радреналина. Однако Schlicker et al. (1997) считают, что все экзогенные лиганды имидазолиновых рецепторов обладают способностью активировать и альфа 2-адре-нергические рецепторы, и способность производных имидазолина угнетать выделение норадреналина из пресинаптических окончаний не связано с активацией имидазолиновых рецепторов.
У млекопитающих имидазолиновые рецепторы обнаружены в лимбическом и продолговатом мозге (Kamisaki et al., 1990).Низкая плотность имидазольных рецепторов обнаружена в мозжечке и спинном мозге (De Vosetal., 1994).
Попытка выяснить функциональную роль имидазолиновых рецепторов в регуляции кровообращения привела к появлению данных о том, что иммунореак-тивные имидазолин-подобные субстанции присутствуют в сыворотке крови человека и у 20-30% людей, страдающих гипертонической болезнью, уровень этих субстанций выше (Dontenwill et al., 1994).
Доказано, что агмантин и клонидин-замещающая субстанция не только находятся в сыворотке крови, но и могут участвовать в пролиферации гладких мышц (Molderings, Gothert, 1999).
Углубление представлений о структуре и функции имидазолинового рецептора интенсифицировали поиски химических соединений, которые являясь экзогенными лигандами этих рецепторов могли бы быть и гипотензивными соединениями. Эти поиски привели к созданию двух лекарственных препаратов - моксонидина и рилменидина и пересмотру старых представлений о причинах гипотензивного действия клонидина.
Уже предварительные исследования показали, что локализация действия этих препаратов аналогична кло-нидину. При внутривенном введении крысам линии SHR клонидин (3-30 мг/кг) и рилменидин (0,2-3 мг/кг) вызывали однотипную дозозависимую брадикардию. Динамика изменений артериального давления у препаратов тоже была однотипной - первоначальная гипертензия и затем снижение артериального давления в течение 3-х часов (Smitsetal., 1991).
У анестезированных крыс инъекция рилменидина в вентролатеральную часть продолговатого мозга, но не в ядро солитарного тракта, снижало артериальное давление (Gomez et al., 1991).
Chan, Head (1996) в опытах на кроликах показали, что моксонидин и рилменидин как гипотензивные средства в 7-8 раз менее активны, чем клонидин, хотя по способности вызывать брадикардию моксонидин и клонидин близки. Нейрохимический анализ действия препаратов позволил авторам сделать заключение, что моксонидин и рилменидин влияют на центральные имида-зольные рецепторы, в то время как клонидин - на адре-нергические.
Моксонидин связывается мембранами нервных клеток вентролатерального ядра (где и локализованы имидазолиновые рецепторы) в 40 раз выше, чем клонидин (Ernsberger et al., 1993).
Head et al. (1997) отметили, что гипотензия, вызываемая рилменидином и моксонидином при внутривенном или внутримозговом введении, предотвращается идазоксаном и эфароксаном, в то время как эффект клонидина после введения антагонистов имидазольных рецепторов сохранялся.
Для изучения локализации действия препаратов Head et al. (1998) осуществляли их внутримозговое введение. Эксперименты показали, что рилменидин при введении в 4-й желудочек вызывает более сильную ги-потензию, чем при внутривенном введении. Инъекция рилменидина в ростровентролатеральную часть продолговатого мозга снижала артериальное давление сильнее, чем его введение в ядро солитарного тракта.
В то же время альфа-метилнорадреналин вызывал гипотензию при введении в оба участка продолговатого мозга. У бодрствующих кроликов как внутривенное, так и внутримозговое введение рилменидина тормозило электрическую активность почечного нерва, и это торможение предотвращалось идазоксаном.
У крыс с денервацией сино-каротидно-аортальной зон Д.Н.Майоров и соавт.(1993) показали, что при инт-рацистернальном введении рилменидин уменьшает электрическую активность почечного нерва, причем идазоксан предотвращал эффект рилменидина, а иохим-бин не влиял на это угнетение.
Если в отношении моксонидина и рилменидина мнение исследователей достаточно определенно, то в отношении нейрохимических механизмов действия клонидина взгляды разделяются. Большинство авторов исходит из того, что клонидин оказывает гипотензивный эффект, влияя на имидазольные рецепторы. Guyenet (1997) приводит 4 довода, свидетельствующие об адренергическом механизме действия препарата: 1) при внутривенном введении клонидина его эффект снимается блокаторами альфа 2-адренергических рецепторов; 2) гипотензивный эффект клонидина отсутствует у мышей с генетически дефектными альфа 2-адренорецепторами; 3) симпатолитический эффект клонидина постоянен в присутствии идентифицированных альфа 2-адренергических рецепторов; 4) Лиганды имидазольных рецепторов без сродства к альфа 2-адрено-рецепторам не вызывают гипотензии.
Возможность влияния препаратов на оба типа рецепторов предполагают Hauser et al. (1995). Авторы показали, что клонидин, моксонидин, рилменидин и агматин у крыс линии SHR с разрушенным спинным мозгом уменьшают выделение норадреналина из окончаний симпатических нервов (что связано с активацией пресинаптических альфа 2-адренорецепторов) и адреналина из надпочечников (что обусловлено активацией имидазольных рецепторов).
Только одиночные исследования посвящены выяснению нейрофизиологических особенностей действия клонидина в сравнении с моксонидином и рилменидином. Godwin et al. (1998) в опытах на бодрствующих кроликах сравнивали эффект препаратов на кардиохро-нотропный компонент артериального барорецепторно-го рефлекса в дозах, вызывающих одинаковый гипотензивный эффект. Проведенные исследования показали, что при введении препаратов в 4-ый желудочек мозга рилменидин и клонидин увеличивали вагальный компонент рефлекса, причем это увеличение обусловлено активацией центральных адренорецепторов.
Ряд исследований посвящен влиянию экзогенных лигандов имидазольных рецепторов на изменения показателей гемодинамики и электрической активности симпатических нервов в условиях стресса. Burke et al. (1998) у кроликов изучали изменение активности почечного нерва при звуковых сигналах и воздействии воздуха. Авторы отметили, что рилменидин уменьшал усиление биоэлектрической активности, обусловленное воздействием воздушного потока, но не влиял на изменения, связанные со звуковым воздействием.
У людей рилменидин не влияет на изменения гемодинамики, вызванные ментальным стрессом, и незначительно уменьшает гипертензию и тахикардию, возникающие при велоэргометрии (Panfilov et al., 1995).
Имеются отдельные наблюдения о том, что роль имидазольных рецепторов в деятельности организма не ограничивается только регуляцией сердечно-сосудистой системы. По мнению Garcia-Sevilla et al. (1999) депрессии, пристрастие к опиоидам, нейрогенеративные заболевания, глиальные опухоли связаны с имидазольными рецепторами в мозгу.
В частности, при депрессии уровень имидазоль-ного рецепторного белка массой 45 KD (потенциального имидазольного рецептора 1 типа) увеличен на 51%. Таким образом, представления о наличии имидазольных рецепторов и появление препаратов, вызывающих фармакологические эффекты за счет их активации, до настоящего времени не позволило ответить на один из основных вопросов нейрохимической организации систем, осуществляющих центральную регуляцию кровообращения, - в деятельности каких нейрональных систем принимают участие элементы, имеющие имидазоль-ные рецепторы.
Российский Научно-Практический
рецензируемый журнал
ISSN 1561-8641
Читайте также:


