На нервно мышечные синапсы препараты
Описание
Передача возбуждения с соматических нервов на скелетную мускулатуру осуществляется с помощью ацетилхолина. Он выделяется пресинаптической мембраной и связывается н-холинорецепторами; активация последних инициирует комплекс изменений, приводящий к сокращению мышцы. Усиление сократительной деятельности можно получить агонистами ацетилхолина или препаратами, вызывающими накопление медиатора в синаптической щели — антихолинэстеразными средствами (см. Холиномиметические средства).
Противоположное действие оказывают миорелаксанты (см. н-Холинолитики (миорелаксанты)). В группу миорелаксантов объединяют лекарственные средства, расслабляющие скелетную мускулатуру.
Кураре и курареподобные препараты применяют в медицине для расслабления скелетной мускулатуры, главным образом, при хирургических операциях. Действие этих препаратов связано с экранирующим влиянием на н-холинорецепторы постсинаптической мембраны поперечно-полосатых мышц.
Кураре представляет собой смесь сгущенных экстрактов из южноамериканских растений видов Strychnos (S. toxifera и др.) и Chondodendron (Ch. Tomentosum, Ch. Platyphyllum и др.); он с давних пор использовался аборигенами в качестве яда для стрел (вызывает обездвиживание или смерть животного в результате асфиксии, обусловленной прекращением сокращений дыхательной мускулатуры). Еще в прошлом столетии было установлено, что вызываемое при помощи кураре обездвиживание зависит от прекращения передачи возбуждения с двигательных нервов на мышцы (Клод Бернар, Е.В. Пеликан).
Оказалось, что сходными свойствами обладают синтетические курареподобные соединения, некоторые алкалоиды и их производные.
Антидеполяризующие или недеполяризующие миорелаксанты (пахикураре) парализуют нервно-мышечную передачу, уменьшая чувствительность н-холинорецепторов синаптической области к ацетилхолину, исключая возможность деполяризации концевой пластинки и возбуждения мышечного волокна. К ним относятся d-тубокурарин, диплацина дихлорид, пипекурония бромид, атракурия безилат и др. Соединения этой группы являются истинными курареподобными веществами. Их антагонисты — антихолинэстеразные вещества: ингибирование холинэстеразы приводит к накоплению в области синапсов ацетилхолина, который при повышенной концентрации вытесняет курареподобные вещества с н-холинорецепторов и восстанавливает нервно-мышечную проводимость.
Деполяризаторы (лептокураре) расслабляют мускулатуру, вызывая, напротив, стойкую деполяризацию концевой пластинки, делая ее (подобно избыточным количествам ацетилхолина) невосприимчивой к новым импульсам и в конечном итоге также нарушая проведение возбуждения с нерва на мышцу. Препараты этой группы относительно быстро гидролизуются холинэстеразой и при однократном введении дают кратковременный эффект; разумеется, антихолинэстеразные средства усиливают их действие. Основным представителем этой группы является суксаметония йодид.
Отдельные миорелаксанты могут оказывать смешанное действие — антидеполяризующее и деполяризующее.
Ряд препаратов расслабляет соматическую мускулатуру по центральным механизмам. Миорелаксацию могут вызывать анксиолитики (см. Анксиолитики). В последние годы найдены соединения (толперизон, баклофен, тизанидин и др.), миорелаксантный эффект которых связан со специфическим влиянием на ретикулярную формацию мозга, спинальные моно- и полисинаптические рефлексы. Они устраняют повышенный тонус произвольных мышц без существенного нарушения двигательных функций. Их используют при спастических состояниях, поясничном радикулите, ревматических и других заболеваниях, сопровождающихся спазмом скелетных мышц. В механизме действия этих препаратов важную роль играет модуляция ГАМКергических процессов мозга.
Синапс (греч. synapsis — соединение) — это специализированная структура, обеспечивающая передачу сигнала от клетки к клетке. Посредством синапса реализуется действие многих фармакологических препаратов.
Структурно-функциональная организация. Каждый синапс имеет пре- и постсинаптическую мембраны и синаптическую щель (рис. 17).
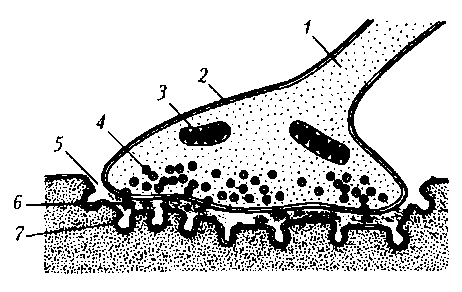
Рис. 17. Нервно-мышечный синапс скелетной мышцы: 1 – ветвь аксона; 2 – пресинаптическое окончание аксона; 3 – митохондрия; 4 – синаптические пузырьки, содержащие ацетилхолин; 5 – синаптическая щель; 6 – молекулы медиатора в синаптической щели; 7 – постсинаптическая мембрана мышечного волокна с N-холинорецепторами
Пресинаптическая мембрана нервно-мышечного синапса представляет собой часть мембраны пресинаптического окончания аксона мотонейрона. Через нее осуществляется выброс (экзоцитоз) медиатора (лат. mediator — посредник) в синаптическую щель. В нервно-мышечном синапсе медиатором является ацетилхолин. Медиатор пресинаптического окончания содержится в синаптических пузырьках (везикулах), диаметр которых составляет около 40 нм. Они образуются в комплексе Гольджи, с помощью быстрого аксонного транспорта доставляются в пресинаптическое окончание, где заполняются медиатором и АТФ. В пресинаптическом окончании содержится несколько тысяч везикул, в каждой из которых имеется от 1 тыс. до 10 тыс. молекул химического вещества.
Постсинаптическая мембрана (концевая пластинка в нервно-мышечном синапсе) — это часть клеточной мембраны иннервируемой мышечной клетки, содержащая рецепторы, способные связывать молекулы ацетилхолина. Особенность этой мембраны: множества мелких складок, увеличивающих ее площадь и количество рецепторов на ней до 10—20 млн в одном синапсе.
Синаптическая щель в нервно-мышечном синапсе имеет ширину в среднем 50 нм. Она содержит межклеточную жидкость, ацетилхолинэстеразу и мукополисахаридное плотное вещество в виде полосок, мостиков, в совокупности образующих базальную мембрану, соединяющую пре- и постсинаптическую мембраны.
Механизмы синаптической передачи включают три основных этапа (рис. 18).
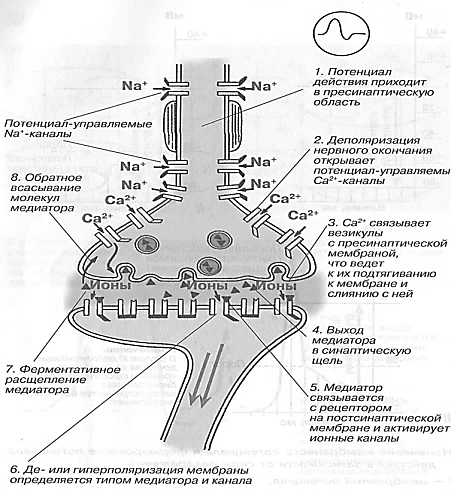
Рис. 18. Механизм проведения импульса через химический синапс: 1-8 – этапы процесса (Чеснокова, 2007)
Первый этап — процесс выброса медиатора в синаптическую щель, который запускается посредством ПД пресинаптического окончания. Деполяризация его мембраны ведет к открытию потенциалуправляемых Са-каналов. Са 2+ входит в нервное окончание согласно электрохимическому градиенту. Часть медиатора в пресинаптическом окончании локализуется на пресинаптической мембране изнутри. Са 2+ активирует экзоцитозный аппарат пресинапса, представляющий собой совокупность белков (синапсин, спектрин и др.), пресинаптического окончания, активация которых обеспечивает выброс ацетилхолина посредством экзоцитоза в синаптическую щель. Количество высвобождаемого ацетилхолина из пресинаптического окончания пропорционально в четвертой степени количеству поступившего туда Са 2+ . На один ПД из пресинаптического окончания нервно-мышечного синапса выбрасывается 200—300 квантов (везикул) медиатора.
Второй этап — диффузия ацетилхолина в течение 0,1—0,2 мс к постсинаптической мембране и действие его на N-холинорецепторы (стимулируются также никотином, вследствие чего и получили свое название). Удаление ацетилхолина из синаптической щели осуществляется путем разрушения его под действием ацетилхолинэстеразы, расположенной в базальной мембране синаптической щели, в течение нескольких десятых долей миллисекунды. Около 60% холина захватывается обратно пресинаптическим окончанием, что делает синтез медиатора более экономичным, часть ацетилхолина рассеивается. В промежутках между ПД из пресинаптического окончания происходит спонтанное выделение 1— 2 квантов медиатора в синаптическую щель в течение 1 с, формируя так называемые миниатюрные потенциалы (0,4—0,8 мВ). Они поддерживают высокую возбудимость иннервируемой клетки в условиях функционального покоя и выполняют трофическую роль, а в ЦНС — способствуют поддержанию тонуса ее центров.
Третий этап — взаимодействие ацетилхолина с N-холинорецепторами постсинаптической мембраны, в результате чего открываются ионные каналы на 1 мс и, вследствие преобладания входа N + в клетку, происходит деполяризация постсинаптичедкой мембраны (концевой пластинки). Эту деполяризацию в нервно-мышечном синапсе называют потенциалом концевой пластинки (ПКП) (рис. 19).
Особенностью нервно-мышечного синапса скелетного мышечного волокна является то, что при одиночной его активации формируется ПКП большой амплитуды (30—40 мВ), электрическое поле которого вызывает генерацию ПД на мембране мышечного волокна вблизи синапса. Большая амплитуда ПКП обусловлена тем, что нервные окончания делятся на многочисленные веточки, каждая из которых выбрасывает медиатор.
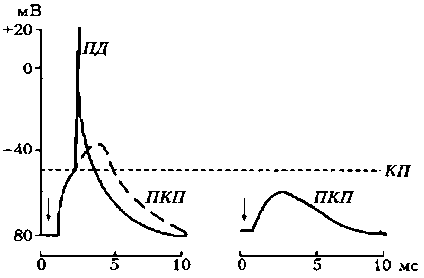
Рис. 19. Потенциал концевой пластинки (Шмидт, 1985): КП – критический потенциал; ПД – потенциал действия; А – ПКП в нормальной мышце; Б – ослабленный ПКП в курарезированной мышце; стрелками указан момент нанесения стимула
Характеристика проведения возбуждения в химических синапсах. Одностороннее проведение возбуждения от нервного волокна к нервной или эффекторной клетке, так как пресинаптическое окончание чувствительно только к нервному импульсу, а постсинаптическая мембрана — к медиатору.
Неизолированное — возбуждение рядом расположенных постсинаптических мембран суммируется.
Синаптическая задержка в передаче сигнала к другой клетке (в нервно-мышечном синапсе 0,5-1,0 мс), что связано с высвобождением медиатора из нервного окончания диффузией его к постсинаптической мембране и возникновением постсинаптических потенциалов, способных вызвать ПД.
Декрементность (затухание) возбуждения в химических синапсах при недостаточном выделении медиатора из пресинаптических окончаний в синаптические щели.
Низкая лабильность (в нервно-мышечном синапсе составляет 100 Гц), которая в 4 - 8 раз ниже лабильности нервного волокна. Это объясняется синаптической задержкой.
Проводимость нервно-мышечного синапса (как и химических синапсов ЦНС) угнетается или, наоборот, стимулируется различными веществами.
Например, кураре и курареподобные вещества (диплацин, тубокурарин) обратимо связываются с N-холинорецепторами постсинаптической мембраны, блокируют действие на нее ацетилхолина и передачу в синапсе. Напротив, некоторые фармакологические препараты, например прозерин, подавляют активность ацетилхолинэстеразы, способствуя умеренному накоплению ацетилхолина и облегчению синаптической передачи, что используется в лечебной практике.
Утомляемость (синаптическая депрессия) — ухудшение проводимости вплоть до полной блокады проведения возбуждения при длительном функционировании синапса (главная причина — истощение медиатора в пресинаптическом окончании).
Вопросы для самоконтроля
1.Каков механизм распространения возбуждения по нервному волокну? Какова роль перехватов Ранвье в проведении возбуждения по миелинизированному нервному волокну?
2.В чем преимущество скачкообразного (сальтаторного) распространения возбуждения над непрерывным его проведением вдоль мембраны волокна?
3.В чем физиологическое значение изолированного проведения возбуждения по нервному волокну?
4.Какие нервные волокна (афферентные или эфферентные, вегетативные или соматические) относятся к группе А? Какова скорость проведения возбуждения по ним?
5.Какие нервные волокна (афферентные или эфферентные, вегетативные или соматические) относятся к группе В? Какова скорость проведения по ним?
6.Какие нервные волокна (афферентные или эфферентные, вегетативные или соматические) относятся к группе С? Какова скорость проведения возбуждения по ним?
7.Перечислите структуры нервно-мышечного синапса (скелетная мышца). Что называют концевой пластинкой?
8.Перечислите последовательность процессов, ведущих к освобождению медиатора из пресинаптической мембраны в синаптическую щель при передаче возбуждения в синапсе.
9. Локальным потенциалом или распространяющимся возбуждением является потенциал концевой пластинки?
10.Что такое миниатюрные потенциалы концевой пластинки, каков механизм их возникновения?
11.В чем заключается трофическое влияние нерва на мышцу, осуществляемое через нервно-мышечный синапс?
12.Какие вещества являются медиаторами в нервно-мышечных синапсах гладкой и поперечнополосатой мышц?
13.Что такое сенсорный рецептор?
14.На какие две группы делятся сенсорные рецепторы по скорости адаптации? Назовите рецепторы, относящиеся к каждой из них.
15.Что понимают под первичными и вторичными рецепторами?
16.Перечислите основные свойства рецепторов.
17.Что называют адаптацией рецепторов? Как изменяется частота импульсов в афферентном нервном волокне при адаптации рецептора?
18.Назовите локальные потенциалы, возникающие при возбуждении первичных и вторичных рецепторов.
19.Рецепторный потенциал, где он возникает, каково его значение?
20.Генераторный потенциал, где он возникает, каково его значение?
21.Где возникает потенциал действия при возбуждении первичного сенсорного рецептора?
22. Где возникает потенциал действия при возбуждении вторичного сенсорного рецептора?
Физиология мышц
1.3.1. Структурнофункциональная характеристика скелетной мышцы
Мышцы подразделяют на поперечнополосатые (скелетная и сердечная) и гладкие (сосуды и внутренние органы, кроме сердца).
Скелетная мышца состоит из мышечных волокон, изолированных в структурном и функциональном отношении друг от Друга, которые представляют собой вытянутые многоядерные клетки. Толщина волокна составляет 10—100 мкм, а его длина варьирует в пределах от нескольких миллиметров до нескольких сантиметров. Количество мышечных волокон, установившись постоянным на 4—5-м месяце постнатального онтогенеза, в последующем не изменяется; с возрастом изменяются (увеличиваются) лишь их длина и диаметр.
Назначение основных структурных элементов. Характеристика основных элементов мышечного волокна. От клеточной мембраны мышечного волокна (сарколеммы) вглубь отходят многочисленные поперечные инвагинации (Т-трубочки), которые обеспечивают ее взаимодействие с саркоплазматическим ретикулулом (СПР) (рис. 20).
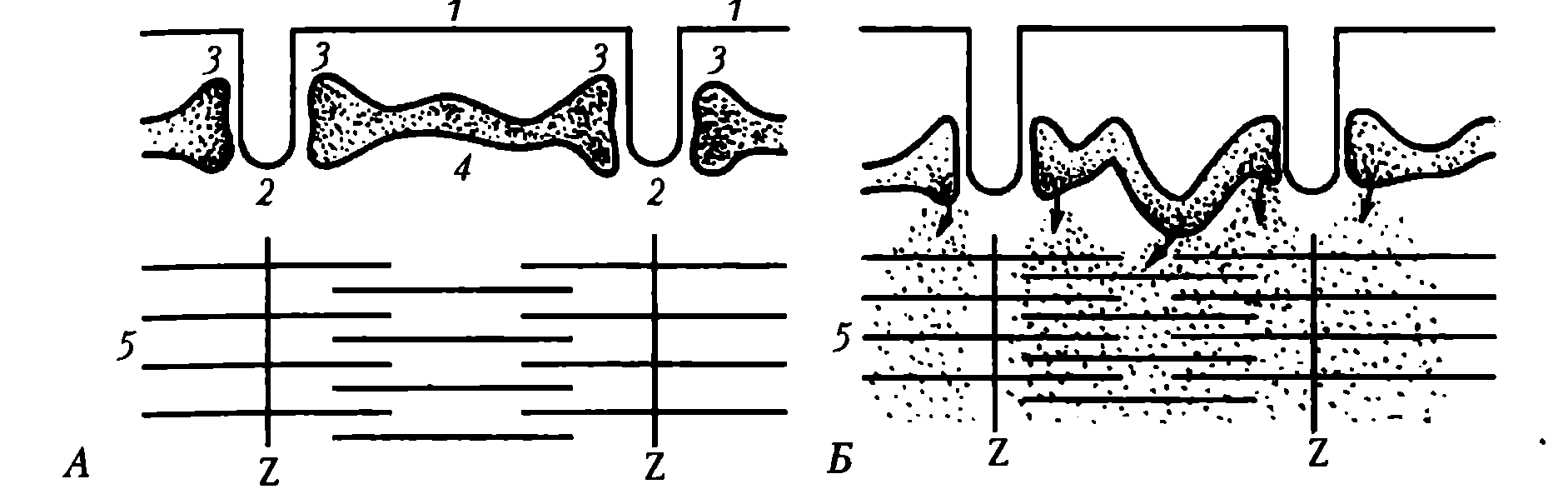
Рис. 20. Взаимоотношение клеточной мембраны (1), поперечных трубочек (2), боковых цистерн (3) и продольных трубочек (4) саркоплпзматическаого ретикулума, сократительных белков (5): А – в состоянии покоя; Б – при сокращении мышечного волокна; точками обозначены ионы Ca 2+
СПР представляет собой систему связанных друг с другом цистерн и отходящих от них в продольном направлении канальцев, расположенных между миофибриллами. Терминальные (концевые) цистерны СПР примыкают к Т-трубочкам, формируя так называемые триады. В цистернах содержится Са 2+ , играющий важную роль в мышечном сокращении. В саркоплазме имеются внутриклеточные элементы: ядра, митохондрии, белки (в том числе миоглобин), капельки жира, гранулы гликогена, фосфатсодержащие вещества, различные малые молекулы и электролиты.
Миоибриллы — субъединицы мышечного волокна. В одном мышечном волокне может насчитываться более 2 тыс. миофибрилл, их диаметр 1—2 мкм. В одиночной миофибрилле содержится 2—2,5 тыс. протофибрилл — параллельно расположенных нитей белка (тонкие — актин, толстые — миозин). Актиновые нити состоят из двух субъединиц, скрученных в виде спирали. В состав тонких нитей входят также регуляторные белки — тропомиозин и тропонин (рис. 21).
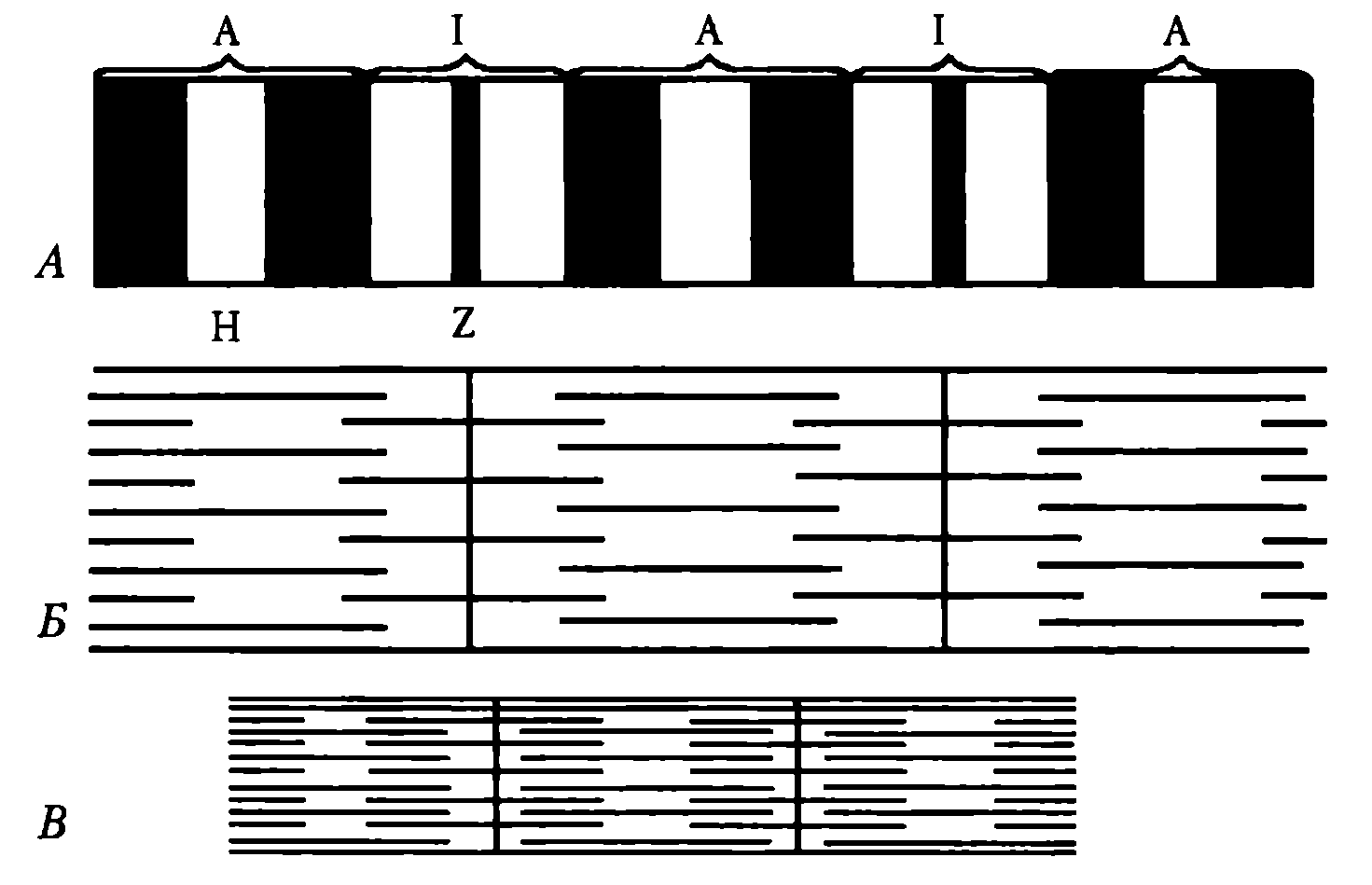
Рис. 21. Взаимное расположение структурных элементов миофибрилл при их расслаблении (А,Б) и сокращении (В)
Эти белки в невозбужденной мышце препятствуют взаимосвязи актина и миозина, поэтому мышца в покое находится в расслабленном состоянии. Миофибриллы включают в себя последовательно соединенные блоки — саркомеры (Б), отделенные друг от друга Z-полосками. Саркомер (длина 2—Змкм) является сократительной единицей мышечного волокна; при длине 5см оно включает в себя около 20 тыс. последовательно соединенных саркомеров. Миофибриллы отдельного мышечного волокна связаны таким образом, что расположение саркомеров совпадает, и это создает картину поперечной исчерченности волокна при наблюдении в световом микроскопе (рис. 22).
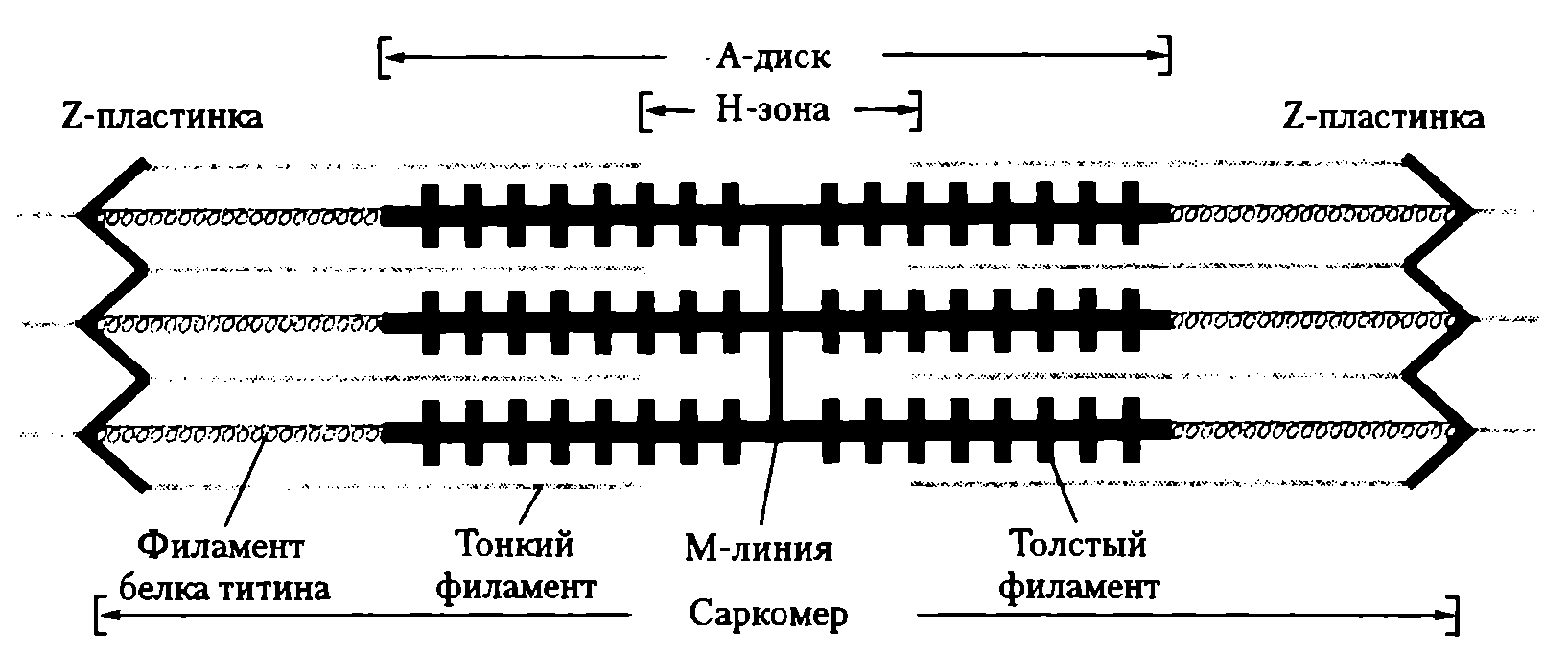
Рис. 22. Саркомер миоцита скелетной мышцы (A. Vander, J. Sherman, D. Luciano, 2004)
Элементы саркoмера (см. рис. 21). Миозиновые протофибриллы образуют наиболее темную часть саркомера — А-диск (анизотропный, он сильно поляризует белый свет). Более светлый участок в центре А-диска называют Н-зоной. Светлый участок саркомера между двумя А-дисками называют 1-диском (изотропный, почти не поляризует свет). Он образован актиновыми протофибриллами, идущими в обе стороны от Z-полосок. Каждый саркомер имеет два набора тонких нитей, прикрепленных к Z-полоскам, и один комплект толстых нитей, сосредоточенных в А-диске. В расслабленной мышце концы толстых и тонких филаментов в разной степени перекрывают друг друга на границе между А- и 1-дисками.
Классификация мышечных волокон:
По структурно-функциональным свойствам и цвету выделяют две основные группы мышечных волокон: быстрые и медленные.
Белые (быстрые) мышечные волокна содержат больше миофибрилл и меньше — митохондрий, миоглобина и жиров, но больше гликогена и гликолитических ферментов; эти волокна называют гликолитическими. Капиллярная сеть, окружающая эти волокна, относительно редкая. Скорость рабочего цикла у данных волокон примерно в 4 раза больше, чем у медленных, что объясняется более высокой АТФазной активностью быстрых волокон, но они обладают малой выносливостью. У белых мышечных волокон число нитей актина и миозина больше, чем у красных, поэтому они толще и сила их сокращения больше, чем у красных волокон.
Красные мышечные волокна содержат много митохондрий, миоглобина, жирных кислот. Эти волокна окружены густой сетью кровеносных капилляров, они имеют меньший диаметр. Митохондрии обеспечивают высокий уровень окислительного фосфорилирования, поэтому данные волокна называют оксидативными. Красные мышечные волокна подразделяются на две подгруппы: быстрые и медленные. Медленные волокна могут выполнять работу в течение относительно продолжительного периода времени; утомление в них развивается медленнее. Они более приспособлены к тоническим сокращениям. Красные быстрые волокна по скорости утомления занимают промежуточное положение между белыми и красными медленными. Скорость их сокращения близка к скорости сокращения белых волокон, что также объясняется высокой АТФазной активностью миозина красных быстрых волокон.
Также имеется незначительное число истинных тонических мышечных волокон; на них локализуется по 7-10 синапсов, принадлежащих, как правило, нескольким мотонейронам, например, в глазодвигательных мышцах, мышцах среднего уха. ПКП этих мышечных волокон не вызывают генерации ПД в них, а непосредственно запускают мышечное сокращение.
Группа мышечных волокон, двигательную (нейромоторную) единицу. В мышцах, совершающих быстрые и точные движения, например в глазодвигательных, нейромоторные единицы состоят из 3—5 мышечных волокон. В мышцах, осуществляющих менее точные движения (например, мышцы туловища и конечностей), двигательные единицы включают сотни и тысячи мышечных волокон. Большая двигательная единица, по сравнению с малой, включает крупный мотонейрон с относительно толстым аксоном, который образует большое число концевых веточек в мышце и, следовательно, иннервирует большое число мышечных волокон. Все мышечные волокна одной двигательной единицы, независимо от их количества, относятся к одному типу. Все скелетные мышцы по своему составу являются смешанными, т.е. образованы красными и белыми мышечными волокнами.
Специфическим свойством всех мышц является сократимость — способность сокращаться, т.е. укорачиваться или развивать напряжение. Реализация этой способности осуществляется с помощью возбуждения и его проведения по мышечному волокну (свойства соответственно возбудимости и проводимости).
Скелетные мышцы не обладают автоматией, управляются организмом произвольно импульсацией из ЦНС, поэтому их называют также произвольными. Гладкие мышцы по собственному желанию не сокращаются, поэтому их называют также непроизвольными, но они обладают автоматией.
Функции скелетной мышцы:
Обеспечение двигательной активности организма — поиск и добывание воды и пищи, ее захват, жевание, глотание, оборонительные реакции, трудовая деятельность — физическая и творческая работа художника, писателя, ученого, композитора в конечном итоге выражается в движении: рисование, письмо, игра на музыкальном инструменте и т.п.
Обеспечение дыхания (движений грудной клетки и диафрагмы).
Коммуникативная функция (устная и письменная речь, мимика и жесты).
Участие в процессах терморегуляции организма с помощью изменения интенсивности сократительного термогенеза.
Средства, блокирующие нервно-мышечные синапсы (ФАРМАКОЛОГИЯ)
Средства, блокирующие нервно-мышечные синапсы, вызывают расслабление скелетных мышц (миорелаксацию) вследствие блокады передачи нервных импульсов с двигательных нервов на мышцы. Препараты этой группы называются также миорелаксантами периферического действия, в отличие от веществ, которые вызывают расслабление скелетных мышц, действуя на ЦНС (миорелаксанты центрального действия, см. бензодиазепины, стр. 230).
В зависимости от механизма нервно-мышечного блока выделяют миорелаксанты антидеполяризующего (недеполяризующего) действия и миорелаксанты деполяризующего действия.
Миорелаксанты антидеполяризующего действия
Вещества этой группы блокируют Н-холинорецепторы, локализованные на концевой пластинке скелетных мышц, и препятствуют их взаимодействию с аце-тилхолином, в результате чего ацетилхолин не вызывает деполяризацию мембраны мышечных волокон - мышцы не сокращаются. Такое состояние называется нервно-мышечным блоком. Однако при повышении концентрации ацетилхоли-на в синаптической щели (например, при применении антихолинэстеразных
средств) ацетилхолин конкурентно вытесняет миорелаксант из связи с Н-холи-норецептором и вызывает деполяризацию постсинаптической мембраны — происходит восстановление нервно-мышечной передачи. Вещества, действующие подобным образом, называются миорелаксантами антидеполяризующего конкурентного действия.
Первым препаратом этой группы был алкалоид тубокурарин - основное действующее вещество стрельного яда кураре. В состав этого яда входят экстракты южноамериканских растений вида Strychnos и Chondodendron . Индейцы Южной Америки использовали кураре во время охоты на животных, смазывая им наконечники стрел. Кураре, попав в организм животного, вызывало паралич скелетных мышц и животное теряло способность двигаться, но его мясо было пригодно к употреблению в пищу. Впоследствии было установлено, что по химической структуре тубокурарин является четвертичным аммониевым соединением и не всасывается из ЖКТ.
Вещества, близкие тубокурарину по действию, стали называть курареподобны-ми средствами. Большинство курареподобных средств, так же как тубокурарин, относятся к четвертичным аммониевым соединениям. В молекуле большинства веществ имеются два положительно заряженных атома азота (катионные центры), которые и взаимодействуют с анионными структурами Н-холинорецепто-ров скелетных мышц, вызывая нервно-мышечный блок.
Антидеполяризующие миорелаксанты в основном относятся к двум химическим группам:
бензилизохинолины (тубокурарин, атракурий, мивакурий);
аминостероиды (пипекуроний, векуроний, рокуроний).
В зависимости от продолжительности вызываемого ими нервно-мышечного блока выделяют препараты: длительного действия (30 мин и более) — тубокурарин, пипекуроний; средней продолжительности действия (20—30 мин) - атракурий, векуроний, рокуроний; короткого действия (10 мин) - мивакурий.
Продолжительность действия курареподобных средств в основном определяется характером их элиминации. Наиболее продолжительно действуют вещества, которые главным образом выделяются почками (пипекуроний). Вещества средней продолжительности действия в большей степени выделяются вместе с желчью в неизмененном виде и в виде метаболитов (векуроний и рокуроний), или подвергаются спонтанному гидролизу в плазме крови (атракурий). Короткое действие мивакурия связано с тем, что он быстро разрушается холинэстеразой плазмы крови (псевдохолинэстераза).
Курареподобные средства используются для расслабления скелетных мышц при хирургических операциях. Под действием курареподобных средств мышцы расслабляются в следующей последовательности: сначала мышцы лица, гортани, шеи, затем мышцы конечностей, туловища и в последнюю очередь дыхательные мышцы — наступает остановка дыхания. При выключении дыхания больного переводят на искусственную вентиляцию легких.
Кроме того, курареподобные средства применяют для устранения тонических судорог при столбняке и при отравлении стрихнином. При этом расслабление скелетных мышц способствует устранению судорог.
Побочные эффекты некоторых курареподобных средств (тубокурарин, атракурий, мивакурий) связаны главным образом с их способностью высвобождать гистамин. Это может быть причиной гипотензии, бронхоспазма, покраснения кожи, а также реже — других анафилактоидных реакций. В большей степени высвобождению гистамина способствует тубокурарин. Способность высвобождать
гистамин практически отсутствует у препаратов из группы аминостероидов, но некоторые из них (панкуроний, рокуроний) оказывают умеренное ваголитичес-кое действие (возможна тахикардия).
Антагонистами миорелаксантов антидеполяризующего действия являются антихолинэстеразные средства. Угнетая активность ацетилхолинэстеразы, они предотвращают гидролиз ацетилхолина и таким образом увеличивают его концентрацию в синаптической щели. Ацетилхолин вытесняет препарат из связи с Н-холинорецепторами, что приводит к восстановлению нервно-мышечной передачи. Антихолинэстеразные средства (в частности, неостигмин) применяют для прерывания нервно-мышечного блока или устранения остаточных явлений после введения антидеполяризующих мышечных релаксантов.
Миорелаксанты деполяризующего действия
Суксаметония йодид (Дитилин, Листенон, Миорелаксин) Суксаметония йодид по химическому строению представляет собой удвоенную молекулу ацетилхолина.
Суксаметоний взаимодействует с Н-холинорецепторами, локализованными на концевой пластинке скелетных мышц, подобно ацетилхолину и вызывает деполяризацию постсинаптической мембраны. При этом мышечные волокна сокращаются, что проявляется в виде отдельных подергиваний скелетных мышц -фасцикуляций. Однако в отличие от ацетилхолина суксаметоний обладает устойчивостью к ацетилхолинэстеразе (он гидролизуется только холинэстеразой плазмы крови) и поэтому практически не разрушается в синаптической щели. В результате суксаметоний вызывает стойкую деполяризацию постсинаптической мембраны концевой пластинки. Это приводит к нарушению нервно-мышечной
передачи и расслаблению скелетных мышц. При этом выделяющийся в синапти-ческую щель ацетилхолин лишь усиливает деполяризацию мембраны и углубляет нервно-мышечный блок.
Антихолинэстеразные средства не устраняют действие суксаметония (не являются его антагонистами). Более того, подавляя активность ацетилхолинэсте-разы и холинэстеразы плазмы крови, они усиливают и удлиняют его действие.
Суксаметоний применяется при интубации трахеи, эндоскопических процедурах (бронхо-, эзофаго-, цистоскопии), кратковременных операциях (наложение швов на брюшную стенку, вправление вывихов, репозиция костных отломков), для устранения тонических судорог при столбняке.
После внутривенного введения суксаметония его миопаралитическое действие начинается через 30 с—1 мин, и продолжается до 10 мин. Такое кратковременное действие препарата связано с его быстрым разрушением псевдохолинэстеразой плазмы крови (образуются холин и янтарная кислота). При генетической недостаточности этого фермента действие суксаметония может продолжаться до 2-6 ч. Миорелаксирующее действие препарата можно прекратить переливанием свежей цитратной крови, которая содержит активную псевдохолинэстеразу.
Побочные эффекты: послеоперационные мышечные боли (что связывают с микротравмами мышц во время их фасцикуляций), угнетение дыхания (апноэ), гиперкалиемия и аритмии сердца, гипертензия, повышение внутриглазного давления, рабдомиолиз и миоглобинемия, гипертермия. Суксаметоний противопоказан при глаукоме, нарушении функции печени, анемии, беременности, злокачественной гипертермии, в грудном возрасте.
Сравнительные характеристики миорелаксантов антидеполяризующего и деполяризующего действия приведены в таблице 8.2.
Таблица 8.2. Сравнительные характеристики миорелаксантов антидеполяризующего и деполяризующего действия
Механизм развития нервно-мышечного блока
Блокада Н-холинорецепторов концевой пластинки скелетных мышц, устранение деполяризующего действия ацетилхолина
Стойкая деполяризация постси-наптической мембраны нервно-мышечного синапса
Фаза мышечной фасцикуляций Фаза расслабления
Влияние антихолин-эстеразных средств
Устранение нервно-мышечного блока
Усиление и удлинение нервно-мышечного блока
Диоксоний является препаратом смешанного типа действия.
Диоксоний сочетает в себе свойства деполяризующих и недеполяризующих миорелаксантов. Сначала он вызывает кратковременную деполяризацию, которая сменяется недеполяризующим блоком.
Вводят диоксоний внутривенно. Мышечное расслабление наступает через 1-3 мин и продолжается 20—40 мин.
Курареподобные препараты применяются только в условиях стационара и самостоятельное введение их больными недопустимо.
Взаимодействие миорелаксантов периферического действия с другими лекарственными средствами
Взаимодействующий препарат (группа препаратов)
Атракурий, другие антидеполя-ризующие мио-релаксанты
Аминогликозиды, линкомицин, клин-дамицин и некоторые другие антибиотики, соли магния, антагонисты кальция, лидокаин, новокаин. Средства для ингаляционного наркоза: изофлуран, энфлуран
Усиление и удлинение миорелак-сирующего действия
Уменьшение или полное устранение миорелаксирующего действия
Аминогликозиды, лидокаин, новокаин, хинидин, соли магния и лития
Удлинение миорелаксирующего действия
Усиление и удлинение миорелаксирующего действия
Усиление угнетающего действия на дыхание
Международное непатентованное название
Патентованные (торговые) названия
Тубокурарина хлорид (Tubocurarin! chloridum)
Ампулы по 1, 5 мл 1% раствора
Атракурия бесилат (Atracurii besilas)
Ампулы по5и2,5мл1% раствора
Пипекурония бромид (Pipecuronii bromidum)
Ампулы, содержащие по 0,004 г
Суксаметония йодид (Suxametonii iodidum)
Ампулы по 5 и 10 мл 2% раствора
Ампулы по 5 мл 0, 1% раствора
8.2.4. Средства, уменьшающие выделение ацетилхолина
Б о т о к с является препаратом ботулинового токсина типа А, который препятствует выделению ацетилхолина из окончаний холинергических нервных волокон.
Ботулиновый токсин состоит из двух цепей (тяжелой и легкой, различающихся молекулярной массой), объединенных дисульфидным мостиком. Тяжелая цепь ботулинового токсина обладает способностью связываться со специфическими рецепторами мембран нервных клеток. После связывания с пресинаптической
мембраной нервного окончания ботулиновый токсин путем эндоцитоза проникает внутрь нейрона. По некоторым данным легкая цепь ботулинового токсина обладает протеазной активностью по отношению к белку пресинаптической мембраны ( SNAP -25), принимающему участие в процессе экзоцитоза везикул. В результате энзиматического расщепления этого белка нарушается слияние мембраны везикул с пресинаптической мембраной и нарушается экзоцитоз везикул, при этом не происходит высвобождения ацетилхолина в синаптическую щель. Вследствие уменьшения выделения ацетилхолина в нервно-мышечных синапсах развивается паралич скелетных мышц. Кроме того, нарушается передача нервных импульсов в других холинергических синапсах, в том числе с симпатических хо-линергических волокон, иннервирующих потовые железы.
Ботулиновый токсин типа А выпускается в виде комплекса с гемагглютини-ном в форме лиофилизированного порошка для инъекций. Препарат применяют в офтальмологии при блефароспазме, для лечения косоглазия, а также для лечения других спастических состояний, включая локальный мышечный спазм у взрослых и детей старше 2 лет. Вводят внутримышечно. Действие продолжается 4—6 мес. Длительное действие препарата объясняется тем, что мышечные сокращения восстанавливаются только вследствие процесса реиннервации (появления боковых отростков нервных окончаний).
Вследствие того, что ботокс препятствует выделению ацетилхолина окончаниями симпатических холинергических волокон, иннервирующих потовые железы, препарат применяют при гипергидрозе для уменьшения секреции экрин-ных потовых желез (подмышечные впадины, ладони, стопы). Вводят внутрикожно. Эффект продолжается 6—8 мес.
Препарат концентрируется в месте инъекции в течение некоторого времени, а затем попадает в системный кровоток, не проникает через ГЭБ и быстро метабо-лизируется.
В качестве побочных эффектов отмечаются боль и микрогематомы в месте инъекции, незначительная общая слабость в течение 1 недели ( при применении больших доз), в зависимости от места введения возможны птоз, слезотечение или дисфагия. У некоторых пациентов при применении препарата появляются антитела к комплексу гемагглютинин-ботулиновый токсин. Этому способствует введение препарата в высоких дозах. Ботокс противопоказан при миастении, беременности, лактации.
Читайте также:


