Немоторные проявления при болезни паркинсона

Этиология и патогенез. Несмотря на большое число исследований, направленных на поиск основного фактора развития БП, этиология данного заболевания до настоящего времени неизвестна. Предполагается участие генетических факторов, влияние внешней среды и
процессов старения. У 5-10% больных заболевание имеет наследственный характер и передается в семьях по аутосомно-доминантному типу с неполной пенетрантностью мутантного гена. Но в абсолютном большинстве случаев БП является мультифакториальным заболеванием, в механизмах развития которого большое значение придается наследственной предрасположенности.
В настоящее время болезнь Паркинсона относится к синуклеинопатиям, так как ключевым процессом является выделение α-синуклеина, нарушение конформации и внутриклеточного процессинга, которое приводит к формированию нерастворимых белковых агрегатов, а они, в свою очередь, – к нейродегенерации.
Ключевым звеном патогенеза БП является гибель дофаминергических нейронов, тела которых локализованы в чёрной субстанции, а аксоны проецируются в стриатум. Важной особенностью патогенеза БП является системный характер – нейродегенеративный процесс не ограничивается нигростриарной системой, а охватывает другие отделы мозга и периферическую нервную систему[4].
До поражения дофаминергических нейронов чёрной субстанции дегенерации последовательно подвергаются нейроны дорсального ядра блуждающего нерва, нейроны обонятельной луковицы, норадренергические нейроны голубоватого пятна, серотонинергические нейроны ядер шва, холинергические нейроны ядра Мейнерта, нейроны коры больших полушарий и некоторые вегетативные сплетения. При этом в некоторых отделах нервной системы нейроны погибают намного раньше, чем в нигростриарной системе, что приводит к нарушению многих функций мозга, а также внутренних органов, что сопровождается появлением немоторных симптомов на доклинической стадии БП[1].
Клиника. Клиническая картина БП чрезвычайно гетерогенна. К моторным проявления относят олигобрадикинезию, тремор покоя, мышечную ригидность и постуральную неустойчивость. Наряду с моторными симптомами, большое место в клинической семиотике заболевания занимают разнообразные немоторные проявления. Среди них вегетативная недостаточность, когнитивное снижение, аффективные нарушения, диссомнические расстройства. Многие из этих симптомов имеют гетерогенную нейромедиаторную иннервацию. В нашей работе НМС разделены по принципу приемущественной нейромедиаторной (серотонинергическая (СТ-ая), норадренергическая (НА-ая), холинергическая (АХ-ая), дофаминергическая (ДА-ая)) и вегетативной (вег-ая) активности. Среди дофаминергической дисфункции выделяют бред, галлюцинации, избыточную дневную сонливость. Норадренергическая дисфункция включает в себя затруднения глотания и дыхания, необъяснимую боль, ортостатическую гипотензию, нарушение поведение в REM-фазу сна. К холинергической дисфункции мы отнесли когнитивные нарушения. Серотонинергическая дисфункция: изменение массы тела, апатия, депрессия, парестезии в конечностях. Вегетативная дисфункция представлена нарушением мочеиспускания, запорами, потливостью, отечностью ног, нарушением половых функций.
Цель исследования: Выявить и оценить распространенность немоторных симптомов болезни Паркинсона у лиц разных возрастных групп.
Результаты и их обсуждения. В анализируемой выборке средний возраст пациентов составил 63,67 ± 7,98 (средний возраст мужчин составил 62,87 ± 7,93 года, средний возраст женщин – 64,08 ± 8,0 года). При оценке половозрастной структуры соотношение М:Ж составило 1:1,95 (абсолютные значения). Преобладают пациенты в возрастной группе от 60-69 лет. При анализе длительности заболевания преобладал стаж до 3 (33,6%) и от 6-9лет (27,4%) (Рис.1). Наименьшим числом пациентов представлена группа со стажем от 10 и более – 18,6%.
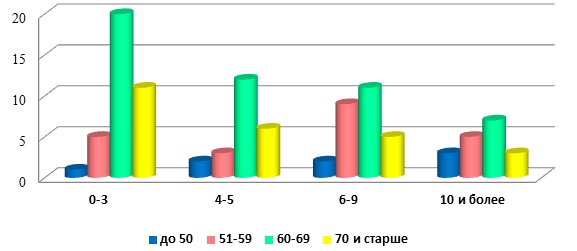
Рис.1. Распределение пациентов в зависимости от стажа и возраста
Примечательно, что, несмотря на небольшой процент исследованных, в данной группе наибольшее кол-во (14,3%) больных молодого возраста (до 50 лет). Средняя стадия по Хен-Яру в среднем составила - 2,25 ± 1,5. У большинства пациентов зарегистрирована II(42,5%) и III (34,5%) стадии заболевания.
I стадия по Хен и Яр у 18,6% больных от общего число обследованных. Наибольшее кол-во пациентов(38%) представлено в возрасте 60-69 лет. Более 70% больных получает терапию АДР. Достаточно высокий процент заболевших (42,9%) получают Леводопу, что объясняется преобладанием в данной стадии лиц старше 60 лет. Преимущественно проводится монотерапия Леводопой или комбинированная терапия (Амантадин + АДР).
Наибольшее число обследованных со II стадией по Хен и Яр(42,5%). Также большее количество составляют пациенты в возрасте 60-69 лет( 46%). На данной стадии увеличивается число лиц, принимающих Леводопу (75%), сохраняется большой процент больных, принимающих АДР (79,2%). Большой процент больных (35%) находятся на комбинированной терапии, включающей в себя Леводопа и АДР.
Пациенты с III стадией по Хен и Яр составляют 34,5% от общего числа обследованных. В данной группе пациенты в возрасте 60-69 лет составляют больше половины исследуемых (54%). Примечательно, что по мере прогрессирования заболевания, пациенты в возрасте 60-69 лет все также преобладают. Все 100% исследуемых в этой группе получают Леводопу, довольно большой процент больных принимают АДР (79,49%). В большинстве случаев либо в комбинации с АДР, либо в составе трехкомпонентной терапии, включающей в себя Амантадин, АДР и Леводопу.
Наименьшее количество исследуемых представлено с IV стадией по Хен и Яр(4,4%). Равное количество пациентов (40%) в возрасте 60-69 лет и 70 лет и старше. Все обследованные принимают Леводопу в комбинации, либо с АДР, либо в составе трехкомпонентной терапии.
В исследуемой выборке все пациенты имели более одного НМС. При анализе НМС в зависимости от стадии заболевания установлено, что в каждой стадии наблюдаются проявления различных нейромедиаторных и вегетативных дисфункций (рис.2). Во всех стадиях преобладает холинергическая недостаточность, проявляющаяся в клинике когнитивными нарушениями, вплоть до деменции. Серотонинергическая дисфункция усиливается с каждой стадией и наиболее ярко представлена в III и IV стадии (до 50%). Норадренергические нарушения наиболее выражены в IV стадии, достигая 62,8%. Проявления дофаминергической дисфункции также медленно нарастают, от 40,5% в I стадии до 50 % в IV стадии. Вегетативная дисфункция составляет 31,2% в первой стадии, постепенно возрастая до 49% в IV стадии, что способствует инвалидизации пациента.
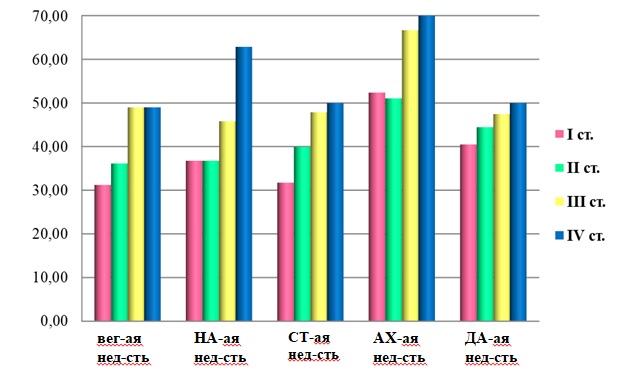
Рис.2. Степень выраженности немоторных симптомов в зависимости от стадии заболевания
Таким образом, можно отметить, что, несмотря на оказываемую медикаментозную терапию, выраженность немоторных симптомов болезни Паркинсона прогрессирует, достигая своего максимума в IV стадии.
1) В настоящее время увеличивается число пациентов с ранним дебютом болезни Паркинсона.
2) У всех пациентов с болезнью Паркинсона наблюдается дофаминергические, норадренергические, холинергические, серотонинергические и вегетативные дисфункции.
3) Немоторные симптомы болезни Паркинсона наиболее выражены в возрасте 60-69 лет.
4) Болезнь Паркинсона ассоциируется с нарушениями памяти уже на ранней стадии заболевания, степень выраженности которых увеличивается со стажем болезни.
5) У пациентов с длительным стажем заболевания и выраженными моторными проявлениями, немоторные симптомы также выражены ярче и вызывают инвалидизацию пациента.
6) Степень выраженности немоторных симптомов увеличивается со стадией заболевания.
7) Взаимосвязи между лекарственными препаратами и их комбинациями и выраженностью немоторных симптомов у разных групп пациентов выявлено не было.
Статья посвящена проблеме немоторных симптомов при болезни Паркинсона и влияние дофаминергической терапии на их коррекцию. Рассматриваются такие немоторные проявлений болезни Паркинсона как: когнитивные расстройства, тревога, депрессия, апатия, повышенная дневная сонливость, поведенческие расстройства. Приведены данные собственного исследования.


Распространение нейродегенеративного процесса на корковые отделы при БП с деменцией связано как с нарастанием синуклеинопатии и увеличением количества телец Леви [14, 15], так и присоединением альцгеймеровских изменений (сенильные бляшки, нейрофибриллярные клубочки), которые выявляются у 50% больных [16, 17].
Развитие КН при БП, так же как и других немоторных симптомов, связывают не только с дофаминергической патологией, но и с вовлечением холинергической, норадренергической, серотонинергической систем. В гистологических посмертных исследованиях выявлено снижение уровня ацетилхолина в лобных долях на 35% у недементных больных и на 65% у пациентов с деменцией. Выраженные изменения уровня ацетилхолина отмечаются в гиппокампе [18, 19]. Кроме ацетилхолина, уменьшается концентрация серотонина и норадреналина в коре. Недавние исследования показали, что у некоторых пациентов на фоне терапии ингибитором обратного захвата норадреналина — атомоксетином, а также ингибитором обратного захвата серотонина — циталопрамом отмечалось улучшение внимания, уменьшение поведенческих расстройств [20]. Вероятно, при БП имеет место гетерогенность вовлечения различных структур и функциональных нарушений, что определяет индивидуальный профиль когнитивной дисфункции у каждого конкретного пациента.
Определенную роль в развитии КН при БП играют генетические мутации, в частности мутация в гене КОМТ (Val 158 Met) [21], GBA [22], гене аполипопротеина Е (APOE), а также в гене тау-протеина MAPT [23]. Клинические исследования показали, что когнитивные нарушения чаще развиваются у больных с акинетико-ригидными формами заболевания, расстройством обоняния, депрессией, нарушением поведения в фазе быстрого сна [23]. Появление зрительных галлюцинаций свидетельствует о прогрессировании когнитивных расстройств [8]. Позитивное влияние на когнитивную сферу, в частности на скорость реакции, концентрацию внимания, гибкость мышления, память, отмечено практически у всех агонистов дофаминовых рецепторов. Пирибедил, имеющий дополнительное влияние на норадренергическую сферу, может дополнительно корректировать УКР при БП.
Депрессия и тревога
Апатия — это поведенческий синдром, который характеризуется снижением интереса, эмоций и мотиваций и не связан со снижением уровня сознания, когнитивными или эмоциональными нарушениями [44]. Апатия является распространенным нейропсихическим симптомом БП, и ее частота оценивается на уровне 25% у de novo пациентов с БП на ранней стадии [45–47] с увеличением до 40% у пациентов без деменции после 5–10-летнего периода заболевания [48] и до 60% у пациентов с деменцией [49]. Клинически апатия часто не распознается, поскольку она может сосуществовать с депрессией и деменцией при БП, однако может возникать независимо от них как отдельный и самостоятельный немоторный симптом [50, 51].
Описаны подтипы апатии, в зависимости от лежащей в их основе дофаминергической или холинергической дисфункции. Апатия входит в структуру холинергического немоторного подтипа БП [3, 52].
Для изучения возможности коррекции апатии с помощью АДР проведено несколько исследований с разными препаратами. Положительный эффект пирибедила показан в 12-недельном проспективном плацебо-контролируемом рандомизированном двойном слепом исследовании у пациентов с развившейся после проведения глубокой стимуляции (DBS) субталамического ядра апатией. В группе пирибедила отмечено значимое увеличение балла по шкале Startstein Apathy Scale (на 34, 6%) в сравнении с группой, получающей плацебо, где этот показатель улучшился только на 3, 2% (p=0, 015) [53]. В отношении других АДР (ропинирола, прамипексола, ротиготина) также получены положительные результаты в открытых исследованиях [43, 54, 55]. Вовлечение холинергических механизмов в развитие апатии может подтверждаться уменьшением этого симптома на фоне 6-месячного использования ингибитора ацетилхолинэстеразы ривастигмина (9, 5 мг/сут) по шкале апатии Lille Apathy Rating Scale (LARS) [56].
Использование антидепрессантов для коррекции апатии при БП противоречиво. Описаны случаи апатии после DBS, резистентной к антидепрессантам. С одной стороны, прием СИОЗС может приводить к усилению апатии при БП, с другой — имеются данные по улучшению мотивации у пожилых пациентов с БП и депрессией на фоне приема ингибитора обратного захвата норадреналина и дофамина бупропиона [57].
Повышенная дневная сонливость
Повышенная дневная сонливость (ПДС) (нарушение бодрствования в пассивном состоянии, иногда в период активности) — характерная жалоба и важный фактор снижения качества жизни при БП [58]. В исследовании M. A. Brodsky ПДС встречалась у 76% больных с БП и у 47% возрастного контроля (p

С.Н. Иллариошкин
доктор медицинских наук, профессор, заместитель директора по научной работе
ГУ НЦ неврологии РАМН
В нашем журнале мы уже неоднократно обращались к теме болезни Паркинсона, что обусловлено высокой распространенностью данного страдания в популяции, особенно у лиц старшей возрастной группы. Однако это заболевание настолько многогранно, а прогресс последних лет в изучении механизмов развития и методов терапии паркинсонизма настолько впечатляющ, что всё новые аспекты этиологии, клиники, диагностики, лечения и профилактики болезни Паркинсона привлекают внимание врачей, ученых и общества в целом.
В настоящее время хорошо известно, что в основе болезни Паркинсона лежит поражение особых пигментированных ("черных") клеток среднего мозга, синтезирующих вещество дофамин.
Дофамин - это основной медиатор центральной нервной системы, регулирующий двигательные функции. Снижение интенсивности дофаминовой передачи импульсов в соответствующих проводящих путях рассматривается как главный биохимический и нейрофизиологический "субстрат" болезни Паркинсона. Таких основных путей в головном мозге три.
Первый дофаминзависимый путь - нигростриарный (от лат. nigros - черный и stria - полоска). Этот путь, как следует из названия, ведет от пигментированных дофаминовых нейронов к полосатому телу - скоплению двигательных нервных клеток в глубоких отделах мозга, имеющему характерную полосатую исчерченность при микроскопии. Именно дегенерация нигростриарного пути ответственна за основные и хорошо изученные двигательные проявления болезни Паркинсона - малоподвижность, скованность различных групп мышц и тремор покоя.
Второй дофаминовый путь, также начинающийся в среднем мозге - мезолимбический (от лат. meso - средний). Он ведет к так называемой лимбической системе - эволюционно древней структуре в основании мозга, отвечающей за обоняние и эмоции. Дегенерация мезолимбического пути при болезни Паркинсона сопровождается нарушением функции обоняния (весьма ранний симптом заболевания) и разнообразными нарушениями в эмоционально-волевой сфере.
Среди последних ведущее место принадлежит депрессии. Депрессия считается практически облигатным симптомом болезни Паркинсона, она значительно затрудняет ведение пациентов и уход за ними, проведение необходимых реабилитационных мероприятий. Во многих случаях именно депрессия является первым проявлением нейродегенеративного процесса при первичном паркинсонизме.
Третий дофаминовый путь в мозге, который также страдает при патологии дофамин-продуцирующих клеток - мезокортикальный, ведущий к коре больших полушарий. Дегенерация этого пути является причиной развития нарушений познавательных (когнитивных) функций при болезни Паркинсона - памяти, абстрактного мышления, временно-пространственной ориентировки и т.д. В наиболее тяжелых случаях, обычно имеющих место на поздних стадиях заболевания, у пациентов может развиваться деменция - выраженное снижение когнитивных способностей, приводящее к социально-бытовой и профессиональной дезадаптации.
Хорошо известны и другие немоторные (то есть не связанные с двигательной сферой) проявления болезни Паркинсона - вегетативные нарушения (запоры, потливость, сальность кожных покровов), расстройства сна, снижение артериального давления. В целом патогенез немоторных проявлений чрезвычайно сложен и связан не только с дофамином, но и с рядом других медиаторов нервной системы. Следует подчеркнуть, что во многих случаях немоторные проявления болезни являются ведущей причиной инвалидизации больных. Например, расстройства мочеиспускания, сна и другие ночные симптомы могут, по оценке самих пациентов, служить главными факторами снижения качества жизни, а наступление деменции, помимо возникающих социальных проблем, является противопоказанием для применения хирургических подходов к лечению болезни (операции на глубоких ядерных структурах головного мозга).
Таким образом, своевременное выявление немоторных проявлений болезни Паркинсона и их адекватное, максимально раннее лечение представляет собой важнейшую задачу современной клинической неврологии.
Медикаментозное лечение болезни Паркинсона предполагает использование препаратов различных классов, воздействующих на разные "мишени" патологического процесса. Так, "золотым стандартом" лечения являются препараты леводопы - биологического предшественника дофамина; заместительная терапия леводопой позволяет компенсировать недостаток дофамина в головном мозге и улучшить двигательные возможности пациентов. В клинике широко применяются также препараты, воздействующие непосредственно на рецепторы дофамина (агонисты дофаминовых рецепторов); важное место занимают препараты, влияющие на метаболизм дофамина и некоторых других медиаторов мозга. Однако, к сожалению, все эти средства направлены в основном на двигательную сферу и практически не влияют на немоторные проявления болезни Паркинсона и, самое главное, не способствуют замедлению прогрессирования нейродегенеративного процесса. Именно поэтому внимание исследователей сегодня сконцентрировано на поиске лекарственных соединений, позволяющих видоизменять течение болезни, оказывать защитное действие в отношении гибнущих нейронов (нейропротекция) и при этом способствовать уменьшению выраженности резистентных к лечению немоторных симптомов.
К числу таких препаратов принадлежат амантадины - достаточно давно известные противопаркинсонические средства, значение которых в последнее время было как бы "переоткрыто" благодаря выявленным уникальным молекулярным механизмам действия и нейропротективным (защитным) свойствам. Амантадины (ПК-Мерц, мидантан и др.) характеризуются комплексным эффектом: они усиливают выделение дофамина в межклеточное пространство и замедляют его обратный захват, стимулируют рецепторы дофамина, действуют также и на другие медиаторы (ацетилхолин) и т.д. Препарат ПК-Мерц (амантадина сульфат) имеет ряд преимуществ перед другими представителями данного класса, в том числе за счет возможности внутривенного введения и, следовательно, более эффективного лечения декомпенсаций болезни Паркинсона. Было показано, что амантадины специфически блокируют рецепторы глутамата - возбуждающего нейромедиатора, избыток которого наблюдается при болезни Паркинсона и способствует повреждению нейронов. Токсическое действие глутамата является важнейшим фактором нейродегенерации, поэтому применение амантадиновых соединений может иметь превентивный эффект и замедлять прогрессирование болезни.
Совсем недавно группой исследователей из Израиля и Италии было представлено убедительное подтверждение нейропротективного действия амантадина. Ученые сравнили частоту развития деменции - важнейшего немоторного проявления болезни Паркинсона - у больных, получавших и не получавших амантадин. Оказалось, что на фоне приема амантадина имело место достоверно более медленное снижение умственных способностей, а выраженность когнитивных нарушений у больных, использовавших для лечения амантадин, была меньше по сравнению с больными, не принимавшими амантадин. Таким образом, применение амантадина способствует задержке появления симптомов деменции у пациентов с болезнью Паркинсона, а также уменьшает ее тяжесть. Интересно отметить, что аналогичное действие при другом нейродегенеративном заболевании (хорее Гентингтона) отмечено и для одного из аналогов амантадина - мемантина.
Можно заключить, что внедрение в практику "антиглутаматных" препаратов означает начало новой главы в неврологии, связанной с воздействием на механизмы прогрессирования нейродегенеративных заболеваний.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.


Читайте в новом номере
Болезнь Паркинсона (БП) — одно из наиболее частых нейродегенеративных заболеваний, представляющая собой мультинейротрансмиттерное расстройство с вовлечением как дофаминовой системы, так и недофаминергичеких механизмов. Клинически это выражается в появлении немоторных симптомов, которые возникают еще в продромальный период до первых двигательных признаков и сопровождают пациента вплоть до поздней стадии болезни, оказывая большее влияние на качество жизни, чем двигательные проявления БП. В статье рассматриваются особенности немоторных проявлений БП: когнитивные расстройства, тревога, депрессия, апатия, повышенная дневная сонливость, поведенческие расстройства (гиперсексуальность, патологическое переедание, безудержное чрезмерное совершение покупок, игромания, пандинг и дофаминовый дизрегуляционный синдром). Приведены данные о частоте встречаемости, патогенезе, клинических особенностях, факторах риска и некоторых аспектах лечения немоторных симптомов. Важное внимание уделено рассмотрению проблемы импульсивно-компульсивных расстройств (ИКР). Высокую частоту распространения этого синдрома связывают с назначением агонистов дофаминовых рецепторов, а также их комбинации с леводопой. Приведены данные собственного исследования частоты развития ИКР у больных с БП и влияния агонистов дофаминовых рецепторов на развитие этого синдрома.
Ключевые слова: болезнь Паркинсона, агонисты дофаминовых рецепторов, немоторные симптомы болезни Паркинсона, повышенная дневная сонливость, когнитивные нарушения, тревога, депрессия, апатия, импульсивно-компульсивные расстройства.
Для цитирования: Шипилова Н.Н., Титова Н.В., Катунина Е.А. Проблема немоторных симптомов при болезни Паркинсона и влияние дофаминергической терапии на их коррекцию. РМЖ. 2018;4(II):85-90.
The problem of non-motor symptoms of Parkinson’s disease and the effect of dopaminergic therapy on their correction
Shipilova N.N., Titova N.V., Katunina E.A.
Pirogov Russian National Research Medical University, Moscow
Parkinson’s disease is one of the most frequent neurodegenerative disorders, it is a multi-neurotransmitter dysfunction involving both the dopamine system and nondophaminergic mechanisms. It is clinically manifested in the appearance of non-motor symptoms that occur even in the prodromal period, prior to the first motor signs, and accompany each patient until the late stage of the disease, having a greater influence on the quality of life than the motor manifestations of Parkinson’s disease. The article is devoted to the features of non-motor manifestations of Parkinson’s disease. The following non-motor manifestations are considered in detail: cognitive disorders, anxiety, depression, apathy, excessive daytime sleepiness, behavioral disorders (hypersexuality, pathological overeating, addictive shopping, game addiction, punding and dopamine dysregulation syndrome). Data on incidence rate, pathogenesis, clinical features, risk factors and some aspects of treatment of non-motor symptoms are given. Important attention is paid to the problem of impulse-compulsive disorders. The high incidence of this syndrome is associated with the administration of dopamine receptor agonists, as well as their combination with levodopa. The authors present the data of their own research, devoted to the incidence rate of impulsive-compulsive disorders in patients with Parkinson’s disease, their peculiarities, as well as the effect of dopamine receptor agonists on the development of this syndrome.
Key words: Parkinson’s disease, dopamine receptor agonists, non-motor symptoms of Parkinson’s disease, excessive daytime sleepiness, cognitive impairment, anxiety, depression, apathy, impulsive-compulsive disorders.
For citation: Shipilova N.N., Titova N.V., Katunina E.A. The problem of non-motor symptoms of Parkinson’s disease and the effect of dopaminergic therapy on their correction // RMJ. 2018. № 4(II). P. 85–90.
Статья посвящена проблеме немоторных симптомов при болезни Паркинсона и влияние дофаминергической терапии на их коррекцию. Рассматриваются такие немоторные проявлений болезни Паркинсона как: когнитивные расстройства, тревога, депрессия, апатия, повышенная дневная сонливость, поведенческие расстройства. Приведены данные собственного исследования.
Распространение нейродегенеративного процесса на корковые отделы при БП с деменцией связано как с нарастанием синуклеинопатии и увеличением количества телец Леви [14, 15], так и присоединением альцгеймеровских изменений (сенильные бляшки, нейрофибриллярные клубочки), которые выявляются у 50% больных [16, 17].
Развитие КН при БП, так же как и других немоторных симптомов, связывают не только с дофаминергической патологией, но и с вовлечением холинергической, норадренергической, серотонинергической систем. В гистологических посмертных исследованиях выявлено снижение уровня ацетилхолина в лобных долях на 35% у недементных больных и на 65% у пациентов с деменцией. Выраженные изменения уровня ацетилхолина отмечаются в гиппокампе [18, 19]. Кроме ацетилхолина, уменьшается концентрация серотонина и норадреналина в коре. Недавние исследования показали, что у некоторых пациентов на фоне терапии ингибитором обратного захвата норадреналина — атомоксетином, а также ингибитором обратного захвата серотонина — циталопрамом отмечалось улучшение внимания, уменьшение поведенческих расстройств [20]. Вероятно, при БП имеет место гетерогенность вовлечения различных структур и функциональных нарушений, что определяет индивидуальный профиль когнитивной дисфункции у каждого конкретного пациента.
Определенную роль в развитии КН при БП играют генетические мутации, в частности мутация в гене КОМТ (Val 158 Met) [21], GBA [22], гене аполипопротеина Е (APOE), а также в гене тау-протеина MAPT [23]. Клинические исследования показали, что когнитивные нарушения чаще развиваются у больных с акинетико-ригидными формами заболевания, расстройством обоняния, депрессией, нарушением поведения в фазе быстрого сна [23]. Появление зрительных галлюцинаций свидетельствует о прогрессировании когнитивных расстройств [8]. Позитивное влияние на когнитивную сферу, в частности на скорость реакции, концентрацию внимания, гибкость мышления, память, отмечено практически у всех агонистов дофаминовых рецепторов. Пирибедил, имеющий дополнительное влияние на норадренергическую сферу, может дополнительно корректировать УКР при БП.
Только для зарегистрированных пользователей

Несмотря на то, что диагноз болезни Паркинсона (БП) базируется на обнаружении и идентификации специфических двигательных проявлений, являющихся непосредственным следствием недостаточности дофаминергической передачи в нигростриарной системе, целый набор немоторных симптомов оказываются столь же характерными для заболевания, большинство из которых являются недофаминергическими по своей природе.
Продолжение. Начало в № 1 (01) 2006 г.
Возникая зачастую уже на ранних стадиях болезни (иногда предшествуя моторным проявлениям), они носят поначалу второстепенный характер, и врачи не уделяют им достаточного внимания, не подвергают должной коррекции. На поздних стадиях БП немоторные проявления начинают доминировать как факторы, влияющие на качество жизни пациента, становятся в определенные моменты более важными и инвалидизирующими, чем моторные колебания, вызванные леводопной терапией, составляя непреодолимые трудности для самих больных и ухаживающих за ними. Основную же проблему представляет плохая курабельность подобных симптомов, для части которых, в отличие от дофаминергических моторных проявлений, еще не разработана адекватная терапия.
Нейропсихиатрические проявления
Когнитивные и нейропсихиатрические немоторные проявления болезни Паркинсона, пожалуй, наиболее существенны в отношении качества жизни, от тревожного расстройства и апатии до депрессии и выраженной деменции.
Симптомы депрессии могут в некоторых случаях предшествовать развитию БП и, считается, что больные с диагностированной в течение жизни депрессией имеют больший риск развития БП, чем люди без депрессивного эпизода. Подобными расстройствами страдают от 10 до 45% больных, в зависимости от критериев, которые используют для оценки. Несмотря на высокую частоту и кажущуюся простоту выявления, распознавание депрессии может быть затруднительным. Классические жалобы на печаль, ощущение вины, раскаяние и снижение самооценки, длительные периоды тоски или самоуничтожения хотя реально и существуют, но вербализуются больными относительно редко. Невролог или участковый терапевт обычно не задают целенаправленных специфических по отношению к депрессии вопросов. Жалобы больного группируются вокруг моторного комплекса и связанных с ним проблем повседневной активности. И это, по сути, маскирует сопутствующую депрессию за счет слияния ее проявлений с очевидными последствиями болезни Паркинсона. Практическое значение диагностики депрессии играет важную роль не только в отношении оценки больным своего состояния, но и его реакции на терапию. При нераспознанной и нелеченной депрессии даже объективно значительное улучшение моторной активности больной может субъективно игнорировать. Неверная оценка пациентом своего состояния приводит к нерациональному изменению терапии, увеличению доз или смене противопаркинсонических препаратов, повышению риска осложнений.
Стандартным подходом в лечении больного БП должен стать регулярный скрининг депрессии, вне зависимости от стадии заболевания, тяжести основных расстройств или иных обстоятельств. Наиболее удобным и простым методом является структурированный опросник Бека, заполняемый самим больным и не требующий специальной квалификации врача. Сумма баллов по опроснику более 16-18 должна указывать на вероятное сопутствующее депрессивное расстройство и служить поводом либо для направления пациента к специалисту, либо к назначению пробной терапии антидепрессантами. Учитывая, что тревожные расстройства часто сопутствуют БП и считаются ее предиктором (есть данные, что тревожные расстройства характерны для больных с преимущественными левосторонними моторными проявлениями), в качестве антидепрессанта первого выбора при БП для безопасной и хорошо переносимой терапии следует отдавать предпочтение флуоксетину или амитриптилину. Результаты адекватной терапии оценивают через 3-4 недели, обычно пациенты отмечают отчетливое улучшение состояния даже в случаях, когда депрессивное расстройство ими не распознавалось или не признавалось.
Менее известные нейропсихиатрические проявления БП – апатия и ангедония. Эти симптомы не имеют отношения к депрессии, являются самостоятельными. Их происхождение связывают с дегенерацией нейронов в областях, отвечающих за целенаправленное поведение в лобно-субкортикальных проекциях или связанных с передачей импульсов между покрышечными структурами и прилегающим ядром (n. accumbens). Последние образования относятся к дофаминергическим системам, однако апатия и ангедония в незначительной степени реагируют на дофаминергическую терапию, что предполагает более сложный медиаторный механизм, лежащий в основе этих симптомов. Интересным исключением является обнаруженный недавно антиангедонический эффект прамипексола (мирапекса), неэрголинового прямого агониста дофамина. Возможно, его такое действие связано с другим эффектом препарата – стимуляцией в ряде случаев склонности к азартным играм, непреодолимого влечения к игре. В этом смысле получаемое пациентом удовлетворение от игры, даже вызванное навязчивым влечением, можно отнести к антиангедонистическим проявлениям. Имеются также данные о том, что апатия, потеря энергии, сексуальная дисфункция и депрессия у больных БП, главным образом у мужчин, обусловлена снижением содержания тестостерона. В случае очевидного доминирования таких симптомов можно рассматривать возможность аддитивной, заместительной терапии небольшими дозами тестостерона.
Психотические расстройства прямо коррелируют с повышением смертности больных БП и необходимостью постоянного постороннего ухода. Уже на ранних стадиях болезни могут наблюдаться доброкачественные зрительные галлюцинации в виде очень живых, необычно ярких сновидений. Со временем зрительные галлюцинации становятся частыми эпизодами и днем, нарушают нормальное функционирование пациента. Вместе с тем зрительные галлюцинации больше связаны с дофаминергической терапией, их появление сигнализирует о переходе к фазе осложнений лечения и часто требует редукции текущей дозы. Следует помнить, что раннее появление галлюцинаций, особенно сопровождаемое быстрым снижением когнитивных функций, может подтверждать диагноз болезни с диффузными тельцами Леви, отличающейся от БП быстрым развитием психических исходов и отхождением моторного дефицита на второй план. Это имеет значение не только в терапевтическом, но и в прогностическом плане.
Более тяжелые расстройства психической функции – параноидные нарушения, делирий и другие психотические эпизодические дисфункции – развиваются чаще при возникновении деменции на поздних стадиях болезни Паркинсона, когда в патогенез вносит свой вклад и терапевтическая составляющая – длительная дофаминергическая стимуляция. Подобные выраженные нарушения сильно снижают повседневную активность больного, требуют постоянного ухода и наблюдения, часто становятся причиной госпитализации. Существует предположение, что психозы и галлюцинации могут быть вызваны прерывистым сном больных, обусловленным терапией дофаминергическими препаратами: вначале появляются живые, яркие сновидения, затем доброкачественные галлюцинации и далее – психозы.
Когнитивное снижение присуще БП, деменция поражает в среднем до 40% больных, хотя последние данные указывают, что, вероятно, почти 80% пациентов в конечной стадии заболевания будут дементными [2]. Клинически деменция при БП характеризуется прежде всего как синдром нарушений исполнительных функций, планирования действий, нарушений пространственно-зрительных способностей и лишь потом – как нарушение памяти. Хотя нейровизуализационные данные могут быть очень похожи на таковые при болезни Альцгеймера (уменьшение объема гиппокампа, атрофия), считается, что деменция при БП имеет самостоятельное происхождение и отличается от других ее разновидностей. Последние исследования показали возможность существования определенных подтипов деменции при БП (ассоциация апатии с депрессией, галлюцинаций с психозами и пр.), что в будущем может привести к дифференцированным подходам в лечении и ведении больных [2], но очевидной остается зависимость когнитивных расстройств от возраста больных, стадии заболевания и тяжести основного синдрома. Практически важным является скрининг когнитивных функций
(с помощью простой шкалы MMSE), что позволяет вовремя определить начальные нарушения и предупредить или корректировать значительное снижение качества жизни больных и ухаживающих за ними.
Вегетативная дисфункция
Так называемая дизавтономия, или прогрессирующая вегетативная недостаточность, проявляющаяся в нескольких сферах, является патогномоничной для мультисистемной атрофии, однако может встречаться с довольно высокой частотой (иногда с достаточной выраженностью) и при БП. Патофизиология таких нарушений, безусловно, сложна и предположительно объясняется дегенерацией как стволовых вегетативных центров и образований, так и периферических вегетативных структур (ганглиев, центров спинного мозга и т. п.).
Наиболее частым проявлением вегетативной дисфункции являются запоры, которые считаются устойчиво преморбидным проявлением и фактором риска последующего развития БП (трехкратное повышение риска у пациентов, страдающих привычными запорами, с латентным периодом развития болезни около 10 лет). Хотя обнаружены потери дофаминергических нейронов, как в стволе мозга, так и в кишечнике при запорах у больных БП, реакция на дофаминергическую терапию, как правило, слаба или негативна, что говорит о недофаминергических механизмах запоров. Интересно, что наиболее эффективным подходом к лечению является применение объемных слабительных, а не стимуляторов стеночной перистальтики. На поздних стадиях болезни запоры становятся огромной проблемой для больных, и многие ставят их на первое место по значимости в структуре болезни, отодвигая на второй план моторные проявления.
Второй по значимости признак вегетативной недостаточности при БП – кардиоваскулярные расстройства. Несмотря на то, что имеются все признаки симптоматической денервации сердца, наблюдаемые при специальных исследованиях, клинически проявления выглядят главным образом как ортостатическая гипотензия. Спектр субъективных ощущений больного широк – от эпизодического головокружения и дурноты до обмороков и падений. Принято делить подобные расстройства на симптомные (в основном обмороки и падения), когда тест на ортостатическую гипотензию часто может быть позитивным, и асимптомные, когда тест еще негативен, но жалобы носят не вполне определенный характер (как правило, отличаются эпизодичностью, пароксизмальностью и привязанностью к ортостатическим обстоятельствам). Практический подход в сомнительных ситуациях – это проведение простой ортостатической пробы: измерение АД в положении лежа после 15 минут отдыха и через 2 минуты после быстрого перевода пациента в вертикальное положение. Падение давления (систолического или диастолического) более чем на 20 мм рт. ст. позволяет диагностировать ортостатическую гипотензию, частота которой нарастает с развитием заболевания, с возрастом, но может быть и результатом дофаминергической терапии, одним из тяжелых и инвалидизирующих ее осложнений. Раннее проявление ортостатических нарушений говорит, скорее, о мультисистемной атрофии, чем о БП.
Сексуальная дисфункция включается в комплекс вегетативных нарушений при БП, хотя частично может быть обусловлена как снижением уровня тестостерона, так и поведенческими отклонениями, имеющими отношение к нарушениям в психической сфере пациентов. По крайней мере, наличие сексуальной дисфункции очень важно в оценке совокупности немоторных проявлений при БП, их распространенности и тяжести.
Особое место при болезни Паркинсона занимают расстройства обоняния. В последнее время им стали уделять особое внимание, обнаружив как высокую частоту клинических и субклинических нарушений у больных с идиопатической формой заболевания, так и практически отрицательную связь аносмии с другими нейродегенерациями. Это имеет важное диагностическое значение. Некоторые исследователи предлагают включать гипосмические нарушения в число патогномоничных признаков БП, подтверждающих диагноз. Очень часто гипосмия предшествует развитию моторных проявлений болезни, опережая их на 3-5 лет и более.
Диагностика немоторных проявлений сегодня недостаточно разработана. Кажущаяся простота определения перечисленных основных проявлений этой группы нарушений часто приводит к их недооценке. Наиболее практичный подход заключается в применении специальных опросников, позволяющих выявлять подобные нарушения в их совокупности, во взаимосвязи с общим качеством жизни у больных с БП. Некоторые из опросников будут приведены и проанализированы в следующих материалах. Важно, на наш взгляд, знать о их существовании и проводить первичную интерпретацию различных немоторных симптомов в структуре болезни Паркинсона, а не относить их к другим, предполагаемым сопутствующим заболеваниям у конкретного больного.
Мы не рассматривали в данной статье подробно методы терапии немоторных проявлений болезни Паркинсона и ведение таких больных в рамках общей стратегии лечения, поскольку медикаментозный и немедикаментозный подходы должны быть сбалансированы в зависимости от стадии болезни, клинического паттерна, возраста больного и текущего прогноза. Необходимо еще раз подчеркнуть, что немоторные симптомы не менее важны для общего качества жизни больных с паркинсонизмом, чем его моторные проявления, и требуют очень внимательного подхода и значительных усилий со стороны врача, медицинского персонала и ухаживающих за больным окружающих, в том числе родственников. Эти симптомы значительно расширяют наше представление о самом заболевании, демонстрируя его сложную природу, выходящую далеко за рамки устоявшихся представлений.
Литература
1. Chaudhuri K.R., Healy D.J., Schapira A.H.V. Non-motor symptoms of Parkinson's disease: diagnosis and management // Lancet Neurol. – 2006. – Vol. 5. – P. 235-245.
2. Aarsland D., Bronnick K., Ehrt U. et al. Neuropsychiatric symptoms in patients with Parkinson's disease and dementia: frequency, profile and associated care giver stress // J Neurol Neurosurg Psychiatr. – 2007. – Vol. 78. – P. 36-42.
Продолжение читайте в следующем номере.
Читайте также:


