Нервная эндокринная регуляция углеводного обмена
Поможем написать любую работу на аналогичную тему
Регуляция углеводного обмена осуществляется на всех его этапах нервной системой и гормонами. Помимо этого, активность ферментов отдельных путей метаболизма углеводов регулируется по принципу “обратной связи”, в основе которого лежит аллостерический механизм взаимодействия фермента с эффектором. К аллостерическим эффекторам можно отнести конечные продукты реакции, субстраты, некоторые метаболиты, адениловые мононуклеотиды. Важнейшую роль в выборе направленности углеводного обмена (синтез или распад углеводов) играет соотношение коферментов НАД+/НАДН∙Н+ и энергетический потенциал клетки.
Постоянство уровня глюкозы в крови – важнейшее условие поддержания нормальной жизнедеятельности организма. Нормогликемия является результатом слаженной работы нервной системы, гормонов и печени.
Печень – единственный орган, депонирующий глюкозу (в виде гликогена) для нужд всего организма. Благодаря активной фосфатазе глюкозо-6-фосфата гепатоциты способны образовывать свободную глюкозу, которая, в отличие от ее фосфорилированных форм, может проникать через мембрану клеток в общий круг кровообращения.
Выдающуюся роль среди гормонов играет инсулин. Он оказывает действие только на инсулинзависимые ткани, прежде всего, на мышечную и жировую. Мозг, лимфатическая ткань, эритроциты относятся к инсулиннезависимым. Поступление глюкозы в печеночные клетки и выход глюкозы в кровь из печени также являются независимыми от инсулина процессами.
Наиболее существенным действием инсулина на организм является снижение нормального или повышенного уровня глюкозы в крови – вплоть до развития гипогликемического шока при введении высоких доз инсулина. Уровень глюкозы в крови снижается в результате: 1) ускорения поступления глюкозы в клетки; 2)повышения использования глюкозы клетками.
Инсулин ускоряет поступление моносахаридов в инсулинзависимые ткани, особенно глюкозы (а также сахаров схожей конфигурации в положении С-1– С-3), но не фруктозы. Связывание инсулина со своим рецептором на плазматической мембране приводит к перемещению запасных белков-переносчиков глюкозы (ГЛУТ 4) из внутриклеточных депо и включению их в мембрану.
Инсулин активирует использование клетками глюкозы путем:
- активирования и индукции синтеза ключевых ферментов гликолиза (глюкокиназы, фосфофруктокиназы, пируваткиназы);
- увеличения включения глюкозы в пентозофосфатный путь (активирование дегидрогеназ глюкозо-6-фосфата и 6-фосфоглюконата);
- повышения синтеза гликогена за счет стимуляции образования глюкозо-6-фосфата и активирования гликогенсинтазы (одновременно инсулин ингибирует гликогенфосфорилазу);
- торможения активности ключевых ферментов глюконеогенеза (пируваткарбоксилазы, фосфоенолпируваткарбоксикиназы, дифосфатазы, глюкозо-6-фосфатазы) и репрессии их синтеза (уставлен факт репрессии гена фосфоенолпируваткарбоксикиназы).
Другие гормоны, как правило, способствуют увеличению содержания глюкозы в крови.
Глюкагон и адреналин приводят к росту гликемии путем активации гликогенолиза в печени (активирование гликогенфосфорилазы), однако в отличие от адреналина глюкагон не влияет на гликогенфосфорилазу мышц. Кроме того, глюкагон активирует глюконеогенез в печени, следствием чего также является увеличение концентрации глюкозы в крови.
Глюкокортикоиды способствуют повышению уровня глюкозы в крови за счет стимуляции глюконеогенеза (ускоряя катаболизм белков в мышечной и лимфоидной тканях, эти гормоны увеличивают содержание в крови аминокислот, которые, поступая в печень, становятся субстратами глюконеогенеза). Кроме того, глюкокортикоиды препятствуют утилизации глюкозы клетками организма.
Гормон роста вызывает увеличение гликемии опосредованно: стимулируя распад липидов, он приводит к увеличению уровня жирных кислот в крови и клетках, снижая тем самым потребность последних в глюкозе (жирные кислоты – ингибиторы использования глюкозы клетками).
Тироксин, особенно вырабатываемый в избыточных количествах при гиперфункции щитовидной железы, также способствует повышению уровня глюкозы в крови (за счет увеличения гликогенолиза).
При нормальном уровне глюкозы в крови почки полностью ее реабсорбируют и сахар в моче не определяется. Однако если гликемия превышает 9–10 ммоль/л (почечный порог), то появляется глюкозурия. При некоторых поражениях почек глюкоза может обнаруживаться в моче и при нормогликемии.
В норме содержание глюкозы в крови натощак обычно ниже 6 ммоль/л, уровень в пределах 6–8 ммоль/л должен рассматриваться как пограничное состояние, а равный или превышающий 8 ммоль/л может служить диагнозом сахарного диабета.
Проверка способности организма регулировать содержание глюкозы в крови (толерантность к глюкозе) используется для диагностики сахарного диабета при постановке перорального глюкозо-толерантного теста. Первая проба крови берется натощак после ночного голодания. Затем больному в течение 5 мин. дают выпить раствор глюкозы из расчета 1 г глюкозы на кг массы тела (1,5 г сахарозы) в 200 мл воды. После этого каждые 30 мин на протяжении 2 ч определяют содержание глюкозы в крови и полученные результаты используют для построения “сахарных кривых”. Некоторые варианты таких кривых в сравнении с данными, полученными у здорового человека, приводятся на рис.5.21. Гликемические кривые у детей имеют такой же характер, что и у взрослых, с тем лишь отличием, что повышение концентрации глюкозы в крови у детей после нагрузки меньшее.
Рис.5.21. Гликемические кривые при однократной нагрузке глюкозой в норме и при некоторых патологических состояниях
Таблица 5.3. Критерии ВОЗ, используемые при диагностике сахарного диабета и нарушения толерантности к глюкозе
Регуляция обмена углеводов
Энергетический гомеостаз обеспечивает энергетические потребности тканей с использованием различных субстратов. Т.к. углеводы являются основным источником энергии для многих тканей и единственным для анаэробных, регуляция углеводного обмена является важной составляющей энергетического гомеостаза организма.
Регуляция углеводного обмена осуществляется на 3 уровнях:
3. клеточный (метаболический).
1. Центральный уровень регуляции углеводного обмена
Центральный уровень регуляции осуществляется с участием нейроэндокринной системы и регулирует гомеостаз глюкозы в крови и интенсивность метаболизма углеводов в тканях. К основным гормонам, поддерживающим нормальный уровень глюкозы в крови 3,3-5,5 мМоль/л, относят инсулин и глюкагон. На уровень глюкозы влияют также гормоны адаптации – адреналин, глюкокортикоиды и другие гормоны: тиреоидные, СДГ, АКТГ и т.д.
2. Межорганный уровень регуляции углеводного обмена
Глюкозо-лактатный цикл (цикл Кори) Глюкозо-аланиновый цикл
Глюкозо-лактатный цикл не требует наличие кислорода, функционирует всегда, обеспечивает: 1) утилизацию лактата, образующегося в анаэробных условиях (скелетные мышцы, эритроциты), что предотвращает лактоацидоз; 2) синтез глюкозы (печень).
Глюкозо-аланиновый цикл функционирует в мышцах при голодании. При дефиците глюкозы, АТФ синтезируется за счет распад белков и катаболизма аминокислот в аэробных условиях, при этом глюкозо-аланиновый цикл обеспечивает: 1) удаление азота из мышц в нетоксичной форме; 2) синтез глюкозы (печень).
3. Клеточный (метаболический) уровень регуляции углеводного обмена
Метаболический уровень регуляции углеводного обмена осуществляется с участием метаболитов и поддерживает гомеостаз углеводов внутри клетки. Избыток субстратов стимулирует их использование, а продукты ингибируют свое образование. Например, избыток глюкозы стимулирует гликогенез, липогенез и синтез аминокислот, дефицит глюкозы - глюконеогенез. Дефицит АТФ стимулирует катаболизм глюкозы, а избыток – наоборот ингибирует.
IV. Педфак. Возрастные особенности ПФШ и ГНГ, значение.
ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
кафедра биохимии
Зав. каф. проф., д.м.н.
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический. 2 курс.
Гормоны поджелудочной железы
Поджелудочная железа выполняет в организме две важнейшие функции: экзокринную и эндокринную. Экзокринную функцию выполняет ацинарная часть поджелудочной железы, она синтезирует и секретирует панкреатический сок. Эндокринную функцию выполняют клетки островкового аппарата поджелудочной железы, которые секретируют пептидные гормоны, участвующие в регуляции многих процессов в организме. 1-2 млн. островков Лангерганса составляют 1-2% массы поджелудочной железы.
В островковой части поджелудочной железы выделяют 4 типа клеток, секретирующих разные гормоны: А- (или α-) клетки (25%) секретируют глюкагон, В- (или β-) клетки (70%) — инсулин, D- (или δ-) клетки ( + или Са 2+ в крови; 6. лекарства, производные сульфонилмочевины (глибенкламид).
Под влиянием соматостатина секреция инсулина понижается. β-клетки также находятся под влиянием автономной нервной системы. Парасимпатическая часть (холинергические окончания блуждающего нерва) стимулирует выделение инсулина. Симпатическая часть (адреналин через α2-адренорецепторы) подавляет выделение инсулина.
Секреция инсулина осуществляется с участием нескольких систем, в которых основная роль принадлежит Са 2+ и цАМФ.
Поступление Са 2+ в цитоплазму контролируется несколькими механизмами:
1). При повышении концентрации глюкозы в крови выше 6-9 ммоль/л, она при участии ГЛЮТ-1 и ГЛЮТ-2 поступает в β-клетки и фосфорилируется глюкокиназой. При этом концентрация глюкозо-6ф в клетке прямо пропорциональна концентрации глюкозы в крови. Глюкозо-6ф окисляется с образованием АТФ. АТФ образуется также при окислении аминокислот и жирных кислот. Чем больше в β-клетке глюкозы, аминокислот, жирных кислот тем больше из них образуется АТФ. АТФ ингибирует на мембране АТФ-зависимые калиевые каналы, калий накапливается в цитоплазме и вызывает деполяризацию клеточной мембраны, что стимулирует открытие потенциалзависимых Са 2+ -каналов и поступление Са 2+ в цитоплазму.
Гормональная регуляция углеводного обмена осуществляется за счет функционирования островковой ткани поджелудочной железы, которая продуцирует инсулин — гормон, вырабатываемый бета-клетками островков Лангерганса. Инсулин усиливает поступление глюкозы из крови в клетки печени и скелетной мускулатуры, что приводит к повышению образования и накоплению гликогена. Воздействуя на жировую ткань, инсулин стимулирует превращение глюкозы в жир, который может быть использован как источник энергии, т. е. способствует ее резервированию. Одновременно с этим тормозится процесс новообразования глюкозы (глю-конеогенез). В результате под действием инсулина в крови быстро снижается концентрация Сахаров. Физиологический антагонист инсулина глюкагон, вырабатываемый альфа-клетками островковой ткани, активирует гликогенолиз, в ходе которого разрушается гликоген, и свободная глюкоза поступает в кровь. Адреналин — гормон мозгового вещества надпочечника, как и глюкагон
активируя фосфорилазу, вызывает распад гликогена в печени, одновременно в мышечной ткани усиливается распад гликогена, в результате этого в крови поднимается концентрация глюкозы и молочной кислоты. Гормон аденогипофиза — адренокортикотропный гормон (АКТГ) влияет на углеводный обмен опосредованно, изменяя уровень секреции глюкокортикоидов — гормонов коркового вещества надпочечников. Глюкокортикоиды значительно усиливают глюко-неогенез: концентрация глюкозы в крови повышается за счет глю-конеогенеза — образования сахара из неуглеводов. В мышцах и некоторых других органах начинается распад белка, освобождающиеся аминокислоты после дезаминирования используются для образования глюкозы. Соматотропный гормон (СТГ), обеспечивая энергетические потребности процессов роста, уменьшает утилизацию глюкозы периферическими тканями и одновременно усиливает распад жира для обеспечения процессов глюконеогенеза. Гормоны щитовидной железы — тироксин и трийодтиронин в пределах физиологической нормы способствуют процессам всасывания некоторых Сахаров. Повышение их количества тормозит окислительное фосфо-рилирование углеводов: в крови резко повышается концентрация глюкозы. Чрезмерная продукция тиреоидных гормонов может быть следствием влияния тиреотропного гормона гипофиза, формирующего общее гипертиреоидное состояние.
Надлежащая концентрация сахара в крови автоматически регулируется. Все более или менее значимые отклонения содержания глюкозы в крови возбуждают механизмы, под воздействием которых уровень гликемии возвращается к свойственной данному организму норме. При гипогликемии — снижении уровня глюкозы ниже нижнего предела нормы — активируются нейроны гипотала-мической области. Прежде всего возбуждаются центры симпатико-адреналовой системы, в результате чего вырабатывается адреналин, а в печени и мышечной ткани происходит распад гликогена. Выделяющаяся в процессе гликогенолиза глюкоза поступает в кровь, а выделенная из мышц молочная кислота восполняет запасы печеночного гликогена. Аналогичным, глюкозомобилизующим действием обладают глюкагон, СТГ и глюкокортикоиды. Наиболее мощным фактором, противодействующим повышению уровня глюкозы в крови, служит инсулин, который выделяется при повышении концентрации глюкозы в крови либо под влиянием парасимпатического отдела вегетативной нервной системы, обеспечивающего контроль за островковой тканью поджелудочной железы.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Регуляция углеводного обмена
А. Регуляция углеводного обмена
У высших организмов обмен углеводов подвержен сложным механизмам регуляции, в которых участвуют гормоны, метаболиты и коферменты. Представленная здесь схема относится к печени , которая занимает в углеводном метаболизме центральное место (см. с. 302). Некоторые из представленных механизмов не действуют в других тканях.
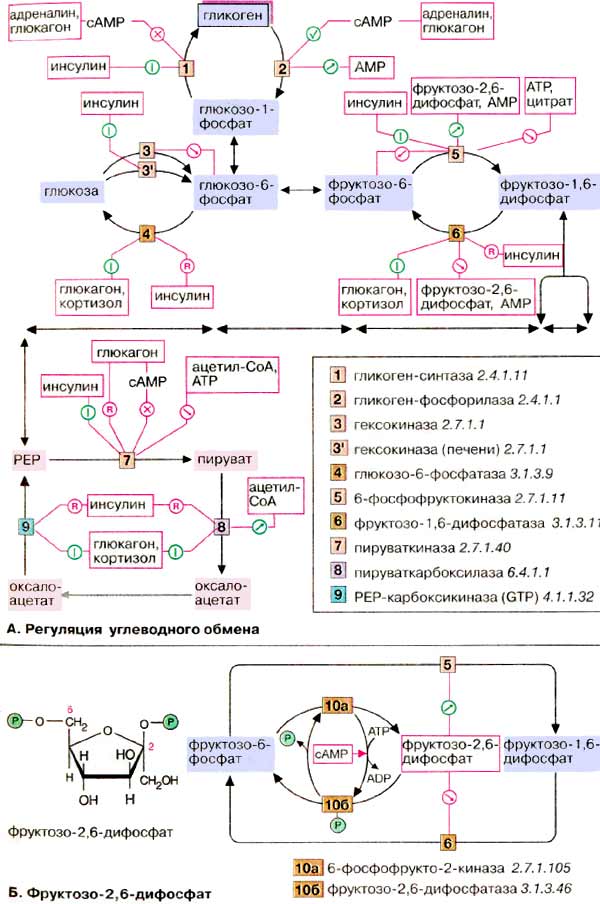
Одной из важнейших функций клеток печени является накопление избыточной глюкозы в виде гликогена и ее быстрое высвобождение по мере метаболической необходимости (буферная функция). После полной мобилизации запасов гликогена печень может поставлять глюкозу за счет синтеза de novo (глюконеогенез, см. сс. 156, 232). Кроме того, как и все ткани, она потребляет глюкозу путем гликолиза. Функции накопления (синтеза) глюкозы в виде гликогена и его распада должны быть взаимосогласованы. Таким образом, совершенно невозможно одновременное протекание гликолиза и глюконеогенеза, как и синтеза и деградации гликогена. Согласование процессов обеспечивается тем, что синтез (анаболизм) и распад (катаболизм) катализируются двумя различными ферментами и контролируются независимо. На схеме показаны только эти ключевые ферменты .
Гормоны. К гормонам, которые влияют на углеводный обмен, принадлежат пептиды инсулин и глюкагон , глюкокортикоид кортизол и катехоламин адреналин (см. сс. 362, 368). Инсулин индуцирует (см. с. 120) синтез de novo гликоген-синтазы [ 1 ], а также некоторых ферментов гликолиза [ 3, 5, 7 ]. Одновременно инсулин подавляет синтез ключевых ферментов глюконеогенеза (репрессия, [ 4, 6, 8, 9 ]). Глюкагон как антагонист инсулина действует в противоположном направлении: индуцирует ферменты глюконеогенеза [ 4, 6, 8, 9 ] и репрессирует пируваткиназу [ 7 ], ключевой фермент гликолиза. Другие аффекты глюкагона основаны на взаимопревращении ферментов и опосредованы вторичным мессенджером цАМФ (сАМР, см. с. 114). По этому механизму тормозится синтез гликогена [ 1 ] и активируется расщепление гликогена [ 2 ]. Подобным образом действует и адреналин. Торможение пируваткиназы [ 7 ] глюкагоном также обусловлено взаимопревращением ферментов.
Глюкокортикоиды, прежде всего кортизол (см. с. 362), индуцируют все ключевые ферменты глюконеогенеза [ 4, 6, 8, 9 ]. Одновременно они индуцируют ферменты деградации аминокислот и обеспечивают тем самым глюконеогенез исходными соединениями.
Метаболиты. Высокие концентрации АТФ (АТР) и цитрата тормозят гликолиз путем аллостерической регуляции фосфофруктокиназы. Кроме того, АТФ тормозит пируваткиназу. Ингибитором пируваткиназы является ацетил-КоА. Все эти метаболиты образуются при распаде глюкозы (торможение конечным продуктом). АМФ (AMP), сигнал дефицита АТФ, активирует расщепление гликогена и тормозит глюконеогенез.
Важную роль в обмене веществ в печени играет фруктозо-2,6-дифосфат . Это сигнальное вещество образуется в незначительных количествах из фруктозо-6-фосфата и выполняет чисто регуляторную функцию: стимулирует гликолиз путем активации фосфофруктокиназы и подавляет глюконеогенез с помощью торможения фруктозо-1,5-дифосфатазы.
Образование и распад фруктозо-2,6-дифосфата катализируются одним и тем же белком [ 10а и б ]. В нефосфорилированной форме этот белок вызывает образование фруктозо-2,6-дифосфата [ 10а ]. После фосфорилирования цАМФ-зависимой киназой он действует как фосфатаза [ 10б ] и катализирует превращение фруктозо-2,6-дифосфата в фруктозо-6-фосфат. В присутствии адреналина и глюкагона в клетках печени повышается уровень цАМФ (см. с. 122), т.е. оба гормона воздействуют как на гликолиз, так и на глюконеогенез. Суммарным результатом является быстрое повышение уровня глюкозы в крови.
Постоянство уровня глюкозы в крови – важнейшее условие поддержания нормальной жизнедеятельности организма. Нормогликемия является результатом слаженной работы нервной системы, гормонов и печени.
Печень – единственный орган, депонирующий глюкозу (в виде гликогена) для нужд всего организма. Благодаря активной фосфатазе глюкозо-6-фосфата гепатоциты способны образовывать свободную глюкозу, которая, в отличие от её фосфорилированных форм, может проникать через мембрану клеток в общий круг кровообращения.
Из гормонов выдающуюся роль играет инсулин. Инсулин оказывает свое действие только на инсулинзависимые ткани, прежде всего, на мышечную и жировую. Мозг, лимфатическая ткань, эритроциты относятся к инсулиннезависимым. В отличие от других органов, действие инсулина не связано с рецепторными механизмами его влияния на метаболизм гепатоцитов. Хотя глюкоза свободно проникает в печёночные клетки, но это возможно только при условии повышенной её концентрации в крови. При гипогликемии, напротив, печень отдаёт глюкозу в кровь (даже несмотря на высокий уровень инсулина в сыворотке).
Наиболее существенным действием инсулина на организм является снижение нормального или повышенного уровня глюкозы в крови – вплоть до развития гипогликемического шока при введении высоких доз инсулина. Уровень глюкозы в крови снижается в результате: 1. Ускорения поступления глюкозы в клетки. 2. Повышения использования глюкозы клетками.
1. Инсулин ускоряет поступление моносахаридов в инсулинзависимые ткани, особенно глюкозы (а также сахаров схожей конфигурации в положении С1-С3), но не фруктозы. Связывание инсулина со своим рецептором на плазматической мембране приводит к перемещению запасных белков-переносчиков глюкозы (глют 4) из внутриклеточных депо и включению их в мембрану.
2. Инсулин активирует использование клетками глюкозы путём:
· активирования и индукции синтеза ключевых ферментов гликолиза (глюкокиназы, фосфофруктокиназы, пируваткиназы).
· Увеличения включения глюкозы в пентозофосфатный путь (активирование дегидрогеназ глюкозо-6-фосфата и 6-фосфоглюконата).
· Повышения синтеза гликогена за счёт стимуляции образования глюкозо-6-фосфата и активирования гликогенсинтазы (одновременно инсулин ингибирует гликогенфосфорилазу).
· Торможения активности ключевых ферментов глюконеогенеза (пируваткарбоксилазы, фосфоенолПВКкарбоксикиназы, бифосфатазы, глюкозо-6-фосфатазы) и реп-рессии их синтеза (уставлен факт репрессии гена фосфоенолПВКкарбоксикиназы).
Другие гормоны, как правило, способствуют увеличению содержания глюкозы в крови.
Глюкагон и адреналин приводят к росту гликемии путём активации гликогенолиза в печени (активирование гликогенфосфорилазы), однако в отличие от адреналина глюкагон не влияет на гликогенфосфорилазу мышц. Кроме того, глюкагон активирует глюконеогенез в печени, следствием чего также является увеличение концентрации глюкозы в крови.
Глюкокортикоидыспособствуют повышению уровня глюкозы в крови за счёт стимуляции глюконеогенеза (ускоряя катаболизм белков в мышечной и лимфоидной тканях, эти гормоны увеличивают содержание в крови аминокислот, которые, поступая в печень, становятся субстратами глюконеогенеза). Кроме того, глюкокортикоиды препятствуют утилизации глюкозы клетками организма.
Гормон роставызывает увеличение гликемии опосредованно: стимулируя распад липидов, он приводит увеличению уровня жирных кислот в крови и клетках, снижая тем самым потребность последних в глюкозе (жирные кислоты – ингибиторы использования глюкозы клетками).
Тироксин,особенно вырабатываемый в избыточных количествах при гиперфункции щитовидной железы, также способствует повышению уровня глюкозы в крови (за счёт увеличения гликогенолиза).
При нормальном уровне глюкозыв крови почки полностью её реабсорбируют и сахар в моче не определяется. Однако если гликемия превышает 9-10 ммоль/л (почечный порог), то появляется глюкозурия. При некоторых поражениях почек глюкоза может обнаруживаться в моче и при нормогликемии.
В норме содержание глюкозы в крови натощак обычно ниже 6 ммоль/л, уровень в пределах 6-8 ммоль/л должен рассматриваться как пограничное состояние, а равный или превышающий 8 ммоль/л может служить диагнозом сахарного диабета.
Проверка способности организма регулировать содержание глюкозы в крови (толерантность к глюкозе) используется для диагностики сахарного диабета при постановке перорального глюкозо-толерантного теста:
Первая проба крови берётся натощак после ночного голодания. Затём больному в течение 5 мин. дают выпить раствор глюкозы (75г глюкозы, растворённой в 300 мл воды). После этого каждые 30 мин. на протяжении 2-х часов определяют содержание глюкозы в крови
Должность и ф.и.о. автора лекции
Дата
По биологической химии
для студентов_____2-го_____ курса ___лечебного___________________факультета
Тема:___Углеводы 4. Патология углеводного обмена
1.Сформировать представления о молекулярных механизмах основных нарушений углеводного обмена.
1.Биохимия человека:, Р.Марри, Д.Греннер, П.Мейес, В.Родуэлл.- М.книга ,2004.- т.1.с..
2.Основы биохимии:А.Уайт, Ф.Хендлер,Э.Смит, Р.Хилл, И.Леман.-М. книга,
1981,т. -.2,.с. 639- 641,
3.Наглядная биохимия: Кольман., Рем К.-Г-М.книга 2004г.
4.Биохимические основы . под. ред. член- корр. РАН Е.С. Северина. М.Медицина,2000.-с.179-205.
Регуляция углеводного обмена
Одной из важнейших функций углеводов является обеспечение всего организма энергией. Из всех представителей углеводов главное значение принадлежит глюкозе, которая является основным исходным продуктом почти всех превращений углеводов в организме. Ее содержание в крови в норме отличается удивительным постоянством, и по изменению уровня глюкозы судят о характере углеводного обмена в клинике. Поэтому важное значение представляет изучение регулятор-ных механизмов, ответственных за этот процесс.
Регуляция углеводного обмена осуществляется многими системами организма. Главное значение принадлежит центральной нервной системе. Внешние факторы (эмоциональные состояния: чувство страха, боязни, радости и др.) и внутренние раздражители регуляторных механизмов фиксируются в центральной нервной системе, которая немедленно на них реагирует. Классическим примером регуляции углеводного обмена является так называемый "сахарный укол" - раздражение дна IV мозгового желудочка, впервые произведенный К. Бернаром. Раздражение этого участка мозга немедленно приводит к увеличению уровня сахара в крови. В организме таким раздражителем является сниженный против нормы уровень сахара в крови (гипогликемия). В этом случае импульсы из нервной системы направляются в надпочечники и стимулируют выработку их мозговым слоем гормона адреналина. Последний активирует фермент фосфорилазу, который катализирует распад гликогена. В результате этого увеличивается количество глюкозы и соответственно повышается ее концентрация в крови до нормы, что приводит к снятию такого раздражителя.
Гормональная регуляция осуществляется рядом гормонов. Наибольшее значение имеют гормоны, перечисленные ниже.
Инсулин - гормон поджелудочной железы, обеспечивает снижение сахара в крови путем активации ферментов, ответственных за использование глюкозы клетками организма (рис. 53).
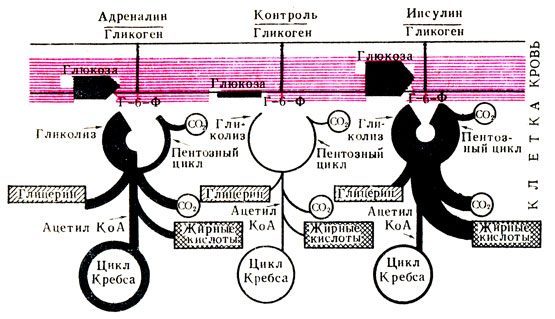
Рис. 53. Механизм действия инсулина и адреналина (объяснение в тексте)
На рис. 53 показан механизм действия инсулина. Глюкоза крови при участии инсулина поступает в клетки организма, в результате чего уровень ее в крови снижается (гипогликемический эффект). В клетках глюкоза превращается в глюкозо-6-фосфорный эфир (Г-6-Ф), который подвергается распаду или по пути гликолиза, или при аэробных условиях (пентозный цикл). При гликолизе из промежуточных продуктов может быть образован глицерин и небольшое количество ацетил-КоА, который поступает в цикл Кребса. В пентозном цикле глюкоза полностью окисляется с выделением большого количества СО2 (из одной молекулы глюкозы образуется 6 молекул СО2) и ряда промежуточных соединений, из которых могут быть синтезированы жирные кислоты.
Из других гормонов, участвующих в регуляции уровня сахара в крови, интерес представляет адреналин - гормон мозгового слоя надпочечников. Адреналин повышает уровень сахара путем активации распада гликогена (фермента фосфорилазы) до глюкозы и выброса ее в кровь. Помимо этого, адреналин умеренно активирует гликолиз. При этом происходит образование большего количества ацетил-КоА и, соответственно, большего количества энергии.
Глюкагон - гормон поджелудочной железы, действует аналогично адреналину.
Глюкокортикоиды - гормоны коры надпочечников, активируют процесс превращения жиров и белков в углеводы - глюконеогенез.
Адренокортикотропный гормон (АКТГ), вырабатываемый в гипофизе, стимулирует выработку глюкокортикоидов, т. е. опосредованно способствует повышению уровня сахара в крови путем активации глюконеогенеза. Аналогичным путем повышает сахар крови и соматотропный гормон.
Следовательно, только инсулин способствует снижению уровня сахара в крови, тогда как остальные гормоны вызывают его повышение. Эти кажущиеся на первый взгляд антагонистические отношения между инсулином, с одной стороны, и другими гормонами - с другой, являются по сути дела физиологически целесообразными в пределах всего организма. Так, адреналин и другие гормоны обеспечивают распад запасной формы углеводов - гликогена - до глюкозы и поступление ее в кровь. Инсулин же способствует использованию этой глюкозы клетками организма.
Из других регуляторных механизмов необходимо выделить печень, в клетках которой происходят процессы распада и синтеза глюкогена. Поэтому кровь, протекающая через печень, или насыщается глюкозой при ее недостатке в крови, или уровень сахара в крови снижается при ее избытке.
Таким образом, в регуляции углеводного обмена принимают участие различные факторы, совместное действие которых обеспечивает клетки необходимой энергией и питательными веществами, что характеризуется поддержанием на вполне определенном уровне сахара крови как показателя обмена углеводов всего организма.
доклад Регуляция углеводного обмена
1. Регуляция углеводного обмена.
2.Сахарный диабет тип I.
Диабет- это выделение какого- либо метаболита с мочой.
По распространенности занимает 3- место среди других заболеваний, после ССЗ и рака.
В мире насчитывается100 млн чел больных СД, и каждые 10-15 лет число больных СД удваивается. Наиболее подвержены риску к заболеванию СД малообеспеченные лица. проживающие в индустриально развитых странах.
Диабет 1 типа развивается в юношеском возрасте, иногда в детстве, и очень редко у взрослых. Протекает тяжелее, чем СД 2- типа. При отсутствии врачебного контроля- возможны острые осложнения. Встречается в 10 раз меньше , чем СД 2 типа.
Регуляция углеводного обмена осуществляется гормонами Инсулином и Глюкагоном. Эти же гормоны влияют на механизм депонирования и мобилизации гликогена, а также на метаболизм жиров.
Инсулин и Глюкагон это главные регуляторы изменений метаболизма при смене состояний пищеварения и голодания ( абсорбтивное и постабсорбтивное состояния). Пищеварение длится 10-15 час в сутки, а расход энергии все 24 час.( снижен ночью). Поэтому часть энергии депонируется, для того, чтобы использоваться в постабсорбтивный период. Печень, жировая ткань и мышцы- главные органы, при этих изменениях. При 3х разовом питании, смена режимов происходит 3 раза в сутки. Но эта смена выражена нестойко ,т.к. в течение дня промежутки между приемами пищи небольшие (5-6 ч) и постабсорбтивный период едва- едва успевает начаться, как наступает время очередного приема пищи. Типичное постабсорбтив. состояние – это утро перед завтраком, после 10 часового перерыва в еде. Немецкий ученый- Эммануил Кант считал разумным есть 1 раз/ сутки. За сутки запас гликогена в печени заканчивается и единственным источником остается глюкоза, синтезируемая в ГНГ. В этот период глюкоза потребляется. Нервными клетками, а другие клетки получают Энергию за счет окисления ЖК., и кетовых тел, синтезируемых в печени.. Эта модель считается как постабсорбтивная или рассматривается как кратковременное голодание.
Существуют два основных механизма переноса Гл в клетки- : активный транспорт, зависящий от
Градиента конц ионов Nа+, и облнегченная диффузия. Соответственно есть два типа рецепторов Дл Гл. Рецепторы, Зависимые от конц. Nа есть только в почках и кишечнике, они обеспечивают реабсорюцию Гл из почечных канальцев и всасывание ее из просвета кишечника против градиента конц. Рецепторы облегченной диффузии – есть во всех тканях.
В тканях человека есть 5 разных Глют.
ГЛЮТ 1- в плаценте, мозге, почках, толстой кишке, в бета Кл-ках островков Лангенгарса, меньше в жировой ткани и мышцах .
ГЛЮТ 2 преимущественно в печени, энтероцитах , в проксимальных тубулярных Кл-х почек, в бета Кл-х Лангенгарса.
ГЛЮТ 3 во многих тканях включая мозг, плаценту, почки.
ГЛЮТ 4 – единственный переносчик, регулируемый инсулином, сод-ся в мыщцая ( скелетных и сердечной) и жировой ( инсулинзав.ткани)
ГЛЮТ 5 – главный переносчик гл в базальном состоянии т.е. в отсутствии стимуляции Инсулина.
Основные энергоносители- это ГЛ и ЖК. Регуляцию метболизма Углеводов ИНС и Глюкогоном нельзя рассматривать по отдельности В крови постоянно присутствуют оба гормона, но их соотношение их меняется. Оба действуют на одни и те же мишени. Гликоген через путь RAS однгвременно активирует гликогенсин-зу и ингибирует гликогенфосфорилазу, глюкагон через цАМФ зависимые протеинкиназы ингибирует гликогенсинтазу и активирует гликогенфосфорилазу.. ИНс подавляет не базальную скоростьГНГ ,а только скорость стимулированную глюкагоном.. Кроме того ИНс снижает секрецию и самого глюкагона.
ИНс образуется из препроинс в результате посттрансляционной модификации. Недавно было обнаружено, что С- пептид в физол. Конц. Стимулирует потребление гл. клетккми здорового человека и б-х СД втакой степени как и Инс.
Глюкоза- регулирует экспрессию гена ИНС , а также др. белков, участвующих в обмене основных энергоносителей. В печени, под.Ж. и жировых Кл. при потреблении углеводов, происходит транскрипция целого ряда генов, связанных с метаболизмом углеводов.
Инс участвует в регуляции таких клеточных процессов как метаболизм, трансмембранный перенос ионов, АмК, , Гл, синтез и распад белков, ИНС влияет на ядерные процессы- репликацию и транскрипцию, участвует в регуляции клеточной пролиферации, и дифференцировке, а также трансформации клеток.
Гены, индуцируемы глюкозой и инсулином
| Продукт гена | Регулятор | Клетки |
| Глюкокиназа печени Пируваткиназа ГлицеральдегидфосфатДГ-за АТФ-цитрат-лиаза Ацетил-КоА карбоксилаза Пальмитилсинтетаза Глю-2 Инсулин | Инсулин Глюкоза Инсулин |
Действие Гл-зы может быть прямым, когда сама Г или ее метаболиты непосредственно взаимодействуют с аппаратом регуляции гена, или вторичным, обусловленным с влиянием Гл на секрецию Гормонов ( Глюкагона и ИНС).
При стимуляции Глюкозой Инсулин быстро освобождается из секреторных гранул, а количество инсулиновой мРНК в клетке возрастает как результат активации транскрипции и стабилизации мРНК. Активация требует образования метаболитов глюкозы на стадии гликолиза. Синтез и секреция ИНС прочно не связаны между собой. Например при отсутствии ионов Са++ в среде, Гл-за не будет стимулировать секреции ИНС, хотя синтез гормона продолжается.
ГЛ. АмК( особенно АРГ и ЛИЗ), кетоновые тела и ЖК в физиолог. концентрациях стимулируют секрецию ИНС. ЛАКТАТ. ПТРУВАТ и ГЛИЦЕРИН такого влияния не оказывают.Но главным регулятором секреции остается ИНС. На рис. показано изменение конц. ИНС в крови человека после приема пищи.
Время полураспада ИНС в крови составляет 3-10 мин, а С-пептида-около 30 мин. Кровь при однократном прохождении через печень теряет около 60% ИНС. В почках задерживается до 40% ИНС, содержащегося в протекающей через почки крови, причем в клубочках он фильтруется , а затем как и др. белки ( Альбумин, Нв) реабсорбируется и разрушается в клетках проксимальных канальцев нефрона.
Есть предположение, что секреция ИНС зависит не только от Гликолиза, но и от митохондр. процессов.. Существенное значение имеют анаплеротические реакции ( восполняющие, компенсирующие): пируват- a ЩУК, глутамат----- a альфа-кето ГЛУ. Эти реакции увеличивают количество компонентов цитратного цикла, а значит и его мощность. Секреция ИНС усиливается под влиянием некоторых АмК, .ЖК, кетоновых тел. Значит количество секретируемого ИНС прямо зависит от энергетической ценности пищи. Окисление основных энергоносителей в ЦТК быстро приводит к изменению соотношений АТФ/АДФ и NADH/NAD+ в клетке. Изменение концентрации этих веществ в свою очередь приводит к появлению вторичных вестников ( ионов Са++. цАМФ, ДАГл, ИФ3)., которые включаются в процесс экзоцитоза инсулиновых гранул.
В жировых клетках активация ИФ3-киназы инсулином приводит к ингибированию липолиза. При стимуляции ИНС конц. цАМФ в адипоцитах снижается , но активируется фосфодиэстераза цАМФ. Инсулин активирует сигнальный путь RAS.
Белки Ras входят в суперсемейство малых GTF- связывающих белков Это небольшие белки( 21000 масса и до 190 Амк ), содержащие на С-концах гидрофобные фрагменты фарнезила или геранила. За счет такого гидрофобного конца белки Ras (р21) цепляются к внутренней поверхности плазматической мембраны. Эти белки ключаются в разнообразные клеточные процессы, включая везикулярный транспорт, функции шаперонов, пролиферацию.
Инсулинзависимый сахарный диабет- аутоиммунное заболевание
При этом типе Д происходит разрушение бета- клеток в рез-те аутоиммунных реакций.
Нарушение синтеза гликогена и жиров при дефиците Инсулина.
Для всех форм СД характерна сниженная толерантность к Гл,т.е. гиперглюкоземия после приема пищи или даже натощак.
Причины гиперглюкоземии:
- Потребление глюкозы мыщцами и жировой тканью ограничено,т.к. при отсутствии Инс на - поверхности миоцитов и адипоцитов нет ГЛЮ-4.
- в печени Гл не используется для запасания в форме гликогена ине используется для синтеза жиров. Ферменты гликолиза и ПВК-ДГ находятся в неактивной форме, заторможен переход Гл в ацетил-КоА, необходимый для синтеза ЖК.
- Активирован ГНГ за счет глюкагона и возможен синтез за счет АмК и глицерина.
Другими характерным признаком СД является повышенная концентрация в крови ЛПОНП, СЖК и главное кетоновых тел. Повышенное содержание ЖК в крови ведет к поглощению их печенью, где из них синтезируются ТГ ( в адипоцитах) , который далее в составе ЛПОНП секретируются в кровь. Другая часть ЖК вступает на путь бета- окисления в митохондриях печени, образуется СН3-СО-SКоА, из которого даоее синтезируются кетоновые тела.
Коматозные состояния ( острые осложнения ) при СД как результат нарушения обмена глюкозы и жиров
При СД возможны три основных коматозных состояния: кетоацидотическая кома с абсолютной ИНС недостаточностью; гиперосмолярная кома с умеренной недостаточностьюИНС; лактатацидотическая кома с выраженной гипоксией, сепсисом, СС шоком . При инсулинотерапии может быть гипогликемическая кома, связанная с передозировкой ИНС.
Первые три состоянии возможны не только при СД, но и при действии многих др. факторов ( токсических, инфекционных).
Три основные формы коматозных состояний никогда не встречаются в отдельности. Обычно проявляется какая-то из низ, обычно гиперосмолярный синдром. В период комы С-пептид и иммунореактивный ИНС в крови не определяются, гипергликемия отмечается всегда (20-30 ммоль/л, иногда и более) Ацидоз при диабетической коме- это накопление органических кислот: кетоновых тел, лактата, пирувата, конц-я кетоновых тел- 2ммоль/л, что в 200 раз превышает норму. Она повышается как следствие повышенного синтеза кетоновых.тел в печени, но и является результатом олигурии и анурии, которые часто бывают при коме. рН крови снижается до 7.0 и ниже ( при норме 7.4)
Развивается дегидратация организма: дефицит воды может быть до 10% л от общей массы тела. Количество циркулирующей жидкости уменьшается на 25-30%, в результате чего снижается АД.
Отмечается кислородное и энергетическое голодание миокарда, уменьшение объема крови, что ведет к ССН. Возможны повышенная свертываемость крови, ИМ. Инфаркты паренхиматозных органов, Инсульт, Тромбозы.
Диабетическая кома развивается медленно, несколько дней, иногда нес. часов. Появляются тошнота, рвота, черты заостряются, глаза западают, сознание выключается, рефлексы отсутствуют, отмечается атония мышц. Запах ацетона.
Первое проявление болезни в 15-30% случаев сопровождается кетоацидозом и комой. Смертность от диб. комы остается высокой 1-30% Основной причиной смерти больных СД в настоящее время являются поздние осложнения.
Главная причина осложнений—гликозилирование белков.
Поздние осложнения СД связаны прежде всего с повреждением кровеносных сосудов ( диабетические ангиопатии). Основной механизм- это гликозилирование белков- неферментатив ная реакция Гл по группе –СОН аминокислотами –ЛИЗ, АРГ, . Вначале образуется альмидин нестабильный, переходящий в кетоамин (фруктозамин). Функции белка могут быть нарушены в результате изменения заряда белковой молекулы,ее конформации, блокады активного .центра. Гликозилирование-это медленная реакция в крови у здоровых людей. Но при СД она ускоряется. Например у больных диабетом в состоянии гипергликемии. Содержание Нb А1с в течение недели увеличивается в 2-3 раза. Степень гликозилирования разных белков неодинакова., она зависит от скорости обновления данного белка. В медленно обменивающихся белках накапливается больше модифицированных аминогрупп. Образуются разнообразные поздние продукты гликозилирования (ППГ). , коричневого цвета, некоторые обладают высокой реакционной активностью и способны дополнительно повреждать белки, образовывать поперечные сшивки между белками. К таким белкам относят белки соединительнотканных образований, межклеточный матрикс, базальные мембраны. ППГ- белки гидролизуются макрофагами или межклеточными протеолитич. системами с образованием ППГ- пептидов. Концентрация их в крови резко возрастает при почечной недостаточности, разного происхождения. В том числе и при диабетической нефропатии.. ППГ-пептиды фильтруются в почках, реабсобируются в проксимальных канальцах и катаболизируются лизосомами этих клеток.
ППГ проявляют многообразную биол. активность : повышают проницаемость эндотел клеток, соединяются с рецепторами макрофагов, эндотелиальных и мезангиальных клеток, активируют макрофаги к секреции цитокинов, подавляют образование NO и ингибируют расширение сосудов, усиливая окисление ЛПНП.
Диагностика и лечение СД.
Концентрация ГЛ больше 7. 2 ммоль/л указывает на СД. И нет необходимости проводить тест толерантности к глюкозе.
Наличие гликозилированного Нb. Обычно уровень НвА1с, -5% от всего содержания Нв. При СД его концентрация увеличивается в 2-3 раза.
Инс и С-пептид секретируются бета- клетками в эквимолярных количествах. В печени задерживается около 60% ИНс, поступающего с кровью воротной вены из поджелуд. железы. Поэтому отношение С-петид/ Инс в воротной вене и периф. кровообращении при н.ус. равно примерно—3/1. С-пептид удаляется обычно через почки его суточная секреция-45 мкг и пропорц. суточной секреции ИНС.
Альбуминурия.- ранний признак СД. В норме с мочой-выводится в среднем 8мг А. При выделении 30-300мг, микроальбуминурия. Причем через 10 лет после постановки диагноза увеличивается на 15-40% в год.
Перспективы лечения:
Трансплантация поджел. железы неудачна, т.к. идет отторжение, ( возможно применении иммунодепрессантов).но есть перспективы..( когда трансплантант заключен в полупроницаемую мембрану, пропускающую малые молекулы-- ИНС).
Трансплантация генетически реконструированных клеток
Создание клеток не вызывающих иммунного ответа, но способных секретировать ИНС пропорц. конц. ГЛ. в крови. ( метод генной инженерии).Исходным материалом являются –клетки самого пациента.- это позволяет снять проблему отторжения трансплантанта. Но при этом клетка, пригодная для трансплантации должна иметь ряд свойств:
-
содержать глюкозоизмерительный аппарат- ГЛЮТ-2 и глюкокиназу:
экспрессия высокоаффинных гексокиназ должна быть небольшой;
иметь эффетивный механизм экспрессии проинсулина и образования ИНС
иметь механизм регуляции секреции ИНС в ответ на изменения конц. ГЛ.
Предсказание и предупреждение СД
ИЗСД рассматривается как многофакторное заболевание, обусловленное наследственной предрасположенностью и влиянием среды. У человека восприимчивость к ИЗСД в большой степени зависит от Главного Комплекса Гистосовместимости (ГКГ). И особенно от полиморфизма HLA- генов, кодирующих белки класса 11 ( второго) ( гены DP, PQ, DR в коротком плече хромосомы 6.) Гены HLA являются наиболее полиморфной генетической системой популяции человека. С нарушением функции этой системы связаны многие аутоиммунные заболевания человека, в том числе и ИЗСД.
Область генов ГКГ класса 11
Группы генов DP DQ DR
ДНК -// --------------------//-------- --------------------// ---------------
Гены В2 А2 В1 А1 В2 А2 В3 В1 А1 В* А
Число аллелей 32 8 35 19 1
А - гены альфа цепей, В-- гены – бета цепей . Подчеркнутые- это действующие гены, остальные- псевдогены ( не экспрессируются).
В отличие от генов групп DP и DQ , каждый их которых представлен одним локусом в группе DR содержится 9 локусов, из которых 5- псевдо. ( не эксп). Действующие- 1.3.4 и 5 кодируют каждый особую бета-цепь. Метод полимеразной р-ции позволяет быстро и точно определять наличие того или иного аллеля в геноме и проводить массовые исследования распределения аллелей среди популяций индивидов. У б-х ИЗСД встречаемость аллелей ГКГ класса 11 существенно отличается от встречаемости тех же аллелей у взрослых людей. Эндокринологический центр РАМН провел исследования по распространению аллелей локусов DR и DQ у больных ИЗСД и здоровых людей 3 этнических групп ( европеидной) , монголдоидной ( буряты) и евро-монголоидной ( узбеки). Обнаружено, что заболеваемость ИЗСД русских и узбеков составляет от 1.5—5 на 10000, а у бурят примерно в 10 раз ниже.
Найдены генотипы предрасположенности к СД.
4. Причины фруктоземии и галактоземии
Фруктоза образуется в кишечнике при гидролизе сахарозы сахаразой; кроме того, в состав фруктов и мёда входит свободная фруктоза, которая легко всасывается. Поступая с током крови в различные органы, фруктоза подвергается следующим превращениям:
1. Фосфорилируется гексокиназой с образованием фруктозо-6-фосфата, который изомеризуется в глюкозо-6-фосфат – центральный метаболит обмена глюкозы. У человека фруктоза в свободном, т.е. нефосфорилированном виде, находится только в семенной жидкости.
гексокиназа АТФ
фруктоза фруктозо-6-фосфат глюкозо-6-фосфат
2. В печени фосфорилируется фруктокиназой с образованием фруктозо-1-фосфата, который может либо ещё раз фосфорилироваться (при этом образуется фруктозо-1,6-дифосфат), либо расщепляться альдолазой В на две триозы.
При врождённом недостатке фруктокиназы нарушается образование фруктозо-1-фосфата. В связи с блоком этого фермента возможно протекание только гексокиназной реакции, которая приводит к образованию фруктозо-6-фосфата. Однако гексокина ингибируется глюкозой, поэтому фруктоза накапливается в крови и выделяется с мочой (почечный порог для фруктозы низок) – эссенциальная фруктозурия.
При недостаточности альдолазы В (фруктозо-1-фосфат-альдолазы) в тканях накапливается фруктозо-1-фосфат, являющийся ингибитором альдолазы А . Дефект альдолаз приводит к нарушениям реакций гликолиза и глюконеогенеза (глицерин может образовываться при распаде липидов).
фосфофрукто-
и т.д.
* Примечание. Уникальность работы указана на дату публикации, текущее значение может отличаться от указанного.
Читайте также:
- Природные резервуары возбудителей клещевого энцефалита
- При поражение лицевого нерва опущение века
- Воспаление нерва боли в ушах и зубах
- Прививка от клещевого энцефалита что нельзя после прививки от
- Защемление нерва при грыже уколы
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

