Нервно гуморальная регуляция гемостаза
Свертываемость крови изменяется под влиянием нервной системы. Свертывание ускоряется при болевых раздражениях, это препятствует кровопотере. При раздражении верхнего шейного симпатического узла время свертывания крови укорачивается, а при удалении его – удлиняется.
Свертывание крови может изменяться условнорефлекторно. Известно, что адреналин, выделение которого из надпочечников стимулируется нервной системой и увеличивается при болевых раздражениях и эмоциональных состояниях, повышает свертывание крови. Одновременно с этим адреналин суживает артерии и артериолы и тем способствует также уменьшению кровотечения при ранении кровеносных сосудов.
Болезни системы гемостаза – гемостазиопатии, которые можно разделить на 3 группы:
1) геморрагические;
2) тромбофилические;
3) смешанного характера (тромбогеморрагические).
К геморрагическим гемостазиопатиям относятся заболевания, связанные с патологией тромбоцитов, патологией сосудистой стенки, дефектом плазменных факторов.
Заболевания, связанные с патологией тромбоцитов:
а) Тромбоцитопении – снижение количества тромбоцитов. Могут быть врожденными и приобретенными. Снижение числа тромбоцитов наступает при нарушениях функций клеток – предшественников тромбоцитов, обусловленных генетическими дефектами, нарушением функций некоторых паренхиматозных органов или дефектами в питании. Примеры заболеваний: тромбоцитопеническая пурпура, гетероиммунные тромбоцитопении.
б) Тромбоцитемии – повышение числа тромбоцитов, что способствует гиперкоагуляции.
в) Тромбоцитопатии – качественные дефекты тромбоцитов. При этом нарушается форма ромбоцитов. Примеры тромбоцитопатий – тромбастения Гланцмана, аномалия Мея-Хеглина (следствие измененного созревания мегакариоцитов, тромбоцитов и нейтрофилов, а также аномалий этих клеток).
Заболевания, связанные с нарушением сосудистой стенки:
а) Геморрагические вазопатии – нарушения гемостаза, связанные с изменениями сосудистой стенки. Например, геморрагический васкулит, образуются мелкие кровоточащие сосудистые образования, носовые кровотечения, мелкоточечная сыпь, желудочно-кишечные кровотечения, кровоподтеки и др.
б) Геморрагические диатезы – группа заболеваний, характеризующихся повышенной кровоточивостью – появлением кровоизлияний на коже, в полости суставов, кровотечений из носа, дёсен, матки, почек, длительных кровотечений при небольших порезах, после удаления зубов и т.д.
Кровоизлияния и кровотечения возникают в результате нарушения процессов свертывания крови и проницаемости сосудистой стенки. Они могут быть наследственными и проявляются в детском возрасте или приобретенными, которые обусловлены тромбогеморрагическим синдромом, передозировкой антикоагулянтов или активаторов фибринолиза.
В зависимости от места нарушения процессов гемостаза:
а) Выделяют нарушения свертывания крови и фибринолиза – коагулопатии. Они могут быть наследственными или приобретенными. Наиболее распространенными заболеваниями этого типа являются гемофилии, обусловленные дефектом структуры фактора VIII (гемофилия А) или фактора IХ (гемофилия В).
2-я группа гемостазиопатий – тромбофилические гемостазиопатии, к ним относят тромбозы и эмболии.
Тромбозы–прижизненное образование тромбов в просвете сосуда, нарушающие гемодинамику и метаболизм тканей. Возникновению способствуют атеросклероз, ишемическая болезнь сердца, гипертоническая болезнь, ревматизм и другие.
Эмболии – патологическое состояние, при котором просвет сосуда полностью или частично закрывается каким-то телом – эмболом, образовавшимся вдали от места закупорки. Чаще эмболом служит тромб или кусочек тромба. Иногда пузырек газа, капля жира, твердое тело (пуля), скопление опухолевых клеток.
В основе тромбогенеза – нарушение первичного и вторичного гемостаза. Непосредственными факторами тромбогенеза являются поврежденная или измененная сосудистая стенки, активация тромбоцитов и системы свертывания крови.
3-я группа гемостазиопатий: тромбогеморрагические гемостазиопатии, к ним относят заболевания приобретенного характера.
Сюда относят синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) – он представляет собой общепатологический процесс, вызванный проникновением в кровоток активаторов свертывания крови т агрегации тромбоцитов. Это ведет к тромбинемии, активации и истощению свертывающего, фибринолитического потенциалов, к развитию геморрагий, гипоксии, ацидоза, дистрофии и дисфункции органов, к интоксикации продуктами распада белков и других соединений. Течение процесса может быть острым или затяжным, рецидивирующим, хроническим.
Хронический ДВС-синдром часто осложняет злокачественные заболевания, хронический сепсис, хроническую сердечно-сосудистую и легочную недостаточность, лейкозы.
Острый ДВС-синдром может развиться при тяжелых инфекционно-септических заболеваниях, всех видах шока, хирургических вмешательствах, внутрисосудистом гемолизе, массивных кровопотерях, ожогах и др.
Фаза гиперкоагуляции характеризуется повышенной свертываемостью крови и агрегацией тромбоцитов, угнетается фибринолитическая активность крови, появляются растворимые комплексы мономеров фибрина и изменяются другие тесты, характеризующие гиперкоагуляцию.
Фаза гипокоагуляции характеризуется признаками потребления факторов свертывания крови и тромбоцитов (падает уровень фибриногена, снижается количество тромбоцитов, уменьшается протромбин, удлиняется время свертывания крови и другие тесты, характеризующие гипокоагуляцию).
Осуществляется на молекулярном, клеточном, органном уровнях.
Эта система функционирует по принципу надежности: избыточность элементов управления и протекающего процесса, дублирование и взаимозаменяемость элементов с совершенным и быстром возвратом к состоянию относительного постоянства, динамичность взаимодействия различных звеньев системы.
Например, дублирование реализуется существованием альтернативных (дополнительных) механизмов свертывания, какими являются макрофагально– моноцитарный механизм. Макрофаги, моноциты в норме обладают слабой прогоагулянтной и фибринолитическолй активностью, фагоцитируют активные факторы свертывания.
Избыточность элементов, участвующих в процессе проявляется высокой концентрацией факторов свертывания (табл. 5.1).
М о л е к у л я р н ы й уровень регуляции - обеспечивает поддержание гомеостатического баланса отдельных факторов свертывающей, фибринолитической и антисвертывающей систем.
К л е т о ч н ы й уровень регуляция синтетической активности клеток, продуцирующих факторы свертывания, фибринолиза. Осуществляется по типу обратной связи или афферентации.
О р г а н н ы й уровень обеспечивает оптимальные условия функционирования системы гемостаза в различных участках сосудистого русла, синтез и разрушение основных компонентов системы. Установлено, что протекающая и оттекающая от тех или иных органов кровь обладает различной свертывающей и фибринолитической активностью. Особенно важно это для парных органов, т.е. существует асимметричность показателей свертывающей и фибринолитической систем справа и слева, их неодинаковая активность в зависимости от места получения крови. Отсюда вопрос об идентичности коагулограммы, определенной в крови из правой и левой локтевых вен, или из вен другой локализации. Существуют региональные различия систем гемостаза.
Таким образом, органы, синтезирующие факторы свертывания являются эфферентными факторами регуляции свертывающей системы.
Нейро-гуморальная регуляция - обеспечивает целостность реакции свертывающей системы.
Роль коры головного мозга - возможна выработка условного рефлекса на некоторые раздражители, результат гипо– или гиперкоагуляция.
Симпатическая нервная система - усиление её тонуса сопровождается повышением адгезии и агрегации тромбоцитов, ускорением свертывания крови, активацией фиблинолиза. Такое явление наблюдается при гиперсекреции катехоламинов (стресс), острой кровопотери, острой гипоксии, боли, тяжелой физической нагрузке.
П а р а с и м п а т и ч е с к а я н е р в н а я с и т е м а (ПСН) - усиление её тонуса также вызывает ускорение свертывания крови и стимуляцию фибринолиза, т.к. она стимулирует выброс тромбопластина и активаторов плазминогена из эндотелия сосудов и сердца.
После гиперкоагуляции, вызванной стимуляцией СНС, ПСН может наступить гипокоагуляция.
Иммулогические механизмы регуляции - неактивные факторы свертывания являются иммулогически инертными, активированные - способны вызывать образование антител с последующей их реакцией с антигенами (Кузник). Например, тималин - нормализует не только показатели иммунитета, но нарушения в системе гемостаза.
Система гемостаза находится в функциональном взаимодействии с ферментными системами в функциональном взаимодействии с ферментными системами крови, в частности с фибринолитической, кининовой и системой комплемента (рис. 5.12).
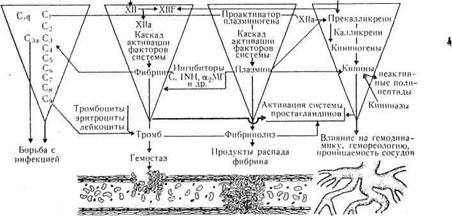
Важная роль в регуляции полисистемы принадлежит ингибиторам α2–макроглобулин α1-антитрипсин, антитромбин III, гепарин). Включение сторожевых систем (гемокоагуляции, фибринолиза, кининогенеза и комплемента), их взаимодействие в процессе функционирования обеспечивают защиту организма от кровопотери, предупреждают распространение тромба по сосудистой системе, оказывают влияние на сохранение крови в жидком состоянии, гемореологию, гемодинамику и проницаемость стенки сосудов.
Нарушения системы гемостаза имеет место при изменении любой её составляющей: изменение сосудистой стенки (атеросклероз и т.д.), уменьшении числа тромбоцитов (б-нь Верльгофа), сыворочных факторов свертывания (гемофилия А, б-нь Виллбранта), нарушения фибринологической (снижения фибринологической активности крови, повышения уровня ингибиторов фибринолиза).
Система гемостаза изменяется при действии различных факторов (ионизирующее и неионизирующее излучения, изменения парциального давления О2 и т.д.) - см. соответствующую литературу.
Свертывание крови, контактирующей со стеклом, травмированной поверхностью или кожей, осуществляется за 5-10 минут. Основное время в этом процессе уходит на образование протромбиназы, тогда как переход протромбина в тромбин и фибриногена в фибрин осуществляется довольно быстро. В естественных условиях время свертывания крови может уменьшаться (развивается гиперкоагуляция) или удлиняться (возникает гипокоагуляция).
Между тем, образование тромбоцитарной пробки и остановка кровотечения из мелких сосудов осуществляется в течение 2-4 минут.
Существуют четыре уровня регуляции системы гемостаза:
Необходимо также помнить, что существует генетический контроль над продукцией факторов, обеспечивающих образование и растворение кровяного сгустка.
3. Органный уровень регуляции – обеспечивает оптимальные условия функционирования системы гемостаза в различных участках сосудистого русла. Благодаря этому уровню проявляется мозаичность сосудисто-тромбоцитарного гемостаза, свертывания крови и фибринолиза.
4. Нервно-гуморальная регуляцияконтролирует состояние системы гемостаза от молекулярного до органного уровня, обеспечивая целостность реакции на уровне организма, главным образом, через симпатический и парасимпатический отделы вегетативной нервной системы, а также гормоны и различные биологически активные соединения.
Установлено, что при острой кровопотере, гипоксии, интенсивной мышечной работе, болевом раздражении, стрессе свертывание крови значительно ускоряется, что может привести к появлению фибрин-мономеров и даже фибрина s в сосудистом русле. Однако, благодаря одновременной активации фибринолиза, носящего защитный характер, появляющиеся сгустки фибрина быстро растворяются и не наносят вреда здоровому организму.
Ускорение свертывания крови и усиление фибринолиза при всех перечисленных состояниях связано с повышением тонуса симпатического отдела вегетативной нервной системы и поступлением в кровоток адреналина и норадреналина. При этом активируется фактор Хагемана, что приводит к запуску внешнего и внутреннего механизма образования протромбиназы, а также стимуляции Хагеман-зависимого фибринолиза. Кроме того, под влиянием адреналина усиливается образование апопротеина III – составной части тромбопластина и наблюдается отрыв от эндотелия фрагментов клеточных мембран, обладающих свойствами тромбопластина, что способствует резкому ускорению свертывания крови. Из эндотелия также выделяются ТАР и урокиназа, приводящие к стимуляции фибринолиза.
При повышении тонуса парасимпатического отдела вегетативной нервной системы (раздражение блуждающего нерва, введение ацетилхолина, пилокарпина) также наблюдается ускорение свертывания крови и стимуляция фибринолиза. Как это ни покажется на первый взгляд странным, но и в этих условиях происходит выброс тромбопластина и активаторов плазминогена из эндотелия сердца и сосудов. Оказалось, что как сосудосуживающие, так и сосудорасширяющие воздействия вызывают со стороны свертывания крови и фибинолиза однотипный эффект – освобождение тканевого фактора и ТАР. Следовательно, основным эфферентным регулятором свертывания крови и фибринолиза является сосудистая стенка. Напомним также, что в эндотелии сосудов синтезируется PgI2, препятствующий в кровотоке адгезии и агрегации тромбоцитов.
Вместе с тем, развивающаяся гиперкоагуляция может смениться гипокоагуляцией, которая носит в естественных условиях вторичный характер и обусловлена расходом (потреблением) тромбоцитов и плазменных факторов свертывания крови, образованием вторичных антикоагулянтов, а также рефлекторным выбросом в сосудистое русло гепарина и A-III в ответ на появление тромбина.
Следует отметить, что существует корковая регуляция системы гемостаза, что было блестяще доказано школами профессора Е.С. Иваницкого-Василенко и академика А.А. Маркосяна. В этих лабораториях были выработаны условные рефлексы как на ускорение, так и на замедление свертывания крови.
Органный уровень регуляции – обеспечивает оптимальные условия функционирования системы гемостаза в различных участках сосудистого русла. Благодаря этому уровню проявляется мозаичность сосудисто-тромбоцитарного гемостаза, свертывания крови и фибринолиза. На нашей кафедре в последние годы убедительно доказано, что кровь, проходя через те или иные органы (например, головной мозг, мышцы конечности, почки) насыщается дополнительными факторами свертывания крови и фибринолиза, которые могут продуцироваться в них. Более того, нами (В.П. Мищенко, И.В. Мищенко, Е.В. Ткаченко, Е.А. Ткач, О.В. Коковская, Ю.М. Гришко и студентами разных курсов и факультетов, работавших в нашем кружке) показано, что, кровь оттекающая от этих органов с правой и левой стороны имеет разные коагулирующие и фибринолитические свойства. Это дало нам право для заключения о наличии в организме право- левой асимметрии процесса гемостаза и фибринолиза. Такая асимметрия обнаружена нами у различных лабораторных животных (кур, крыс, кроликов, морских свинок, кошек) и людей.
Нервно-гуморальная регуляция контролирует состояние системы гемостаза от молекулярного до органного уровня, обеспечивая целостность реакций на уровне организма и осуществляется это, главным образом, через симпатический и парасимпатический отделы вегетативной нервной системы.
Прежде всего, следует отметить, что существует корковая (условно-рефлекторная) регуляция системы гемостаза. Имеются данные о возможности выработки условных рефлексов как на ускорение, так и, особенно, на замедление свертывания крови вплоть до кровоточивости (кровавые слезы, кровоизлияния в местах, аналогичным участкам ранений, вызванных при распятии Христа и др.).
Отдельные образования центральной нервной системы (мозжечок, таламус, гипоталамус) принимают участие в регуляции, как активации, так и торможения функции системы гемостаза. Эфферентным звеном всех этих нервных механизмов регуляции системы гемостаза является, как это мы уже указали выше, симпатический и парасимпатический отделы вегетативной нервной системы. И как убедительно было доказано ранее нами (Б.И. Кузник и В.П. Мищенко, а позже Л.Л. Гончаренко, Д.С. Зазыкиной) при повышении тонуса симпатического отдела вегетативной нервной системы (острая кровопотеря, гипоксия, стресс, интенсивная мышечная работа, введение адреналина и норадреналина) происходит ускорение свертывания крови и усиление фибринолиза. В значительной мере это связано не только с активацией фактора Хагемана, но и выделением из сосудистой стенки тканевого фактора (тромбопластина), ТАП и других веществ. Но, что самое интересное, что и при возбуждении парасимпатического отдела вегетативной нервной системы (раздражение блуждающего нерва, введении ацетилхолни, пилокарипина) мы также наблюдали ускорение свертывания крови и активацию фибринолиза. Как это не покажется на первый взгляд парадоксальным, но и в этих условиях происходит выброс из сосудистой стенки тромбопластина и ТАП. Более того, препараты, суживающие и расширяющие (вазоконстрикторы и вазодилятаторы) кровеносные сосуды вызывают со стороны свертывания крови и фибринолиза однотипный ответ – освобождение тканевого фактора и ТАП. Это свидетельствует о том, что сосудистая стенка является эфферентным регулятором свертывания крови и фибринолиза.
Однако с моей точки зрения, эти данные чрезвычайно важны, так как Вы неоднократно сами будете использовать при лечении больных гормоны и витамины.
Выше, я неоднократно называл примеры, когда свертывание крови может усиливаться. За счет чего это может произойти? Явление повышенной свертываемости крови или гиперкоагуляция возникает за счет укорочения времени, в основном, первой фазы этого процесса. Поэтому причины гиперкоагуляции весьма разнообразны и зависят от многих факторов свертывания, находящихся как в плазме, так и форменных элементах крови, и тканях.
При избытке факторов свертывания крови (особенно I,VIII, IX) наблюдается гиперкоагуляция. Это наблюдается при мышечной деятельности, эмоциях, боли, увеличении концентрации адреналина, у беременных женщин, при воспалительных процессах. Увеличенное содержание числа тромбоцитов (тромбоцитоз) и эритроцитов (эритроцитоз), также как и гемолиз последних (наблюдается при ожогах, гемолитических состояниях, укусах ядовитых животных, переливаниях крови) приводят к развитию гиперкоагуляции. Это может произойти также при отдельных формах лейкоза и, особенно, повреждениях тканей.
Вместе с тем, гиперкоагуляция может смениться гипокоагуляцией, которая носит, в естественных условиях, вторичный характер и обусловлена расходованием (потреблением) тромбоцитов и плазменных факторов свертывания крови, образованием вторичных антикоагулянтов. Однако она может носить и первичный характер (врожденные нарушения свертывания крови – гемофилия, тромбоцитопатии – болезнь Гланцмана и другие). В последние годы встречаются нередко и тромбоцитопении аутоиммунного происхождения, сопровождаемые кровотечениями.
Нередко в клинической практике возникает вторичная гипокоагуляция коагуляционного характера, например, при развитии диссеменированного внутрисосудистого свертывания (ДВС) крови. Это явление развивается при многих заболеваниях, оно является неспецифичным, универсальным и почти катастрофичным. При его острых формах летальность достигает от 30 до 60% у взрослых и до 90% у новорожденных. В основе этого синдрома лежит рассеянное внутрисосудистое свертывание крови с образованием в циркуляции множества сгустков и агрегатов форменных элементов, которые приводят к нарушению кровообращения. Впоследствие это может вызвать дистрофические изменения в тканях и органах где это происходит.
При развитии этого синдрома все начинается с активации свертывания крови, т.е. гиперкоагуляции (ее причины мы подробно рассмотрели несколько выше). Ее выявление не требует особых условий, так как она обнаруживается при извлечении крови (кровь свертывается в игле, в пробирке со стабилизатором). Это уже первый признак ДВС-синдрома. Основная причина такой реакции – это распад тканей, их повреждение. В результате этого в кровоток попадает большое количество тромбопластина и быстро образуется тромбин.
На втором этапе нарастает тромбоцитопения, часть факторов свертывания крови потребляется (расходуется) на образование сгустков и поэтому в этой фазе часто из лаборатории поступают данные о том, что одни тесты как бы свидетельствуют о повышении свертываемости крови, другие - о ее снижении, а третьи – вообще нормальны. Такая противоречивая картина как раз и свойственна ДВС-синдрому.
Далее развивается третья стадия – гипокоагуляционная, сгустки плохо или вообще не образуются, усиливается тромбоцитопения. Геморрагический этап синдрома очень опасен, но не всегда сопровождает его. Иногда кровоточивость может носить локальный характер, например, органный. Общая же кровоточивость характеризуется появлением большого количества синяков, кровоподтеков, гематом и различных кровотечений (носовых, легочных, жулудочно-кишечных).
По своей частоте и сложности ДВС-синдром развивается в органах-мишенях в такой последовательности: легкие, почки, печень, желудочно-кишечный тракт, мозг. Борьба с ДВС - синдромом очень сложна. Более подробно о механизмах его развития Вы можете прочитать в наших методических руководствах.
В заключение хотелось бы сказать, что существуют физиологические методы профилактики нарушений свертывания крови и ДВС-синдрома. В частности, к этим методам относится, прежде всего, здоровый образ жизни. Это постоянная (регулярная) физическая активность (в тренированном организме всегда больше антикоагулянтов в крови и активаторов фибринолиза), индивидуальное ограниченное питание (желательно в соответствии со своей группой крови). Продукты животного происхождения, особенно, насыщенные жирами будут усиливать реакции свертывания крови. Живите скромно, со вкусом и по потребностям, индивидуальным Вашей крови и не будет проблем!
Регуляция системы крови включает в себя поддержание постоянства объема циркулирующей крови, ее морфологического состава и физико-химических свойств плазмы. В организме существует два основных ме-ханизма регуляции системы крови – нервный и гуморальный.
Высшим подкорковым центром, осуществляющим нервную регуля-цию системы крови, является гипоталамус.Кора головного мозга оказы-вает влияние на систему крови также через гипоталамус. Эфферентные влияния гипоталамуса включают механизмы кроветворения, кровообращения и перераспределения крови, ее депонирования и разрушения.
Нервная система оказывает как прямое, так и косвенное регули-рующее влияние на систему крови. Прямой путь регуляции заключается в двусторонних связях нервной системы с органами кроветворения, крове-распределения и кроверазрушения. Афферентные и эфферентные импуль-сы идут в обоих направлениях, регулируя все процессы системы крови. Косвенная связь между нервной системой и системой крови осуществляет-ся с помощью гуморальных посредников, которые, влияя на рецепторы кроветворных органов, стимулируют или ослабляют гемопоэз.
Среди механизмов гуморальной регуляции крови особая роль при-надлежит биологически активным гликопротеидам – гемопоэтинам, синте-зируемым, главным образом, в почках, а также в печени и селезенке. Продукция эритроцитов регулируется эритропоэтинами, лейкоцитов – лейко-поэтинами и тромбоцитов – тромбопоэтинами. Эти вещества усиливают кроветворение в костном мозге, селезенке, печени, ретикулоэндотелиаль-ной системе. Концентрация гемопоэтинов увеличивается при снижении в крови форменных элементов, но в малых количествах они постоянно со-держатся в плазме крови здоровых людей, являясь физиологическими сти-муляторами кроветворения.
Стимулирующее влияние на гемопоэз оказывают гормоны гипофиза (соматотропный и адренокортикотропный гормоны), коркового слоя надпо-чечников (глюкокортикоиды), мужские половые гормоны (андрогены). Женские половые гормоны (эстрогены) снижают гемопоэз, поэтому содер-жание эритроцитов, гемоглобина и тромбоцитов в крови женщин меньше, чем у мужчин. У мальчиков и девочек (до полового созревания) различий в картине крови нет, отсутствуют они и у людей старческого возраста.
Главную роль в регуляции деятельности сердца играют нервные и гуморальные влияния.Сердце сокращается благодаря импульсам, по-ступающим от главного водителя ритма, деятельность которого контроли-руется центральной нервной системой.
Нервная регуляция деятельности сердца осуществляется аффе-рентными ветвями блуждающего (парасимпатический отдел ВНС) и сим-патического нервов. Исследование нервной регуляции деятельности сердца началось с открытия в Петербурге в 1845 г. братьями Вебер тормозящего влияния блуждающего нерва,а в 1867 г. там же братья Цион обна-ружили ускоряющее влияние симпатического нерва.И. П. Павлов в 1887 г. обнаружил симпатические нервные волокна, усиливающие сердеч-ные сокращения без заметного учащения ритма. По его мнению усили-вающие нервные волокна являются трофическими,т.е. действуют на сердце путем повышения обмена веществ в миокарде.
На основе анализа всех влияний блуждающего и симпатического нервов на сердце создана современная классификация их эффектов. Хронотропный эффект характеризует изменение частоты сердечных сокращений, батмотропный – изменение возбудимости, дромотропный – изменение проводимости и инотропный – изменение сократимости. Все эти процессы блуждающие нервы замедляют и ослабляют, а симпатиче-ские– ускоряют и усиливают.
Центры блуждающих нервов находятся в продолговатом мозге. Вторые их нейроны расположены непосредственно в нервных узлах серд-ца. Отростки этих нейронов иннервируют синусно-предсердный (синоат-риальный) и предсердно-желудочковый (атриовентрикулярный) узлы и мышцы предсердий; миокард желудочков блуждающими нервами не иннервируется.
Гуморальные влияния на сердце могут оказываться гормонами, про-дуктами распада углеводов и белков, изменениями рН, ионов калия и каль-ция. Адреналин, норадреналин и тироксин усиливают работу сердца, аце-тилхолин – ослабляет. Снижение рН, увеличение уровня мочевины и мо-лочной кислоты повышают сердечную деятельность. При избытке ионов калия урежается ритм и уменьшается сила сокращений сердца, его возбуди-мость и проводимость. Высокая концентрация калия приводит к расслабле-нию миокарда и остановке сердца в диастоле. Ионы кальция учащают ритм и усиливают сердечные сокращения, повышают возбудимость и проводи-мость миокарда; при избытке кальция сердце останавливается в систоле.
Функциональное состояние сосудистой системы, как и сердца, ре-гулируется нервными и гуморальными влияниями. Нервы, регулирующие тонус сосудов, называются сосудодвигательными и состоят из сосудосу-живающих и сосудорасширяющих. Симпатические нервные волокна, ока-зывают суживающее действие на сосуды кожи, органов брюшной полости, почек, легких и мозговых оболочек, но расширяют сосуды сердца. Сосудо-расширяющие влияния оказываются парасимпатическими волокнами.
Активация Свертывания крови in vivo модулируется рядом механизмов, локализующих тромбообразование в месте повреждения и предотвращающих возникновение массивного внутрисосудистого тромбоза.
К таким механизмам относятся:
1) протеолитический эффект тромбина. Тромбин in vivo диссоциирует из тромбиназного комплекса и на поверхности эндотелия связывается с тромбомодулином, который меняет активность тромбина. В результате тромбин вызывает протеолиз и деградацию факторов XIa, Va, VIIIa, через активацию протеина С, ограничивая коагуляцию.

2) Ассиметрия биологических мембран.
Ключевые стадии свертывания протекают на поверхности фосфолипидов. Наибольшей прокоагулянтной активностью обладают аминофосфолипиды, но они находятся во внутреннем слое мембран. Ассиметрия в распределении фосфолипидов поддерживается с помощью нескольких ферментов-переносчиков и является одним из механизмов, обеспечивающих отсутствие тромбогенных свойств у мембран неповрежденных или нестимулированных клеток.
С фосфолипидами связано антикоагулянтное действие аннексина V – кальцийзависимого фосфолипид-связывающего белка, ингибирующего фосфолипазу А2 и предотвращающего связывание фактора Xa с прокоагулянтными фосфолипидами.
3) Ингибиторы сериновых протеаз.
1. Серпины (serine protease inhibitor). Это семейство образовалось в ходе эволюции из одного белка предшественника параллельно с возникновением специализированных протеаз. Механизм действия серпинов состоит в образовании стехиометрического комплекса с протеазой, в котором после расщепления по реактивному центру ингибитор остается ковалентно связанным с серином активного центра фермента. Комплекс протеаза-ингибитор выводится из кровотока и катаболизируется. Таким образом, серпины являются белками, которые выполняют свою функцию один раз в жизни.
Антитромбин III (АТ III) – основной ингибитор тромбина, Ф.Xa, Ф.IXa, а также Ф.XIa, Ф. XIIa, плазмина, трипсина, C1s-компонента комплемента.. АТ III нейтрализует протеазы посредством ковалентного связывания. Скорость нейтрализации сериновых протеаз АТ III в отсутствии гепарина невелика и существенно увеличивается в его присутствии (в 1000 – 100000 раз). Гепарин имеет два сайта связывания с АТIII, а тромбин – один. Гепарин связывается с лизиновыми остатками на АТ III, что делает аргининовый активный центр более доступным для активного серинового центра тромбина. Связывание гепарина с АТIII ускоряет образование комплекса тромбин-АТ III-гепарин. Ковалентная связь между активным сериновым центром тромбина и аргининовым сайтом комплекса АТIII-гепарин вызывает инактивацию активной сериновой потеазыю После образования комплекса между АТ III и тромбином гепарин диссоциирует из комплекса и связывается с другой молекулой АТ III, генерируя множественные циклы инактивации фермента. АТ III представляет собой а2-гликопротеин, синтезирующийся в печени.
Гепариновый кофактор II (ГК II) –серпин, ингибирующий тромбин в присутствии гепарина или дерматан-сульфата. Сродство к гепарину (а значит и биологическая активность) у ГК II на порядок ниже, чем у АТ III, но ГК II обладает высокой специфичностью в отношении тромбина. ГК II секретируется печенью в кровоток, но находится преимущественно во внесосудистом пространстве, где локализуется дерматан-сульфат, и именно здесь может играть решающую роль в ингибировании тромбина.
А1-антитрипсин (а1-АТ) – нейтрализует Ф. XIIa и активированный протеин С.
2. Кунины –ингибиторы представляющие собой суперсемейство белков, гомологичных апротину.
Ингибитор пути тканевого фактора (ИПТФ) – это гликопротеин, содержащий три куниновых домена. ИПТФ синтезируется в основном эндотелиоцитами, в меньшей степени – макрофагами и гепатоцитами. ИПТФ - это Ф.Xa-зависимый ингибитор комплекса Ф.III (ТФ)-Ф.VIIa. Инактивация происходит в 2 стадии:
1. сначала ИПТФ связывает Ф.Xa и инактивирует его
2. затем комплекс ИПТФ-Ф.Xa связывается с комплексом ТФ-Ф.VIIa и инактивирует его.
4) Система протеина С
Протеин С (ПС) – витамин К-зависимый фермент, расщепляющий Ф.Va и Ф.VIIIa, которые многократно ускоряют две ключевые реакции системы свертывания крови, что приводит к прерыванию каскада активации свертывания крови и развитию гипокоагуляции.
ПС синтезируется гепатоцитами. Секретируется и циркулирует в крови в неактивной форме. ПС связывается с поверхностью эндотелиоцитов посредством кальциевых мостиков.
ПС активируется небольшим количеством тромбина на поверхности неповрежденного эндотелия (т.е. за пределами тромба). Эта реакция значительно ускоряется тромбомодулином, поверхностным белком эндотелиоцитов, который связывается с тромбином опосредованно другим белком – витронектином.
Комплекс тромбин-тромбомодулин становится антикоагулянтным протеином, способным активировать протеин С.
Активированный ПС в присутствии своего кофактора – протеина S – расщепляет и инактивирует Ф.Va Ф.VIIIа, что предотвращает активацию Ф.X и Ф.II за пределами тромба.
Кроме того, активированный ПС подавляет продукцию ингибитора активатора плазминогена (ИАП-1), и тем самым активирует фибринолиз.
8)Система фибринолиза.
Фибринолитическая система осуществляет фибринолиз - процесс лизиса сгустка фибрина или тромба. Лизис тромба называют тромболизисом. Ключевой фермент лизиса фибрина - плазмин, сериновая протеаза, которая образуется из неактивного предшественника - плазминогена при действии физиологических активаторов: тканевого активатора плазминогена (t-PA) и активатора плазминогена урокиназного типа (урокиназа или u-PA). Оба активатора плазминогена принадлежат, как и плазмин, к семейству сериновых протеиназ, имеют общий субстрат - плазминоген и общие ингибиторы - ингибитор активаторов плазминогена типа 1 (PAI-1) и ингибитор активаторов плазминогена типа 2 (PAI-2).
Плазмин расщепляет: фибрин до растворимых продуктов деградации, белки внеклеточного матрикса, активирует другие протеазы и факторы роста. Кроме фибринолиза плазминоген и плазмин участвуют в целом ряде физиологических и патофизиологических процессов, таких как воспаление, миграция клеток, ангиогенез, заживление ран, овуляция, эмбриогенез, рост опухоли, метастазирование и атеросклероз.
Активация плазминогена.
Превращение плазминогена в плазмин катализируется активаторами плазминогена и строго регулируется различными ингибиторами.
Активаторы плазминогена образуются или сосудистой стенкой (внутренняя активация), или тканями (внешняя активация).
Внешний путь активируется в результате действия тканевого активатора плазминогена (ТАП), выделяемого эндотелиальными клетками. ТАП также синтезируется моноцитами, мегакариоцитами и мезотелиальными клетками.
ТАП – сериновая протеаза, осуществляющая ограниченный протеолиз плазминогена.
Урокиназа – другой активатор плазминогена, выявляемый в большом количестве в моче. Продуцируется фибробластами, макрофагами и эндотелиоцитами.
Читайте также:


