Нервно мышечный блок это

Мышечные релаксанты (MP) произвели подлинную революцию в анестезиологии и хирургии. И хотя современную практику анестезии невозможно представить себе без этих препаратов, несмотря на свои преимущества, МР вызывают ряд серьезных отрицательных эффектов. У пациентов после анестезии показана высокая – от 4 до 57% – частота остаточного нейромышечного блока (НМБ), повышающего риск послеоперационных осложнений и смертность.
Однако обеспечить необходимый хирургу и анестезиологу уровень расслабления скелетных мышц способны отнюдь не только миорелаксанты. Препараты многих других групп прямо или опосредованно влияют на функцию нейромышечного синапса (НМС), сократительный ответ мышцы, формирование мышечного тонуса и произвольных движений. В какой мере мы можем обеспечить безопасность пациента при подавлении мышечного тонуса различного генеза, насколько реален мониторинг различных видов миорелаксации?
Виды стимуляции
Мониторинг нейромышечной проводимости (НМП) заключается в оценке ответа мышцы на супрамаксимальную (на 10-20% больше необходимой для возбуждения всех эфферентных волокон нерва) электрическую стимуляцию периферического двигательного нерва. Как известно, используют различные виды стимуляции:
- одиночную стимуляцию (single twitch, ST),
- четырехразрядную (train-of-four, TOF),
- тетаническую (ТС),
- посттетанический подсчет (ПТП; posttetanic count, РТС),
- режим двойной вспышки (double burst, DBS).
ST-стимуляция заключается в оценке ответа на одиночный стимул или серию стимулов с частотой от 0,1 до 1,0 Гц. Амплитуда сокращения мышцы начинает снижаться, когда заблокировано 75% ацетилхолинового рецептора (АХР), и исчезает, когда заблокировано 90-95% рецепторов. Для количественной оценки этот вид стимуляции требует измерения исходной, до блока, амплитуды ответа. Хотя поверхностные электроды не всегда позволяют создать стимул супрамаксимальной величины, режим ST является стандартом для сравнения эффективности МР.
При TOF-стимуляции четыре супрамаксимальных стимула подают с частотой 2 Гц (через 0,5 с). Этот вид стимуляции наиболее широко используется в клинике. В отличие от ST, он не требует определения исходных, до блока, значений, так как оценивается отношение между последовательными ответами, которые и выступают в качестве контрольных значений.
Отношение амплитуды четвертого ответа к амплитуде первого (Т4/Т1) называют TOF-отношением; ценность этого показателя в том, что он позволяет не только оценить степень блока, но и документировать его вид. Исходно в норме амплитуда всех четырех ответов одинакова, и значение TOF-отношения близко к 1.
При ТС в результате высокочастотного воздействия (> 30 Гц) возникают повторяющиеся мышечные потенциалы действия (ПД) и постоянное мышечное сокращение (тетанус). В отсутствие НМБ сокращение при стимуляции частотой 70-90 Гц может сохраняться в течение нескольких секунд. В клинике чаще используют пятисекундный стимул с частотой 50 Гц, вызывающий такое же напряжение мышцы, как максимальное произвольное усилие.
ПТП заключается в подаче ST после ТС супрамаксимальных стимулов с частотой 1 Гц после (начиная с третьей секунды) пятисекундной 50-Гц ТС, с подсчетом количества посттетанических ответов. ПТП используется для оценки глубокого НМБ, когда он необходим.
Стимуляция двойной вспышкой позволяет визуально и тактильно оценить остаточный НМБ без регистрирующих устройств. Существует несколько различных комбинаций стимулов при DBS, но наиболее часто используют два паттерна. DBS3,3 состоит из вспышек трех коротких (0,2 мс) тетанических импульсов с частотой 50 Гц с последующим повторением второй такой же вспышки через 750 мс. В отсутствие блока DBS3,3 вызывает два одинаковых по величине мышечных сокращения.
DBS3,2 заключается в нанесении одной вспышки, состоящей из трех 50-Гц тетанических импульсов длительностью по 0,2 мс, с последующим (через 750 мс) нанесением второй вспышки, состоящей из двух аналогичных импульсов. DBS позволяет сравнить вызванные первой и второй вспышками ответы большей амплитуды, чем TOF-стимуляция.
Для проведения стимуляции наиболее часто используют локтевой нерв, который иннервирует: мышцу, приводящую большой палец кисти (т. adductor pollicis); мышцу, отводящую мизинец (т. abductor digiti minimi), короткую отводящую мышцу большого пальца кисти (т. abductor pollicis brevis) и тыльные межкостные мышцы кисти (mm. interossei dorsales).
Для т. adductor pollicis характерно наиболее длительное время восстановления НМП, поэтому полное восстановление в этой мышце с высокой достоверностью свидетельствует о восстановлении НМП в диафрагме и мышцах гортани. Так, восстановление НМП в т. adductor pollicis до 60% соответствует восстановлению НМП диафрагмы до 80%.
Другим доступным для стимуляции нервом является лицевой нерв, который в том числе иннервирует мышцу, окружающую глаз (т. orbicularis oculi), и мышцу, сморщивающую бровь (т. corrugator supercilii). М. orbicularis oculi и т. corrugator supercilii имеют сходную с мышцами гортани чувствительность к миорелаксантам. Однако акцелеромиографическая оценка НМП в этих мышцах может преувеличивать глубину блока в связи с тем, что их сокращение в принципе не всегда создает достаточное по амплитуде механическое движение и ускорение.
Регистрация данных мониторинга НМП может быть субъективной и объективной. Хотя большинство анестезиологов мира в своей практике полагаются на результаты визуальной и тактильной оценки ответов, субъективная оценка глубины НМБ часто неадекватна. Увы, исследования, проведенные в Дании, Германии, Великобритании и Мексике, показали, что только 43, 28, 10 и 2% врачей соответственно используют хоть какой-то мониторинг НМП. Объективный интраоперационный мониторинг нейромышечной передачи во Франции используют лишь 52% анестезиологов при однократном введении МР и 72% – при введении поддерживающих доз, в Австралии и Новой Зеландии – 17%, в Бразилии – 14%. У 18% бразильских анестезиологов, принявших участие в исследовании, рабочее место оснащено монитором НМП.
Эти результаты близки к тем, которые отмечены в США (22%), и заметно отличаются от цифр, характерных для стран ЕС (70%). Последняя версия британского стандарта анестезиологического мониторинга (2015) уже относит мониторинг НМП к обязательным требованиям при применении миорелаксантов, в то время как предыдущая (2011) лишь требовала держать монитор наготове.
Регистрация ответа мышцы
К объективным методам регистрации ответов мышцы относят электромиографию (ЭМГ), механомиографию (ММГ), акцелеромиографию (АМГ), кинемиографию (КМГ) и фономиографию (ФМГ).
ЭМГ основывается на регистрации электрической активности (общего ПД) стимулируемой мышцы, которая предшествует механическому сокращению. Регистрирующие электроды располагаются на теле мышцы, референтный электрод – в месте прикрепления сухожилия, а электрод заземления – в удаленном месте.
По данным ЭМГ-сигнала можно определить латентность амплитуды, длительность и форму общего ПД. Двигательная латентность является временным промежутком (мс) между началом стимуляции и началом появления вызванного двигательного ответа и суммарно отражает время проведения импульса по волокну двигательного нерва и время, необходимое для нейромышечной передачи. Латентность также отражает различные влияния на скорость нейротрансмиссии повреждения нерва, температуры, лекарственных средств и т. д.
Амплитуда общего мышечного ПД может быть измерена от изоэлектрической линии до пика, от отрицательного пика до положительного или как площадь под кривой общего мышечного ПД. Она представляет собой сумму амплитуд отдельных мышечных волокон, активированных стимуляцией. Длительность и морфология общего мышечного ПД дают информацию о синхронности и интенсивности мышечного сокращения. ЭМГ-сигнал могут искажать различные факторы – электрические помехи, неправильно наложенные электроды, гипотермия и прямая стимуляция мышцы.
ММГ позволяет измерить фактическую силу изометрического сокращения с помощью силового датчика. Наиболее часто измеряется сила изометрического сокращения мышцы, отводящей большой палец кисти, при стимуляции локтевого нерва. Мышца, нахмуривающая бровь, и круговая мышца глаза не могут использоваться для ММГ. При стимуляции локтевого нерва большой палец воздействует на датчик, сила сокращения преобразовывается в электрический сигнал, который усиливается, отображается и регистрируется.
Из всех методов мониторинга НМП ММГ требует наиболее тщательной подготовки и создания особых условий: в идеале мышцы должны быть зафиксированы в специально вылитой формочке для предотвращения изменения положения. Даже незначительное отсоединение мышц от прибора может изменить амплитуду вызванного сигнала. Также должна применяться постоянная преднагрузка, соответствующая размеру мышцы и местоположению датчика. Датчик может воспринимать силу в диапазоне от 0 до 5 кг, что в большинстве случаев применимо в условиях недеполяризующего НМБ, однако ТС в отсутствие блока генерирует силу 7,1+ 2,2 кг, что может привести к повреждению датчика.
Приборы для ММГ громоздки и неудобны для применения на практике. Существуют и другие методы, являющиеся по сути механомиографическими, например, баллонный метод для мониторинга НМП мышц гортани или мышцы, нахмуривающей бровь: силу измеряют непрямым способом – через изменение давления, оказанного на баллон, в результате сокращения мышцы. Их тоже трудно применять в клинике.
АМГ измеряет силу ответа через ускорение стимулируемой мышцы на основе второго закона Ньютона: если перемещаемая масса неизменна, ускорение прямо пропорционально силе. Ускорение измеряется с помощью пьезоэлектрического кристалла, встроенного в датчик, который крепится к стимулируемой мышце. Движение мышцы создает напряжение в пьезоэлектрическом кристалле, пропорциональное ускорению мышцы. Сигналы анализируются и отображаются.
Несколько исследований показали хорошую корреляцию между значениями TOF, полученными акцелеромиографически и механомиографически. Отклонение TOF-отношения, полученного при АМГ, от TOF-отношения ЭМГ составляет 0,176. Хотя АМГ менее точна в оценке НМП, чем ЭМГ и ММГ, именно этот метод оказался самым доступным для рутинного мониторинга НМП ввиду простоты использования и применимости на различных мышцах.
КМГ основана на определении растяжения и деформации пьезоэлектрической чувствительной гибкой пластины в результате движения большого пальца, вызванного сокращением m. Adductor pollicis во время стимуляции двигательного нерва. Формованное пластичное устройство накладывается в вырезку между большим и указательным пальцем с помощью клейкой ленты. Во время сокращения пьезоэлектрическая пластина деформируется и генерирует разность потенциалов, пропорциональную степени растяжения или сгибания.
Одно исследование продемонстрировало хорошую согласованность результатов КМГ и ММГ при измерении TOF-отношения. Однако недавнее исследование показало, что TOF-отношения, регистрируемые с помощью ЭМГ и КМГ, не могут быть взаимозаменяемыми. КМГ может применяться только для оценки НМП m. adductor pollicis.
ФМГ измеряет НМП путем регистрации специальным микрофоном низкочастотных звуков, возникающих при сокращении мышцы. Распространение звуковых волн происходит из-за пространственного смещения мышцы во время сокращения. Сигнал можно регистрировать с поверхности кожи. Показано, что пик мощности типичного сигнала находится в диапазоне частот от 4 до 5 Гц; 90% генерированного сигнала представлено звуками с частотой ниже 50 Гц, поэтому важно, чтоб микрофон обладал высокой чувствительностью к очень низкочастотным звукам.
Результаты ММГ, ФМГ и КМГ проявляют достаточное соответствие на этапе восстановления НМП в клинических условиях. При регистрации ответов m. corrugator supercilii ФМГ проявляет большую чувствительность, чем АМГ. ММГ и ФМГ являются взаимозаменяемыми методами оценки НМБ для m. adductor pollicis. Таким образом, обнаруженная корреляция между вызванными ответами, полученными с помощью КМГ, ФМГ и ММГ, недостаточна для исследовательских целей, но приемлема для клиники.
Преимущества ФМГ заключаются в том, что регистрировать вызванные ответы можно с любой интересующей мышцы, она легка в применении и неинвазивна. ФМГ, благодаря своим преимуществам, может быть надежным методом оценки НМП в повседневной практике.
Виды нейромышечного блока
Что касается видов НМБ, в большинстве источников на основе электрофизиологической картины описаны два основных вида НМБ: деполяризующий и недеполяризующий. К сожалению, сведения о существовании канального, десенситизационного и экстрасинаптического блоков отрывочны.
Недеполяризующий блок возникает за счет конкурирующей с ацетилхолином (АХ) блокады а-субъединиц АХР на постсинаптической мембране при введении недеполяризующих МР, неконкурентного блока открытия постсинаптических АХ-каналов или уменьшения высвобождения АХ в ответ на стимуляцию двигательного нерва путем блокады пресинаптических АХР на нервной терминали.
Он характеризуется прогрессирующим снижением амплитуды ответа на ST, феноменом угасания (fade или fatigue) в ответ на TOF-стимуляцию и прогрессирующим снижением TOF-отношения, угасанием ответа на ТС, а после 5-секундной ТС – транзиторным увеличением амплитуды одиночного сокращения и TOF-отношения. Это посттетаническое потенцирование, или период облегчения, длится от 1 до 2 мин (после 50-Гц тетануса) до тех пор, пока ответы постепенно не вернутся к прететаническому исходному уровню.
Ответ на ST при недеполяризующем блоке угасает, когда заблокировано 70-75% АХР, и исчезает, когда заблокируется 95% рецепторов. В норме до блока, напротив, повторяющаяся стимуляция двигательного нерва может усилить вызванный механический ответ соответствующей мышцы. Это явление называется в литературе лестничным феноменом. Как правило, когда занято 70-75% АХР, амплитуда Т2, ТЗ и Т4 при TOF-стимуляции начинает снижаться по нарастающей, Т4/Т1 уменьшается как минимум до 0,7, при этом Т1 может все еще оставаться на исходном уровне. Когда четвертый ответ полностью затухает (Т4 отсутствует), Т1 составляет приблизительно 25% от исходного значения. Такая картина соответствует занятости АХР на 80%. Третий ответ исчезает, когда заблокировано 85% АХР, второй ответ исчезает, когда заблокировано 85-90% рецепторов.
В режиме DBS при частичном НМБ второй ответ слабее первого – имеется затухание. Существует корреляция между отношением амплитуды первой вспышки ко второй и TOF-отношением. При значении TOF-отношения
Немногие группы препаратов обладают таким потенциально опасным действием, как миорелаксанты. Всегда, когда они применяются для миорелаксации, необходимо быть готовым проводить искусственную вентиляцию легких.
Миорелаксанты в анестезиологии
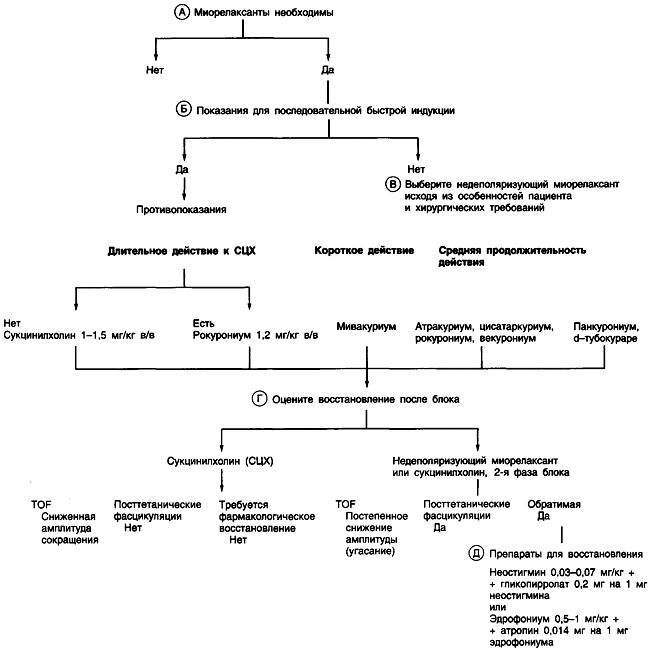
Первое, что необходимо сделать, это решить, показаны ли миорелаксанты. Эндотрахеальная интубация может быть выполнена без мышечной релаксации, но адекватная миорелаксация улучшает условия для ларингоскопии и уменьшает риск травмы голосовых связок. Ситуации, в которых применения миорелаксантов лучше избегать, включают прогнозируемую трудную интубацию, вентиляцию или миастенический синдром.
Для быстрой индукции (полный желудок или выраженный рефлюкс) традиционным препаратом выбора является деполяризующий миорелаксант сукцинилхолин. Начало действия сукцинилхолина составляет 30-60 с при дозе миорелаксанта 1,5 мг/кг. При нормальном уровне псевдохолинэстеразы плазмы продолжительность действия препарата составляет 5-10 мин. При миорелаксации, вызванной действием сукцинилхолина, ожидается повышение концентрации калия плазмы на 0,5—1 мэкв/дл. Другие побочные эффекты включают послеоперационные миалгии, транзиторное повышение внутричерепного/внутриглазного/внутрибрюшного давления.
Абсолютные противопоказания к применению сукцинилхолина:
- риск злокачественной гипертермии,
- избыточная пролиферация синаптических рецепторов у больных:
- с ожогами,
- со спинальной травмой через 24 ч после травмы,
- при мышечной дистрофии,
- некоторых видах миопатий,
- предсушествующая гиперкалиемия,
- аллергические реакции на сукцинилхолин в анамнезе.
Если сукцинилхолин противопоказан, можно использовать недеполяризующие миорелаксанты. Рокурониум , единственный препарат, который по рекомендациям FDA допускается применять в качестве компонента быстрой индукции. Начало действия при дозе 1,2 мг/кг составляет приблизительно 45-60 с.
Если нет показаний для быстрой индукции, любой недеполяризующий миорелаксант может быть использован как компонент вводной анестезии. Выбор недеполяризующего миорелаксанта завит от особенностей пациента, потребностей хирурга и предполагаемой продолжительности операции.
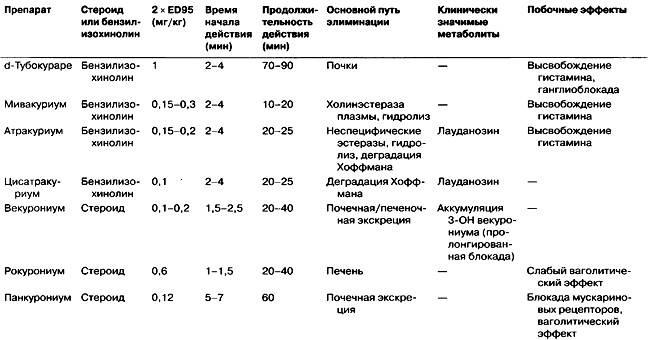
Выше представлены наиболее часто используемые недеполяризующие миорелаксанты (список препаратов включает разреженные в РФ средства).
Необходимо контролировать течение миорелаксации и востановление мышечного тонуса. Важен выбор мониторируемой мышцы, так как у разных мышц разное время восстановления.
Наиболее часто используемой мышцей при мониторировании адекватного восстановления для последующей экстубации является отводящая мышца большого пальца, сокращающаяся в ответ на стимуляцию локтевого нерва. Отношение амплитуды четвертого сокращения к первому (от англ, tzain of foure — TOF) — более чувствительный показатель, чем высота единичного сокращения, особенно когда уровень блокады менее 70%. В большинстве случаев полная миорелаксация пациента (нулевые сокращения) не нужна и даже нежелательна, так как это может привести к трудностям при восстановлении и к длительному сохранению слабости в послеоперационном периоде.
Другим способом контроля степени блокады является методика двойного раздражения: два коротких раздражителя через 750 мс. Данная методика хорошо коррелирует с описанной выше и ее преимущество заключается в простоте оценки. Продолжительность ответа на тетаническую стимуляцию 100 Гц за 5 с также является более чувствительным тестом по сравнению с TOF для выявления остаточной блокады.
Иногда необходимо восстановить нервно-мышечную передачу после использования недеполяризующих миорелаксантов посредством декураризации с помощью ингибитора ацетилхолинэстеразы. Эти препараты (в частности, прозерин) повышают уровень ацетилхолинэстеразы в нервно-мышечном синапсе, устраняя остаточную блокаду.
Факторы которые могут поддерживать остаточный нервно-мышечный блок, несмотря на использование адекватных доз ингибиторов ацетилхолинэстеразы (прозерина) при декураризации, включают:
- остаточное действие ингаляционных анестетиков,
- длительную элиминацию вследствие имеющейся патологии,
- сниженную температуру тела,
- взаимодействие с другими препаратами,
- стойкий нервно-мышечный блок на момент введения ингибиторов ацетилхолинэстеразы.
После повторного введения или инфузии миорелаксантов рекомендуется полностью устранить эффект всех недеполяризующих миорелаксантов прежде чем выполнить экстубацию. У пациентов с TOF<, 90% отмечаются худшие прогнозы в послеоперационном периоде, поэтому экстубация у них должна быть отложена до полного восстановления. Пациентам с длительным нервно-мышечным блоком после введения сукцинилхолина ингибиторы ацетилхолинэстеразы не должны вводиться, так как они лишь замедляют метаболизм. Однако в послеоперационном периоде этих пациентов необходимо обследовать на наличие аномальной псевдохолинэстеразной активности.
Средства, блокирующие нервно-мышечные синапсы, вызывают расслабление скелетных мышц (миорелаксацию) вследствие блокады передачи нервных импульсов с двигательных нервов на мышцы. Препараты этой группы называют также миорелаксантами периферического действия, в отличие от веществ, которые расслабляют скелетные мышцы, действуя на ЦНС (миорелаксанты центрального действия, см. бензодиазепины).
В зависимости от механизма нервно-мышечного блока выделяют миорелаксанты антидеполяризующего (недеполяризующего) дей- ствия и миорелаксанты деполяризующего действия.
Миорелаксанты антидеполяризующего действия
Вещества этой группы блокируют Н-холинорецепторы, локализованные на концевой пластинке скелетных мышц, и препятствуют их взаимодействию с ацетилхолином, в результате чего ацетилхолин не вызывает деполяризацию мембраны мышечных волокон - мышцы не сокращаются. Такое состояние называется нервно-мышечным блоком. Однако при повышении концентрации ацетилхолина в
синаптической щели (например, при применении антихолинэстеразных средств) ацетилхолин конкурентно вытесняет миорелаксант из связи с Н-холинорецептором и вызывает деполяризацию постсинаптической мембраны - происходит восстановление нервномышечной передачи. Вещества, действующие подобным образом, называются миорелаксантами антидеполяризующего конкурентного действия.
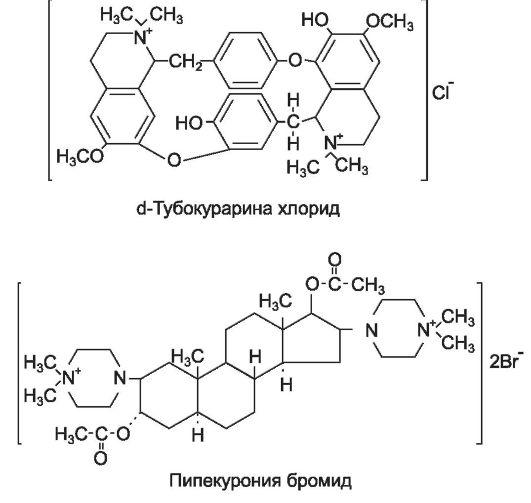
Первым препаратом этой группы был алкалоид тубокурари н * - основное действующее вещество стрельного яда кураре. В состав этого яда входят экстракты южноамериканских растений вида Strychnos и Chondodendron. Индейцы Южной Америки использовали кураре во время охоты на животных, смазывая им наконечники стрел. Кураре, попав в организм животного, вызывало паралич скелетных мышц, и животное теряло способность двигаться, но его мясо было пригодно к употреблению в пищу. Впоследствии было установлено, что по химической структуре тубокурарин * - четвертичное аммониевое соединение и не всасывается из ЖКТ.
Вещества, близкие тубокурарину * по действию, стали называть курареподобными средствами. Большинство курареподобных средств, так же как тубокурарин, относят к четвертичным аммониевым соединениям. В молекуле большинства веществ есть два положительно заряженных атома азота (катионные центры), которые и взаимодействуют с анионными структурами Н-холинорецепторов скелетных мышц, вызывая нервно-мышечный блок.
Антидеполяризующие миорелаксанты в основном относят к двум химическим группам:
• бензилизохинолины (тубокурарин*, атракурий**, цисатракурий**; мивакурий);
• аминостероиды (панкуроний**, пипекуроний, векуроний**, рокуроний **).
В зависимости от продолжительности вызываемого ими нервномышечного блока выделяют препараты: длительного действия (30-60 мин и более) - тубокурарин*, панкуроний**, пипекуроний (действует около 2 ч); средней продолжительности действия (20- 40 мин) - атракурий**, векуроний**, рокуроний**; короткого действия (10-15 мин) - мивакурий. Антидеполяризующие миорелаксанты действуют медленнее, чем деполяризующие; исключение составляет рокуроний ** , который вызывает наиболее быстрый миопаралитический эффект (через 60-90 сек).
Продолжительность действия курареподобных средств в основном определяется характером их элиминации. Наиболее продолжительно действуют вещества, которые главным образом выделяются почками (пипекуроний). Вещества средней продолжительности действия в большей степени выделяются с желчью в неизмененном виде и в виде метаболитов (векуроний ** , рокуроний ** ), или подвергаются спонтанному неферментативному гидролизу (элиминация Хоффмана) в плазме крови (атракурий ** ). Короткое действие мивакурия связано с тем, что он быстро разрушается холинэстеразой плазмы крови (псевдохолинэстераза). В связи с особым характером элиминации продолжительность действия атракурия не зависит от функционального состояния печени и почек (препарат может быть использован у больных с почечной и печеночной недостаточностью).
Курареподобные средства используются для расслабления скелетных мышц при хирургических операциях. Под действием курареподобных средств мышцы расслабляются в следующей последовательности: сначала мышцы лица, гортани, шеи, затем мышцы конечностей,
туловища и в последнюю очередь дыхательные мышцы - наступает остановка дыхания. При выключении дыхания больного переводят на искусственную вентиляцию легких.
Кроме того, курареподобные средства применяют для устранения тонических судорог при столбняке и при отравлении стрихнином. При этом расслабление скелетных мышц способствует устранению судорог.
Побочные эффекты большинства курареподобных средств из группы бензилизохинолинов (тубокурарин * , атракурий ** , мивакурий) связаны главным образом с их способностью высвобождать гистамин. Это может быть причиной гипотензии, бронхоспазма, покраснения кожи, а также других анафилактоидных реакций. В большей степени высвобождению гистамина способствует тубокурарин*. Способность высвобождать гистамин практически отсутствует у цисатракурия и препаратов из группы аминостероидов, но некоторые из них (панку- роний**, рокуроний**) оказывают умеренное М-холиноблокирующее действие и поэтому могут вызвать тахикардию.
Поскольку тубокурарин * обладает выраженным гистаминогенным действием и, кроме того, в определенной степени блокирует Н-холинорецепторы симпатических ганглиев (вследствие чего при его применении возможно существенное снижение АД и существует опасность анафилактоидных реакций), в настоящее время его применяют редко.
Антагонистами миорелаксантов антидеполяризующего действия являются антихолинэстеразные средства. Угнетая активность ацетилхолинэстеразы, они предотвращают гидролиз ацетилхолина и таким образом увеличивают его концентрацию в синаптической щели. Ацетилхолин вытесняет препарат из связи с Н-холинорецепторами, что приводит к восстановлению нервно-мышечной передачи. Антихолинэстеразные средства (в частности, неостигмин) применяют для прерывания нервно-мышечного блока или устранения остаточных явлений после введения антидеполяризующих мышечных релаксантов. Для предотвращения эффектов неостигмина, вызываемых стимуляцией М-холинорецепторов, за 10 мин до неостигмина вводят атропин.
Миорелаксанты деполяризующего действия
С у к с а м е т о н и я х л о р и д (листенон * ), с у к с а м е т о н и я й о д и д (дитилин*), суксаметония бромид.
По химической структуре суксаметоний представляет собой удвоенную молекулу ацетилхолина.
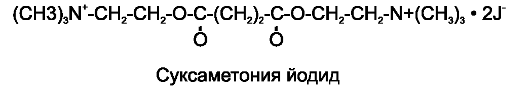
Суксаметоний взаимодействует с Н-холинорецепторами, локализованными на концевой пластинке скелетных мышц и подобно ацетилхолину вызывает деполяризацию постсинаптической мембраны. При этом мышечные волокна сокращаются, что проявляется в виде отдельных подергиваний скелетных мышц - фасцикуляций. Однако в отличие от ацетилхолина суксаметоний обладает устойчивостью к ацетилхолинэстеразе (он гидролизуется только холинэстеразой плазмы крови) и поэтому практически не разрушается в синаптической щели. В результате суксаметоний вызывает стойкую деполяризацию постсинаптической мембраны концевой пластинки скелетных мышц (деполяризационный блок). Это приводит к нарушению нервномышечной передачи и расслаблению скелетных мышц. При этом выделяющийся в синаптическую щель ацетилхолин лишь усиливает деполяризацию мембраны и углубляет нервно-мышечный блок.
По этой причине антихолинэстеразные средства не устраняют действие суксаметония. Более того, подавляя активность ацетилхо- линэстеразы, антихолинэстеразные средства повышают концентрацию ацетилхолина в синаптической щели, что поддерживает стойкую деполяризацию постсинаптической мембраны. Кроме того, ингибируя холинэстеразу плазмы крови, они препятствуют разрушению суксаметония, вследствие чего также усиливают и удлиняют его действие.
Суксаметоний применяют при интубации трахеи, эндоскопических процедурах (бронхо-, эзофаго-, цистоскопии), кратковременных операциях (наложение швов на брюшную стенку, вправление вывихов, репозиция костных отломков), для устранения тонических судорог при столбняке.
После внутривенного введения суксаметония его миопаралитическое действие начинается через 30-60 сек, и продолжается до 10 мин. Такое кратковременное действие препарата связано с его быстрым разрушением псевдохолинэстеразой (бутирилхолинэстеразой) плазмы крови (образуются холин и янтарная кислота). При генетической недостаточности этого фермента действие суксаметония может продолжаться до 2-6 ч. Миорелаксирующее действие препарата можно прекратить переливанием свежей цитратной крови, которая содержит активную псевдохолинэстеразу.
При частых повторных введениях суксаметония возможно развитие десенситизации Н-холинорецепторов концевой пластинки скелетных мышц, вследствие чего в ответ на введение препарата уже не возника- ет деполяризация мембраны и деполяризационный блок сменяется на антидеполяризационный. При таком характере нервно-мышечного блока антихолинэстеразные средства могут ослабить миопаралитическое действие суксаметония.
Побочные эффекты: послеоперационные мышечные боли (что объясняют микротравмами мышц во время их фасцикуляций), угнетение дыхания (апноэ), гиперкалиемия (выход ионов калия из скелетных мышц при стойкой деполяризации постсинаптической мембраны) и связанные с этим аритмии сердца, гипертензия (в связи со стимуляцией Н-холинорецепторов симпатических ганглиев при повторных введениях препарата), брадикардия и повышение секреции слюнных желез (М-холиномиметическое действие), повышение внутриглазного давления (тоническое сокращение под действием суксаметония экстраокулярных мышц затрудняет отток внутриглазной жидкости). Кроме того, возможны тяжелые осложнения: рабдомиолиз и миоглобинемия, а также злокачественная гипертермия, которая проявляется быстрым повышением температуры тела (до 41-42 градусов) и тоническим сокращением скелетных мышц, что связывают с повышенным выбросом ионов кальция из саркоплазматического ретикулума (для устранения этого эффекта вводят дантролен). Развитию злокачественной гипертермии при введении суксаметония способствует одновременное применение таких средств для наркоза, как галотан или изофлуран.
Суксаметоний противопоказан при глаукоме, нарушении функции печени, анемии, беременности, в грудном возрасте.
Сравнительные характеристики миорелаксантов антидеполяризующего и деполяризующего действия приведены в таблице 8-2.
Сравнительные характеристики миорелаксантов антидеполяризующего и деполяризующего действия
Читайте также:


