Неврологические послеоперационные боли в

Боль в области шва и другие виды боли
Почему не проходит боль после операции? Как снять боль после операции? Каковы причины боли после операции? – в данной статье мы поможем найти ответы на эти и подобные вопросы, а именно – расскажем об эффективном и безопасном методе лечения боли после операции, о причинах и симптомах этого заболевания, а также о наиболее популярных мифах, связанных с ним.
что такое боль после операции
Боль после операции – это мучительные или неприятные ощущения у пациента, перенёсшего операцию. Боли ощущаются не только в области шва или смежных с ней, но и в отдаленных областях.
Характер болей зависит от того, по поводу какого заболевания была проведена операция. Чаще всего такие боли развиваются после операций по удалению грыжи межпозвонкового диска, паховой грыжи, желчного пузыря, протезирования суставов, гинекологических операций, а также после кесарева сечения, травм и ожогов.
причины боли после операции
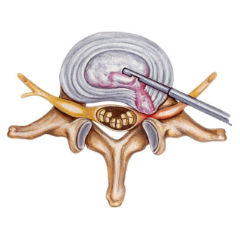
Боли после других видов операций схожи в своих проявлениях: боль и скованность при движении, мышечные спазмы, ноющая боль в области шва.
Причинами развития боли после операции по удалению грыжи межпозвонкового диска как в ближайшем, так и в отдаленных послеоперационных периодах, являются:
- глубинные и поверхностные послеоперационные рубцы, которые сдавливают болевые нервные окончания, сосуды и нервные стволы;
- сужение позвоночного канала от рубцов и застоя венозной крови, сдавление спинного мозга и нервов;
- прогрессирование остеохондроза, появление новых грыж в соседних межпозвонковых дисках;
- воспаление в спинно-мозговом канале позвоночника;
- воспаление межпозвонковых суставов (артроз);
- спазм мышц поясницы и таза в области операционного шва;
- неполное удаление грыжи, которая продолжает давить на нервный корешок;
- повреждение нервных стволов, приводящее к онемению и нарушению функций конечности.
После других операции боли возникают по следующим причинам:
- глубинные и поверхностные послеоперационные рубцы, которые сдавливают болевые нервные окончания, сосуды и нервные стволы;
- спазм мышц в области операционного шва;
- воспалительный процесс в мягких тканях вокруг операционного шва;
- нарушение обменных процессов в мягких тканях вокруг операционного шва;
- образование спаек между швом и оболочками внутренних органов;
- венозный и лимфатический отёк в конечностях.
развенчиваем мифы о боли после операции
На сегодняшний день существует ряд заблуждений о лечении боли после операции, порождаемых в основном отсутствием у человека, столкнувшегося с данной проблемой, объективной информации по поводу предлагаемой терапии. Постараемся внести ясность в этом вопросе и развенчать наиболее популярные мифы.
Болевой синдром, или альгосиндром – это сложный комплекс болезненных ощущений различной степени тяжести. Обычно располагается в области основной патологии – травмы, места сосудистого спазма, больного органа, сустава; реже имеет неясный или блуждающий характер.
Внимание! Боль – это защитная реакция на патологическое воздействие, которая сигнализирует об угрозе здоровью. Даже незначительное проявление дискомфорта игнорировать нельзя, так как болевой синдром – основной маркер проблем с организмом.
При травматических болях следует обращаться к травматологу или хирургу, при внутренних (органных) – к терапевту или узкому специалисту. Диагностикой и лечением альгосиндромов неясной этиологии или с поражением нервной системы занимается врач-невролог.
Классификация
По субъективным проявлениям боль может быть колющей, режущей, тянущей, пульсирующей, давящей, ноющей и т.п. Вне зависимости от причины, проявление может быть острым и хроническим.
Острый болевой синдром сопровождает острые патологические процессы и длится не более 2-3 месяцев. По истечение этого срока он либо проходит вместе с причиной его вызывающей, либо переходит в хроническую стадию. Это совсем не обязательно сильная и резкая (острая) боль, и ее легко можно устранить анальгетиками и анестетиками.
Хронический болевой синдром может длиться годами. Часто является единственным признаком патологии и плохо поддается медикаментозному купированию. Со временем провоцирует депрессию, беспокойство, апатию – вплоть до полной деградации личности.
На заметку! И острая, и хроническая форма могут иметь различную степень интенсивности – от легкой до нестерпимой. Многое зависит от причины, расположения и субъективных особенностей пациента.
В зависимости от локализации можно выделить широкий спектр альгосиндромов. Основные из них:
- миофасциальный – связан с перенапряжением мышц и фасций, не имеет четкой привязки к органу, связан с травмами и физическими перегрузками;
- абдоминальный – объединяет патологии брюшной полости, в первую очередь в области ЖКТ;
- вертеброгенный – в медицине известен как корешковый болевой синдром; проявляется при сжатии или травмировании спинномозговых отростков;
- анокопчиковый – формируется в нижнем отделе позвоночного ствола и задней стенки малого таза с вовлечением прилежащих органов – толстой кишки, половой системы;
- пателлофеморальный – является следствием артрозных изменений в коленном суставе;
- нейрогенный – связан с поражением нервных структур, в первую очередь – головного и спинного мозга.
Болевой синдром: причины возникновения
Основные причины боли – травмы, спазмы, нарушения кровообращения, инфекции, отравления, ожоги и переохлаждения, деформации и деструкции различных участков опорно-двигательной системы (позвоночника, суставов).
С учетом особенностей происхождения различают 2 большие группы альгосиндромов – ноцицептивный и нейропатический.
Возникает при воздействии раздражителей непосредственно на болевые рецепторы, расположенные в тканях по всему организму. Может быть легкой или нестерпимой, но в любом случае легко купируется анальгетиками и быстро проходит при устранении причины. В зависимости от типа и расположения этих рецепторов, ее подразделяют на 2 подвида:
- соматическая боль – имеет поверхностное проявление с четкой локализацией; характерна для воспалительного процесса, отеков, травматических повреждений (ушибы, переломы, разрывы, растяжения и т.п.), а также некоторых нарушений метаболизма и кровообращения;
- висцеральная боль – появляется при повреждении внутренних органов; имеет более глубокое залегание и плохо просматриваемую локализацию; в качестве примера можно привести кардиомиалгию, почечную колику, язвенную болезнь.
Механизм ноцицептивного синдрома связан с выработкой специальных медиаторов боли – ацетилхолина, гистамина, брадикининов, простагландинов. Накапливаясь в области повреждения, они раздражают ткани, вызывая неприятные ощущения. Дополнительный эффект исходит от факторов воспаления, вырабатываемых лейкоцитами.
Возникает при воздействии непосредственно на функциональные структуры периферической и центральной нервной системы – нервные отростки, а также отделы головного и спинного мозга. Иногда сопровождается патологическим возбуждением нейроструктур с формированием аномальной реакции на неболевые раздражители (простое прикосновение). Часто проявляется как хроническая боль, поэтому может плохо поддаваться купированию.
Имеет 2 разновидности:
- периферическая – при поражении нервных отростков в виде невралгий, невропатий, невритов, туннельных синдромов;
- центральная – развивается как следствие острого нарушения мозгового кровообращения, спинномозговых травм, миелопатий, рассеянного склероза;
- дисфункциональная – проявляется как несоответствие между силой воздействия раздражителя и ответной реакцией организма; является следствием дисфункции ЦНС.
На заметку! В качестве отдельной группы выделяют психогенный альгосиндром. В этом случае повреждения организма отсутствуют, а характерные для него хронические боли являются следствием фантазий и страхов самого пациента. Он может развиваться как вариант нейропатической боли или при вынужденном длительном существовании с сильными ноцицептивным болевым синдромом.
Симптоматика
Основной признак болевого синдрома – постоянная или периодическая боль определенной, мигрирующей или неясной локализации. При этом ощущения могут быть резкими или тянущими, колющими, ноющими, пульсирующими. Все остальные признаки зависят от причины и характера недуга. Среди них:
- дискомфорт при движении, стихающий в состоянии покоя;
- болезненные ощущения в неподвижном положении;
- иррадиация в другие части тела;
- повышение температуры в области болезненных ощущений;
- проявление альгосиндрома при незначительном прикосновении (характерно для нейропатий);
- нарушение чувствительности в прилегающей зоне.
Болевой синдром может сопровождаться отечностью и покраснением поврежденных тканей, а также слабостью, повышенной утомляемостью, общей подавленностью.
Диагностика

Последовательность действий при диагностике причин болевого синдрома зависит от его расположения, характера и сопутствующих симптомов. При болях невыясненной локализации первоочередное внимание уделяют инструментальным методам – УЗИ, рентгенографии, МРТ, КТ, ЭКГ, гастродуоденоскопии и т.п. Список тестов и анализов назначает травматолог, терапевт, хирург или другой узкий специалист.
Для оценки интенсивности болевого синдрома используют 2 системы градации – упрощенную и расширенную.
- легкая боль – не мешает движению и выполнению повседневных дел;
- сильная боль – нарушает нормальный ритм жизни, не позволяет выполнять обычные действия;
- нестерпимая боль – спутывает сознание, способна спровоцировать обморок и шоковое состояние.
Только установив причину боли, ее интенсивность и характер, врач назначит подходящие обезболивающие препараты. Это связано с отличиями в механизме действия у разных групп анальгетиков – что подходит при ноцицептивном синдроме совершенно не эффективно при нейропатическом.
Особенности терапии болевого синдрома
Лечение напрямую зависит от причины боли и ее характера (ноцицептивный, нейропатический). В арсенале средств присутствуют как консервативные методики с использованием медикаментозных средств и физиотерапии, так и радикальные хирургические методы.
Лекарственная терапия:
- обезболивающие – анальгетики, анестетики;
- противовоспалительные – преимущественно НПВС, реже – инъекции кортикостероидов;
- миорелаксанты;
- спазмолитики;
- седативные препараты.
Внимание! Самостоятельный прием обезболивающих средств без воздействия на причину недуга может затруднить диагностику, усугубить ситуацию и сделать дальнейшее лечение неэффективным.
Методы физиотерапии улучшают усвоение медикаментозных средств, снимают воспаление, отечность, спазмы, повышают регенерацию, расслабляют мышцы, успокаивают нервную систему.

На практике применяют:
- УВЧ;
- токовую терапию;
- грязевые компрессы;
- электрофорез;
- массаж;
- иглоукалывание;
- гирудотерапию.
При нарушениях опорно-двигательной системы широко применяют метод иммобилизации поврежденных участков – шины, гипсовые повязки, корсеты, воротники, бандажи.
Хирургическое лечение является крайней мерой и применяется только в том случае, если консервативные методы неэффективны.
На заметку! Боль – универсальный симптом для патологических процессов, поэтому его лечением занимаются врачи самых различных специальностей – терапевты, невропатологи, гастроэнтерологи и др. В экстренных случаях, при остром болевом синдроме может потребоваться срочная помощь реаниматологов, травматологов, хирургов.
Профилактические меры
В целях предотвращения ангиосиндрома, придерживайтесь некоторых общих рекомендаций:
- избегайте травм, в особенности с поражением позвоночника, черепа, суставов;
- следите за своей осанкой – тренируйте, но не перегружайте мышцы спины;
- практикуйте умеренные физические нагрузки – гиподинамия, также как и перенапряжение, плохо влияет на состояние опорно-двигательной системы, вызывая со временем артралгию и/или невралгию;
- при наличии заболеваний (острых, хронических) обеспечьте их своевременное лечение;
- поддерживайте нормальный вес тела, не допускайте ожирения или дистрофии тканей;
- откажитесь от неудобной одежды и обуви – они вызывают боли, связанные с нарушением кровообращения и деформацией скелета;
- избегайте длительных нервных стрессов и психологических перегрузок;
- регулярно проходите профилактические осмотры в клинике по месту жительства.
Очень важно обращаться к врачу при первых же признаках болевого синдрома. Решение перетерпеть или заняться самолечением может дорого обойтись вашему здоровью!

Эффективное лечение невропатической боли в реальной практике — сложная задача, которая требует от врача специальных знаний и навыков. Фармакотерапия является базисом лечебного процесса таких больных, но здесь необходим комплексный, мультимодальный подход. В 2018 году были опубликованы клинические рекомендации по диагностике и лечению невропатической боли, созданные Российским обществом по изучению боли
Несмотря на достижения последних двух десятилетий, для практического здравоохранения диагностика и лечение невропатической боли (НБ) — боли, обусловленной заболеванием или повреждением соматосенсорной нервной системы, — остается сложной задачей.
Частота встречаемости этого типа боли чрезвычайно высока и составляет в среднем, согласно новейшим эпидемиологическим исследованиям, 6–7% популяции. НБ связана со значительным экономическим бременем как для государства и системы здравоохранения, так и для общества и пациентов. Например, анализ прямых расходов на хроническую боль в спине продемонстрировал, что присутствие НБ в клинической картине этого состояния увеличивает расходы государства на 160% в год. В США было подсчитано, что ежегодные расходы государства и/или страховых компаний на одного больного с НБ невысокой интенсивности составляют порядка 3000 долл., а у пациентов с умеренной и высокоинтенсивной болью — 5700 и 8000 долл. соответственно. Помимо средств государства и страховых компаний, еще порядка 2500 долл. в год пациент тратит дополнительно из собственных средств. Очевидно, что расходы можно снизить, например, путем правильно подобранной фармакотерапии в комбинации с другими методами лечения, позволяющими значительно уменьшить интенсивность боли.
За последние годы было опубликовано несколько метаанализов и систематических обзоров, направленных на оценку эффективности и безопасности препаратов, применяемых для лечения НБ.
К сожалению, сегодня существует определенный разрыв между эффективностью препаратов для купирования НБ, показанной в ходе высокодоказательных контролируемых клинических исследований, и эффективностью этих же препаратов, наблюдаемой в обычной врачебной практике. В ряде исследований, проанализировавших схемы назначений у нескольких тысяч больных с НБ в Германии, Нидерландах, США и Канаде, было показано, что длительная (от 6 месяцев до 1 года) монои комбинированная фармакотерапия средствами с высоким уровнем доказательности (антиконвульсанты, антидепрессанты, местные анестетики, опиоидные анальгетики) позволяла добиться успеха (30% снижение интенсивности боли), по разным данным, только у 18–30% больных .

Среди причин неуспеха лечения отмечают использование препаратов в более низких дозах и высокую частоту отмены фармакотерапии из-за побочных эффектов. К другим ограничениям системной фармакотерапии относят риск лекарственных взаимодействий, а также злоупотребления и зависимость от лекарств. Ограничивают терапевтические возможности и другие факторы, например необходимость титрования дозы, медленное наступление эффекта или самостоятельная отмена препаратов пациентами по причине недостаточной эффективности.
Характерно, что более выраженный болевой синдром, обусловленный неадекватной терапией, достоверно чаще приводит к ухудшению состояния здоровья в целом, нарушению функционирования организма, сопровождается значимыми нарушениями сна и выраженными тревожно-депрессивными расстройствами. Становится очевидным, что монои комбинированная фармакотерапия является важным, но не единственным методом лечения НБ, необходим комплексный, мультимодальный подход. Данный подход нашел отражение в ряде авторитетных международных и национальных рекомендаций лечения НБ, сформулированных в помощь практикующим врачам во всем мире.
В 2018 году были опубликованы клинические рекомендации по диагностике и лечению НБ, созданные Российским обществом по изучению боли. Данный документ представляет собой дополненную и обновленную версию рекомендаций, опубликованных в 2008 году. В рекомендациях представлена современная классификация причин, описаны клинические проявления как периферической, так и центральной НБ, а также особенности ее симптоматики при различных заболеваниях. Отдельное внимание уделено расстройствам, сопровождающим НБ (эмоциональноаффективные расстройства, нарушения сна). Для практического использования представлены основные принципы и современный алгоритм диагностики НБ, базирующийся как на выявлении качественных характеристик боли и позитивных и негативных сенсорных симптомов, так и на объективном подтверждении заболевания соматосенсорной нервной системы (ЭНМГ, УЗИ, нейровизуализация). Дополнительно публикуются вопросники для скрининговой диагностики НБ, описаны их основные достоинства и недостатки.
В рекомендациях изложены основные принципы и алгоритмы как фармакологического, так и нефармакологического лечения НБ.
С позиций доказательной медицины средствами первой линии терапии НБ являются:
- антидепрессанты — как трициклические (ТЦА),
- ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН — дулоксетин и венлафаксин),
- антиконвульсанты (габапентин (Тебантин®), прегабалин (Прегабалин-Рихтер), карбамазепин — только при тригеминальной невралгии),
Ко второй и третьей линиям относят:
- опиоидные анальгетики (трамадол, тапентадол, оксикодон, морфин),
- препараты для местного применения (пластыри с 5% лидокаином или 8% капсаицином), ботулинический токсин типа А (в виде подкожных инъекций).
В реальной практике при следовании рекомендациям необходимо принимать во внимание несколько основополагающих принципов.
Прежде всего терапия должна быть многокомпонентной. В рамках комплексной терапии НБ могут использоваться следующие методы:
- терапия основного заболевания;
- фармакотерапия болевого синдрома;
- немедикаментозные методы лечения боли; малоинвазивные и хирургические методы терапии боли;
- терапия сопутствующих боли расстройств.
Фармакотерапия является базисом лечения больных с НБ и должна учитывать следующие положения:
- формирование адекватных ожиданий пациента от лечения;
- старт терапии следует начинать с более низких доз с плавной титрацией до средних и максимальных с учетом переносимости;
- прогнозирование и мониторинг нежелательных явлений терапии;
- достаточная длительность терапии;
- непрерывность и комплексность лечения.
При диагностике и выборе терапии НБ следует учитывать многокомпонентность болевого синдрома (наличие у одного и того же больного сочетания невропатической и ноцицептивной, а иногда и дисфункциональной боли). НБ нередко может существовать одновременно с ноцицептивной болью, наиболее известные примеры таких сочетаний:
- хроническая боль в спине с радикулопатией;
- боль при онкологических заболеваниях с поражением нервных стволов и сплетений;
- боль при травмах конечностей с повреждением периферических нервов;
- поражения нервов на фоне ревматоидного артрита и др.
В подобных клинических ситуациях стратегии фармакотерапии должны иметь два направления, одно из них — купирование ноцицептивного болевого синдрома, другое — невропатического. Принимая во внимание, что лечение ноцицептивной боли, например при хронической боли в спине с радикулопатией, потребует с высокой вероятностью длительного назначения НПВП, выбор препарата должен осуществляться с особой тщательностью и учитывать все возможные риски от такого назначения.

Другой важный момент, который следует учитывать при выборе терапии у пациентов с сочетанием невропатической и ноцицептивной боли, — наличие или отсутствие выраженного болезненного напряжения мышц в пораженной анатомической области. В этой ситуации в комплекс терапии могут быть включены миорелаксанты. К препаратам этой группы, зарегистрированным в России, относятся толперизон (Мидокалм®), тизанидин и баклофен.
Однако включение миорелаксантов в комплекс терапии сочетанной боли должно быть тщательно взвешено. С одной стороны, миорелаксанты усиливают эффект НПВП, с другой — у тизанидина и баклофена высокий риск лекарственных взаимодействий с другими средствами, влияющими на ЦНС.

Мидокалм® (толперизон) — препарат, не вызывающий седацию и имеющий низкий риск взаимодействий. Более того, в недавнем РКИ толперизон в комбинации с НПВП показал свое преимущество над монотерапией НПВП в отношении уменьшения боли и улучшения функциональных возможностей.
Еще один значимый аспект ведения пациентов с НБ в практике — подбор дозы препаратов и оценка эффективности обезболивающей терапии. Необходимо отметить, что оценивать эффективность препаратов первой линии терапии НБ следует только по достижении среднетерапевтической, а в ряде случаев максимальной дозы этих лекарственных средств.

Например, для габапентина (Тебантин®) эта доза, достигаемая путем титрации в течение 14 дней, равна 1800 мг в сутки. Зачастую по достижении меньшей дозы препараты первой линии отменяются как неэффективные и делается вывод о нечувствительности пациента к терапии.
Таким образом, эффективное лечение НБ в реальной практике — сложная задача, которая требует от врача специальных знаний и навыков. Прежде всего индивидуализированная и всесторонняя оценка качественных характеристик болевого синдрома позволяет более точно понять как причину болевого синдрома, так и патофизиологические механизмы его развития и поддержания, являющиеся потенциальной мишенью для фармакотерапии.
Лечение невропатической боли — длительный процесс, требующий регулярного врачебного контроля и выполнения пациентом назначений. Как уже было сказано выше, фармакотерапия является важным, но не единственным методом лечения; необходим комплексный, мультимодальный подход в лечении пациентов с НБ.

Анализ совокупности специфических вербальных дескрипторов, результатов неврологического осмотра и достоверность связи между выявленными нарушениями и поражением нервной системы позволяет выделить характерный паттерн для нейропатической боли
Внимание! Все материалы размещенные на странице не являются рекламой,
а есть не что иное как мнение самого автора,
которое может не совпадать с мнением других людей и юридических лиц!

В этой белой, ослепительно сверкающей комнате он тоже не проронил ни слова. Даже когда ему объявили, что состояние сердца не позволяет усыплять его и операцию придется делать под местным наркозом, он только кивнул головой. Во время операции он не издал ни стона, ни крика. Василий Васильевич, сам делавший эту несложную ампутацию … несколько раз заставлял ассистента смотреть, не умер ли больной под ножом.
Когда пилили кость, боль была страшная, но он привык переносить страдания и даже не очень понимал, что делают у его ног эти люди в белых халатах, с лицами, закрытыми марлевыми масками.
Боль является индивидуальным субъективным ощущением, включающим сенсорные, эмоциональные и поведенческие аспекты, вызванным имеющимся или вероятным повреждением тканей. Понимание физиологии боли важно для выбора адекватного метода ее купирования.
Существует значительная индивидуальная вариабельность восприятия боли, которая определяется полом и возрастом пациентов, генетическими, а также социо-культурными факторами. Большую роль в интенсивности послеоперационного болевого синдрома играют индивидуальные особенности пациента. Выделяют группы пациентов повышенного риска в отношении неадекватности послеоперационного обезболивания. К ним относят детей, пациентов пожилого и старческого возраста, пациентов, испытывающих трудности в общении, обусловленные тяжелым состоянием, психическими нарушениями, языковым барьером и т. д.
В основе отношения к боли лежит личный болевой опыт, неразрывно связанный с социальными, экономическими и культурными основами жизненного опыта. В частности, большую роль играет болевой опыт пациентов, переносивших разного рода оперативные вмешательства, сопровождавшиеся выраженной послеоперационной болью. У пациентов формируется болевой стереотип, своего рода условный рефлекс, пусковым моментом которого становится любое последующее оперативное вмешательство. Купирование послеоперационного болевого синдрома у таких пациентов представляет значительные трудности. По данным российских авторов, непреодолимый страх, боязнь боли и опасения ее неотвратимости испытывают более 85% пациентов, готовящихся к повторному оперативному вмешательству.
Известно, что эмоциональное состояние влияет на толерантность к боли. При увеличении степени выраженности отрицательных эмоций болевая чувствительность обостряется. Наиболее часто усиление болевого синдрома связано со страхом пациента. Страх перед болью обостряет все проявления боли – мышечное напряжение, увеличение ЧСС, АД, периферическую вазоконстрикцию и т. д.
К факторам, влияющим на интенсивность ПБС, также относятся:
- интенсивность ноцицептивной стимуляции при различном объеме травмирования тканевых структур;
- наличие предоперационной боли; интенсивность послеоперационной боли, а следовательно, и потребность в анальгетиках значительно выше у пациентов, страдавших от болей в предоперационном периоде;
- наличие воспалительного процесса в тканях до и после операции;
- злоупотребление алкоголем может приводить к истощению потенциальных возможностей антиноцицептивной системы, снижению уровня продукции эндорфинов, что способствует повышению интенсивности ПБС и потребности в опиоидных анальгетиках;
- ритмы болевой чувствительности; существуют отчетливые колебания порога болевой чувствительности в течение суток.
Очевидно, что на формирование и интенсивность болевого синдрома влияют вид хирургического вмешательства и связанную с ним степень травматичности операции. Принято выделять операции низкой, средней и высокой травматичности (табл. 1).
Таблица 1. Классификация хирургических вмешательств по степени травматичности.
Овечкин А.М.
Московская медицинская академия им. И.М.Сеченова.
В одном из наиболее крупных исследований (около 20.000 пациентов хирургических отделений Великобритании) послеоперационные болевые ощущения средней интенсивности в среднем были отмечены в 29,7% (26,4-33%) случаев, высокой интенсивности – в 10,9% (8,4-13,4%) случаев (Dolin S., Cashman J.,2002).
Развитие послеоперационного ХБС является серьезной медико-социальной проблемой, имеющей, кроме всего прочего, большое экономическое значение. По подсчетам американских специалистов, стоимость лечения ХБС, развившегося у 30-летнего пациента, к концу его жизни достигает 1.000.000 $. В связи с этим, основной задачей повышения эффективности послеоперационного обезболивания на современном этапе является профилактика хронизации острого ПБС.
Несколько слов о патофизиологии острой боли. Вокруг операционной раны формируются зоны гиперальгезии, т.е. повышенной болевой чувствительности (зоны сниженных болевых порогов). Различают первичную и вторичную гипералгезию. Первичная гиперальгезия быстро развивается в непосредственной близости от раны, в зоне поврежденных тканей. Патофизиологической основой первичной гипералгезии является избыточное повышение чувствительности (сенситизация) болевых рецепторов (ноцицепторов). При повреждении тканей происходит активация синтеза метаболитов арахидоновой кислоты. Сенситизация периферических ноцицепторов обусловлена действием медиаторов боли (алгогенов), выделяющихся из плазмы крови, поврежденных клеток, а также из окончаний С-афферентных волокон.
Развитие вторичной гиперальгезии не только усиливает интенсивность острого болевого синдрома, но и является пусковым моментом для его хронизации. В настоящее время выявлены причинно-следственные связи между травматичностью операции, интенсивностью послеоперационного болевого синдрома и вероятностью формирования ХБС. В частности, известно, что раннее развитие ПБС (в течение первых 4-х часов после операции), его интенсивный характер и длительное существование являются основными факторами риска ХБС.
Каковы современные тенденции послеоперационного обезболивания?
Анализируя мировой опыт, в настоящее время можно выделить несколько основных тенденций послеоперационного обезболивания:
- все более широкое применение неопиоидных анальгетиков (нестероидные противовоспалительные препараты (НПВП) и парацетамол). В различных европейских клиниках частота назначения данных препаратов в качестве базиса послеоперационного обезболивания варьирует от 45 до 99%.
- ограничение традиционного внутримышечного назначения опиоидных анальгетиков, что обусловлено низкой эффективностью и значительным количеством побочных эффектов данной методики.
- широкое применение высокотехнологичных методов обезболивания – продленной эпидуральной анальгезии (ЭА) посредством инфузии местных анестетиков и опиоидов, а также контролируемой пациентом внутривенной или эпидуральной анальгезии (КПВА и КПЭА).
- мультимодальный характер послеоперационного обезболивания, т.е. одновременное назначение нескольких препаратов или методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома. Например: парацетамол + НПВП ± опиоид, или продленная ЭА + парацетамол и т.д.
Опиоидная анальгезия и способы ее оптимизации.
Наиболее эффективные попытки улучшения качества послеоперационной опиоидной анальгезии основаны на оптимизации способов введения препаратов. Самым современным методом является контролируемая пациентом анальгезия (КПА), в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании. При необходимости, нажав на кнопку дистанционного устройства, пациент сам себе вводит дополнительный болюс анальгетика, что придает ему ощущения независимости и уверенности, а также облегчает работу среднего медперсонала.
Надо сказать, что высокотехнологичные методы послеоперационного обезболивания, такие как КПА и ЭА, проводимая посредством непрерывной эпидуральной инфузии, в развитых странах в совокупности применяются у 35-50% пациентов, перенесших хирургические вмешательства. Данные методы характеризуются высокой эффективностью и сравнительной безопасностью. В уже упоминавшемся крупном британском исследовании (Dolin S., Cashman J.,2002) была проанализирована частота депрессии дыхания при использовании опиоидов посредством КПА, а также при их внутримышечном и эпидуральном введении. При КПА средняя частота угнетения дыхания составила 1,2%, если в качестве критерия использовали гиповентиляцию и около 11,5%, если в качестве критерия оценивали степень снижения сатурации капиллярной крови.
Аналогичный показатель для ЭА опиоидами равнялся 1,1 и 15,1% соответственно. Для сравнения, традиционное внутримышечное введение опиоидных анальгетиков характеризовалось 0,8% частотой угнетения дыхания при ориентации на гиповентиляцию и 37% (!) при использовании в качестве критерия снижение сатурации. Полученные данные свидетельствуют о том, что стандартом мониторинга при КПА должна являться пульсоксиметрия, лучше в сочетании с капнографией.
Весьма распространенной является ситуация, когда пациент в комфортном состоянии переводится из отделения интенсивной терапии, где для его лечения использовались самые современные методы обезболивания, такие как КПА и ЭА, в профильное хирургическое отделение – и остается один на один с болью. В настоящее время в таких ситуациях рекомендуется переводить пациентов на обезболивание внутривенным введением парацетамола, c последующим переходом на таблетированную форму (Brodner G.,2000).
Широкое развитие контролируемой пациентом опиоидной анальгезии в нашей стране ограничено: а) дефицитом инфузионных помп, имеющих модуль для КПА, б) проблемами учета и списывания опиоидных анальгетиков. Например, для проведения КПА промедолом шприц инфузионной помпы (60 мл) должен быть заполнен 100 мг препарата. При списывании 5 ампул промедола на одного больного в сутки могут возникнуть вопросы, как у администрации клиники, так и у представителей структур, контролирующих расход наркотических анальгетиков в медицинских учреждениях.
Очевидно, что в нашей стране перспективы развития КПА (при наличии соответствующего оборудования) связаны, в основном, с использованием неопиоидных анальгетиков, в частности, НПВП и внутривенного парацетамола.
Нестероидные противовоспалительные препараты. Важнейшая роль тканевого воспаления в механизмах центральной сенситизации, а, следовательно, и в формировании хронической боли является показанием для обязательного включения в схему лечения послеоперационной боли НПВП. В течение длительного периода времени НПВП считали периферическими анальгетиками, способными через обратимую блокаду циклооксигеназы (ЦОГ) подавлять синтез медиаторов воспаления, в первую очередь простагландинов, в тканях. Затем были получены доказательства центрального действия НПВП. В частности, показано, что НПВП угнетают таламический ответ на ноцицептивную стимуляцию и препятствуют повышению концентрации простагландинов в спинномозговой жидкости, что тормозит развитие вторичной гиперальгезии.
Наибольшее применение находят препараты, имеющие форму для парентерального введения (диклофенак, кеторолак, кетопрофен, лорноксикам). Недостатком диклофенака и кетопрофена является невозможность их внутривенного введения. Наиболее мощным анальгетическим эффектом характеризуются кеторолак и лорноксикам (ксефокам). Следует отметить, что с применением кеторолака ассоциируется большинство сообщений о повышенной кровоточивости послеоперационных ран, случаях желудочно-кишечных кровотечений и нефротоксических эффектах. Лорноксикам, способный в равной степени подавлять активность ЦОГ-1 и ЦОГ-2, характеризуется выраженным анальгетическим и противовоспалительным эффектом. В литературе практически нет сообщений о побочных эффектах данного препарата при кратковременном его назначении (3-4 суток) в дозе 16-24 мг/сут.
Не так давно были получены данные о положительном влиянии НПВП на выживаемость пациентов, перенесших обширные хирургические вмешательства, в том числе и осложненные абдоминальной хирургической инфекцией. Простагландин E2 (PGE2) способствует белковому распаду, причем этот эффект усиливается на фоне лихорадки и сепсиса. НПВП способны уменьшить потерю мышечной массы за счет подавления синтеза PGE2 и снижения деградации протеина. Оценивая потери азота в послеоперационном периоде у пациентов, которым проводилась длительная ЭА, установили, что комбинирование ЭА с НПВП позволяет снизить потери азота на 75-80% в первые трое суток после операции, по сравнению с контрольной группой, получавшей только ЭА.
НПВП - селективные ингибиторы циклооксигеназы 2-го типа.
Большие надежды были связаны с внедрением в клиническую практику селективных ингибиторов ЦОГ-2. На сегодняшний день из препаратов данной группы доступны мелоксикам, нимесулид, целекоксиб, эторикоксиб, вальдекоксиб и парекоксиб (инъекционная форма вальдекоксиба). Теоретически селективные ингибиторы циклооксигеназы 2-го типа (ЦОГ-2) должны иметь клиническое преимущество перед другими НПВП. Сохраняя сопоставимый с ними анальгетический эффект, они не подавляют физиологической продукции простагландинов тканями, что должно сопровождаться снижением числа присущих НПВП побочных эффектов. К сожалению, теоретические предположения не полностью подтверждаются в клинической практике.
Влияние на ЖКТ. В крупных исследованиях продемонстрировано, что ингибиторы ЦОГ-2 оказывают менее значимый с клинической точки зрения ульцерогенный эффект на ЖКТ. В исследовании VIGOR выявлено, что частота язвенных поражений верхних отделов ЖКТ сократилась с 4,5 случаев при назначении напроксена до 2,1 случаев на 100 пациентов в год при назначении рофекоксиба (Bombardier C et al.,2000). В исследовании CLASS за период от 3 до 6 месяцев частота язвенных осложнений составила 0,76% для целекоксиба и 1,45% для ибупрофена или диклофенака. Дискутабельным остается вопрос о преимуществах ингибиторов ЦОГ-2 у пациентов, имеющих дополнительные факторы риска язвенных поражений ЖКТ: пожилой возраст, параллельный прием аспирина или кортикостероидов, наличие Helicobacter pylori. Подсчитано, что количество пациентов, нуждающихся в преимущественном назначении ингибиторов ЦОГ-2 по сравнению с неселективными НПВП для профилактики язвенных осложнений составляет 40-100 в год (Laine L.,2003).
Таким образом, назначение селективных ингибиторов ЦОГ-2 ассоциируется с меньшим, по сравнению с неселективными НПВП количеством язвенных поражений ЖКТ, тем не менее данный показатель остается достаточно высоким.
Влияние на функцию тромбоцитов и тромбогенный эффект. Тромбоциты продуцируют только ЦОГ-1, следственно селективные ингибиторы ЦОГ-2 не оказывают влияния на их функцию. Данный факт подтвержден клинически снижением кровопотери в интра- и раннем послеоперационном периоде, по сравнению с использованием неселективных НПВП. При этом надо отметить, что в большинстве контролируемых исследований не выявлено достоверного влияния неселективных НПВП на увеличение интраоперационной кровопотери. В связи с этим, отсутствие антитромбоцитарного эффекта ингибиторов ЦОГ-2, очевидно, является основанием для их преимущественного использования у пациентов с геморрагическими диатезами, параллельным назначением антикоагулянтов, нейроаксиальной анестезией, предполагаемой большой кровопотерей.
В последние годы неоднократно поднимался вопрос о крайне нежелательном тромбогенном потенциале селективных ингибиторов ЦОГ-2. Препараты этого типа угнетают продукцию эндотелиального простациклина, сохраняя при этом синтез тромбоксана тромбоцитами, а также их способность к агрегации. В уже упоминавшемся исследовании VIGOR был выявлен повышенный риск развития инфаркта миокарда у пациентов, получавших рофекоксиб по сравнению с пациентами, которые получали напроксен. В одном из исследований, посвященных лечению острой боли при помощи парекоксиба, а затем вальдекоксиба в течение 1-2 недель у пациентов перенесших операции АКШ, было выявлено достоверное увеличение частоты сердечно-сосудистых осложнений, почечной недостаточности и проблем с заживлением стернотомной раны. Clark D и др. в обзоре, посвященном вопросам безопасности применения селективных ингибиторов ЦОГ-2, отметили, что на сегодняшний день ингибиторы ЦОГ-2 могут быть рекомендованы только при тех состояниях, когда их эффективность является доказанной, и только у тех пациентов, которые имеют минимальный риск развития вышеуказанных осложнений (Clark D et al.,2004). К факторам высокого риска относят пожилой возраст, наличие сердечно-сосудистых и почечных заболеваний. Кроме того, необходим тщательный контроль состояния всех пациентов в процессе получения ими препаратов.
Не так давно компанией-производителем с фармацевтического рынка был отозван рофекоксиб. Рандомизированное контролируемое исследование APPROVE, посвященное исследованию эффективности и безопасности рофекоксиба, было прекращено досрочно, поскольку в группе, получавшей препарат, риск инфаркта миокарда вдвое превысил аналогичный показатель у пациентов, получавших плацебо.
Парацетамол.
Эффективность таблетированных форм парацетамола в качестве послеоперационного анальгетика была подтверждена в ряде исследований, анализ которых представлен в Кокрановской базе данных (Barden J.,2004). Доказана анальгетическая эффективность разовых доз парацетамола 325 мг, 500 мг, 600/650 мг, 975/1000 мг и 1000 мг.
Механизм действия парацетамола пока не совсем ясен. В отличие от опиодов и НПВП соответственно, парацетамол не имеет эндогенных рецепторов и практически не подавляет активность циклооксигеназы на периферии. Появляется все больше доказательств центрального антиноцицептивного эффекта парацетамола. Вероятные механизмы его включают: а) подавление активности ЦОГ-2 в ЦНС (профилактика развития вторичной гиперальгезии), б) подавление активности ЦОГ-3 (существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу), в) усиление активности нисходящих тормозных серотонинергических путей. Парацетамол препятствует продукции простагландина на уровне клеточной транскрипции, т.е. не зависимо от уровня активности ЦОГ. Парацетамол является эффективным анальгетиком, потенциал которого лишь несколько уступает стандартным дозам морфина или НПВП. Внедрение в клинику внутривенной формы парацетамола делает перспективы данного препарата в послеоперационном обезболивании весьма обнадеживающими.
Внутривенный парацетамол. Появление внутривенной формы существенно повысило ценность и расширило показания к применению препарата в качестве базисного компонента мультимодальной послеоперационной анальгезии. Внутривенная форма (Перфалган®, Bristol Myers-Squibb) превосходит таблетированные формы по безопасности, поскольку характеризуется более предсказуемой плазменной концентрацией в раннем послеоперационном периоде. В одном из исследований были выявлены значительные колебания концентрации парацетамола в плазме в раннем послеоперационном периоде, в том числе, достижение опасно высоких уровней при пероральном назначении, по сравнению с внутривенным (Petterson P.,2004). Таким образом, использование внутривенной формы предпочтительно у пациентов групп высокого риска, особенно с патологией печени. Имеются убедительные данные об анальгетической эффективности внутривенного парацетамола. В частности, в исследовании на добровольцах была выявлена способность препарата снижать выраженность центральной гиперальгезии, что подтверждает центральный механизм его действия (Koppert W.,2004).
В настоящее время в Европе парацетамол получают 90-95% пациентов хирургического профиля. Обычно препарат вводят внутривенно во время операции, примерно за 30 минут до ее окончания, что обеспечивает спокойное, безболезненное пробуждение. Как мы уже упоминали, отсутствие боли в течение первых 4-5 часов после операции положительно влияет на последующую динамику болевого синдрома. Повторно 1 г парацетамола вводят через 4 часа, а затем каждые 6 часов (общая доза 4 г в сутки). Назначение препарата облегчает наличие его готовой лекарственной формы, не требующей разведения (в отличие, например, от лорноксикама). Через 1-3 дня применения внутривенного парацетамола пациентов переводят на его пероральную форму, которая является основным анальгетиком, назначаемым при выписке из клиники.
Некоторые специалисты рассматривают парацетамол в качестве альтернативы НПВП, поскольку препарат сопоставим с ними по анальгетическому эффекту, но лишен нежелательных побочных эффектов. Безопасность парацетамола может быть иллюстрирована рекомендациями применения внутривенной формы препарата при анестезии в акушерстве, а также у кормящих грудью женщин или беременных, которым проводятся хирургические вмешательства.
Острая нейропатическая боль в послеоперационном периоде.
Как уже упоминалось, в достаточно большом проценте случаев у пациентов, перенесших плановые и экстренные хирургические вмешательства, острый послеоперационный болевой синдром трансформируется в форму хронического нейропатического болевого синдрома. Диагноз нейропатического болевого синдрома ставится на основании характерных признаков боли, часто имеющей жгучий, жалящий или стреляющий характер с сохранением или даже усилением болевых ощущений после полного заживления раны. Еще одной характерной чертой нейропатической боли является ее резистентность к назначению опиоидных анальгетиков.
Лечение острой нейропатической боли является сложной задачей. Основные рекомендации перенесены из опыта лечения хронической боли и подразумевают назначение антиконвульсантов и / или трициклических антидепрессантов, что может быть затруднено в раннем послеоперационном периоде. В этих случаях достаточно эффективным может быть системное введение низких доз лидокаина и / или кетамина. Введение данных препаратов может быть осуществлено в виде непрерывной подкожной инфузии – лидокаина со скоростью 1 – 1,5 мг/кг/час, кетамина – 5 – 15 мг/час.
Заключение.
Острая послеоперационная боль до сих пор является серьезной проблемой в хирургии, плохо поддается лечению и имеют тенденции перехода в хроническую форму. Современные достижения фармакотерапии боли способны повысить эффективность обезболивания, качество жизни пациентов в послеоперационном периоде, а также снизить вероятность хронизации острого послеоперационного болевого синдрома. В настоящее время послеоперационное обезболивание имеет мультимодальный характер, значительную роль играют неопиоидные анальгетики, характеризующиеся высокой эффективностью и безопасностью.
Читайте также:


