Патологические изменения нервных клеток
ГЛАВА 19. ЗАБОЛЕВАНИЯ НЕРВНОЙ СИСТЕМЫ
Этиология повреждений нервной системы может быть связана с разнообразными эндогенными и экзогенными воздействиями. Их делят на физические, химические (в том числе, лекарственные), биологические и психо-эмоциональные.
Классификация патологических процессов и болезней нервной системы учитывает следующие особенности:
влияние наследственных и приобретённых факторов (наследственные и приобретённые болезни);
характер этиологического фактора (травматические, сосудистые, инфекционные, аутоиммунные, токсические поражения, болезни, обусловленные физическими факторами, нарушением обмена веществ, психо-эмоциональными нарушениями, неизвестной этиологии);
морфологические особенности (дистрофические, демиелинизирующие, воспалительные болезни, опухоли);
клиническое течение (острые, подострые и хронические болезни).
В зависимости от механизма действия патогенного фактора различают виды повреждений нервной системы:
прямое, или первичное;
непрямое, или вторичное (при нарушениях центрального и мозгового кровообращения, изменении состава крови, поражении нервно-эндокринной системы).
Патология нейрона
В ЦНС возникают общие патологические процессы, однако они приобретают особенности, обусловленные строением нервной ткани. Существуют также патологические процессы, характерные только для ЦНС.
Нейроны различных отделов ЦНС имеют структурно-функциональные различия, однако все они состоят из ядра, цитоплазмы (в ней выделяют перикарион, вещество Ниссля и другие компоненты), дендритов и аксона. Изменения нейронов при различных патологических состояниях делят на неспецифические (возникающие при различных воздействиях) и специфические, или патогномоничные (указывающие на наличие конкретной болезни).
● Неспецифические изменения нейронов. Наибольшее значение имеют изменения нервных клеток при ишемии мозга, ретроградное клеточное перерождение при пересечении аксонов, транссинаптическая дегенерация при разрушении афферентных связей с нейронами.
◊ Изменения нейронов при гипоксии. Нейроны ЦНС чрезвычайно чувствительны к гипоксии и гипогликемии, однако степень чувствительности в разных отделах неодинакова. При внезапном прекращении кровотока в сосудах головного мозга через 6–7 с наступает потеря сознания, а через 15 с — изменение биоэлектрической активности мозга. Уже через 4–5 мин после остановки кровотока возникают необратимые повреждения корковых нейронов. В то же время нейроны мозгового ствола способны переносить ишемию длительностью до 30 мин. При ишемии происходят следующие структурные изменения нейронов:
тигролиз — распад вещества Ниссля, возникающий в нейронах коры через 20 мин после 4-минутной остановки кровотока;
сморщивание нейронов — через 12 ч ишемии;
микровакуолизация вследствие набухания митохондрий нейронов;
цитолиз — побледнение окраски, а затем исчезновение нейрона.
Клетки микроглии фагоцитируют остатки погибших нейронов. При гибели нейронов происходит гиперплазия астроцитов с увеличением количества волокон (глиоз). Это может приводить к неравномерной деструкции серого вещества с сохранением одних и поражением других слоёв (псевдоламинарный некроз).
◊ Изменения при пересечении аксонов наблюдают, в основном, в теле клеток. Заметен хроматолиз вещества Ниссля. Ядро смещено к периферии. Происходит распад части нейрофибрилл и смещение других к периферии. В процессе регенерации в клетке снова возникают глыбки тигроида. Часть клеток не регенерирует, в них возможны цитолиз или атрофия. В периферической части аксона идёт вторичная дегенерация (дегенерация Тюрка–Валлера, или валлеровское перерождение). При этом наблюдают резкое утолщение и распад аксона на эозинофильные глыбки (аксональные глыбки) или сфероиды, имеющие зернистую структуру. В периферической нервной системе шванновские клетки и макрофаги фагоцитируют аксональные и миелиновые остатки. На месте волокна остаются пустые шванновские футляры, в них прорастают регенерирующие осевые цилиндры. В ЦНС данный процесс идёт гораздо медленнее, чем в периферической нервной системе. Клетки микроглии фагоцитируют продукты распада аксонов в течение нескольких месяцев или даже лет.
◊ Транссинаптическая дегенерация бывает при разрушении афферентных связей нейронов. Она возникает, например, после потери глаза в латеральном коленчатом теле, где расположен подкорковый центр зрения. Микроскопически наблюдают выпадение функционально связанных друг с другом нейронов и реактивный глиоз.
● Специфические изменения нервных клеток. Наибольшее значение имеют нейрофибриллярные пучки, характерные для болезни Альцхаймера и тельца Леви, свойственные болезни Паркинсона. Важное диагностическое значение имеют оксифильные включения внутри цитоплазмы при бешенстве (тельца Бабеша–Негри), остром полиомиелите (тельца Каудри типа В), внутриядерные включения при нейроинфекции, вызванной вирусом простого герпеса типа I (тельца Каудри типа А). Другие специфические изменения нейронов редки.
Нарушения деятельности нейрона проявляются изменением его возбудимости и проводимости.
● Повышение возбудимости нейрона (снижение порога возбуждения) возникает при снижении мембранного потенциала покоя, снижении содержания Ca 2+ во внеклеточной среде, уменьшении количества тормозных синаптических медиаторов, снижении чувствительности к ним соответствующих рецепторов (десенситизация). Возбуждение нейрона — обязательное условие формирования приспособительных реакций, например, гипервентиляции лёгких при гипоксии и т.п. Клинически патологическое возбуждение нейрона может быть основой развития спастических сокращений мышц, судорожных состояний, расстройств висцеральных функций и других явлений.
● Понижение возбудимости нейрона (повышение порога возбуждения) возникает при снижении уровня внеклеточного Na + , повышении содержания внеклеточного K + , избытке тормозных медиаторов и др. Угнетение активности нейронов, например, вазомоторного центра, может стать механизмом развития коллапса, а снижение возбудимости центральных нейронов во время сна обеспечивает восстановление их ресурсов.
Ритмическая стимуляция синапсов афферентными импульсами может приводить к длительным изменениям эффективности синаптической передачи в виде долговременных потенциации или депрессии. Эти явления могут лежать в основе патологического возбуждения или торможения.
● Долговременная потенциация вызвана увеличением в постсинаптическом нейроне концентрации Са 2+ и активацией системы вторичных посредников. Последнее приводит к появлению дополнительного количества возбуждающих рецепторов на постсинаптической мембране и увеличению их чувствительности к нейромедиаторам.
● Долговременная депрессия возникает при снижении количества и уменьшении чувствительности постсинаптических рецепторов.
Парабиоз (от греч. para — около, biosis — жизнь) — особое состояние нервной и мышечной ткани с изменением возбудимости и проводимости, возникающее под действием патогенных факторов. Развитие парабиоза связано с блокадой натриевых каналов мембраны нейрона. В зависимости от степени повреждения нервных волокон различают следующие фазы парабиоза:
уравнительная (при небольшом повреждении нерва) — ответная реакция на сильное и слабое раздражение одинакова;
парадоксальная — снижение реакции на сильное раздражение и более энергичный ответ на слабое раздражение;
тормозящая — никакие раздражения нерва не способны вызвать ответную реакцию.
Дата публикования: 2015-01-23 ; Прочитано: 2232 | Нарушение авторского права страницы
Во всех типах патологии на уровни клетки, нервных волокон и синапсов наблюдается нарушение мембранного потенциала. В норме соотношение калия и кальция равно 2. Например, люминал угнетает калиево-натриевый насос. Некоторые патологические факторы усиливают это, или вовсе блокируют (яды, токсины).
Патология со стороны нервного волокна: разрыхление или уплотнение миелиновой оболочки, а также нарушение мембранного потенциала осевого цилиндра нервного волокна.
На отрезанном конце нервного волокна осевой цилиндр распадается, остается шванновская оболочка в виде трубки, по нему может расти нервное волокно (1 мм в сутки), если не попадает в трубку растет невринома.
Патология в синапсах. В норме медиатор вызывает поток натрия во внутр постсинаптической мембраны, а калия - в синаптическую щель. Например, дифтерийный токсин блокирует на синапсе влияние симпатикуса на сердце. Накопление в синапсах норадреналина, повышает симпатическую возбудимость. Моноаминооксидаза разрушает норадреналин. А серотонин подавляет моноаминооксодазу.
Ацетилхолин в парасимпатических синапсах, разрушается холинэстеразой. Ацетилхолин накапливаясь много возбуждает, а затем блокирует передачу (мышцы, дыхательный центр).
Тормозной медиатор (глицин) вызывает гиперполяризацию, не допуская деполяризацию постсинаптической мембраны (вызывая поток калия в синаптическую щель, а хлора в пластинку). Стрихнин, столбнячный токсин таким же образом блокируют нервную передачу.
В вегетативной патологии имеет место и парабиоз- промежуточное состояние между жизнью и смерти. Это причина застойного возбуждения патологии в нервной ткани.
Вопрос 27.
Боль. Механизмы боли: рецепторный, проводниковый, центральный. Биологическое значение боли. Патофизиологические основы
Обезболивания
Боль - особый вид чувствительности, формирующийся под действием патогенного раздражителя, характеризующийся субъективно неприятными ощущениями, а также существенными изменениями в организме, вплоть до серьезных нарушений его жизнедеятельности и даже смерти (П.Ф. Литвицкий).
Путь боли: 1-нейрон в спинномозговых узлах, 2- нейрон в задних рогах сп мозга, далее спино-таламический путь,3-нейрон в зрительном бугре, 4-нейрон в теменной доле коры.
Боль защитного проявления-выброс адреналина, сужение сосудов, остановка кровотечения.
Иррадиация–распространение боли, напр. сердечные боли в область лопатки.Возможны и условнорефлекторные боли.
Физиологическая боль - в неповрежденной ткани, патотогическая -в поврежденной нервной тани. Раздражение токсинами, давлением рецепторов-рецепторная боль, проводниковая-когда передается по нервным волокнам,центральная-когда генерация боли из клеток ЦНС. Есть и участки, угнетающие боль. Торможение их усиливает боль. Как физиологическое понятие боль включает такие компоненты, как сознание, ощущения, память, мотивации; вегетативные, соматические и поведенческие реакции, эмоции.
Итак, боль может иметь сигнальное и патогенное значение. Болевые ощущения крайне важны для распознавания болезней, т.к. часто боль является первым и единственным анамнестическим признаком заболевания, заставляющим больного обратиться к врачу. Ощущение боли вызывают различные этиологические факторы, но их объединяет общее свойство — реальная или потенциальная опасность повредить организм. В связи с этим болевой сигнал обеспечивает мобилизацию организма для защиты от патогенного агента и охранительное ограничение функции поврежденной о органа.
Мобилизация организма для защиты от патогенного агента включает, например, активацию фагоцитоза и пролиферацию клеток, изменения центрального и периферического кровообращения и др. Важна и защитная поведенческая реакция на боль. направленная либо на "уход" от действия повреждающего фактора (например, отдергивание руки), либо на его ликвидацию (извлечение из кожи инородного тела и т.п.).
Ограничение функции органа или организма в целом формируется, например, при болях, характерных для инфаркта миокарда. Они сопровождаются страхом смерти, что заставляет пациента значительно ограничить двигательную активность, а это, в свою очередь, существенно снижает гемодинамическую нагрузку на повреждённое сердце.
Боль также может иметь патогенное значение. Она нередко является причиной и/или компонентом патогенеза различных болезней и болезненных состояний (например, боль в результате травмы может вызвать шок и потенцировать его развитие; боль при воспалении нервных стволов обусловливает нарушение функции тканей и органов„развитие общих реакций организма: повышение или снижение АД, нарушение функции сердца, почек).
Нейрофизиология и патогенез боли.Боль вызывают следующие этиологические факторы: 1) Механические (например, травма).
2) Физические (например, повышенная или пониженная температура, высокая доза ультрафиолетового облучения, электрический ток).
3) Химические (например, попадание на кожу или слизистые оболочки сильных кислот, щелочей, окислителей; накопление в ткани солей кальция или. калия).
4) Биологические (например, высокая концентрация кининов, гистамина, серотонина).
Чувство боли формируется на разных уровнях ноцицептивной системы: от воспринимающих болевые ощущения нервных окончаний до проводящих путей и центральных нервных структур.
Считают, что болевые (ноцицептивные) раздражители воспринимаются свободными нервными окончаниями (они способны реагировать на воздействие различных агентов как болевые). Вероятно, существуют и специализированные ноцицеппюрьс — свободные нервные окончания, активирующиеся только при действии ноцицептивных агентов (например, капсаицина — вещества, содержащегося в красном перце).
Сверхсильное (зачастую разрушающее) воздействие на мономодальные экстеро- и интерорецепторы (механо-, хемо-, терморецепторы и др.) также может привести к формированию ощущения боли.
Патогенные агенты, вызывающие боль (алгогены), приводят к высвобождению из поврежденных клеток ряда веществ (их нередко называют медиаторами боли), действующих на чувствительные нервные окончания. К медиаторам боли относят конины, гистамин, серотонин, высокую концентрацию Н + и К + , капсаицин, субстанцию Р, ацетилхолин, норадреналин и адреналин в нефизиологических концентрациях, некоторые простагландины. Однако, разные фрагменты субстанции Р могут вызывать противоположные эффекты — гипералгезию или аналгезию. Конечный эффект зависит от того, какой фрагмент субстанции Р и на какие структуры болевой чувствительности действует.
Порог возбуждения истинных ноцицепторов не является одинаковым и постоянным. В патологически измененных тканях (воспаление, гипоксия) он снижен, что обозначается как сентизация. При этом даже физиологические воздействия могут вызывать выраженные болевые ощущения. Сентизация может быть связана с действием многих биологически активных веществ, в частности простагландинов. Противоположный эффект — десентизация ноцицепторов возникает при действии тканевых анальгетиков и местноанестезируюших средств.
Соответственно двум механизмам восприятия боли проведение ее в нервные центры осуществляется по двум типам нервных волокон. Импульсы от мономодальных рецепторов различных органов, в первую очередь, кожных, проводится гю быстропроводящим тонким миелиновым волокнам группы А-гамма и А-дельта, а при возбуждении свободных нервных окончаний, главным образом, от внутренних органов — по медленнопроводящим безмиелиновым волокнам группы С.
Этот факт лежит в основе возникновения известного двойного ощущения боли. Ранняя боль, возникающая тотчас после нанесения болевого воздействия, является кратковременным сигналом о вредоносном раздражении. Она четко локализована и получила название эпикритической боли. Для ее проявления характерны эффекты, связанные, прежде всего, с активацией симпатической нервной системы общее возбуждение, тахикардия, учащение дыхания, повышение артериального давления, гипергликемия. По сути — все это проявления стрессорного воздействия. Эпикритическая боль отчетливо выражена при действии алгогенного фактора на кожу, слизистые оболочки.
Примерно через 1-2 с эпикритическая боль сменяется длительной, более интенсивной, диффузной болью, которая плохо локализуется пациентом. Это — так называемая протопатическая боль. Она отчетливо выявляется при повреждении внутренних органов и проявляется вагусными эффектами.
Вопрос 28.
Нарушения функций вегетативной нервной системы,
Их виды и механизмы
Повреждение гипоталамуса: передний отдел активирует парасимпатическую часть. Задний отдел активирует -симпатическую часть. Лабирины стимулируют гипофиз, статины ингибируют гипофиз.
Повреждение ядер переднего отдела вызывает сахарный диабет. Повреждение надзрительного ядра обусловливает уменьшение АДГ (полиурия), вызывает обезвоживание.
Повреждение среднего гипоталамуса: вентромдиального, дорсомедиального, паравентрикулярного, инфиндибулярного ядер вызывает расстройство обмена веществ, водно-солевого обмена.
Повреждение ядер заднего гипоталамуса (маммиллярные тела, серый бугор) вызывает расстройство менерального обмена.
Понижение тонуса симпатической части вызывает снижение АД, сужение зрачка, усиление перистальтики кишечника, сужение бронхов, брадикардию. Парасимпатическая часть оказывает действие обратного характера.
Вегетативные неврозы проявляются в форме сосудистой дистонии, неустойчивости функции ЖКТ.
С патологоанатомической точки зрения это заболевание представляет наибольшие трудности для диагностики, вызывая споры среди специалистов в отношении характерных гистопатологических изменений и диагностики по морфологической картине мозга. Полиморфизму клинической картины шизофрении и многообразию форм ее течения соответствует широкий диапазон морфологических изменений мозговой ткани — от случаев, где микроскопически выявляемые изменения мозговых структур практически отсутствуют, до картин, представляющих собой иллюстрацию изменений, отражающих тяжесть и глубину мозгового патологического процесса.
Изучение патоморфологии шизофрении имеет большую историю. Она ярко представлена в трудах многих отечественных и зарубежных исследователей. Первые работы в этой области относятся к концу XIX в. [Мащенко С. М., 1899; Nissl F ., 1899]. Особенно активно стали изучать это заболевание в начале XX в., и соответствующие исследования продолжаются до сих пор. В вопросы патологической анатомии шизофрении внесли большой вклад А. Л. Любушин (1902), Л. И. Омороков (1914), П. Е. Снесарев (1937, 1949, 1955, 1961), В. А. Гиляровский (1925, 1939, 1955), В. К. Белецкий (1937), Л. И. Смирнов (1955, 1956), А. П. Авцын (1960), A . Alzheimer (1900), Josephy (1923, 1930), C . Vogt , O . Vogt (194 8, 1949).
В отечественной нейроморфологии сформировалось представление о том, что патологический процесс, характеризующий шизофрению, можно определить как энцефалопатию, выраженную диффузными дистрофическими изменениями токсико-гипоксического характера и обусловленную обменными сдвигами в организме или в пределах самой нервной системы (в частности, в результате нарушения обмена медиаторов).
Макроскопически мозг при шизофрении, не осложненной возрастными и другими изменениями, не имеет каких-либо характерных особенностей за исключением своеобразной отечности (масса мозга в связи с этим несколько повышена).
Многие авторы обращали внимание на полиморфизм микроскопических клеточных изменений при шизофрении. Находили уменьшение количества нейронов, их атрофию, сморщивание и нагруженность липофусцином, отечность, острое и тяжелое заболевание клеток, их прямую и ретроградную дегенерацию, клетки-тени (кариоцитолиз) и другие изменения.
Частая находка при шизофрении — нагруженность клеток липофусцином (липоидный склероз, пигментная атрофия и т. п.). Существенно, что эти изменения не зависят от возраста больного, они бывают и у молодых пациентов. Этот тип изменений возможен как при острой, так и при хронической патологии нейрона.
При шизофрении встречается сочетание острых и хронических изменений клеток вплоть до обнаружения этих сдвигов в одной и той же клетке; (например, явления сморщивания и набухания). Наличие множества клеток с острым набуханием, ишемией, отечным состоянием и другими изменениями обычно свидетельствует об остроте и злокачественности процесса.
О топике и преимущественной локализации поражения нервных клеток в коре головного мозга при шизофрении до сих пор нет единого мнения. В соответствующих исследованиях называются поверхностные слои коры — III ,, V и VI . По распространенности патологического процесса выделяют изменения в области лобных, височных долей, аммоновом роге, отмечается поражение полей 3, 4, 6, 9, 10, Ц 20
21, 22, 39, 40, 44, 45 (очень редки изменения в полях 17, 18, 19). В патологический
процесс, помимо коры, вовлекаются и другие отделы мозга (подкорковые структуры
ствол мозга, гипоталамус, мозжечок).
Важной особенностью патоморфологической картины мозга при шизофрении является очаговостъ (мелкоочаговость) поражения ткани. Группы патологически измененных клеток и очаги их выпадения располагаются среди неизмененных клеточных элементов. Очаги выпадения (пустоты) не связаны с сосудами. Участки гистологически неизмененной ткани при электронной микроскопии также имеют нормальное строение.
В патоморфологической диагностике шизофрении большую роль играет оценка состояния глии. Характерной особенностью этого заболевания является снижение реактивности нейроглии: отсутствие пролиферативной реакции астроглии, атрофичность микроглии и регрессивные изменения олигодендроглии. В очагах выпадения нервных клеток отсутствует заместительный глиоз, свойственный другим патологическим процессам в нервной системе. Эти особенности, установленные относительно давно [Белецкий В. К., 1937; Снесарев П. Е., 1937; Александровская М. М., 1950; Смирнов Л. И., 1955], подтверждаются и в настоящее время, в том числе с помощью современных иммуноцитохимических исследований [ Jellinger К., 1985; Benes FM 1986; Roberts G . W ., 1986, 1988, 1989; Falkai P ., Bogerts В., 1986, 1988]. Обобщив многие данные литературы, K . F . Berman и D . R . Weinberger (1989) высказывают мнение, что глиальные реакции, встречающиеся в отдельных редких случаях шизофрении, могут не иметь отношения к этому заболеванию.
Существенный прогресс в изучении нейроморфологии шизофрении произошел в связи с проведением морфометрических исследований мозга не только на макроскопическом и микроскопическом (светооптическом), но и на ультраструктурном уровне. Они позволили выявить и количественно охарактеризовать изменения, которые невозможно было установить визуально. Это касалось изменений величины отдельных структур и тонких нарушений цитоархитектоники, проявляющихся изменением плотности расположения клеток, ориентации нейронов и их отростков, искажением разветвления отростков с изменением их арборизации, протяженности и др. ( Беличенко П . В ., 1989; Sheibel A. B. et al., 1981, 1987; Benes P. M., 1986, 1987; Casanova M. F., 1988, 1990]. Особенно большой интерес вызывают обнаруженные при шизофрении изменения межнейрональных связей на синаптическом уровне [Уранова Н. А., 1995; Haracz J . L ., 1985; Goldman - Rakic P . C ., Selemon L . D ., 1997]. В этом отношении особое внимание уделяется таким структурам, как дофаминергическая система мозга, в том числе префронтальной коре [Уранова Н. А., 1995, 1998; Habor S . N ., Fudge L . L ., 1997], и структурам височно-лимбического комплекса [ Bogerts В., 1997; Dwork A . J ., 1997].
Особый вариант как по клиническим, так и по анатомическим данным представляет собой так называемая гипертоксическая шизофрения [Ромасенко В. А., 1967]. В отличие от других форм шизофрении в этих случаях при макроскопическом исследовании обращают на себя внимание отек и набухание мозга, его резкое полнокровие с выраженной гиперемией мягких мозговых оболочек и вещества, кровоизлияния, преимущественно точечные. Гистопатологическая картина мозга во многих случаях определяется дисциркуляторным синдромом. В нервных клетках различных отделов мозга выявляются острые изменения: набухание тел клеток и отростков, хроматолиз, кариоцитолиз, ишемические изменения, вакуолизация, периваскулярные кровоизлияния, отеки, плазморрагии и т. п. Наряду с острыми возможны и хронические изменения нервных клеток — сморщивание, атрофия, липоидный склероз. В микроглии и олигодендроглии преобладают пролиферативно-дистрофические процессы, астроциты часто с острыми дистрофическими изменениями типа клазматодендроза и зернистого распада. Гистопатология внутренних органов при гипертоксической шизофрении характеризуется дистрофией паренхимы, застойным полнокровием и отеком органов; нередки пятнистые и точечные кровоизлияния в них, а также в коже. Однако ни одну из обычных форм патологии внутренних органов в этих случаях диагностировать не удается.
В связи с интенсивной терапией для спасения жизни больного гипертоксической шизофренией (включая реанимационные мероприятия) в морфологической картине в этих случаях могут отсутствовать резко выраженное набухание мозга, кровоизлияние во внутренние органы и другие изменения.
С практической точки зрения важно учитывать видоизменения гистопатологической картины мозга при сочетании шизофрении с атеросклерозом и гипертонической болезнью. Важнейшие из них — разрежение нервных клеток вокруг и вне сосудов, нарушения сосудистой стенки в виде разрыхления, набухания, дистрофии эндотелиальных элементов, плазматическое пропитывание сосудистых стенок и околососудистая глиозная и лимфоидно-клеточная пролиферация, ишемические изменения нервных клеток, пролиферативные изменения астроглии и олигодендроглии при почти полной пассивности микроглии [Заико Ю. В., 1972].
В прозекторской практике необходимо принимать во внимание и изменения, привносимые в морфологическую картину шизофрении общим и лекарственным патоморфозом заболевания. В настоящее время даже при длительном течении заболевания редко встречается картина широко распространенного сморщивания нейронов, стала меньшей выраженность сморщивания и значительно усилилась полиморфность клеточных изменений.
У больных шизофренией, как правило, анатомически выраженных соматических нарушений не обнаруживается. Отклонения сердечно-сосудистой, эндокринной и других систем и органов носят функциональный характер. Примером могут служить эндокринные сдвиги. У части больных возможны признаки ожирения (гипоталамического типа), гирсутизма, инфантилизма, не обусловленные грубой анатомической патологией желез. Морфологическая картина эндокринной системы при шизофрении в 24 % случаев соответствует норме, а в остальных отражает гипофункцию (30 %), стресс-синдром (33 %) и дисфункцию (12 %) [Сколярова НА., 1979]. Электронно-микроскопическое исследование показало достаточно высокую активность лимфоидной ткани больных: выраженная пиноцитозная активность ретикулярных клеток и макрофагов, большое число бластных форм лимфоцитов, плазматических клеток и активированных лимфоцитов в лимфатических узлах [Аверкин B . C ., Бонарцев П. Д., Савулев Ю. И., 1976]. Это дает основание пересмотреть прежние представления о пониженной реактивности (в частности, иммунологической) больных шизофренией.
Анатомические изменения мозга у больных шизофренией, умерших в возрасте далеко за 80 лет, соответствуют картине сенильной деменции, но иногда собственно сенильные изменения могут быть маловыраженными.
20.1. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ НЕРВНЫХ РАССТРОЙСТВ
20.1.1. Причины и условия возникновения нарушений деятельности нервной системы
Патогенные факторы, вызывающие повреждения нервной системы (НС) и нарушение ее деятельности, имеют экзогенную либо эндогенную природу. Экзогенные патогенные факторымогут быть специфически, избирательно нейротропными,поражающими определенные структуры НС, и неспецифическими,повреждающими не только нервные, но и другие тканевые элементы. К экзогенным факторам, поражающим нервную систему, относятся биологические возбудители: вирусы (бешенство, полиомиелит), микробы (лепра), растительные токсины (стрихнин, кураре), микробные токсины (ботулинический, столбнячный), спирты (этиловый, метиловый), ядохимикалии (хлорофос), отравляющие вещества и др. Специфическим для человека патогенным фактором является слово. Оно может вызвать нарушения психической деятельности, поведения, расстройства различных функций. Нарушения деятельности нервной системы и нервной регуляции функций могут быть вызваны условнорефлекторно.
Эндогенные патогенные факторыделятся на первичные и вторичные. К первичнымотносятся наследственные нарушения деятельности генетического и хромосомного аппаратов нейронов, с ними связаны наследственные болезни нервной системы (болезнь Дауна, эндогенные психозы и др.), нарушения кровообращения в различных отделах ЦНС, ишемия и др.
К вторичнымэндогенным патогенным воздействиям относятся те, которые возникают в самой нервной системе после повреждающего действия первичных агентов в ходе развития патологического процесса. Это - изменения нейронов, нарушение выделения и рецепции ней-ромедиаторов, приобретенные альтерации генома нейронов, изменения межнейрональных от-
ношений, нервной трофики и др. Универсальное патогенетическое значение имеет формирование агрегатов гиперактивных нейронов, представляющих собой генераторы патологически усиленного возбуждения (сокращенно - генераторы), образование патологических детерминант и патологических систем. Важную роль патогенного фактора играют антитела к нервной ткани, образующиеся, как правило, на более поздних стадиях патологического процесса.
Возникновение вторичных эндогенных патогенных факторов означает этап эндогенизациипатологического процесса. На этом этапе непосредственной причиной развития процесса являются уже не первичные, а вторичные эндогенные механизмы, присущие самой измененной нервной системе. Однако этиологические первопричины и на этом этапе не теряют своего значения - их патогенное действие ведет к новым повреждениям, к усилению уже возникших или к появлению новых вторичных эндогенных патогенных механизмов.
Понимание указанных особенностей патогенеза и знание механизмов каждой стадии развития патологического процесса необходимы для проведения адекватной патогенетической терапии. Так, бесполезно лечить вызванные столбнячным токсином поражения ЦНС только противостолбнячной сывороткой, нейтрализующей столбнячный токсин, так как последний уже связался с нервными элементами и вызвал соответствующие изменения в ЦНС (в частности, повреждение белков, участвующих в выделении тормозных передатчиков). Терапия на этой стадии должна быть направлена на устранение последствий действия столбнячного токсина (подавление гиперактивности нейронов, борьба с с УД°Р° г ами и др.). Применение противостолбнячной сыворотки на данной стадии необходимо для нейтрализации новых порций столбнячного токсина, продуцируемого в ране столбнячной палочкой.
Реализация патогенных воздействий зависит от их силы и продолжительности - чем сильнее и длительнее эти воздействия, тем значительнее их эффект. Однако даже слабые патогенные воз-Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
Факторы, не вызывающие патологии исходно нормальной нервной системы, могут приобрести патогенное значение для нервной системы, измененной предыдущими патологическими процессами, при генетически обусловленной предрасположенности, при повышенной возбудимости и пр. Лимбические структуры, в частности гиппокамп, более других способны развивать и удерживать патологическую гиперактивность, которая может быть вызвана даже однократным патогенным воздействием.
Важную роль в сохранении патологических эффектов играет пластичность нервной системы- способность закреплять возникшие изменения. Это свойство имеет существенное значение для нормальной деятельности нервной системы. Оно обеспечивает возможность ее развития, образования новых связей, обучения, структурных перестроек и др. Однако пластичность -слепая сила, она закрепляет не только биологически полезные, но и патологические изменения, которые играют роль патогенного фактора. Благодаря пластичности закрепляются возникшие структурно-функциональные патологические изменения в нервной системе (например, синап-гические нарушения, образовавшиеся генераторы возбуждения, патологические системы и др.). С пластичностью связаны во многих случаях хронизация патологического процесса и его устойчивость к лечебным воздействиям.
20.1.2. Две стороны патогенеза
нервных расстройств
На уровне межнейрональных отношений такой интеграцией является агрегат гиперактивных нейронов, на уровне межклеточных отношений - новая патодинамическая организация, состоящая из измененных отделов ЦНС - патологическая система. Таким образом, собственно патологическая часть процесса характеризуется не только разрушением, но и формированием патологических интеграции - агрегата нейронов и патологической системы: происходит разрушение физиологических и формирование патологических систем.
20.1.3. Поступление патогенных
агентов в нервную систему
Существуют два основных пути поступления патогенных агентов в ЦНС - из крови(через сосудистую стенку) и по нервным стволам.
В первом случае патогенный агент (токсическое вещество, вирусы, микробы и др.) должен преодолеть гематоэнцефалический барьер (ГЭБ), который образуется сосудистой стенкой (эндоте-лиоцитами), а также глиальными элементами (астроцитами). ГЭБ осуществляет активный и избирательный транспорт из крови в мозг питательных и других биологически активных веществ, необходимых для деятельности мозга. Одновременно он защищает мозг от непосредственного действия находящихся в крови патогенных агентов. У плодов и новорожденных ГЭБ более проходим. Ряд токсических агентов (стрих-
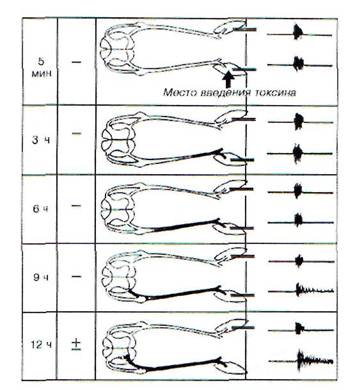 |
Рис. 182. Продвижение столбнячного токсина по невральному пути и развитие местного столбняка. Токсин, введенный в икроножную мышцу крысы, поступает отсюда через мионевральный синапс в двигательные волокна и по ним, через передние корешки, достигает передних рогов люмбосакраль-ных сегментов спинного мозга, где действует на систему эфферентного выхода (мотонейроны и связанные с ними вставочные нейроны), нарушая тормозные механизмы этих нейронов. Вследствие этого указанные нейроны растормаживаются, гиперактивируются и образуют генератор патологически усиленного возбуждения, который продуцирует поток импульсов: последние поступают по двигательным волокнам в мышцу и вызывают повышение электрической активности (ЭА) и тоническое сокращение (гипертонус) мышцы. Скорость и интенсивность развития процесса зависят от дозы столбнячного токсина. При избранной болезнетворной дозе токсин достигает передних рогов у крысы через 9 ч; в этот период в мышце впервые регистрируется незначительная ЭА, сохраняющаяся после активности, вызванной нанесением раздражения (сдавливание стопы). С течением времени по мере поступления токсина в передние рога и увеличения мощности генератора продуцируемый им поток импульсов усиливается, ЭА в мышце возрастает, появляется небольшой (+) гипертонус мышцы. Участки нерва, переднего корешка и переднего рога, содержащие столбнячный токсин, затемнены
нин, спирты, некоторые фармакологические препараты) сравнительно хорошо проходит ГЭБ. Для биологических возбудителей (вирусы, микробы) в норме ГЭБ практически непроницаем. Однако в условиях патологии, при действии ряда физических и химических факторов возникает патологическая проницаемость ГЭБ, что приводит к утяжелению текущего или возникновению нового патологического процесса. Так, сильный длительный стресс способствует поступлению вируса гриппа в мозг.
Путями поступления ряда патогенных агентов в ЦНС являются нервные стволы. Невраль-ный путь характерен для столбнячного токсина, вирусов полиомиелита, бешенства и др. Входными воротами для столбнячного токсина является мионевральный синапс, откуда токсин поступает по двигательным волокнам в спинной и продолговатый мозг (рис. 182). В ЦНС токсины (столбнячный), вирусы, антитела к нервной ткани могут распространяться от нейрона к нейрону внутри нервных отростков (с аксотоком) и по межнейрональным пространствам. Этот невраль-ный путь является одним из механизмов генерализации патологических процессов.
20.1.4. Механизмы защиты нервной системы
К тканевым барьерным механизмам следует добавить также защитную функцию различных оболочек мозга и нервов. Защиту нейрона и его отростков обеспечивают окружающие глиальные и шванновские клетки, а также мембрана самого нейрона. Нервная система защищена также иммунологическим барьером, который состоит из клеточных и гуморальных механизмов общей иммунной системы организма и собственной иммунной системы ЦНС, куда входят иммуно-циты и глиоциты; последние способны превращаться в макрофаги и осуществлять поглощение и переваривание вирусов, а также погибших и необратимо поврежденных нейронов.
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
 |
ленный, антагонистический характер. В условиях патологии указанный принцип реализуется в деятельности антисистем (Г. Н. Крыжановс-кий), антагонистически по отношению к патологическим системам. Антисистема активируется или формируется вместе с образованием патологической системы, ограничивая развитие последней и подавляя ее деятельность. Например, при возникновении чрезмерной боли активируется антиноцицептивная система, регулирующая болевую чувствительность, активация антиноци-цептивной системы купирует возникновение болевого синдрома.
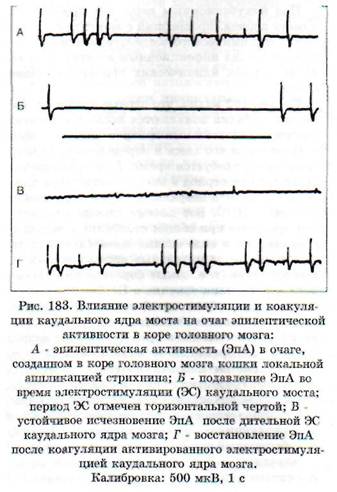
Антиэпилептическая система контролирует уровень возбуждения в различных отделах ЦНС. Электрическая стимуляция каудального ядра моста, относящегося к антиэпилептической системе, подавляет активность в эпилептическом очаге в коре головного мозга, вызванном аппликацией стрихнина (рис. 183, Б). Подавляющий
эффект может продолжаться и после прекращения электростимуляции ядра моста (рис. 183, В). Коагуляция гипервозбужденного ядра ведет к восстановлению эпилептической активности в корковом очаге (рис. 183, Г).
Тоническая активность антисистемы является одним из механизмов поддержания устойчивого состояния здоровья. Недостаточная деятельность антисистем представляет собой условие развития патологического процесса. Например, недостаточность антиноцицептивной системы ведет к появлению повышенной болевой чувствительности и к формированию болевых синдромов; недостаточность антиэпилептической системы обусловливает предрасположенность к судорогам.
Весь комплекс разнообразных процессов, предотвращающих возникновение и развитие патологических изменений, обеспечивающих ликвидацию этих изменений, компенсацию и восстановление разрушенных функций, составляет класс саногенетических механизмов (С. М. Павленко).
20.1.5. Выпадение функций нервной системы
Выпадение той или иной функции нервной системы может быть обусловлено либо разрушением, либо угнетением деятельности структур, осуществляющих данную функцию. Примером выпадения функции вследствие повреждения (разрушения) структуры может быть вялый паралич мышцы при гибели иннервирующих ее мотонейронов спинного мозга, пораженных вирусом полиомиелита, либо при перерыве или дегенерации двигательного нерва. При повреждении структур, относящихся к сенсорным системам, выпадают соответствующие виды чувствительности (болевая, зрительная и пр.).
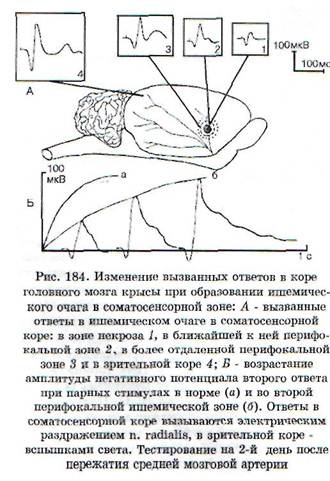 |
нейронов из выполнения функции увеличивается степень функционального дефекта; такая ситуация имеет место при полиомиелите, травмах ЦНС и др. Восстановление в том или ином объеме функции при лечебных воздействиях связано не с регенерацией нейронов (нейроны не регенерируют), а с улучшением состояния и нормализацией деятельности обратимо поврежденных нейронов и со снятием охранительного торможения.
Выпадение функции при возникновении структурных дефектов проявляется не сразу. Оно происходит тогда, когда повреждение достигло такого размера, что уже стали недостаточными механизмы компенсации и перекрытия нарушенной функции. Иначе говоря, на этой стадии патологический процесс достиг значительногоразвития, а не начинается,как принято думать. В таких случаях врач имеет дело с уже довольно запущенным состоянием. Вот почему тера-
пия бывает не всегда эффективна даже на этой, ранней, стадии и столь важна диагностика патологических изменений на доклиническойстадии процесса.
Выпадение функции, обусловленное угнетением деятельности структур ЦНС, может возникнуть также при усиленной активности тех отделов ЦНС, которые в норме оказывают тормозное влияние. Так, если гиперактивируются отделы продолговатого мозга, которые в норме оказывают тормозное влияние на рефлексы спинного мозга, то последние испытывают глубокое торможение и связанная с ними функция выпадает. Известны рефлекторные выпадения чувствительности, истерические параличи, суггестивные (самовнушаемые, или гипнотические) нарушения движений и чувствительности и другие феномены тормозного подавления функции.
Читайте также:


