Печеночная энцефалопатия уровень билирубина
Билирубиновая энцефалопатия (именуемая также ядерной желтухой) - состояние, характеризующееся гибелью мозговых клеток вследствие токсического влияния на них высокой концентрации билирубина (непрямой фракции). Подобное состояние наиболее часто встречается у новорожденных и требует немедленного лечения, в противном случае может привести к инвалидизации и даже гибели пациента.
Этиология болезни
Возможные причины билирубиновой энцефалопатии у новорожденных следующие:
- гемолитическая болезнь (резус- либо групповая несовместимость мамы и малыша);
- сахарный диабет у матери;
- сепсис новорожденного;
- травматизация ребенка при родах с формированием обширных гематом;
- токсоплазмоз (внутриутробное заражение);
- желтуха у недоношенных деток.
Под влиянием какого-либо из перечисленных процессов непрямой билирубин (то есть непереработанный гепатоцитами) в большом количестве выбрасывается в кровь, оказывая нейротоксическое воздействие на мозговые ткани.
Патоморфологические признаки
Поверхность головного мозга имеет бледно-желтый оттенок. Срез препарата выявляет характерную желтую окраску мозговых структур (мозжечка, гиппокампа, таламуса, ствола и других). Однако непрокрашенные области также претерпевают патологические изменения.
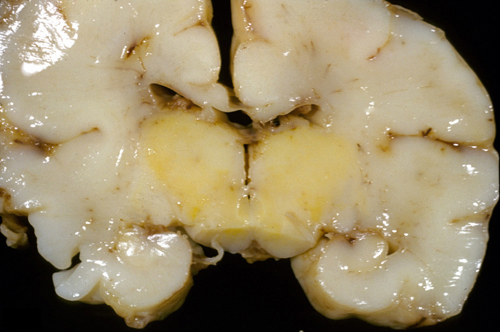
В пораженных областях вследствие гибели нейронов формируется глиоз и происходит атрофия нервной ткани. При этом патоморфологическая картина сходна с таковой при гипоксическом поражении, а значит, с большой долей вероятности можно предполагать, что несвязанный билирубин, повреждая клеточные мембраны, приводит к нарушениям утилизации кислорода в мозговых тканях. А гипоксическое повреждение приводит к еще большему увеличению чувствительности нейронов к токсическим эффектам билирубина.
То есть, ядерная желтуха (билирубиновая энцефалопатия) - это не только изменение окраски мозговых структур под действием билирубина. Это также целый ряд патологических специфических процессов, происходящих на уровне клетки.
Билирубиновая энцефалопатия у взрослых
Причины поражения мозговых структур билирубином у взрослых кроются в тяжелых декомпенсированных патологиях печени (циррозы, гепатиты).
Недуг у взрослых развивается постепенно и сопровождается нарастанием неврологической симптоматики. При этом на первый план выходят нарушения психики и двигательной активности, проявляющиеся бессонницей, когнитивными изменениями, понижением активности и так далее.
Клинические проявления
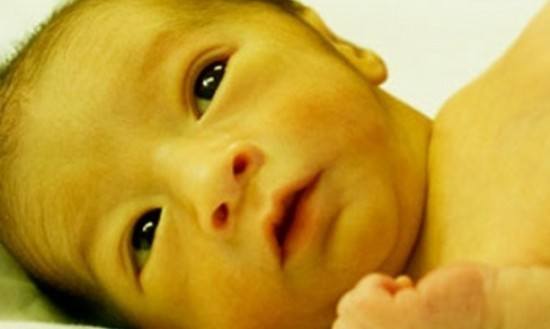
Чаще всего первые признаки патологии возникают у доношенных деток на 2-5 сутки, а у недоношенных - на 7 сутки. Но присутствие гипербилирубинемии может приводить к развитию недуга в течение всего времени новорожденности (до 28 суток).
Ранние симптомы такой энцефалопатии неспецифичны и могут совпадать с таковыми при гипогликемии, сепсисе, внутричерепных кровоизлияниях, гипоксии и других патологических острых состояниях новорожденного.
Как правило, первыми признаками начинающегося поражения мозга становятся снижение сосательного рефлекса, сонливость, пропадание рефлекса Моро. По мере ухудшения (прогрессирования) болезни пропадают сухожильные рефлексы, нарушается дыхание, возникает опистотонус, большой родничок напряжен, лицевые мускулы и мышцы конечностей судорожно подергиваются, ребенок пронзительно кричит.
Затем появляются судороги, сопровождающиеся резким разгибанием ручек и поворотом кистей, сжатых в кулачки, вовнутрь.
Дальнейшая активность процесса часто приводит к гибели, в другом случае состояние ребенка улучшается, и развитие соответствует норме. Однако к году вновь возникает ригидность мускулов, опистотонус и гиперкинезы. Ко второму году жизни судороги и опистотонус исчезают, однако непроизвольные беспорядочные движения, сочетающиеся с гипотонией либо ригидностью мускулов сохраняются и приобретают устойчивый характер.
В трехлетнем возрасте билирубиновая энцефалопатия у детей обретает стойкий и четкий характер, что проявляется тугоухостью на звуки с высокой частотой, хореоатетозом, судорогами, дизартрией, косоглазием, олигофренией, экстрапирамидными нарушениями. Иногда встречается атаксия, гипотония и пирамидные расстройства.
При легком течении билирубиновой энцефалопатии последствия могут проявляться в виде тугоухости, умеренных либо легких нарушений двигательной координации, синдрома гиперактивности в сочетании с нарушенным вниманием (минимальная мозговая дисфункция). Такие симптомы могут сочетаться либо присутствовать по отдельности. При этом энцефалопатия может быть не диагностирована вплоть до поступления в школу.
Стадийность процесса
Патология имеет четыре стадии развития:
- Симптомы билирубиновой энцефалопатии неспецифичны: присутствует слабость, рвота, монотонный безэмоциональный крик. Тонус мышц и аппетит снижены.
- Появляются симптомы энцефалопатии, конечности малыша согнуты, разогнуть их при этом невозможно, подбородок приведен к груди, ребенок неестественно вскрикивает. В некоторых случаях возможна гипертермия и эпизоды апноэ.
- Состояние больного (чаще 10-12 сутки жизни малыша) заметно улучшается, однако явление это не связано с выздоровлением, напротив - процесс прогрессирует. Скованность мышц отступает, отсутствуют судороги.
- Развивается на 2 месяце жизни малыша. Симптоматика нарастает. Присутствуют признаки, сходные с таковыми при церебральном параличе. Ребенок значительно отстает в психоэмоциональном и физическом развитии.
Диагностические мероприятия
Гипербилирубинемия может расцениваться как физиологическая только в случаях исключения абсолютно всех патологических факторов ее появления. Беря во внимание тот факт, что гипербилирубинемия наиболее часто является следствием гемолитических либо физиологических причин, обследование пациента должно включать следующие анализы:
- исследование крови (общее) с обязательным вычислением количества ретикулоцитов и микроскопией кровяного мазка;
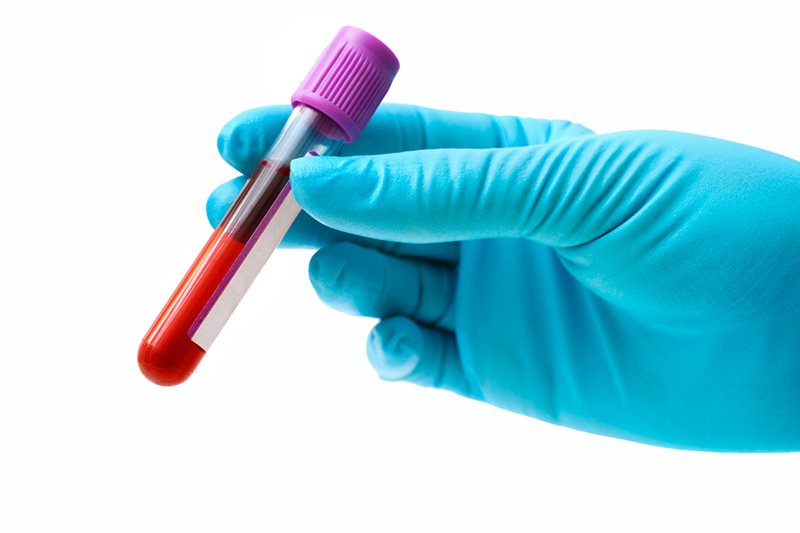
- проба Кумбса (непрямая и прямая);
- выяснение групповой и резус-принадлежности крови матери и малыша;
- определение количества непрямого и прямого билирубина;
Увеличение содержания в пуповинной крови билирубина, наличие симптомов желтухи в первые сутки жизни, если уровень неконъюгированной фракции более 34 мкмоль/л указывают на присутствие патологической желтухи.
В некоторых случаях могут назначаться при билирубиновой энцефалопатии МРТ, УЗИ и КТ.
Терапия состояния
Терапией ядерной желтухи у малышей (вне зависимости от ее стадии) занимается детский невропатолог. Как правило, таких деток госпитализируют.
Лечение недуга у взрослого также проводится в условиях стационара под постоянным контролем врача.
Лечение заболевания заключается в ликвидации причин гипербилирубинемии и восстановлении нормальной концентрации билирубина в крови. В качестве лечения при этом используется фототерапия.
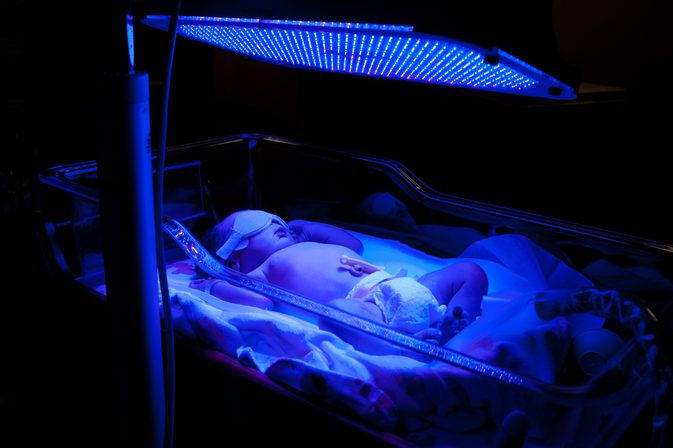
Под влиянием излучения токсичный непрямой билирубин трансформируется в особый изомер, который легко выводится почками и печенью и при этом не связывается с кровяными альбуминами. В случаях, когда концентрация билирубина под влиянием фототерапии не понижается, назначается переливание плазмы.
Если предыдущие методики оказались неэффективными, либо симптоматика стремительно нарастает, пациенту назначаются прямые переливания крови.
Применяемые препараты
Если по каким-то причинам прямое переливание невозможно, назначаются лекарства, влияющие на синтез и трансформацию билирубина ("Протопорфирин").
Вследствие того, что ядерная желтуха - результат токсического воздействия билирубина на нейроны, в лечении ее всегда применяются нейропротекторы.
При наличии показаний назначается противосудорожное лечение.
В случае гемолитической болезни с наличием прямой положительной реакции Кумбса эффективны внутривенные вливания иммуноглобулина.
Частота возникновения, последствия и прогнозы
Согласно данным аутопсии, ядерная желтуха возникает у новорожденных в любом гестационном возрасте при отсутствии адекватной терапии гемолитической болезни и концентрации билирубина свыше 25-30 мг.
Частота возникновения недуга у недоношенных деток с гипербилирубинемией варьируется от 2 до 16 %. Более точные цифры определить невозможно вследствие большого разнообразия симптомов болезни.
Присутствие выраженного неврологического симптомокомплекса является неблагоприятным прогностическим признаком. Так, летальность при этом доходит до 75 %, а 80 % выживших пациентов имеют двусторонний хореоатетоз, сопровождающийся мышечными непроизвольными сокращениями. Кроме того, достаточно часто встречаются осложнения в виде глухоты, олигофрении и спастической тетраплегии.
Детки с гипербилирубинемией в анамнезе должны быть обязательно обследованы на предмет глухоты.
Несмотря на улучшение диагностики, ядерная желтуха все же имеет место. Встречается информация о возникновении ее на фоне гипербилирубинемии без наличия каких-либо причин. А потому специалисты рекомендуют проводить обязательный контроль билирубина на 1-2 день жизни всем новорожденным, дабы выявить пациентов с высокой вероятностью развития тяжелой гипербилирубинемии и, как следствие, энцефалопатии.
Профилактические меры
Важно обязательное исследование концентрации билирубина в случае возникновения желтухи в первый день жизни, а при наличии гипербилирубинемии - исключение развития гемолитической болезни.
Обязателен контроль состояния младенца в течение 3 суток после выписки, особенно это касается недоношенных (до 38 недель) деток, которые были выписаны из родильного отделения до наступления 2 суток жизни.
Частота наблюдения обуславливается возрастом, при котором малыш был выписан, и присутствием факторов риска. Некоторых деток наблюдают в течение суток. Спрогнозировать риски можно, оценив уровень почасового прироста билирубина.

Желтуха представляет собой симптом, при котором в крови и биологических жидкостях повышается содержание билирубина.
- Что такое билирубин
- Обмен билирубина
- Почему развивается механическая желтуха
- Клинические проявления
- Осложнения желтухи
- Диагностика желтухи
- Лечение желтухи
Что такое билирубин
Билирубин — это желчный пигмент, главный компонент желчи. Он образуется в результате метаболизма гемоглобина, миоглобина и цитохрома. Билирубин в крови находится в двух видах — свободный и связанный (прямой и непрямой). В норме уровень общего билирубина колеблется от 5 до 17-21 мкмоль/л (в зависимости конкретной лаборатории).
Обмен билирубина
В результате разрушения гемоглобина происходит образование непрямого билирубина, который поступает в кровь. В среднем, за сутки у человека разрушается 1% эритроцитов, что приводит к образованию 100-250 мг билирубина. С током крови он попадает в печень, где печеночные клетки его захватывают и связывают с глюкуроновой кислотой. Таким образом, происходит образование прямого билирубина. Он приобретает водорастворимые свойства и способен растворяться в желчи. Вместе с ней он поступает в кишечник и выводится из организма с каловыми массами.
В норме в крови должно находиться небольшое количество билирубина, который транспортируется из органов РЭС в печень, но бывают состояния, когда нарушается процесс его обмена и его концентрация в крови увеличивается. Такое состояние называется гипербилирубинемия. Когда билирубина очень много, он выходит из кровеносного русла и пропитывает окружающие ткани, что вызывает синдром желтухи.
Увеличение билирубина в крови может произойти по одной из следующих причин:
- Усиленный распад эритроцитов — гемолитическая анемия. При этом в крови увеличивается содержание непрямого билирубина. Такое состояние называется гемолитической или надпеченочной желтухой.
- Заболевания печени. При некоторых заболеваниях печени происходит разрушение ее клеток и выход их содержимого в кровоток. Поскольку гепатоциты содержат большое количество билирубина, то происходит и его повышение в крови и развивается гипербилирубинемия. Такое состояние называется печеночной желтухой.
- Нарушение свободного прохождения желчи в тонкий кишечник. Она накапливается в желчных протоках, вызывая в них повышение давления, что в конечном итоге приводит к увеличению проницаемости их стенок и попаданию билирубина обратно в кровоток. Такое состояние называется подпеченочной или механической желтухой.
Есть и другие причины гипербилирубинемии, но они встречаются редко и не имеют существенного клинического значения.
Тяжесть симптомов при желтухе напрямую зависит от уровня общего билирубина:
- Легкая желтуха — уровень билирубина не превышает 85 мкмоль/л.
- Среднетяжелая желтуха. Уровень билирубина находится в пределах 86-169 мкмоль/л.
- При тяжелой желтухе уровень билирубина превышает 170 мкмоль/л.
При полной обтурации желчевыводящих путей нарастание билирубина происходит стремительно, на 30-40 мкмоль/л/сутки.
Почему развивается механическая желтуха
Пороки развития гепатобилиарной системы:
- Атрезии и гипоплазии желчных путей.
- Кисты желчного протока.
- Дивертикулы 12-перстной кишки.
Невоспалительные и воспалительные заболевания ЖВП:
- Холангиолитиаз — желчные камни, которые обтурируют просвет желчного протока.
- Стриктуры и стеноз желчных протоков.
- Холангиты.
- Холециститы.
- Панкреатиты.
- Кисты головки поджелудочной железы.
- Рак желчных или печеночных протоков.
- Рак печени.
- Рак поджелудочной железы.
- Метастатическое поражение печени.
- Доброкачественные опухоли — папилломатоз желчных протоков.
- Эхинококк.
- Альвеококк.
Клинические проявления
Характерным и ярким клиническим признаком является пожелтение кожных покровов, слизистых оболочек и склер (белков глаз). По сути, в желтый цвет окрашиваются все биологические жидкости организма, кроме слюны и слез. Желтушность кожи связана с пропитыванием тканей билирубином из-за его высокого содержания в крови.

Холестаз — это прекращение выделения желчи в кишечник. Она остается в протоках, накапливается там и, в конце концов, всасывается обратно в кровь. Все вместе это приводит к следующим проявлениям:
Ахолия — это симптомокомплекс, который развивается, когда желчь не поступает в кишечник. Это приводит к нарушению пищеварения. В первую очередь, страдает пищеварение жиров. Они не всасываются и выделяются вместе с калом. Такое состояние называется стеаторея. Также нарушается метаболизм белков и витаминов, особенно жирорастворимых, в том числе витамина К, который необходим для синтеза факторов свертывания крови. Это, в свою очередь, приводит к кровоточивости. Также в норме желчь оказывает бактерицидное действие. Соответственно, при ее отсутствии начинает нарушаться соотношение кишечной флоры в сторону преобладания анаэробов.
Желчь оказывает стимулирующее действие на перистальтику кишечника. Соответственно, при ее отсутствии возникают запоры, которые сменяются зловонными поносами из-за разжижения кишечного содержимого гнилостной микрофлорой. Отсутствие желчных пигментов в кале приводит к его обесцвечиванию — ахоличный кал.
Застой желчи в протоках приводит к тому, что она меняет свои физические и химические свойства, что в конечном итоге способствует образованию камней.
Осложнения желтухи
Высокая гипербилирубинемия и желтуха являются жизнеугрожающими состояниями и могут привести к летальному исходу, даже после устранения причин, ее вызвавших.
При разрушении гепатоцитов, в кровь выходит большое количество токсических веществ, которые оказывают системное действие. Нарастают функциональные нарушения, развивается почечно-печеночный синдром. Билирубин проникает через гематоэнцефалический барьер и вызывает нарушение работы головного мозга (печеночная энцефалопатия), которая сопровождается оглушенностью сознания, вплоть до комы.
Отмечено также токсическое действие билирубина на сурфактант — важный компонент легких. При его повреждении развивается дыхательная недостаточность. Нарушение продукции факторов свертывания крови приводит к развитию ДВС-синдрома.
Диагностика желтухи
- Лабораторное обследование. Определение уровня билирубина в крови. Определяется прямой и непрямой билирубин. Для механической желтухи характерна билирубинемия за счет увеличения прямого билирубина. Также повышается уровень холестерола, липидов и щелочной фосфатазы, что указывает на развитие холестаза.
- УЗИ печени и желчных протоков. Данное исследование позволит обнаружить расширение просвета желчных протоков, утолщение их стенки, а в некоторых случаях определить причину обструкции (опухоли). При наличии анэхогенных камней, УЗИ может их не показать.
- КТ брюшной полости с контрастным усилением. Проводится для определения причины обструкции, которая не была выявлена на предыдущем этапе.
- Ретроградная холангиопанкреатография. Данная процедура сочетает в себе эндоскопические и рентгенологические технологии. С помощью эндоскопа в фатеров сосочек вводят рентгеноконтрастное вещество и делают серию снимков. Исследование позволяет визуализировать протоки и обнаружить места их обтурации (перекрытия).
- Чрескожная чреспеченочная холангиография. Проводится пункция внутрипеченочного желчного протока через брюшную стенку под контролем УЗИ. После этого проток заполняют рентгеноконтрастным веществом и делают снимки.
Лечение желтухи
Механическая желтуха требует хирургического лечения. На первом этапе проводится медикаментозная терапия, направленная на уменьшение токсического действия билирубина. В рамках хирургического лечения применяют следующие технологии:
При обтурации протока конкрементами применяют литотрипсию — разрушение и удаление камней из просвета протоков. Для этого могут использоваться эндоскопические технологии, лазерное, электрогидравлическое, или ультразвуковое дробление камней.
Если имеется обтурация из-за стеноза, стриктуры или компрессии опухолью, проводится стентирование, бужирование или балонная дилятация места сужения. Выбор метода лечения зависит от причин, вызвавших обструкцию.
Данные мероприятия проводятся эндоскопически через 12-перстную кишку. Если это невозможно, применяется чрескожное чреспеченочное дренирование желчного протока, при котором в него устанавливается дренажный катетер, отводящий желчь в специальный приемник. После стабилизации состояния пациента и устранения токсического действия гипербилирубинемии, делают попытку наладить нормальный пассаж желчи до 12-перстной кишки. С этой целью применяются полноценные операции.
На пике гипербилирубинемии полноценные операции на билиарной системе проводятся только при наличии строгих показаний, в основном они выполняются в плановом порядке.
Экстренные операции для лечения желтухи:
- Холецистостомия — установка в просвет протока желчного пузыря дренажа, который будет отводить желчь в 12-перстную кишку. Проводится открытым доступом или лапароскопически. Применяется при панкреатитах.
- Дренирование по Холдсену — в общий желчный проток устанавливается дренаж, который выводится на брюшную стенку.
Плановые операции при лечении желтухи:
- Холедохолитотомия — рассечение желчного протока и удаление из него конкремента.
- Наложение обходных анастомозов, например, холедоходуоденостомия, холедохоэнтеростомия и др. Используются в онкологии при обширных опухолевых изменениях, а также при грубой деформации желчевыводящих протоков.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
В клинической практике важно отличать печеночную энцефалопатию, развивающуюся при острых и хронических заболеваниях печени. В целом симптоматика сходна, но при острых поражениях печени все проявления печеночной энцефалопатии прогрессируют значительно быстрее, чем при хронических.
Наиболее часто приходится дифференцировать печеночную энцефалопатию и печеночную кому от нарушений мозгового кровообращения, уремической, хлоропенической, алкогольной и других ком. Обычно больших дифференциально-диагностических трудностей не возникает, так как у больных с печеночной энцефалопатией, как правило, имеются желтуха, печеночный запах изо рта, соответствующие указания в анамнезе на заболевания печени, токсические гепатотропные воздействия. Необходимо учитывать также и результаты лабораторных исследований.
При применении бессолевой диеты, диуретиков и абдоминального парацентеза у больных циррозом печени может развиться гипонатриемия. При этом появляются апатия, головная боль, тошнота, артериальная гипотензия. Диагноз подтверждается при обнаружении в сыворотке крови низкого уровня натрия и повышения концентрации мочевины. Такое состояние может сочетаться с надвигающейся печёночной комой.
Острый алкогольный эксцесс представляет особенно сложную диагностическую проблему, так как может сочетаться с печёночной энцефалопатией. Многие синдромы, свойственные алкоголизму, могут быть обусловлены портосистемной энцефалопатией. Алкогольный делирий (dellirium tremens) отличается от печёночной энцефалопатии продолжительным двигательным возбуждением, повышенной активностью вегетативной нервной системы, бессонницей, устрашающими галлюцинациями и более мелким и быстрым тремором. У больных отмечаются гиперемия лица, ажитация, поверхностные и формальные ответы на вопросы. Тремор, исчезающий во время отдыха, становится грубым и нерегулярным в периоды активности. Часто наблюдаются выраженная анорексия, нередко сопровождающаяся позывами на рвоту и рвотой.
Портосистемная энцефалопатия у больных алкоголизмом имеет те же характерные признаки, что и у остальных больных, однако у них редко наблюдаются мышечная ригидность, гиперрефлексия, клонус стоп из-за сопутствующего периферического неврита. В дифференциальном диагнозе используются данные ЭЭГ и динамика клинических признаков при применении безбелковой диеты, лактулозы и неомицина.
Энцефалопатия Вернике часто наблюдается при тяжёлой недостаточности питания и алкоголизме.
Латентно протекающие функциональные психозы - депрессия или паранойя - часто проявляются на фоне надвигающейся печёночной комы. Характер развившихся психических расстройств зависит от предшествующих особенностей личности и связан с усилением её характерных черт. Выраженность серьёзных нарушений психики у таких больных часто приводит к их госпитализации в психиатрическую больницу. Хронические психические расстройства могут быть не связаны с нарушением функции печени у больных с диагностированным печёночным заболеванием. Для того чтобы доказать наличие хронической печёночной энцефалопатии, проводят диагностические исследования: флебографию или КТ с внутривенным введением рентгеноконтрастного вещества, позволяющие выявить выраженное коллатеральное кровообращение. Полезной может оказаться оценка клинических симптомов и изменений ЭЭГ при увеличении или уменьшении количества белка в пище.
- Общий анализ крови: нейтрофильный лейкоцитоз, увеличение СОЭ, анемия и тромбцитопения (особенно выражена при развитии геморрагического синдрома).
- Общий анализ мочи: протеинурия, цилиндрурия, микрогематурия, определяются билирубин, уробилин.
- Биохимический анализ крови: гипербилирубинемия (при острой печеночной энцефалопатии уровень билирубина в крови может превышать норму в 5 раз и более, достигая в некоторых случаях 300 мкмоль/л и более); резкое возрастание активности аминотрансфераз, особенно аланиновой, органоспецифических ферментов (орнитилкарбомоилтрансферазы, аргиназы, фруктозо-1-фосфат-альдолазы); падение активности псевдохолинэстеразы; гипоальбуминемия; повышение уровня у-глобулинов; гипопротромбинемия; гипохолестеринемия (падение содержания холестерина ниже 2.6 ммоль/л считается показателем критического нарушения функции печени); снижение сулемовой пробы до 1.4-1.2 мл; повышение уровня аммиака (при энцефалопатии на фоне цирроза печени и реже при острых поражениях печени); повышение содержания креатинина; снижение содержания мочевины (однако, при сопутствующей почечной недостаточности - повышение); тенденция к гипогликемии; высокий уровень желчных кислот; гипокалиемия; гипонатриемия. В терминальной стадии печеночной энцефалопатии возможно развитие билирубино-ферментной диссоциации, т.е. нарастание уровня общего билирубина и снижение ранее повышенного содержания аминотрансфераз и печеночно-специфических ферментов.
Исследование спинномозговой жидкости
Давление спинномозговой жидкости нормальное, прозрачность её не нарушена. У больных в печёночной коме можно обнаружить увеличение концентрации белка, но количество клеток не изменено. В некоторых случаях наблюдается повышение уровня глутаминовой кислоты и глутамина.
Электроэнцефалография
При печёночной энцефалопатии на электроэнцефалограмме (ЭЭГ) выявляется билатерально-синхронное уменьшение частоты и повышение амплитуды нормального а-ритма с частотой 8-13 в 1 с до 5-ритма с частотой менее 4 в 1 с. Эти данные можно наиболее точно оценить, используя частотный анализ. Стимулы, вызывающие реакцию активации, например открывание глаз, не влияют на основной ритм. Изменения появляются в лобной и теменной областях и распространяются к затылочным.
Этот метод помогает при диагностике печёночной энцефалопатии и оценке результатов лечения.
Изменения на ЭЭГ выявляются очень рано, ещё до появления психических или биохимических нарушений. Они неспецифичны и могут также обнаруживаться при таких состояниях, как уремия, гиперкапния, недостаточность витамина В12 или гипогликемия. У больных, страдающих заболеваниями печени и находящихся в ясном сознании, наличие на ЭЭГ таких изменений - достоверный диагностический признак.
Метод вызванных потенциалов
Вызванные потенциалы представляют собой электрические потенциалы, полученные при стимуляции корковых и подкорковых нейронов зрительными или слуховыми стимулами или при раздражении соматосенсорных нервов. Этот метод позволяет оценить проводимость и функциональное состояние афферентных путей между стимулированными периферическими нервными окончаниями в тканях и корой головного мозга. У больных с клинически выраженной или субклинической энцефалопатией обнаруживаются изменения слуховых вызванных потенциалов мозгового ствола (СВПМС), зрительных (ЗВП) и соматосенсорных (ССВП) вызванных потенциалов. Однако они имеют больше исследовательское, нежели клиническое значение. Поскольку чувствительность этих методов изменяется от одного исследования к другому, ЗВП и СВПМС занимают небольшое место в определении субклинической энцефалопатии, особенно по сравнению с психометрическими тестами. Значение ССВП требует дальнейшего изучения.
В настоящее время изучается новый метод записи эндогенных потенциалов, связанных с реакцией на какое-либо событие. Для его проведения необходимо взаимодействие с больным, поэтому применение такого исследования ограничивается начальными стадиями энцефалопатии. Может оказаться, что такие зрительные Р-300 вызванные потенциалы являются более чувствительными при выявлении субклинической печёночной энцефалопатии у больных циррозом печени, чем психометрические тесты.
Сканирование головного мозга
Компьютерная и магнитно-резонансная томография (КТ и МРТ соответственно) позволяет обнаружить атрофические изменения в головном мозге даже у больных с хорошо компенсированным циррозом печени. Эти изменения обусловлены серьёзным нарушением функции печени. Атрофия особенно выражена у больных с длительно персистирующей хронической энцефалопатией и усугубляется при алкоголизме. При помощи КТ можно количественно оценить выраженность отёка головного мозга и атрофии коры, в том числе у больных с субклинической портосистемной энцефалопатией. Усиление сигнала с базальных ганглиев на Т1-взвешенных изображениях у больных циррозом печени, по-видимому, не связано с энцефалопатией, но коррелирует с концентрацией сывороточного билирубина и марганца в крови.
Макроскопически головной мозг может быть не изменен, однако приблизительно в половине случаев обнаруживается отёк головного мозга. Это особенно характерно для молодых больных, умерших после продолжительной глубокой комы.
При микроскопическом исследовании у больных, страдавших циррозом печени и умерших от печёночной комы, обнаруживается больше характерных изменений в астроцитах, чем в нейронах. Выявляется пролиферация астроцитов с увеличением ядер, выбухающими ядрышками, маргинацией хроматина и накоплением гликогена. Подобные изменения характерны для астроцитоза 2-го типа при болезни Альцгеймера. Они обнаруживаются главным образом в коре головного мозга и в базальных ганглиях и связаны с гипераммониемией. Повреждения нейронов минимальны. Вероятно, на ранних этапах изменения астроцитов обратимы.
При длительном течении заболевания структурные изменения могут стать необратимыми и лечение оказывается неэффективным, развивается хроническая гепатоцеребральная дегенерация. Кроме изменения астроцитов, наблюдается истончение коры головного мозга с уменьшением числа нейронов в коре, базальных ганглиях и мозжечке.
Демиелинизация волокон пирамидного тракта сопровождается развитием спастической параплегии.
Экспериментальная печёночная кома
При острой печёночной недостаточности наблюдается увеличение проницаемости гематоэнцефалического барьера со специфическими повреждениями его транспортных систем. Однако у крыс с галактозамининдуцированной печёночной недостаточностью, находящихся в прекоматозном состоянии, не происходит генерализованное повышение проницаемости барьера. С этим связаны очевидные трудности создания модели аналогичного состояния у животных.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Читайте также:


