Подкорковые ганглии у новорожденных
Повреждение головного мозга у экспериментальных животных может проходить по двум различным моделям (Myers, 1972). Острая тотальная асфиксия быстро приводит к смерти из-за циркуляторного коллапса. Пострадавшие новорожденные обезьян рождаются мертвыми или погибают в перинатальном периоде. Некоторые из них могут выживать с признаками стволовых или таламических нарушений. Повреждения, аналогичные тем, которые развиваются у новорожденных приматов или овец при острой асфиксии, возникают и у человеческих плодов и новорожденных, часто сопровождаясь другими более диффузными поражениями.
Такие изменения является двусторонними симметричными и обнаруживаются, в частности, в стволе мозга, в нижних бугорках четверохолмия, в верхних оливах, в латеральной петле и ядрах нижних черепных нервов (Leech и Brumback, 1988, Natsume et al., 1995). Ядра таламуса также вовлекаются симметрично, и процесс может распространяться вплоть до спинного мозга (Schneider et al., 1975). Таламическая дегенерация может иметь пренатальное или перинатальное происхождение. Кальцификация часто наблюдается при рождении или при пренатальном начале дегенерации, либо развивается в первые несколько месяцев в перинатальных случаях (Di Mario и Clancy, 1989). Эта дорсальная модель повреждения ствола мозга отличается от вентральной модели понтийного нейронального некроза (Volpe, 2001), который часто сопровождается нейрональными некрозами в основании гиппокампа.
Вентральная модель понтосубикулярного некроза (Friede, 1989) чаще наблюдается при хронической, чем при острой асфиксии, и выдвигалось предположение о роли гипоксе-мии в качестве возможной причины (Ahdab-Barmada et al., 1980). Метод MPT позволил приблизиться к пониманию и лучшему распознаванию этой острой субтотальной картины асфиксии (Barkovich, 1992). Было обнаружено, что сохранение сигнала от миелинизации в задней ножке внутренней капсулы, является устойчивым предиктором нормального исхода для развития нервной системы (Rutherford et al., 1998). В последнее время, с увеличением доступности ДВ-МРТ, изменения в таламусе, базальных ядрах, гиппокампе, стволе мозга и перироландическом корковом веществе могут определяться еще лучше даже в течение первых 48-72 часов после рождения (Rutherford et al., 2004). Очевидный коэффициент диффузии (ОКД) можно подсчитать и в дальнейшем использовать распознания большего или меньшего повреждения базальных ядер (Hunt et al., 2004, Rutherford et al., 2004, Barkovich et al., 2006).
Сроки для выполнения MPT в течение первой недели жизни очень важны для подсчета ОКД, так как эти значения изменяются со временем до псевдонормализации (McKinstry et al., 2002, Barkovich et al., 2006). Они находятся на высоком уровне от 1-2 до 3-5 суток, затем снижаются (Barkovich et al., 2006).
Длительная неполная асфиксия является наиболее распространенной причиной гипоксически-ишемического повреждения (Miller et al., 2005). Повреждение ткани мозга при этом имеет более диффузный характер, сопровождается отеком и воздействует в основном на кору и субкортикальное белое вещество; эту область часто называют пограничной зоной или зоной смежного кровоснабжения. Однако нередко можно наблюдать частичное совпадение двух основных типов поражения мозга. Использование ДВ-МРТ и в данном случае повысило возможности выявления этой патологии (Groenendaal и de Vries, 2005).
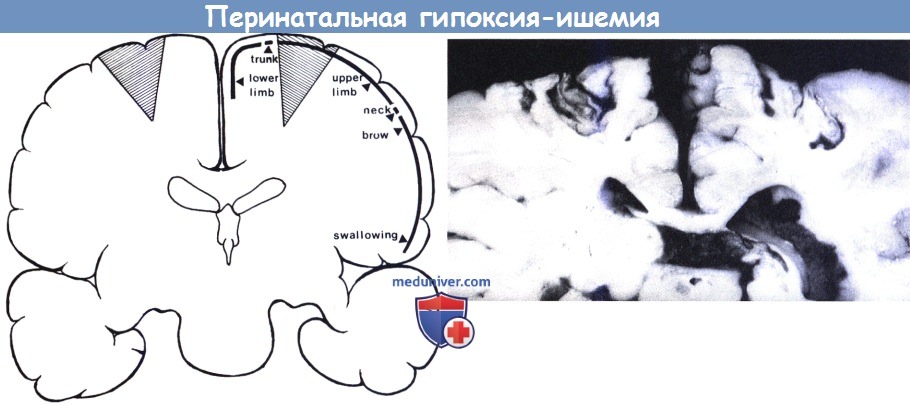
а) Избирательный нейрональный некроз. У доношенных новорожденных наиболее чувствительны к гипоксическому воздействию кора и базальные ганглии. Повреждения подкорковых ядер часто связаны с кортикальной патологией, особенно при билатеральном вовлечении роландовой области (Раре и Wigglesworth, 1979). Изменения могут доминировать в бледном и субталамическом ядрах или распространяться на хвостатое тело и скорлупу. Термин status marmoratus относится к позднему постасфиктическому повреждению, при котором базальные ядра напоминают волокна мрамора из-за повышенного содержания миелинизированных волокон в хвостатом теле, скорлупе и таламусе. Это состояние, вероятно, является результатом регенерации миелинизированных волокон, образования миелина вокруг нормальных немиелинизированных волокон и избыточного формирования миелина или сжатия ткани (Friede, 1989). При микроскопическом исследовании небольшие нейроны скорлупы и хвостатого ядра кажутся особенно уязвимыми. Повреждения мозжечка не характерны, тогда как около 60% случаев изолированно или совместно с поражением подкорковых ядер связаны с ламинарными или фокальными кортикальными некрозами (Friede, 1989).
Доступность МРТ расширила возможности раннего выявления данной патологии. Изменения хорошо распознаются и при краниальном ультразвуковом исследовании, особенно при геморрагическом характере (Kreusser et al., 1984), а через 48-72 часов после рождения и без связи с кровоизлиянием (Shen et al., 1986, Eken et al., 1994a). Обычное MPT может указать на патологическую интенсивность сигнала в вентролатеральной области таламуса и чечевицеобразном ядре (Pasternak et al., 1991, Barkovich, 1992, Rutherford et al., 1992). Rutherford et al. (1998) сделали важное наблюдение, показав, что ненормальный сигнал от задней ножки внутренней капсулы, лучше видимый на Т 1-взвешенной последовательности, является высоким прогностическим фактором неблагоприятного исхода развития нервной системы. Последние данные показали преимущества использования ДВ-МРТ в течение первой недели, которая позволяет еще лучше выявить пострадавшие области в таламусе/базальных ганглиях, перироландической коре и иногда также в ножках мозга (Rutherford et al., 2004, Barkovich et al., 2006, Groenendaal et al., 2006).
Исследование обеспечивает не только возможность визуальной оценки изменений, но и подсчета ОКД, что способствует дальнейшему определению области поражения. Дополнительная ценность подсчета ОКД представляет интерес в первую неделю после рождения, особенно у тяжело пострадавших новорожденных, в то время как у нормальных младенцев и детей с умеренной степенью повреждения базальных ганглиев отмечалось совпадение результатов (Rutherford et al., 2004). Hunt et al. (2004) смогли показать, что ОКД задней ножки коррелирует с тяжелой энцефалопатией. Повторная МРТ позволяет оценить течение этих повреждений (Iwasaki et al., 1988, Byrne et al., 1990, Rutherford et al., 1995, Belet et al., 2004). Иногда можно обнаружить кистозное перерождение в поврежденных областях, наиболее часто в пределах чечевицеобразного ядра и атрофические изменения вокруг перироландической коры. У детей с более легким повреждением фокусы едва различимого глиоза могут быть выявлены в чечевицеобразном ядре и вентролатеральном таламусе. У тяжело пострадавших детей глиозные изменения также присутствуют в полуовальном центре, распространяясь в сторону перироландической коры, иногда напоминая летучую мышь.
Достоверная корреляция была отмечена между объемом поражений, видимых на МРТ, и последствиями для двигательной, а также познавательной сферы (Krageloh-Mann et al., 2002).
Ряд исследований посвящен исходам для развития нервной системы (Cowan, 2000, Krageloh-Mann et al., 2002, Miller et al., 2005, Himmelmann et al., 2007). При участии в процессе только чечевицеобразного ядра и таламуса, без поражения роландической коры, отмечен лучший исход с дискинетическим вариантом коркового паралича и хорошие способности к обучению. Когда процесс затрагивает перироландическую кору и область гиппокампа, исход неизбежно неблагоприятный с развитием тетраплегии, сопутствующей эпилепсии и неспособности к обучению.
Парасагиттальные изображения ишемического повреждения мозга.
Схематичное изображение области инфаркта в зоне слияния бассейнов передней и средней артерий (штриховка).
Обратите внимание, что участки, пораженные инфарктом, отвечают за двигательные зоны верхней части рук.
Патологический образец указывает на наличие типичной улегирии в соответствующей области (шестидневный новорожденный с острым дистрессом плода и неонатальными судорогами).
б) Инфаркт в пограничной зоне мозга/повреждение в зоне смежного кровоснабжения. Pasternak (1987) и Volpe и Pasternak (1977) подчеркивали преобладание нейронального некроза и возникающей в результате улегирии по обеим сторонам пограничной зоны между бассейнами передней, средней и задней мозговых артерий. Эти парасагиттальные явления нейронального некроза могут быть вызываны низким перфузионным давлением, максимально выраженным по периферии артериального кровоснабжения. В некоторой степени в процесс также вовлекается белое вещество.
Более широкое использование МРТ упростило раннюю диагностику этого типа патологии (Barkovich et al., 2001). Повреждения также хорошо могут распознаваться с помощью ультразвука, особенно когда имеет место вовлечение в процесс белого вещества (Eken et al, 1994а). Не является редкостью обнаружение этих очагов в первые сутки после рождения ребенка, что дает основание предположить антенатальное начало процесса. Зачастую это проявляется в виде снижения двигательной активности плода на протяжении нескольких последних дней непосредственно перед родами. Во многих центрах, где МРТ проводится в первую неделю жизни, ДВ-МРТ используется как часть обследования, что в дальнейшем сможет помочь в раннем и более точном выявлении этого типа поражения (Roelants-van Rijn et al., 2001). Подсчет ОКД может также быть полезным при уменьшении объема, присутствующего в первые дни после рождения (McKinstry et al., 2002).
При повторных исследованиях отмечается тенденция к атрофии в пострадавших зонах, и позднее, в периоде младенчества или детства могут обнаруживаться глиозные изменения (Groenendaal и de Vries, 2005). Исход в большей степени зависит от тяжести повреждений с высокой долей вероятности нормального раннего результата, но с легкими двигательными нарушениями и, особенно, с трудностями в обучении (Cowan, 2000). Miller et al. (2005) сравнили последствия через 30 месяцев у 173 доношенных новорожденных с установленной неонатальной энцефалопатией. Из них у 78 (45%) имелись повреждения преимущественно в зоне смежного кровоснабжения и у 44 (25%) — в базальных ганглиях, в то время как у 51 младенца результаты МРТ были нормальными. Показатели двигательных и познавательных исходов при поражении в зоне смежного кровоснабжения оказались лучше, чем при повреждении таламуса/подкорковых ядер. Нередко отмечалось сочетание обоих типов патологических изменений, при этом оценка производилась по доминирующему варианту повреждения.
У некоторых детей патологические изменения казались ограниченными белым веществом. Данный тип поражения хорошо визуализировался при помощи краниальной ультрасонографии (Eken et al., 1994а) с выявлением неоднородных изменений, относящихся к точечным повреждениям белого вещества, что подтверждено последующей МРТ. В большинстве тяжелых случаев развитие кистозных повреждений, в основном затрагивающих глубокие отделы субкортикального белого вещества, выявляется на протяжении следующих нескольких недель. Иногда все белое вещество может стать кистозным, в этом случае говорят о мультикистозной энеце-фаломаляции (МКМ). Исход для развития головного мозга строго коррелирует со степенью вовлечения белого вещества (Cowan, 2000).
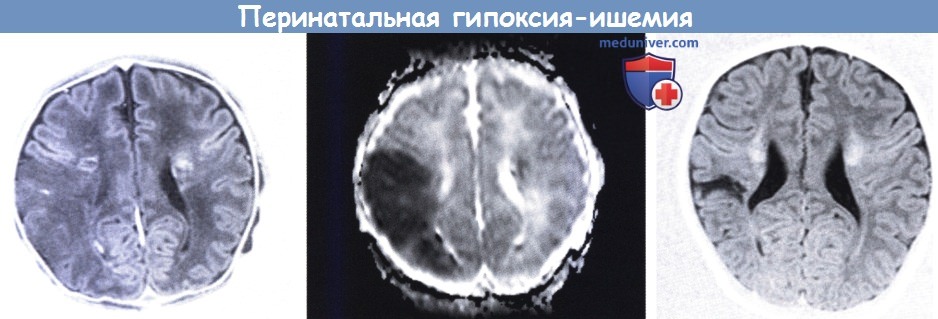
Зрелый новорожденный с неонатальными судорогами, связанными с ишемическим повреждением.
МРТ в первую неделю (слева, в середине) и в три месяца (справа).
Изображение в режиме инверсии-восстановления (слева) демонстрирует клиновидный участок сниженной интенсивности сигнала от задней ветви средней мозговой артерии (справа) и билатеральные мелкие очаги повышенного сигнала в перивентрикулярном белом веществе, подтвержденном картой коэффициентов диффузии (в середине).
Область кавитации в три месяца меньше, чем ожидалось на основании неонатальной нейровизуализации. У ребенка развилась легкая гемиплегия.
У большинства детей артериальные ишемические инфаркты возникают в левом полушарии, примерно в 3-4 раза чаще, чем в правом (Fujimoto et al., 1992; Mercuri et al, 1995,1999; de Vries et al., 1997). Инфаркт в бассейне средней мозговой артерии встречается в два раза чаще, чем в любых других артериях. Передняя мозговая артерия поражается реже всего, однако это может быть отражением скрытой симптоматики, связанной с вовлечением данного сосуда.
Некоторые случаи развиваются вследствие тяжелых родов на фоне какой-либо степени асфиксии, но в основном дети выглядят здоровыми в начальном периоде новорожденности, находясь на попечении матери (Roodhooft et al., 1987, Coker et al., 1988). Ramaswamy et al. (2004) выявили шесть случаев с неонатальным инсультом среди 124 новорожденных детей с диагностированной неонатальной энцефалопатией. Наиболее вероятно эмболическое происхождение (Coker et al., 1988) с образованием тромба в артериальном протоке или пупочных сосудах. При вовлечении крупного артериального бассейна особенно вероятным становится диагноз диссекции артерии, описанный лишь в немногих случаях у новорожденных (Lequin et al., 2004). Согласно сообщениям, большинство детей рождаются зрелыми или близко к доношенному сроку. Однако по нашему опыту, очаговые инфаркты также встречались у недоношенных новорожденных, но в таком случае часто являлись случайной находкой на рутинном ультразвуковом обследовании (de Vries et al., 1997, Benders et al., 2007).
Частота артериального ишемического инсульта обычно оценивается как 1 на 4000 живорожденных (Nelson и Lynch, 2004). Lien et al. (1995) указывали коэффициент заболеваемости около 0,01%. Estan и Норе (1997) обследовали когорту семилетних детей и сообщили о заболеваемости на уровне 0,025%, схожую с показателем в 0,02% по данным Perlman et al. (1994). Несколько групп выявили неонатальный инсульт в качестве второй по распространенности причины судорог у новорожденных (Levy et al., 1985, Lienetal., 1995, Estan и Hope, 1997).
Недавние попытки выделить факторы риска на основании демографических исследований выявили антенатальные факторы, такие как преэклампсия, бесплодие и задержка внутриутробного развития (Lee et al., 2005а). В других работах подчеркивалась связь с патологией системы свертывания крови (сниженный уровень белка С, белка S и антитромбина III и повышенные показатели гомоцистеина и Lp (а) липопротеина, протеина Z), также как некоторые генетические мутации и полиморфизм (такие как фактор V Лейдена G1691A, фактор IIG20210А и метилентетрагидрофолат редуктаза С677Т) (Debus et al., 1988, Gunther et al., 2000, Kurnik et al., 2003). Очаговый венозный инсульт также может развиться в связи с тромбозом венозных синусов, на долю которого приходится около 30% неонатальных инсультов (deVeber et al., 2001, Fitzgerald et al., 2006). Одностороннее таламическое кровоизлияние, ассоциированное с ВЖК у доношенных новорожденных, должно насторожить в отношении возможных венозных тромбозов синусов (Wu et al., 2003). Риск рецидива неонатального инсульта низкий, на уровне 3-5% в соответствии с двумя демографическими исследованиями (Golomb et al., 2001, Kurnik et al., 2003).
Редактор: Искандер Милевски. Дата публикации: 25.11.2018

Перинатальное поражение центральной нервной системы (МКБ-10 – G00-G99) и патоморфологические состояния головного мозга новорожденных являются результатом вмешательства патогенного агента в текущий процесс развития поврежденной области. Окончательной морфологии способствуют реактивные и репаративные изменения в сочетании с продолжением гистогенетического развития.
Важность детальных знаний о внутриутробных и перинатальных повреждениях головного мозга и ППЦНС у детей значительно возросла в последние годы в связи с развитием интенсивной терапии патологических новорожденных, пренатальной ультразвуковой диагностики. Диагноз ППЦНС у ребенка – это осложняющий фактор его дальнейшего развития, составляющий важную часть педиатрии и неврологии. Патологии ЦНС – это фактор риска ряда других болезней, в частности, рассеянного склероза.
Гипоксическая ишемическая энцефалопатия новорожденных (ГИЭ)
ГИЭ – это наиболее распространенное патологическое обнаружение в мозге новорожденных. Заболевание происходит внутриутробно, внутриматочно и послеродово. Оно вносит значительный вклад в процент смертей новорожденных, в различные формы двигательного и психологического нарушения.
Гипоксическая ишемическая энцефалопатия связана с целым рядом причин, среди которых:
- преждевременное отделение плаценты;
- компрессия пуповины;
- непрогрессирующие роды;
- травма ЦНС при родах;
- аномалии верхних дыхательных путей;
- аспирация околоплодных вод;
- пневмоторакс;
- врожденная диафрагмальная грыжа;
- трахео-эзофагеальная фистула;
- пневмония надпочечников и другие факторы.
Повреждение коры при ГИЭ в основном отмечается у зрелых новорожденных. Зрелая кора требовательна к снабжению кислородом. Типичный для расстройства ламинарный некроз III-V слоя, где нейроны имеют высокую метаболическую активность. Очаговый некроз распространен в области деления нижних желобков мозга. Полный некроз поражает кору по всей высоте. После некроза возникает репаративный астроцитоз, извилины сужаются, становятся нерегулярными (улегирия).

Наиболее типичное состояние – перивентрикулярная лейкомаляция. Это небольшие транзиторные инфаркты, расположенные вокруг боковых желудочков примерно в 0,5 см от стенки. Они находятся в зоне деления между центростремительными и центробежными артериями белого вещества. Редко располагаются вокруг межжелудочкового отверстия и затылочного угла боковой камеры. Инфаркты могут быть множественными, распределяться по большей части белого вещества полушарий.
Небольшой некроз излечивается глиальным рубцом, после объемного остаются псевдокисты.
Некроз – это тяжелая форма гипоксического повреждения (градус III). При легкой гипоксии избирательно затрагивается часть глии и меньшее количество аксонов, заживление приводит к гипоплазии белого вещества. Легкая гипоксия вызывает только отек белого вещества (градус I), обратимое изменение.
Повреждение базальных ганглиев (таламус, стриатум, бледный шар) в основном сопутствует повреждению коры. Некроз залечивается астроглиальным рубцом с атипичными процессами миелинизации нервных волокон и астроглии. Макроскопически поврежденные участки уменьшены, нерегулярно мраморизованы.
Повреждение ствола головного мозга, мозжечка и спинного мозга сопровождается серьезными изменениями в коре и подкожной клетчатке. Избирательно гипоксическое повреждение возникает после одного случая асфиксии повышенной тяжести, связанной с кратковременной остановкой сердца.
В части нейронов в мосте, в продолговатой части, базальном ядре и в ядрах четверохолмия происходит регрессия и некроз. Если новорожденный выживает, следует астроглиоз, ствол мозга уменьшается, становится жестким. Ишемическое повреждение нейронов спинного мозга связано с остановкой сердца. В мозжечке зернистый слой более чувствителен к гипоксии, чем слой клеток Пуркинье.
В генезе некроза имеется общая гипоксия, сдавливание позвоночных артерий при экстремальном положении головы во время родов.
Понтосубикулярные некрозы косвенно связаны с ГИЭ. Они вызваны реализацией терапевтической гипероксии при лечении гипоксических состояний. Это избирательные некрозы нейронов моста, базальных ядер и субикулума. После заживления развивается глиоз.

Очаговые и многоочаговые гипоксически-ишемические изменения возникают при блокировке отдельных мозговых артерий. В соответствующей артерии происходит инфарктоподобный некроз с последующим образованием псевдокисты. Степень изменений зависит от размера заблокированных сосудов (от небольшого очага в 1-5 мм до возможного поражения всей доли).
Причины блокировки бывают пренатальными и постнатальными, включающими:
- изоиммунную тромбоцитопению;
- эмболию плаценты;
- тромбоэмболию из закрывающегося артериального протока;
- артериальную диссеминированную внутрисосудистую коагуляцию;
- тромбоз при лептоменингите, характерном, как для раннего постнатального периода, так и для более позднего детского возраста (грудничков).
Дальнейшее развитие выживших детей, последствия перинатального поражения ЦНС зависят от степени и расположения острого повреждения. После заживления острой фазы более поздние хронические состояния проявляются психомоторной отсталостью. С клиническими данными коррелируют следующие морфологические состояния:
- Минимальные поражения головного мозга. Они не имеют достоверно определенной морфологии. При непрерывном исследовании головного мозга в коре можно обнаружить небольшие глиальные шрамы или очаговые нарушения, крошечные астроглиальные шрамы в белом веществе в количестве до 25%.
- Улегирии. Изначально представляют собой нормально сформированные извилины, вторично нерегулярно загибаемые и сужаемые. Изменение может быть отмечено на отдельных извилинах, но также нарушение может затронуть большую часть поверхности полушария. Улегирия распространена в области парасагитального деления. Нейроны отсутствуют, извилины превращаются в глиофиброзный рубец.
- Гидранэнцефалия. Одно или оба полушария замещаются тонким глиомезенхимальным слоем. Патология возникает после обширного разрушения незрелых полушарий мозга.
- Гипоплазия белого вещества. Представляет собой диффузное уменьшение объема белого вещества. Возникает после полной длительной гипоксии недоношенных новорожденных из-за множественного очагового некроза и диффузного повреждения незрелой глии.
- Псевдокисты. Возникают после заживления более крупных некрозов; одиночные являются последствием окклюзии одной артерии, множественные – результатом многоочаговой кистозной энцефалопатии. Полушария, иногда и базальные ганглии, пронизаны многочисленными нерегулярными, часто взаимно связывающимися клетками, разделенными щелями глиофиброзной ткани. Нейроны исчезают. Осложнение является результатом тяжелой диффузной гипоксии или множественной окклюзии сосудов.
Дефекты развития ЦНС
На мальформации приходится 19% причин перинатальной смертности, из которых за 50-70% отвечают дефекты развития ЦНС, представляющие непосредственную угрозу жизни.
Мальформация может иметь морфологическое проявление только в ЦНС; но часто одновременно поражаются другие системы (кожа, кости, мышцы, паренхиматозные органы).
Развитие ЦНС можно разделить на 5 периодов:
- Период дорсальной индукции (3-4 недели внутриматочного развития).
- Период вентральной индукции (5-6 неделя внутриутробного развития).
- Нейробластический период – глиобластная пролиферация (2-6-месячный внутриматочный период).
- Период локальной дифференцировки клеток (с 5-го внутриутробного месяца, продолжение в постнатальном периоде).
- Период миелинизации (с 7-го внутриутробного месяца до постнатального периода).
Большинство обнаружений можно надежно отнести к отдельным периодическим группам.
К этой группе перинатальных поражений ЦНС у новорожденных относятся следующие расстройства:
- Тотальный краниосхиз. Это полный дефект закрытия нервной трубки. Нейрокраниум отсутствует, позвоночный канал частично или полностью расщеплен. Мозга нет (анэнцефалия), лицевая часть навязывает прямо на укороченную грудь. Глаза обращены краниально (ураноскопия), основание черепа покрыто сосудистой мембраной (область нейроаскулозы), проходящей периферически в коже.
- Энцефалоцеле. Нейрокраниальный дефект, связанный с пролапсом оболочек и мозга. Макроскопически он имеет вид сферической формы диаметром несколько сантиметров, покрыт кожей на поверхности. Из-за дефекта прогибается жесткая оболочка и часть мозга, прогиб только жесткой оболочки встречается реже.
- Рахишизис. Это дефект закрытия позвоночного канала. Расстройство часто связано с краниосхизом. Спинная расщелина может быть полной или ограниченной.
- Порок развития мозжечка. Это заболевание в основном является частью более сложных пороков развития мозга. Агенезия встречается редко. Гипоплазия может поражать весь мозг или его часть (черви мозжечка, полушария).
Эта группа ППЦНС у новорожденных включает такие патологии, как голопрозэнцефалия и менее выраженный лицевой дисморфизм.

Это дефект с характерной комбинацией аномалий головного мозга и головы. Это хромосомный дефект, чаще встречающийся у диабетических матерей. Руководящей основной диагноза являются лицевые аномалии:
- циклопия – наличие только одной орбиты и одного глазного яблока, отсутствие носовой полости;
- орбиты, расположенные близко друг к другу, имеют этмоцефалию (гипотелоризм), в небольшой носовой полости отсутствует перегородка;
- премаксилярная агенезия характеризуется гипотелоризмом, плоским носом, средним расщеплением верхней губы и верхней челюсти.
Это смешанные аномалии, такие как гипотелоризм, гипертелоризм, очень плоский нос, односторонние и двусторонние расщелины лица.
Группа пролиферативных нарушений включает дефекты, вызванные уменьшенной, чрезмерной или нетипичной пролиферацией зародышевых слоев мозга, незрелого белого или серого вещества. В эту группу входят первичные изменения размера мозга (макроцефалия и микроцефалия), состояния, характеризующиеся чрезмерной пролиферацией некоторых компонентов ткани (нейрокутанные синдромы).
Мозг уменьшается по сравнению с нормой (менее 2 стандартных отклонений от нормы), но все анатомические компоненты создаются пропорционально. Признаки предшествующего повреждения отсутствуют (послевоспалительные состояния, гипоксия, пороки развития). Предположительное время появления патологии – 2-4-й внутриматочный месяц.
В симптоматике нет значительных изменений моторики, интеллект обычно снижен. В анамнезе течения беременности присутствует фенилкетонурия, применение противоэпилептических препаратов, гиперавитаминоз А, вирусная инфекция, этилизм.
Микроцефалия также является частью ряда хромосомных синдромов.
Это гетерогенная группа с общим признаком – большим мозгом, в котором пропорционально созданы все анатомические компоненты. Клинически регистрируется снижение интеллекта. При церебральном гигантизме макроцефалия связана с общим ускоренным ростом в детстве (большие руки, ноги, челюсть, долихоцефалия, нормальный или слегка сниженный интеллект). В отдельных случаях этиология совершенно неясна.

С 5-го внутриутробного месяца все анатомические части мозга уже четко сформированы. Поражение проявляется нейродинамичными нарушениями, регрессивными изменениями и последующим глиальным рубцеванием. Кроме того, каждое повреждение изменяет процесс миелинизации, развивающийся преимущественно постнатально. Процессу миелинизации препятствуют также метаболические заболевания и воспаления.
Перинатальная травма ЦНС и внутричерепное кровоизлияние
Роды всегда связаны с риском травмы головы и позвоночника у новорожденных. Обычно травмы вызываются диспропорцией между размером головы и шириной родового канала, патологическим положением плода в матке, использованием щипцов и другими факторами. Существует ряд типичных состояний при травмах головы:
- Родовая опухоль. Скопление серозного геморрагического транссудата между сухожильным шлемом и надкостницей. Симптомы включают отек кожи и подкожной клетчатки, диаметром около 6 см, возникающие в месте налегания головы на шейку матки. В патологическом положении плода родовая опухоль может находиться в другом положении. Отек исчезает через 24 часа после родов.
- Кефалогематома. Это субпериостальная гематома над выпуклостью плоских черепных костей. Размер варьируется от 1 см до размера теннисного мяча. Отек не распространяется за край пораженной кости.
- Отступ черепной кости. Это вдавливание гибкой плоской кости черепа новорожденного, диаметром 3-4 см. Внутри кости обычно присутствует трещина.
- Переломы плоской кости имеют форму щелей, идущих радиально и периферически от приподнятой части кости. Часто встречается сочетание с кефалогематомой.
- Остеодиастаз затылочной кости. У новорожденного затылочная кость состоит из 4 частей, связанных синхондрозом. При сдвиге синхондроза может произойти разрыв синусов твердой мозговой оболочки и повреждение ствола мозга.
- Деформация головы. Приблизительно сферическая форма зрелой головки плода в процессе рождения несколько расширяется цилиндрически. В узких родовых путях деформация чрезмерна, края плоских костей движутся друг над другом, повышая риск травмы мозга.
Субарахноидальное кровотечение в форме небольших очагов диаметром 1-10 мм является отдаленным признаком гипоксической энцефалопатии и сепсиса. Объемные субарахноидальные гематомы являются частью крупных желудочковых гематом.
Это частое нахождение у недоношенных новорожденных. Как правило, желудочковая система заполнена свернувшейся кровью, кровоток продолжается через ромбовидное отверстие в субарахноидальное пространство. Чаще всего кровью заполнена только одна боковая камера. Источник гематомы в основном представлен треснувшей субэпендимальной гематомой, депонированной в клеточном перивентрикулярном зародышевом слое.
У доношенных новорожденных желудочковые гематомы исключены.
Эти расстройства всегда являются частью травмы позвоночника. Наиболее распространенное изменение вокруг спинного мозга – эпидуральная гематома. Если она объемная, то может повредить спинной мозг, стать источником затрудненного дыхания новорожденного. Механическое повреждение спинного мозга происходит во время сильного вытяжения при непрогрессивных родах и после использования щипцов.
Лечение
В большинстве случаев для предотвращения серьезных последствий перинатального поражения требуется сердечно-легочная реанимация сразу после рождения и других необходимых действий для обеспечения стабильного состояния и минимизации произошедшего поражения. После успешной реанимации и первичных восстановительных действий у младенца, рожденного после 36-й недели беременности, прекращается нагревание, происходит переход к некоторым из контролируемых методов охлаждения.
Кроме того, необходимо стабилизировать дыхательную активность путем ведения искусственной вентиляции легких. Компенсирование кровяного давления, сердечной недостаточности, регулирование сердечного ритма и капиллярного возврата обеспечивает стабилизацию сердечно-сосудистой системы. В соответствии с лабораторными результатами, измерениями уровня глюкозы в крови, ионограммой стабилизируется внутренняя среда, назначаются соответствующие лекарства (один из используемых препаратов – Кортексин).

Путем выведения жидкости, применения диуретиков достигается противоотечный эффект. При развитии судорожной мышечной активности, под наблюдением невролога назначается противосудорожная терапия (Диазепам, Фенобарбитал) и массажи. Цель такого лечения состоит в достижении полного исчезновения или, как минимум, облегчении судорог.
В зависимости от фактической зрелости и уязвимости структур головного мозга, вследствие гипоксии или ишемии, происходит их повреждение в различной степени. Возбуждающие аминокислоты, активация NMDA-рецепторов с последующим рефлюксом кальция в клетки также играют ключевую роль. При отсутствии энергетической активности нервной клетки это состояние приводит к ее гибели. NMDA-рецептор – это распространенный нейромедиатор (N-метил D-аспартар). Носитель NMDA имеет интересную особенность: он отвечает за создание следов памяти в мозге, особенно в центре памяти (гиппокампе).
В некоторой степени блокировать активацию NMDA-рецептора можно путем применения магния в форме уколов ввиду его нейропротекторного эффекта.
Нет необходимости лечить ППЦНС у новорожденных с использованием всех указанных выше мер. При определении подходящего терапевтического подхода следует учитывать общее состояние ребенка, сроки беременности, на которых он родился, наличие других сопутствующих расстройств. Также необходимо следить за серьезностью гипоксии, ее проявлениями.
Для проведения контролируемой гипотермии существуют точные критерии. Этот метод предназначен исключительно для доношенных детей. Он проводится только в специализированных отделениях интенсивной терапии и реанимации, которые оснащены для этой операции не только технически, но и профессионально подготовленным персоналом.
Прогноз перинатального поражения ЦНС довольно сложен. Существуют определенные взаимосвязи между типичными случаями и дальнейшим развитием заболевания, что, несомненно, влияет на нейромоторное состояние, психическое, эмоциональное и интеллектуальное развитие ребенка. Поэтому необходимо уделять большое внимание надлежащему лечению, дополнять его реабилитационной и педагогической психологической помощью (дизартрия, нарушение когнитивных способностей). После правильной терапии много детей могут жить нормальной жизнью. Но без лечения прогрессирующее заболевание редко не приводит к смерти.
Читайте также:


