Применение актовегина при дисциркуляторной энцефалопатии
Актовегин в лечении больных с дисциркуляторной энцефалопатией
Проведено комплексное клинико-инструментальное обследование 59 пациентов с дисциркуляторной энцефалопатией (ДЭ), получавших парентерально Актовегин по 160 мг (4 мл) в сутки в течение 25 дней (2 курса в год). Применение Актовегина в сочетании с гипотензивными и антитромботическими препаратами оказывало выраженное положительное влияние на неврологическую симптоматику, вызывая ее регресс. При лечении Актовегином отмечен эффект нарастания эффективности после окончания курса лечения, что способствует стабильному улучшению состояния больных с разными стадиями ДЭ. Комплексное лечение пациентов с ДЭ с использованием Актовегина приводило к значительному снижению риска прогрессирования заболевания, а также к уменьшению риска развития ТИА и инсультов по сравнению с контрольной группой, получавшей только базовую терапию.
Введение
Сосудистые заболевания головного мозга — одна из ведущих причин не только заболеваемости, но и, в первую очередь, смертности и инвалидизации как в Российской Федерации, так и во всем мире. Сердечно-сосудистые заболевания являются ведущей причиной смерти в промышленно развитых странах мира. Например, в США на них приходится 42% всех случаев смерти, ежегодно от них умирает до миллиона человек [20, 24, 27, 28]. Россия выделяется среди промышленно развитых стран мира высокой частотой развития инсульта и высокими показателями смертности от этого заболевания. Она занимает второе место в мире по смертности от церебрального инсульта, которая в 3-8 раз выше, чем, к примеру, в США, Франции и Швейцарии. Более того, в отличие от Японии, США, Австралии и многих стран Западной Европы в России смертность от инсульта не снижается [13, 14, 27, 29]. По данным аналитических исследований, проведенных ВОЗ, проблема цереброваскулярной патологии и инсульта является чрезвычайной важной, и ее влияние на уровень здоровья и жизни населения всего мира будет последовательно возрастать [28].
Инвалидизация после перенесенного инсульта достигает 3,2 на 10 тыс. населения, занимая первое место среди всех причин первичной инвалидности. Из выживших пациентов до 80% остаются инвалидами разной степени тяжести, 30% больных, перенесших инсульт, полностью не восстанавливаются, а еще 20% нуждаются в постороннем уходе. Безусловно, решение данной проблемы возможно лишь при проведении первичной и вторичной профилактики, совершенствовании системы квалифицированной медицинской помощи больным с цереброваскулярной недостаточностью [13, 27].
К настоящему времени в целом сформировано представление о многофакторном механизме развития сосудистой мозговой недостаточности [4, 5, 15, 20, 22]. Однако ни один из факторов риска не может целиком объяснить ни выраженность неврологических нарушений, ни характер течения заболевания, что подтверждает сложность механизмов возникновения и прогрессирования острой и хронической сосудистой мозговой недостаточности [7-9, 28, 31].
Дисциркуляторная энцефалопатия (ДЭ) является следствием патофизиологических процессов при хронической церебральной гипоперфузии.
В последнее время многочисленные нейробиологические исследования, посвященные механизмам смерти клетки, в т.ч. при недостаточности мозгового кровообращения, значительно расширили понимание основных закономерностей некроза и апоптоза. Было установлено, что оба фундаментальных механизма смерти клеток сопряжены с нарушениями энергетического метаболизма, дисфункцией митохондрий, оксидантным повреждением [3, 6, 11, 16].
При ишемии мозга, как острой, так и хронической, возникает каскад биохимических процессов, включающих нарушения мембранной целостности и ионного транспорта, прогрессирующий протеолиз, расстройства функционального взаимодействия нейромедиаторов, индукцию апоптоза, ведущих в конечном счете к гибели популяций нервных клеток [13,14-19, 22].
Лечение пациентов с хронической церебральной сосудистой недостаточностью представляется сложной медико-социальной проблемой. Разработка универсального метода терапии и профилактики ДЭ проблематична, так как эта патология характеризуется высокой степенью патогенетической гетерогенности. В настоящее время большое внимание уделяется изучению места нейропротекторов в лечении больных с острыми и хроническими формами цереброваскулярной патологии. Протекция мозга при хронической недостаточности мозгового кровообращения может быть одним из наиболее эффективных методов лечения пациентов с данной патологией. Назначение нейропротекторов способствует предотвращению развития нарушений церебрального метаболизма у больных с повышенным риском ишемии мозга, т.е. в случаях, когда резервы церебральной гемодинамики и метаболизма ограничены. Это может предотвратить тяжелое и необратимое повреждение нейронов [3, 10, 13, 17, 23, 27-30].
Однако в изученной литературе, посвященной лечению нейропротекторами больных с хронической недостаточностью мозгового кровообращения, мы не нашли однозначного ответа на целесообразность их применения, поскольку:
— недостаточно изучены вопросы влияния нейропротекторов на прогрессирование ДЭ и развитие осложнений данного заболевания;
— нет сведений об их использовании в комплексе с препаратами, применяющимися для устранения основных факторов риска цереброваскулярных заболеваний — артериальной гипертензии и атеротромбоза.
Одним из лекарственных средств, обладающих выраженным нейропротективным действием, является препарат Актовегин, содержащий исключительно физиологические компоненты (органические низкомолекулярные соединения: аминокислоты, олигопептиды, нуклеозиды; промежуточные продукты углеводного и жирового обмена; электролиты и ряд важных микроэлементов), характеризующиеся высокой активностью. Физиологические субстанции, входящие в состав Актовегина, составляют основу плазмы крови.
Актовегин, являясь антигипоксантом, активно влияет на уровень циклических нуклеотидов, поддерживающих окислительно-восстановительные процессы, адекватный церебральный метаболизм. Основой фармакологического действия Актовегина является его влияние на процессы внутриклеточного метаболизма. С помощью этого препарата улучшаются транспорт глюкозы и поглощение кислорода в тканях, что приводит к активации процессов аэробного окисления, увеличивающей энергетический потенциал клетки.
Актовегин улучшает микроциркуляцию и трофику тканей организма. В клетках под его влиянием:
— повышается обмен высокоэнергетических фосфатов (АТФ);
— активируются ферменты окислительного фосфорилирования (пируват- и сукцинатдегидрогеназы, цитохром-c-оксидаза);
— повышается активность кислой фосфатазы и липосомальная активность;
— возрастает активность щелочной фосфатазы, ускоряется синтез углеводов и белков;
— увеличивается приток ионов калия, происходит активация калийзависимых ферментов: каталаз, сахараз, гликозидаз;
— ускоряется распад продуктов анаэробного гликолиза — лактата и β-гидроксибутирата.
Эффекты Актовегина наиболее выражены при гипоксическом характере повреждения тканей, при этом препарат оказывает системное действие на организм, увеличивая кислородный энергообмен в клетках всех органов, находящихся в состоянии метаболической недостаточности.
Опыт применения Актовегина в неврологической практике у больных, страдающих сосудистыми и атрофическими заболеваниями головного мозга, показывает, что под его влиянием повышается устойчивость мозговой ткани к гипоксии. Улучшая доставку кислорода и уменьшая выраженность ишемических повреждений тканей, Актовегин, кроме того, опосредованно усиливает белоксинтезирующую функцию клеток и оказывает иммуномодулирующее действие [1-3, 6, 17-19, 23].
В настоящем исследовании нами была предпринята попытка изучить эффективность Актовегина в плане его влияния на прогрессирование ДЭ и развитие обострений в ходе заболевания, а также на динамику отдельных неврологических синдромов в зависимости от вариантов течения ДЭ.
Материал и методы
На кафедре неврологии и нейрохирургии лечебного факультета РГМУ с циклом ФУВ было проведено комплексное обследование пациентов с хронической недостаточностью мозгового кровообращения, включающее клинико-инструментальные и лабораторные исследования. Всего обследовано 427 больных с ДЭ I, II и III стадий, находившихся на амбулаторном лечении. Пациенты наблюдались в течение года. Больные были обследованы до начала приема препаратов, затем в конце 1, 3, 6, 7 и 12-го месяцев.
Исследуемую группу составили 59 пациентов с ДЭ I, II и III стадий, получавших Актовегин в дозе 160 мг (4,0 мл) внутримышечно. Курс лечения составил 25 дней. В течение года больные получали 2 курса — на 1-й и 6-й месяцы лечения.
В 1 группу контроля вошли 118 пациентов с ДЭ, клинически сопоставимых с больными исследуемой группы.
Больные 1 контрольной и исследуемой групп получали базовую терапию, которая была максимально унифицирована и включала прием ацетилсалициловой кислоты (100 мг/сут), дипиридамола (150 мг/сут), глицина (900 мг/сут) и эналаприла. Последний назначался в индивидуальной дозе, в зависимости от стадии артериальной гипертензии и исходного уровня артериального давления (АД). В результате коррекции АД достигало уровня 120/70 — 150/80-85 мм рт.ст. в зависимости от длительности течения артериальной гипертензии, степени выраженности перфузионных нарушений головного мозга и исходного уровня АД в начале исследования. При недостаточности гипотензивного эффекта эналаприл комбинировали с индапамидом в дозе 2,5 мг/сут.
При наборе пациентов использовался метод рандомизации. Исследование проводилось открытым методом.
Вторую контрольную группу составили 250 пациентов, данные которых были проанализированы ретроспективно на основании амбулаторных карт поликлиник ЦАО г. Москвы.
Диагноз ДЭ ставился на основании результатов комплексного клинико-инструментального обследования в соответствии с существующей классификацией сосудистых заболеваний головного мозга [26].
Пациенты, имевшие выраженные двигательные и речевые нарушения, не включались в исследование из-за возникновения сложностей при их транспортировке на обследования и невозможности проведения адекватного тестирования. Больные, перенесшие инсульт, имели балльную оценку по шкале Рэнкин 3 балла и ниже.
При обследовании больных большое внимание уделялось сбору анамнеза, фиксировались особенности течения цереброваскулярной недостаточности. Учитывалась предшествующая терапия (нейропротекторная, гипотензивная, антитромботическая, применение контрацептивных препаратов и т.п.).
Оценка эффективности Актовегина у больных с разными стадиями ДЭ проводилась в следующих направлениях:
— влияние препарата на выраженность тех или иных неврологических синдромов;
— влияние препарата на риски прогрессирования заболевания, возникновение транзиторных ишемических атак (ТИА) и инсультов.
Ввиду разномасштабности и разнонаправленности используемых шкал, для удобства изложения и восприятия материала мы сочли удобным описывать динамику упомянутых показателей в терминах относительных изменений, говоря о проценте улучшения (либо ухудшения) соответствующего показателя по отношению к его исходному состоянию.
Помимо клинического обследования, всем больным проводились лабораторные, инструментальные и нейровизуализационные исследования.
Результаты исследования
Сравнительный анализ контрольных групп пациентов и группы больных, получавших Актовегин, свидетельствовал об их сопоставимости по полу, возрасту, этиологии, тяжести течения и преимущественной локализации патологического процесса.
Перед рассмотрением действия Актовегина необходимо остановиться на результатах лечения больных, входивших в 1 контрольную группу, получавших антигипертензивную и антитромботическую терапию.
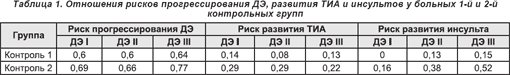
В течение 12-месячного наблюдения базовая терапия, назначаемая больным 1 контрольной группы, способствовала регрессу астенического синдрома, активно влияла на показатели нейропсихологических характеристик. У больных с ДЭ I стадии статистически достоверное влияние лечения на балльную оценку в соответствии с используемыми шкалами прослеживалось начиная с 7 месяца терапии. При анализе результатов лечения больных с ДЭ II стадии статистически достоверной была динамика астенического синдрома, показателей тревоги и мотивации, а также оценки по шкале MMSE. Положительное влияние базовой терапии на вестибулярную и лобную атаксию было в пределах достоверности р > 0,05. У больных с ДЭ III стадии статистически достоверное влияние такого лечения было отмечено лишь в отношении выраженности астенического синдрома и балльной оценки по шкале тревоги Спилберга к 7 месяцу наблюдения (табл. 2-4).
Сравнение результатов лечения у больных ДЭ I стадии в исследуемой и 1 контрольной группах свидетельствует о положительном влиянии Актовегина на неврологические показатели: усиление регресса астенического синдрома, вестибулярной атаксии, улучшение балльной оценки по шкалам мотивации и тревоги (табл. 2).
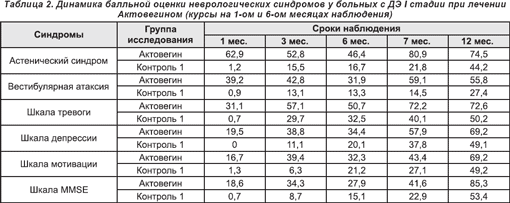
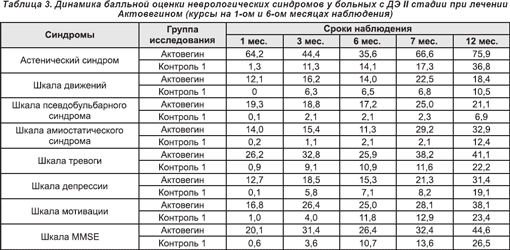
У больных с ДЭ III стадии также была продемонстрирована высокая клиническая эффективность Актовегина в отношении балльных оценок по шкалам астенического синдрома, движения, атаксии, псевдобульбарного и амиостатического синдромов (табл. 4).
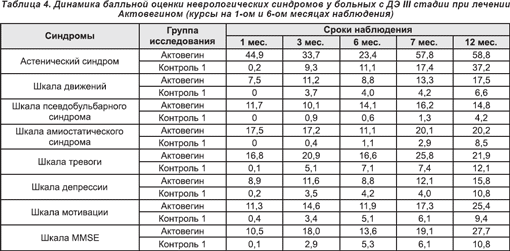
Актовегин, проявлявший высокую клиническую эффективность при лечении пациентов старших возрастных групп, статистически достоверно уменьшал проявления отмечавшейся у больных венозной дисциркуляции (р Список литературы
1. Актовегин: новые аспекты применения в клинической практике. — М., 1997. — 102 с.
2. Актовегин: в хирургии, внутренней медицине, лучевой терапии, дерматологии, спортивной медицине, общей медицинской практике // Научно-медицинская документация. Хафслунг Никомед фарма АГ. — Линц, Австрия. — 62 с.
3. Антиоксидантная и энергопротекторная терапия ишемического инсульта. — Метод. пособие. МЗ РФ РГМУ / Под ред. А.И. Федина, С.А. Румянцевой, О.Р. Кузнецова и др. — М., 2004. — 48 с.
4. Бригов А.Н. Современные проблемы профилактики сердечно-сосудистых заболеваний // Кардиология. 1996. — №3.— С. 18-22.
5. Бригов А.Н., Быстрова М.М., Орлов А.А. Профилактика инсульта — реальная задача в практике кардиологов и терапевтов // Кардиоваскулярная терапия и профилактика. — 2002. — №1. — С. 53-61.
6. Бурлакова Е.Б. Молекулярные основы применения антиоксидантов при лечении сердечно-сосудистых заболеваний // Биологические мембраны и проблемы современной кардиологии. — М., 1979. — С. 22-25.
7. Бурцев ЕМ. Дисциркуляторная энцефалопатия (эпидемиология, варианты клинического течения, классификация, лечение) // Проблемы неврологии и нейрохирургии. Сборник научных трудов. — Иваново, 1994. — С. 93-102.
8. Василенко Ф.И., Лифшиц Ф.И., Макарова Л.Д. и др. К патогенезу инфаркта головного мозга при атеросклеротической дисциркуляторной энцефалопатии в пожилом возрасте // VII Всероссийский съезд неврологов (тезисы докладов). — Н. Новгород, 1995.
9. Верещагин Н.В., Варакин Ю.Я. Профилактика острых нарушений мозгового кровообращения: теория и реальность // Журнал неврологии и психиатрии им. Корсакова, 1996. — №5. — С. 5-9.
10. Виленский Б.С. Препараты нейротрофического действия в лечении инсульта // Качество жизни. Медицина. Болезни сердечно-сосудистой системы, 2003. — №2. — С. 53-56.
12. Гомазков О.А. Молекулярные механизмы регуляции нейрохимических процессов // Успехи физиологических наук. М., 2003. Т. 34. № 3. С. 42-54.
13. Гусев Е.И., Скворцова В.И. Ишемия головного мозга М., 2001.326 с.
14. Гусев Е.И., Скворцова В.И. Нейропротекторы в комплексной терапии ишемического инсульта // Лечение нервных болезней, 2002. — Т.3. — № 3 (8). — С. 3-10.
15. Дамулин И.В. Дисциркуляторная энцефалопатия в пожилом и старческом возрасте. Дис. докт. мед. наук. — М., 1997.
16. Ермилов В.В., Капитонова М.Ю. Апоптоз: современные геронтологические и патологические аспекты // Клиническая геронтология, 1997. — №3. — С. 43-50.
17. Нейрометаболическая терапия хронической ишемии мозга. Метод. пособие МЗ и СР РФ/ под ред. З.А. Суслиной, С.А. Румянцевой. — М., 2005.
18. Одинак М.М., Вознюк И.А. Программированная клеточная гибель — патогенетический механизм дисциркуляторной энцефалопатии // Лечение нервных болезней. — 2002. — № 1(6). — С. 40-42.
19. Одинак М.М., Вознюк И.А. Новое в терапии при острой и хронической патологии нервной системы (нейрометаболическая терапия при патологии нервной системы). — 2001. — 62 с.
21. Румянцева С.А., Гридчик И.Е., Врублевский О.П. Место актовегина и инстенона в лечении энцефалопатии различного генеза // Клиническая геронтология. — 1996. — №2. — С. 37-40.
23. Федин А.И. Оксидантный стресс и применение антиоксидантов в неврологии // Атмосфера. — 2002. — №1. — С. 15-19.
25. Шкалы, тесты и опросники в медицинской реабилитации. Руководство для врачей и научных сотрудников / под ред. А.Н. Беловой и О.Н. Щепетовой. — М., 2002. — 439 с.
26. Шмидт Е.В., Максудов Г.А. Классификация сосудистых заболеваний головного и спинного мозга // Журнал невропатологии и психиатрии им. Корсакова. — 1971. — №71. — С . 3-11.
27. Anderson K.M., Wilson P.W.F., Odell P.M. et al. An updated coronary risk profile // Circulation, 1991; 83: 356-62.
28. Argentine C., Prencipe M. The Burden of stroke: a need for prevention. In: Prevention oflschemic Stroke. Eds Fieschi C, Fischer M. London: Martin Dunitz 2000, p. 1-5.
29. Bogousslavsky J. On behalf of the European Stroke Initiative. Stroke prevention by the practitioner // Cerebrovasc Dis., 1999; 9 (Suppl. 4): 1-68.
30. Bonita R. Epidemiology of stroke // Lancet, 1992; 339: 342-47.
31. Brunner L.L., Kanter D.S., Manson J.E. Primary prevention of stroke // New Eng 1 Med 1995: 333: 1392-1400.
32. Burn J., Dennis M, Bamford J. et al. Long-term risk of recurrent stroke after a first-ever stroke: the Oxfordshire Community Stroke Project. // Stroke, 1994: 25: 333-37.
Шабалина Н.И.
Дисциркуляторная энцефалопатия (ДЭ) - хроническое поражение головного мозга сосудистого генеза, развивающееся чаще всего на фоне артериальной гипертонии, атеросклероза или сочетания этих заболеваний [1,2]. В связи с широкой распространенностью цереброваскулярной патологии в популяции и увеличением количества пожилых людей во всем мире наблюдается увеличение частоты случаев ДЭ и одного из ее грозных проявлений - сосудистой деменции.
В основе патофизиологии ДЭ лежат процессы хронической церебральной гипоперфузии. Механизмы смерти нейронов при этом связаны с нарушениями энергетического метаболизма, дисфункцией митохондрий и оксидантным повреждением [1]. При ДЭ возникает каскад патологических событий, включающий нарушение мембранной целостности, изменение ионного транспорта, протеолиз, дисбаланс нейромедиаторных систем и апоптоз, что ведет к гибели нервных клеток.
Лечение пациентов с ДЭ представляется сложной и чрезвычайно актуальной медико-социальной проблемой, особенно в связи с необходимостью внедрения в клинику действенных методов нейропротекции 4. Одним из лекарственных средств, обладающих выраженным нейропротективным действием, является препарат Актовегин, содержащий в своем составе исключительно физиологические компоненты (аминокислоты, олигопептиды, нуклеозиды, микроэлементы). Актовегин, являясь антигипоксантом, активно влияет на уровень циклических нуклеотидов, поддерживающих окислительно-восстановительные процессы и адекватный церебральный метаболизм 7.
Целью настоящего исследования была оценка влияния препарата Актовегин на прогрессирование ДЭ (динамику отдельных неврологических синдромов и когнитивных функций), а также оценка эффективности Актовегина при лечении типичного неврологического осложнения сахарного диабета - диабетической полинейропатии (ДП).
Материал и методы исследования
На базе Центральной поликлиники ОАО “РЖД” нами было проведено комплексное обследование пациентов с ДЭ и ДП. У всех больных перед исследованием оценивался общесоматический и неврологический статус, изучались общеклинические и стандартные биохимические показатели крови и мочи, осматривалось глазное дно, проводились электрокардиография, ультразвуковая допплерография магистральных артерий головы, компьютерная томография головного мозга.
Всего обследовано 100 пациентов, в том числе 80 с ДЭ и 20 с ДП (в анамнезе - сахарный диабет на протяжении не менее 15 лет). Пациенты наблюдались в течение года. Курс лечения Актовегином включал 10 внутривенных вливаний 10% раствора (250 мл) с последующим ежедневным приемом препарата в виде таблеток по 200 мг 3 раза в день в течение 2 мес. Курсы лечения проводились дважды в год в дневном стационаре. При обследовании больных оценивалось влияние препарата на выраженность неврологических симптомов и когнитивных функций, а также на характер прогрессирования заболевания. Обследование проводилось на 3-м, 6-м и 12-м месяцах. Анализ эффективности лечения основывался на результатах следующих исследований (шкалы, тесты) [9]:
- общий неврологический статус;
- субъективная оценка основных клинических симптомов болезни (головная боль, головокружение, шум в голове, забывчивость, нарушение сна, утомляемость) с использованием 5-балльной рейтинговой шкалы (диапазон изменения от 0 (нет нарушений) до 4 баллов(грубые нарушения)) со стандартизированными критериями оценки выраженности каждого симптома;
- краткая шкала оценки психического статуса - ММSЕ (Mini Mental State Examination);
- шкала тревоги Спилбергера (State Trait Anxiety Inventory);
- шкала Гамильтона (Hamilton Depression Rating Scale);
- шкала нейропатического дисфункционального счета (NDS);
- шкала неврологических симптомов (ТSS).
Результаты
Динамика состояния пациентов с ДП по шкале неврологических симптомов (Т55)
| Субъективные ощущения | До лечения Актовегином (средний балл) | На фоне лечения (средний балл) | |
| 3 мес | 6 мес | ||
| Симптомы | |||
| жжение | 2 | 2 | 1 |
| онемение | 2 | 1 | 1 |
| боли | 2 | 1 | 0 |
| парастезии | 2 | 1 | 1 |
| Локализация | |||
| стопа | 2 | 1 | 1 |
| икры | 1 | 0 | 0 |
| Время возникновения | |||
| ночью | 2 | 1 | 1 |
| днем | 2 | 0 | 0 |
Динамика балльной оценки неврологических синдромов пациентов с I стадией ДЭ
| Синдромы | Группа исследовния | Сроки наблюдения | |
| 3 мес | 6 мес | ||
| Астенический синдром | Актовегин | 52,8 | 46,4 |
| Группа сравнения | 15,5 | 16,7 | |
| Вестибулярная атаксия | Актовегин | 42,8 | 31,9 |
| Группа сравнения | 13,1 | 13,3 | |
| Шкала тревоги | Актовегин | 57,1 | 50,7 |
| Группа сравнения | 29,7 | 32,5 | |
| Шкала депрессии | Актовегин | 38,8 | 34,4 |
| Группа сравнения | 11,1 | 20,1 | |
| Шкала мотивации | Актовегин | 39,4 | 32,3 |
| Группа сравнения | 6,3 | 21,2 | |
| Шкала MMSE | Актовегин | 34,3 | 27,9 |
| Группа сравнения | 8,7 | 15,1 | |

Динамика симптомов ДП (“диабетическая стопа”) на фоне лечения Актовегином
Субъективные ощущения у пациентов с ДП (боль, жжение, парестезии, онемение) по шкале Т55 достоверно уменьшились уже к 3-му месяцу лечения Актовегином (табл. 1). Положительной также была динамика объективных симптомов по шкале N05: улучшение чувствительности в области голеней отмечалось к 3-му месяцу лечения, в области стоп - к 12-му месяцу. Оживление сухожильных рефлексов (коленных, ахилловых) отмечено к 6-му месяцу наблюдения.
Отдельного анализа заслуживают результаты лечения ДП у 5 пациентов с начальной стадией заболевания (I стадия развития “диабетической стопы”, характеризующаяся поверхностными трофическими нарушениями). Уже на 8-е сутки лечения Актовегином у этой категории пациентов была отмечена местная положительная динамика в виде уменьшения болей в области стопы и исчезновения трофических нарушений на стопе (рисунок).
При оценке эффективности Актовегина в лечении ДЭ нами в качестве группы сравнения оценивались пациенты, у которых проводилась стандартная гипотензивная и антитромботическая терапия. Сравнительный анализ групп больных, получавших Актовегин и стандартную сосудистую терапию, свидетельствовал об их сопоставимости по полу, возрасту, этиологии ДЭ, тяжести течения и преимущественной локализации патологического процесса.
В течение всего периода наблюдения базовая терапия, назначаемая больным группы сравнения, способствовала регрессу астенического синдрома и улучшению ряда нейропсихологических характеристик, в частности, показателей тревоги и мотивации, а также оценки по шкале ММSЕ (р Режим работы поликлиники:
Понедельник – пятница с 8-00 до 20-00
суббота с 9-00 до 15-00
воскресенье – выходной
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!

О.А. ШАВЛОВСКАЯ, д.м.н., Первый МГМУ им. И.М. Сеченова Минздрава России
В статье обсуждается проблема терапии цереброваскулярных болезней (ЦВБ). Даны определения ЦВБ, хронической ишемии мозга (ХИМ) и дисциркуляторной энцефалопатии (ДЭП). Рассматривается место ДЭП в МКБ-10, диагностические критерии, клиническая картина и стадии течения ДЭП. Подчеркивается значимость оценки когнитивных функций, их профилактики и коррекции. Лечение когнитивных нарушений при ДЭП должно быть направлено прежде всего на предупреждение дальнейшего повреждения мозговых сосудов и вещества мозга, улучшение и долгосрочную стабилизацию когнитивных функций. Подчеркивается актуальность назначения препаратов нейрометаболического и нейропротективного типа действия, показана необходимость проведения тромболитической терапии в лечении хронической дисциркуляторной энцефалопатии и профилактике инсульта, а также коррекции астенических состояний и инсомнических проявлений.
Цереброваскулярные болезни (ЦВБ) – одна из основных причин летальности и стойкой утраты трудоспособности больных. В настоящее время ими страдают около 9 млн человек на планете. Согласно статистическим данным, смертность от ЦВБ в экономически развитых странах достигает 11–12%; в России первичная заболеваемость и показатели смертности от ЦВБ – одни из самых высоких в мире, и они будут только увеличиваться в связи со старением населения [1]. В России отчетливо прослеживается основная демографическая тенденция последних десятилетий – быстрое увеличение доли пожилых в общей структуре населения. Так, по данным Всероссийской переписи населения 2010 г. в нашей стране проживают около 47 млн человек пожилого возраста, 71,8% составляют лица в возрасте старше трудоспособного [2].
Для клинической картины ДЭП характерно [7]: 1) прогрессирующее нарастание когнитивных нарушений (снижение памяти, внимания, интеллекта), достигающих на последних этапах уровня деменции, которая проявляется сочетанием выраженных нарушений когнитивных функций, личностными изменениями со значительным затруднением обычной социальной активности и невозможности продолжать работу; 2) прогрессирующее эмоциональное оскудение, потеря интереса к жизни; 3) постепенное нарастание нарушений координации и ходьбы, дестабилизация темпа и ритма движений, склонность к падениям; в выраженных случаях ходьба становится невозможной, несмотря на отсутствие парезов; 4) подкорковый синдром: олигобрадикинезия, гипомимия, ахейрокинез, повышение мышечного тонуса по экстрапирамидному типу (по типу синдрома паркинсонизма); 5) различной выраженности псевдобульбарный синдром: дизартрия, дисфагия, насильственный смех и плач, симптомы орального автоматизма; 6) снижение силы в конечностях, легкие парезы при выраженном поражении головного мозга; 7) постепенное появление нарушений контроля функции тазовых органов.
Выделяют три стадии ДЭП: I – легкую, или умеренную (компенсация), II – выраженную (субкомпенсация), III – резко выраженную (декомпенсации) [1, 11]. Для ДЭП I ст. характерно [7]: жалобы на повышенную утомляемость, частые головные боли, раздражительность, умеренные нарушения памяти (прежде всего оперативной), умеренное снижение работоспособности, нарушения сна, которые сопровождаются стойкими объективными расстройствами в виде анизорефлексии, дискоординаторных явлений, легких глазо-двигательных нарушений, симптомов орального автоматизма. Наблюдается рассеянная неврологическая симптоматика, выявленные нарушения носят субсиндромальный характер [1]. Для ранних стадий ДЭП наиболее характерна сосудистая депрессия и эмоциональная лабильность, а, как известно, эмоциональные расстройства могут оказывать неблагоприятное влияние на когнитивную сферу [4].
При неадекватном лечении ДЭП прогрессирует и переходит в ДЭП II ст., при которой отмечавшаяся рассеянная неврологическая симптоматика формируется в отдельный доминирующий синдром, который наиболее существенно снижает профессиональную и социальную адаптацию больного [1, 7]. Появляются тревожные и депрессивные реакции, когнитивные расстройства усугубляются, снижается мыслительная продукция, волевая активность, ухудшается профессиональная память, отмечается вязкость мышления, сужение круга интересов, снижение критики и изменение личности. Нарушаются циркадианные ритмы в виде дневной сонливости при плохом ночном сне. Для ДЭП II ст. характерно: углубление нарушений памяти и снижение функции внимания, нарастание интеллектуальных и эмоциональных расстройств, значительное снижение работоспособности. Несколько реже встречаются жалобы на хроническую утомляемость, головную боль и другие проявления астенического синдрома. У части больных выявляются легкие подкорковые нарушения и изменения походки (она становится шаркающей, семенящей). Более отчетливо проявляется очаговая симптоматика в виде оживления рефлексов орального автоматизма, центральной недостаточности лицевого и подъязычного нервов, координаторных и глазодвигательных расстройств, пирамидной недостаточности, амиостатического синдрома [7].
При ДЭП III ст. количество жалоб уменьшается, что обусловлено снижением критики больных к своему состоянию, выраженность интеллектуально-мнестических и неврологических расстройств нарастает, наблюдаются немотивированные поступки, неадекватные реакции, эмоциональные расстройства характеризуются дистимически-дисфорическим фоном настроения с раздражительностью, недовольством окружающим и слабодушием. Для этой стадии характерно: четко очерченные дискоординаторный, амиостатический, психоорганический, псевдобульбарный, пирамидный синдромы. Чаще наблюдаются пароксизмальные состояния – падения, обмороки, эпилептические припадки. Основное отличие ДЭП III ст. от ДЭП II ст. заключается в том, что при ДЭП III ст. в клинике наблюдается несколько достаточно выраженных синдромов, тогда как при ДЭП II ст. явно преобладает какой-либо один из них [1, 7].
Схематично соотношение удельного веса жалоб и неврологической симптоматики на разных стадиях ДЭП изображено на рисунке 1.
Диагноз ДЭП устанавливается при наличии следующих критериев [7]: 1) объективно выявляемые нейропсихологические или неврологические симптомы; 2) признаки цереброваскулярного заболевания, включающие факторы риска (артериальная гипертензия, гиперлипидемия, сахарный диабет, нарушения сердечного ритма и др.) и/или анамнестические признаки и/или инструментально подтвержденные признаки поражения мозговых сосудов или вещества мозга; 3) свидетельства причинно-следственной связи между (1) и (2); 4) соответствие динамики нейропсихологического и неврологического дефицита особенностям течения цереброваскулярного заболевания (тенденция к прогрессированию с чередованием периодов резкого ухудшения, частичного регресса и относительной стабилизации); 5) соответствие выявляемых при КТ /МРТ изменений вещества мозга сосудистого генеза ведущим клиническим проявлениям; 6) исключение других заболеваний, способных объяснить клиническую картину.
Диагностические критерии ДЭП [12]: 1) наличие признаков (клинических, анамнестических, инструментальных) поражений головного мозга; 2) наличие признаков острой или хронической дисциркуляции (клинических, анамнестических, инструментальных); 3) наличие причинно-следственной связи между нарушениями и клинической, нейропсихологической, психиатрической симптоматикой; 4) клинические и параклинические признаки прогрессирования сосудистой мозговой недостаточности.
Течение ДЭП и прогноз
Выделяют стабильное, медленно прогрессирующее (с пароксизмами и ПНМК и без сосудистых эпизодов), приступообразное, быстро прогрессирующее течение. Стабильное и медленно прогрессирующее течение более характерно для ДЭП I ст., которая может длиться в течение 7–12 лет. При быстро прогрессирующем варианте ДЭП II или III ст. развиваются менее чем за 5 лет болезни. Клинический прогноз ДЭП III ст. неблагоприятен, на этой стадии заболевания больные нередко нуждаются в уходе, а иногда полностью беспомощны в быту.
Когнитивные нарушения являются ключевым проявлением ДЭП, которое во многом определяет тяжесть состояния больных. Они могут служить важнейшим диагностическим критерием ДЭП и являются, возможно, лучшим ориентиром для оценки динамики заболевания [6]. На ранней стадии ДЭП преобладают умеренные нейродинамические нарушения в виде замедленности, аспонтанности, снижения работоспособности, истощаемости, ослабления концентрации внимания. Тем не менее такие пациенты в целом хорошо справляются с тестами, не предусматривающими учета времени выполнения, это соответствует легкой степени когнитивных нарушений [6]. Дальнейшее прогрессирование когнитивного дефекта при ДЭП сопряжено с развитием деменции, при которой когнитивный дефицит (независимо от двигательных и других симптомов) приводит к ограничению повседневной активности и хотя бы частичной утрате бытовой независимости [6].
Лечение пациентов с ДЭП является сложной медико-социальной проблемой. В амбулаторно-поликлинических условиях лечение больных с дисциркуляторной энцефалопатией, по сути, ограничено терапевтическим воздействием на проявления ДЭП I и II ст. Основными направлениями ведения данных больных являются купирование развившейся декомпенсации патологического процесса, профилактика прогрессирования заболевания, в т. ч. инсульта, снижение выраженности когнитивных расстройств, неврологического дефицита [10]. Наиболее эффективной мерой по предупреждению дальнейшего прогрессирования заболевания является воздействие на сосудистые факторы риска, прежде всего правильная гипотензивная терапия, коррекция углеводного и липидного обменов, изменения сосудистого тонуса, повышения церебральной перфузии, улучшения метаболизма мозговой ткани [6].
Основой терапии, направленной на улучшение самочувствия пациента с ДЭП и улучшение качества его жизни, являются препараты, воздействующие на мозговое кровообращение на микроциркуляторном уровне (вазоактивные препараты), и препараты, улучшающие обменные процессы в головном мозге (ноотропные средства). Вазоактивные препараты улучшают кровоснабжение головного мозга за счет расширения сосудов микроциркуляторного русла. К ним относятся: блокаторы фосфодиэстеразы (такие как пентоксфиллин), в т. ч. растительного происхождения (гинкго билоба); кальциевые блокаторы, эффект которых наиболее выражен в том случае, если кровоток нарушен в бассейне позвоночных артерий, кровоснабжающих ствол мозга; -адреноблокаторы, действующие на рецепторы сосудистой стенки. Ноотропные средства позволяют повысить нейрональную пластичность, таким образом, увеличить адаптационные возможности нервных клеток и снизить их подверженность воздействию повреждающих факторов за счет улучшения обменных процессов в нейронах. Ноотропные препараты оказывают позитивное влияние на высшие интегративные функции мозга, улучшают способность к обучению, консолидацию памяти.
На сегодняшний день существует несколько фармакологических групп препаратов нейрометаболического действия. К первой группе относятся Актовегин, пирацетам, пиридитол и Церебролизин. Актовегин обладает широким спектром фармакологических эффектов (антигипоксантным, антиоксидантным), оказывает нейротрофическое действие, способствует реваскуляризации зоны ишемии. Антиоксидантный и антиапоптотический механизм действия обусловливает нейропротективные свойства Актовегина. Препарат улучшает транспорт глюкозы и поглощение кислорода, стимулирует их утилизацию, что способствует улучшению кислородного метаболизма даже в условиях гипоксии. Режим назначения Актовегина в амбулаторно-поликлинических условиях: Актовегин-форте по 3 драже 3 р/д. В настоящее время разработаны и широко используются терапевтические схемы лечения цереброваскулярных заболеваний с назначением Актовегина: по 10 мл (400 мг) на 200 мл физ. раствора в/в капельно курсом 7–10 дней, затем по 1–2 драже (200–400 мг) 3 р/д внутрь в течение 1–2 мес., при наличии мнестико-интеллектуальных нарушениях у лиц пожилого возраста – до 12 нед. по 2–3 драже 3 р/д. Повторные курсы через 6–8 мес. [13].
Патогенетически обосновано назначение препаратов, воздействующих преимущественно на микроциркуляторное русло. К числу таких препаратов относится Трентал (пентоксифиллин), который представляет собой производное метилксантина [14, 15]. Механизм действия данного препарата заключается в ингибировании фосфодиэстеразы 4-го типа, что вызывает увеличение содержания циклического АМФ в гладкомышечных клетках сосудистой стенки и форменных элементах крови. На фоне применения Трентала увеличивается церебральный кровоток за счет увеличения просвета сосудов, без эффекта обкрадывания. Кроме того, накопление циклического АМФ в тромбоцитах и эритроцитах оказывает антиагрегантный эффект, способствует увеличению деформируемости форменных элементов крови и снижению ее вязкости. В результате проведенных исследований доказана эффективность применения тромболитической терапии в лечении хронической дисциркуляторной энцефалопатии и профилактике инсульта [14, 15]: Трентал назначают по 100 мг 3 р/с, длительность курса лечения составляет 2 месяца; лечение пентоксифиллином (общая доза от 500 до 700 мг в день) больных, перенесших транзиторную ишемическую атаку, быстрее приводит к улучшению настроения и значительному снижению показателей двигательного и речевого дефицита, чем лечение ксантинола никотинатом (общая доза от 2 250 до 3 150 мг в день). Показана также эффективность Трентала при сосудистой деменции при применении препарата в дозе 400 мг/с в течение 36 нед. Больным с последствиями неинвалидизирующего инсульта рекомендуется назначение пентоксифиллина (Трентал 400) по 1 200 мг в сутки [15].
Лечение когнитивных нарушений при ДЭП должно быть направлено прежде всего на предупреждение дальнейшего повреждения мозговых сосудов и вещества мозга, улучшение и долгосрочную стабилизацию когнитивных функций, коррекцию других клинических проявлений заболевания [6]. На I и II стадии ДЭП когнитивные нарушения присутствуют в 88% случаев. Для улучшения когнитивных функций применяется широкий спектр ноотропных и нейропротекторных препаратов [4].
В профилактике и терапии умеренных когнитивных расстройств сосудистого генеза показана высокая эффективность нейрометаболических препаратов, к числу которых относится Цераксон (цитиколин) [16–18]. Препарат оказывает целевое воздействие на ключевые звенья процессов гибели нервных клеток сосудистой, травматической, токсической и другой этиологии. Цераксон является естественным метаболитом биохимических процессов в организме и сочетает нейромедиаторные и нейрометаболические эффекты. Важнейшим из них является активация биосинтеза мембранных фосфолипидов нейронов мозга, в первую очередь фосфатидилхолина. Цитиколин может корригировать когнитивные нарушения уже на начальных этапах их проявлений у пациентов с ДЭП [16], его применение способствует регрессу когнитивных нарушений, уменьшает сопутствующие эмоционально-аффективные и поведенческие расстройства. Цераксон способен потенцировать действие других ЛС при лечении острой цереброваскулярной патологии, в т. ч. тромболитиков, антиагрегантов и нейротрофиков [17]. Цераксон назначают по 1 000 мг 10 дней в/м или в/в один раз в день, затем внутрь раствор Цераксона 2 мл 3 р/д в течение 3 мес. [16], или по схеме [19]: ежедневно в дозе 3 мл 2 р/с на протяжении 6 мес. Нейропротективный эффект может длиться до 12 мес.
Тревожные расстройства – специфический симптомокомплекс, встречающийся у пациентов с ХИМ [8]. В терапии тревожно-депрессивных расстройств при ХИМ приоритет отдается ЛС, которые сочетают анксиолитические и нейропротекторные свойства. Наиболее перспективными среди препаратов этой группы оказались производные 3-оксипиридина, важным положительным свойством которых является способность проникать через гематоэнцефалический барьер. Одним из таких препаратов является Мексиприм, который относится к группе гетероароматических антиоксидантов, антигипоксантов с ноотропными, анксиолитическими и нейропотекторными свойствами. Мексиприм не обладает миорелаксантным действием даже в дозах, превышающих среднюю терапевтическую анксиолитическую дозу в 4–5,5 раза, и не вызывает таких явлений, как нарушение координации движений, снижение мышечного тонуса и мышечной силы, а также – в противоположность анксиолитикам – не оказывает седативного и амнезирующего действия, а наоборот обладает позитивным влиянием на память, особенно в условиях нарушения когнитивных функций [8]. Мексиприм может быть рекомендован как один из основных препаратов выбора при лечении легких когнитивных нарушений сосудистого генеза. Отсутствие стимулирующего эффекта на биоэлектрическую активность мозга позволяет рекомендовать его для коррекции когнитивных расстройств, в т. ч. и у пациентов, имеющих пароксизмальную активность. В исследованиях показана высокая эффективность препарата Мексиприм в лечении когнитивных расстройств при применении препарата по следующим схемам [20]: 1) ДЭП I–II ст. – 750 мг/сут перорально (250 мг 3 р/сут) курсом 5 дней, далее перорально 375 мг/сут (125 мг 3 р/сут) в течение 20 дней; 2) легкие когнитивные расстройства сосудистого генеза – 200 мг (5%-ный раствор по 2 мл 2 р/сут в/м) в течение 2 нед., далее перорально 125 мг/сут 3 р/сут в течение 1 мес.; 3) хронические формы недостаточности кровоснабжения головного мозга – 200 мг/сут в/в в течение 10 дней, далее перорально 125 мг 3 р/сут в течение 6 нед.
Жалобы на повышенную утомляемость, раздражительность, нарушения сна и снижение работоспособности (астенический синдром) являются характерными для пациентов с ДЭП [21]. В терапии астенических состояний используются препараты нейрометаболического действия, общетонизирующие средства и адаптогены. К таким препаратам относится Метапрот. Препарат обладает ноотропной, регенеративной, антигипоксической, антиоксидантной и иммуномодулирующей активностью. В ряде исследований показано, что комбинированная терапия комбинацией Метапрот – Пирацетам способствует выраженному регрессу неврологической симптоматики у больных в остром периоде ишемического инсульта, а комбинация Метапрот – Глиатилин используется для активации мозгового метаболизма и нормализации состояния пациента на ранних этапах лечения при тяжелых формах диффузной гипоксически-ишемической ЭП III ст. Метапрот назначают внутрь после еды по 0,25 г 2 р/сут курсом на 5 дней, с 2-дневными перерывами между ними во избежание кумуляции препарата. Количество курсов зависит от эффекта и в среднем составляет 2–3 (реже 1 или 4–6) [22].
В ряде исследований показана эффективность и безопасность Донормила (доксиламина сукцината) при нарушении сна у лиц пожилого возраста (включая пациентов с нарушением когнитивных функций) с диагнозом ДЭП I и II ст. [23]. Применение Донормила у лиц пожилого возраста имеет ряд преимуществ: препарат действует не только как снотворное средство, но и обладает успокаивающим действием; Донормил не изменяет структуру сна [24]; при его применении не выявлено признаков апноэ во сне и синдрома отмены (назначение при синдроме апноэ – только с осторожностью); Донормил не влияет на память и когнитивные функции, не изменяет скорость реакций [24, 25]. Важным преимуществом доксиламина сукцината при использовании препарата в гериатрической практике является период полувыведения, который составляет в среднем 10 ч. Пациентам с ДЭП I и II ст. в возрасте до 60 лет Донормил назначают в дозе 15 мг, старше 60 лет – 7,5 мг за 15 мин до сна в течение 2–5 дней (у пациентов старше 65 лет применять с осторожностью) [23, 25].
Читайте также:


