Проводимость по нервным корешками

13.11.2016
Исследование проводимости периферических нервов позволяет просто и надежно определить состояние периферических нервов. Импульс, вызванный электростимуляцией нерва, направляется по двигательным, чувствительным и смешанным нервам, и характеристики проведения импульса оцениваются с помощью записи потенциалов с мышц, либо непосредственно с нерва.
Двигательная единица состоит из одиночного нижнего двигательного нейрона и всех иннервируемых им мышечных волокон. Исследование проводимости двигательного нерва используется для оценки целостности двигательной единицы. При этом исследователь получает информацию о функционировании и структурной целостности двигательного нейрона, нерва, нервно-мышечного соединения и мышцы. Она позволяет установить локализацию, распространенность, длительность и патофизиологические особенности повреждений периферической нервной системы (ПНС). Также можно получить представления о прогнозе, эффективности лечения и степени восстановления двигательной единицы. При исследованиях двигательной проводимости записывающие электроды размещают на коже над мышцей и сухожилием, а стимулирующие электроды размещают на коже вдоль исследуемого нерва. Ответ мышцы на электростимуляцию может быть измерен путем регистрации суммарного потенциала действия мышцы (СПДМ), являющегося суммой электрических потенциалов всех мышечных волокон, которые реагируют на стимуляцию нерва. Может быть определено время, необходимое электрическому импульсу для достижения мышцы (латентность). Скорость прохождения импульса по нерву определяют путем стимуляции нерва в различных местах и определения дистанции, которую стимул преодолел.
Исследование проводимости двигательного нерва могут быть использованы в следующих целях:
- Для получения объективных доказательств поражения двигательной единицы.
- Для идентификации и определения точного места компрессии, ишемии и очаговых повреждений нервов, которые могут проявляться блокадой проведения импульса, замедлением проведения импульса в месте повреждения или патологическим проведением проксимальнее или дистальнее повреждения.
- Для определения степени распространенности поражения нервов у пациентов, у которых наблюдаются признаки поражения одиночного нерва (например, при мононевропатиях).
- Для дифференциальной диагностики периферических невропатий, миопатий и болезней нижнего двигательного нейрона (например, бокового амиотрофического склероза) у пациентов со слабостью конечностей.
- Для диагностики заболевания до его перехода в стадию развернутых клинических проявлений (например, при семейных невропатиях).
Обследование по поводу заболеваний нервно-мышечного синапса может включать ритмическую стимуляцию двигательных нервов. По мере утомления нервно-мышечного соединения при записи СПДМ, и его сравнении с полученным позднее СПДМ может наблюдаться падение амплитуды потенциала, поскольку со временем все меньше и меньше волокон способны реагировать на стимуляцию, даже если стимулировать нерв с интенсивностью, которую в норме нерв способен выдерживать длительное время.
Исследования проводимости чувствительных нервов проводятся с помощью записи потенциалов действия, при электростимуляции кожного нерва. Селективные исследования чувствительных нервов могут быть выполнены при стимуляции нервов, имеющих только чувствительный компонент (например, икроножного нерва), или, в качестве альтернативы, при селективной стимуляции чувствительного компонента смешанного нерва. Последнее, может быть сделано путем анатомической изоляции чувствительного компонента (например, стимуляция пальцев руки и запись над смешанным нервом в области запястья или локтя) или стимуляции смешанного нерва и записи над пальцами, в области которых расположены преимущественно чувствительные аксоны.
Исследования проводимости чувствительных нервов могут представлять ценность в следующих случаях:
- При системных заболеваниях, протекающих с поражением чувствительных нервов— для определения разновидности вовлеченных в патологический процесс чувствительных нервов (например, тонкие волокна, проводящие болевые и температурные ощущения, или толстые волокна, ответственные за проприоцептивную чувствительность); для установления того, какая часть периферического нерва поражена в большей степени — аксон или миелиновая оболочка; для получения объективных доказательств поражения чувствительного нерва.
- При очаговых невропатиях — для определения места повреждения или блокады, особенно при изолированном поражении чувствительных нервов.
- Для подтверждения или количественной оценки нарушений, если расстройства чувствительности возникают при периферической невропатии раньше, чем двигательные изменения или до появления объективных клинических признаков.
- Для установления локализации повреждения (проксимальнее или дистальнее) по отношению к ганглию заднего корешка (например, при дифференциальной диагностике повреждения плечевого сплетения и повреждения корешков).
Электромиографию (ЭМГ) обычно выполняют вместе с исследованиями проводимости нервов, получая при этом дополнительную информацию. Игольчатый электрод вводят в исследуемую мышцу и регистрируют потенциалы действия, генерируемые группами мышечных волокон (потенциалы действия двигательной единицы, или ПДДЕ). Исследуют мышцы в покое, в состоянии слабого сокращения и в состоянии сильного сокращения. В норме в состоянии покоя активность мышц не регистрируется. При активно протекающей невропатии, при тяжелых или воспалительных миопатиях могут регистрироваться спонтанные потенциалы действия с одиночных мышечных волокон (фибрилляционные потенциалы). При некоторых неврогенных процессах (особенно это характерно для болезни двигательного нейрона) могут наблюдаться спонтанные сокращения групп мышечных волокон (фасцикуляционные потенциалы). Характерные изменения ПДДЕ могут наблюдаться при патологии нервов и мышц. При заболевании периферических нервов амплитуда, продолжительность и степень полифазности ПДДЕ часто увеличены, а восстановление затруднено, в то время как при миопатиях амплитуда и продолжительность ПДЕ могут быть снижены, полифазность увеличена, восстановление ускорено. Потенциалы действия единичного мышечного волокна могут быть исследованы с помощью технически более сложного метода — электромиографии одиночного мышечного волокна.
В целом, электромиография и исследования нервной проводимости используются для обследования и уточнения диагноза у пациентов с болезнью двигательного нейрона (например, при боковом амиотрофическом склерозе), патологическими процессами, протекающими с поражением сплетений или нервных корешков, компрессионными невропатиями, периферическими полиневропатиями, заболеваниями нервно-мышечного синапса (например, myasthenia gravis), а также с заболеваниями мышц. Поскольку исследование требует введения игольчатых электродов в мышцы и применения электрических разрядов, для пациента оно сопряжено с определенными неудобствами. При соблюдении техники безопасности исследование не представляет опасности; ограничить проведение ЭМГ может склонность пациента к кровотечениям.
ЭМГ и определение скорости распространения возбуждения (СРВ) по нервному волокну при различных заболеваниях
1. ЭМГ и исследование СРВ важны при обследовании и электрофизиологической диагностике болезней двигательного нейрона (например, бокового амиотрофического склероза). В целом, исследования проводимости периферических нервов дают нормальные результаты, кроме, вероятно, некоторого снижения амплитуд ПДЕ (поскольку заболевание исключительно двигательного характера, результаты исследования чувствительности патологии не выявляют). С помощью игольчатой ЭМГ можно обнаружить признаки диффузного повреждения клеток переднего рога, в том числе патологическую спонтанную активность (фибрилляции и фасцикуляции), патологические параметры (увеличение амплитуды, расширение, полифазность) и замедление восстановления ПДЕ. Часто данные ЭМГ свидетельствуют об активном патологическом процессе даже при отсутствии клинических проявлений заболевания или минимальных проявлениях. С помощью игольчатой ЭМГ можно получить также информацию о прогнозе заболевания; ЭМГ может помочь диагностировать другие заболевания клеток переднего рога, такие как постполиомиелитический синдром и спинальная мышечная атрофия.
2. Термин радикулопатии объединяет различные симптомы и признаки, возникающие в результате преходящего или стойкого повреждения нерва при его выходе из спинного мозга на уровне межпозвоночных отверстий. Результаты исследований проводимости обычно в норме. ЭМГ выявляет признаки неврогенных изменений (например, фибрилляции и изменения ПДЕ) в мышцах, иннервируемых определенным корешком, тогда как мышцы, иннервируемые не вовлеченными в патологический процесс корешками, интактны. Характер неврологических изменений зависит от степени тяжести процесса, длительности заболевания и степени восстановления (реиннервации).
В клинической практике ЭМГ может быть полезна в следующих ситуациях:
- ЭМГ используется для подтверждения повреждения корешка и определения уровня поражения. Следует заметить, что патологические изменения по результатам ЭМГ наблюдались лишь примерно у 90 % пациентов с шейной или пояснично-крестцовой радикулопатиями, обнаруженных при оперативном вмешательстве. Таким образом, нормальные результаты ЭМГ не исключают наличия радикулопатии.
- ЭМГ позволяет уточнить вовлечение конкретных корешков.
- ЭМГ используют для выявления активной денервации (определяется по наличию фибриллярных потенциалов).
- С помощью ЭМГ можно определить время, прошедшее с момента возникновения радикулопатии (острая, подострая, хроническая или длительно существующая).
- ЭМГ может предоставить определенную информацию о степени выраженности радикулопатии.
- При ЭМГ можно обнаружить другую патологию, способную объяснить существование имеющихся у пациентов симптомов.
- ЭМГ может помочь определить, имеют ли обнаруженные при МРТ или миелографии изменения какое-либо физиологическое значение.
- Помощью ЭМГ и ЭНМГ можно диагностировать плечевые и пояснично-кресцовые плексопатии и компрессионные нейропатии, а также определить уровень поражения при этих заболеваниях.
По электрофизиологическим характеристикам периферические полинейропатии могут быть разделены на следующие категории:
- Демиелинизирующие смешанные сенсомоторные невропатии, в том числе некоторые наследственные невропатии,
- Сегментарные демиелинизирующие сенсомоторные полинейропатии, в том числе воспалительные невропатии (например, синдром Гиен-Барре) и невропатии, ассоциированные с гаммапатиями, гипотиреозом, злокачественной опухолью или лимфомой, СПИДом, болезнью Лайма и воздействием определенных токсинов.
- Аксональные моторно-сенсорные полинейропатии, включая порфирию, некоторые наследственные невропатии, лимфоматозные невропатии и некоторые токсические невропатии.
- Аксональные сенсорные нейронопатии или нейропатии, включая первичный амилоидоз, синдром Шегрена, паранеопластические нейропатии, а также нейропатии, вызванные приемом лекарственных препаратов и дефицитом витамина В12.
- Смешанные аксональные сенсомоторные полинейропатии, в том числе нейропатии при уремии и сахарном диабете.
- Аксональные сенсомоторные полинейропатии, в том числе нейропатии, вызванные дефицитом определенных питательных веществ, приемом алкоголя, связанные с саркоидозом, заболеваниями соединительной ткани, воздействием токсинов, тяжелых металлов и лекарственных препаратов.
4. Заболевания нервно-мышечного синапса могут быть диагностированы с помощью ритмической стимуляции. Ритмическая стимуляция двигательных нервов применяется, в основном, для диагностики миастении. Для этой патологии характерно прогрессивное снижение амплитуды ответа на несколько первых раздражающих стимулов, получаемое при стимуляции с частотой 3 стимула в секунду. Уточнить характер заболевания можно по изменению ответа на стимуляцию после непродолжительного сокращения мышцы. У некоторых пациентов с миастенией при нормальных результатах стимуляции диагноз может быть установлен с помощью ЭМГ единичного мышечного волокна. При миастеническом синдроме Итона-Ламберта значительно уменьшена амплитуда ответа находящейся в покое мышцы, вызванного единичной максимальной стимуляцией нерва. Дальнейшее уменьшение амплитуды может наблюдаться при ритмической низкочастотной стимуляции, но значительное улучшение (увеличение ПДДЕ) наблюдается во время высокочастотной стимуляции. При других заболеваниях, таких как боковой амиотрофический склероз, иногда может наблюдаться необычная утомляемость периферической нервно-мышечной системы, но это патологическое изменение не представляет большой диагностической ценности.
ЭМГ/ЭНМГ позволяют прояснить следующие вопросы
- Дифференцировать нейрогенные и миопатические причины мышечной слабости.
- Установить ключевые моменты этиологии миопатии.
- Оценить тяжесть патологического процесса, а также является ли он острым, подострым или хроническим.
- Оценить степень активности и характер течения заболевания.
- Предоставить информацию о распространенности патологического процесса.
- Диагностировать патологию, даже если она не сопровождается клиническими проявлениями.
Специалисты, работающие в клинических нейрофизиологических лабораториях, преимущественно имеют дело с двумя группами вопросов: оценкой функционального состояния периферической нервной системы (ПНС) и оценкой состояния коры головного мозга. Для оценки состояния ПНС применяют методы исследования нервной проводимости (ИНП). При этом исследуемый нерв стимулируют электрическим током с одновременной регистрацией электрических волн, которые нерв генерирует в ответ на раздражение. Второй метод оценки состояния ПНС — электромиография (ЭМГ), при которой в исследуемых мышцах регистрируют волны, возникающие при их произвольном сокращении. Комплекс методов ИНП и ЭМГ называют электродиагностическим обследованием.
При подозрении на поражение ПНС после клинического осмотра проводят исследование нервной проводимости (ИНП). С помощью электрической стимуляции нерва и последующей регистрации деполяризации связанного с этим нервом мышечного волокна можно определить, поражает ли заболевание нерв, нервно-мышечный синапс или саму мышцу. ИНП также позволяет установить, является ли заболевание фокальным или диффузным, повреждает чувствительные и/или двигательные аксоны, поражает миелиновую оболочку или сам аксон.
а) Исследование проведения по нервам верхней конечности. Основной нерв верхней конечности, исследование проводимости которого позволяет выявить наличие фокального (в отличие от генерализованного) поражения периферической нервно-мышечной системы,— срединный нерв. Срединный нерв — одновременно двигательный и чувствительный — обладает тремя основными преимуществами в плане проведения электрофизиологической диагностики.
1. В области локтевого сустава и запястья он расположен близко к поверхности, поэтому технически просто проводить стимуляцию нерва и выполнять регистрацию его реакции.
2. Срединный нерв иннервирует короткую мышцу, отводящую большой палец кисти, которая хорошо подходит для проведения поверхностной и игольчатой ЭМГ (двигательное ИНП).
1. Проведение по двигательным нервам:
- Стимуляция. Обычный стимулирующий электрод имеет катод и анод в форме двух тупых штырей, которые прикладывают к поверхности кожи над нервом. На рисунке ниже изображен электрод, размещенный над срединным нервом у запястья (сразу латеральнее сухожилия длинной ладонной мышцы). Для того чтобы анод не заблокировал проведение нервного импульса, катод должен быть расположен к месту регистрации ближе, чем анод. Когда между катодом и анодом возникает электрический ток достаточной силы, изменение трансмембранного тока ионов вызывает появление нервного импульса, который распространяется по нерву в обоих направлениях. Сначала деполяризация возникает на крупных миелинизированных нервных волокнах, расположенных вблизи катода; к ним относят Аα-аксоны мотонейронов переднего рога спинного мозга. Обычно стимул в 20-40 mА продолжительностью 0,1 мс достаточен для возбуждения всех двигательных единиц короткой мышцы, отводящей большой палец.
- Регистрация. Активный поверхностный датчик, имеющий в нашем случае форму диска, устанавливают к двигательной точке. Это место, расположенное в центре исследуемой мышцы, имеет наибольшую концентрацию двигательных концевых пластинок. Второй, референтный электрод устанавливают на нейтральную область на некотором удалении от первого электрода. Для записи разницы потенциалов между этими двумя электродами используют усилитель, который также увеличивает выраженность вызванной двигательной реакции мышцы. Система настроена таким образом, что при регистрации активным электродом отрицательного значения кривая на мониторе отклоняется вверх.
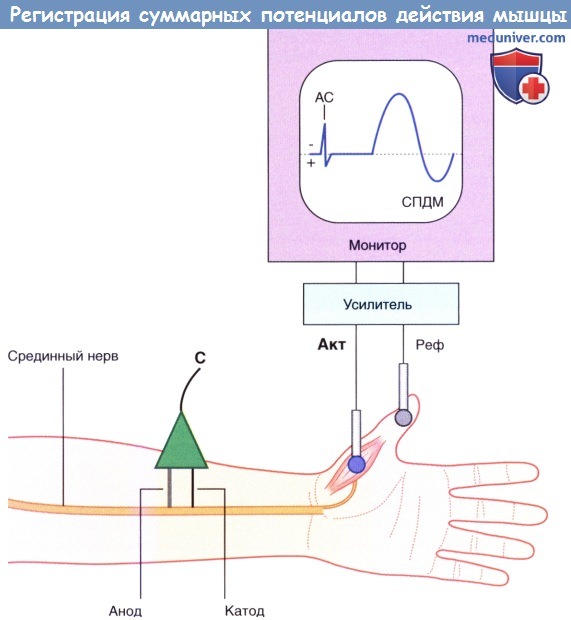
Базовая установка для регистрации СПДМ. АС — артефакт стимуляции.
Стимулирующий электрод (С) расположен над срединным нервом.
Активный электрод (Акт) расположен над короткой мышцей, отводящей большой палец.
Референтный электрод (Реф) установлен дистальнее.
При подаче слабого стимула на мониторе будет отображаться только плоская линия, которая иногда прерывается стимуляционными артефактами. При увеличении интенсивности стимула появляются небольшие суммарные потенциалы действия мышцы (СПДМ). Они возникают за счет активации крупных миелинизированных аксонов, расположенных вблизи стимулирующего электрода. Волна деполяризации, передающаяся по аксону, приводит к деполяризации всех мышц, которые иннервирует этот аксон. В двигательных единицах внутренних мышц руки, в том числе в короткой мышце, отводящей большой палец, один мотонейрон иннервирует 200-300 мышечных волокон. Для крупных мышц, которые не совершают точных мелких движений (например, дельтовидная, икроножная), минимальное отклонение кривой на мониторе будет в несколько раз больше. Это связано с двумя факторами: соотношение мотонейронов к двигательным волокнам составляет примерно 1:1000, а их крупные мышечные волокна генерируют потенциалы действия большей амплитуды.
Следует еще раз подчеркнуть, что кривая, возникающая на мониторе, не отображает сокращения мышц, а представляет результат внеклеточного потенциала, который возникает за счет деполяризации мембран мышечных клеток и передается через подкожные ткани и кожу. Несмотря на это, при большинстве мышечных заболеваний патологический процесс также будет нарушать процесс деполяризации клеточной мембраны, что приведет к появлению аномалий на кривой.
При повышении вольтажа происходит возбуждение дополнительных двигательных единиц. Это происходит до тех пор, пока все двигательные единицы не будут активироваться одним импульсом. Такой стимул называют максимальным. Для точности окончательный стимул обычно делают супрамаксималъным, т.е. на 5-10 % превышающим максимальный. Окончательная наблюдаемая волна и представляет собой СПДМ — сумму потенциалов действия отдельных мышечных волокон.
Результат измерения конечного СПДМ изображен на рисунке ниже. К измеряемым параметрам относят латентность (временной интервал) между временем подачи стимула и началом деполяризации, амплитуду и длительность отрицательной фазы волны. (Появление последней, положительной фазы, обусловлено движением ионов внутрь клетки во время общей реполяризации мышечных волокон.)
- Повторное измерение. Целесообразно повторно измерить СПДН, но уже с другого нерва. Обычно для повторного измерения используют локтевой нерв. Точка С1 расположена на запястье сразу латеральнее локтевого сгибателя запястья, а С2 — на уровне выхода нерва у медиального надмыщелка. Активный электрод устанавливают над мышцами гипотенара у медиального края ладони.
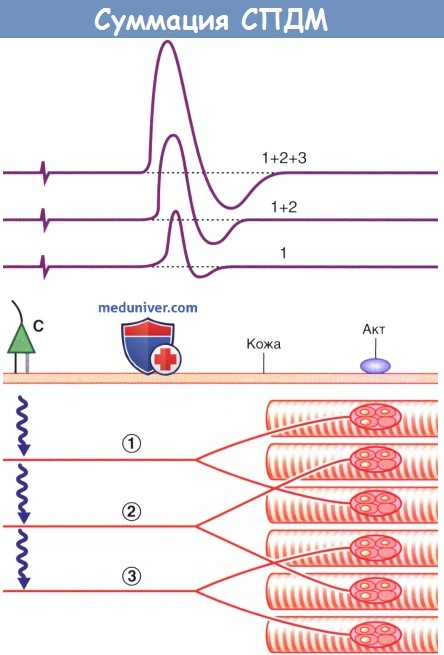
Суммация СПДМ. Двигательные единицы представлены перекрещивающимися парами мышечных волокон.
При легкой (1), средней (2) и максимальной (3) стимуляции на экране возникают волны все большей амплитуды, хотя они и являются разными с точки зрения физиологии феноменами. 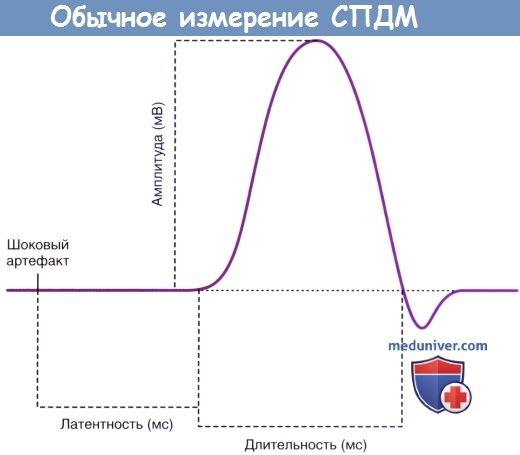
Обычное измерение СПДМ 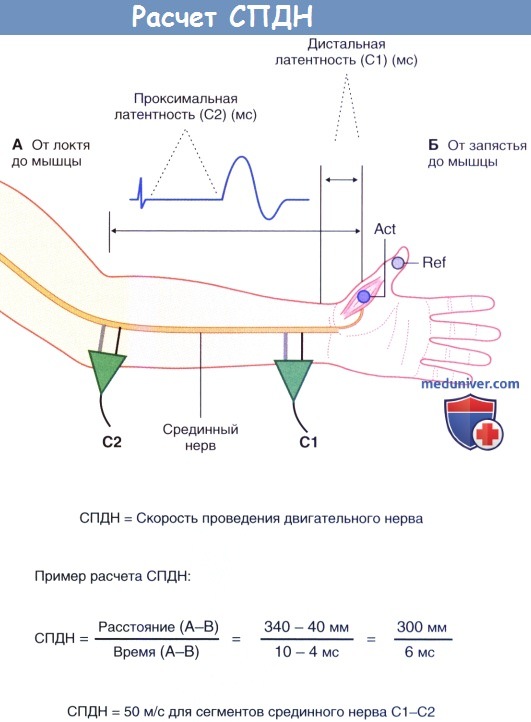
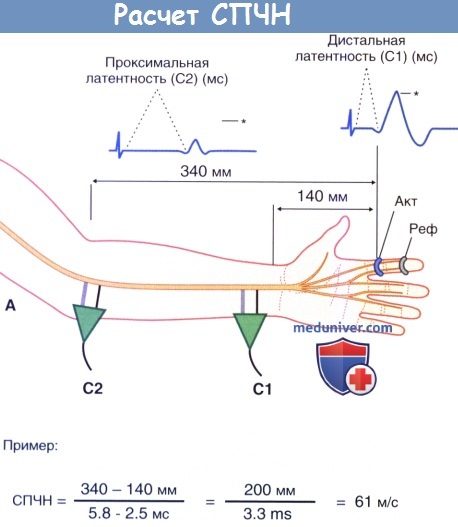
Расчет скорости проведения двигательного нерва (СПДН). Нерв стимулируют дважды: С1—первый стимул, С2 — второй стимул.
Двунаправленными стрелками отмечены два измерения длины.
Исходное значение времени не представлено. Внизу показан пример расчета нормальной скорости проведения.
2. Проведение по чувствительным нервам. Для измерения скорости проведения чувствительных нервов (СПЧН) также удобнее всего использовать срединный нерв. Точно также при стимуляции происходит возбуждение крупных миелинизированных нервных волокон, места и характер стимуляции в локтевой ямке и у запястья остаются прежними. Однако в данном случае избирательно записывают антидромные потенциалы кожных чувствительных волокон, в частности пальцевых ветвей срединного нерва, идущих к коже указательного пальца. Для этого на указательный палец надевают активное записывающее устройство в форме кольца.
1. Физиологическая временная дисперсия. Подобно тому, как во время гонки расстояние между бегунами прогрессивно увеличивается, наиболее быстрый проводник импульса выходит вперед, а самый медленный остается позади. Из-за этого при увеличении расстояния измерения кривая СЧПД удлиняется. Данное явление и называют временной дисперсией (рассеивание во времени).
- Скорость проведения чувствительных нервов. Основные режимы и принципы измерения остаются теми же, что и при исследовании суммарных потенциалов действия мышцы (СПДМ). На рисунке ниже изображен пример, на котором показан феномен отмены фазы при наличии физиологической временной дисперсии.
- Повторное измерение. Обычно проводят с локтевым нервом. Как и ранее, нерв стимулируют у запястья и у локтевой ямки, кольцо надевают на мизинец.
Расчет скорости проведения чувствительных нервов (СПЧН). Представлены пальцевые ветви срединного нерва. Основные принципы расчета те же, что и в случае скорости проведения двигательного нерва (СПДН).
б) Проведение по нервам нижней конечности:
1. Проведение по двигательным нервам. При исследовании СПДМ на нижней конечности чаще всего используют глубокий малоберцовый нерв, регистрацию осуществляют с короткого разгибателя пальцев на подошвенной поверхности стопы. Сначала глубокий малоберцовый нерв стимулируют на передней поверхности лодыжки, а затем на уровне шейки малоберцовой кости. Иногда регистрацию осуществляют также с передней большеберцовой мышцы; в этом случае общий малоберцовый нерв сначала стимулируют у шейки малоберцовой кости, а затем у латерального края подколенной ямки вблизи сухожилия двуглавой мышцы бедра.
Повторное исследование СПДМ проводят со стимуляцией большеберцового нерва, запись осуществляют с мышцы, приводящей большой палец, расположенной у медиального края стопы.
2. Проведение по чувствительным нервам. Для исследования СЧПД используют икроножный нерв. Он начинается от большеберцового нерва и получает ветвь от общего малоберцового нерва; данный нерв иннервирует кожу вдоль латерального края стопы. Запись осуществляют с кожи, расположенной немного ниже латеральной лодыжки, далее нерв антидромно стимулируют в точках, показанных на рисунке ниже.
• на уровне шеи, где корешки спинномозговых нервов С6 и С7 предрасположены к сдавливанию остеофитами, возникающими при шейном спондилезе;
• на уровне поясницы, где корешки спинномозгового нерва S1 могут сдавливаться при пролапсе межпозвоночного диска L5/S1;
• радикулопатия может быть компонентом генерализованной периферической нейропатии.
Н-рефлекс. Поскольку корешки спинномозговых нервов залегают глубоко, оценить проводимость по ним можно лишь косвенно за счет активации сенсомоторных чувствительных дуг соответствующего уровня. Стандартный тест, названный в честь Hoffman, который впервые его описал, называют Н-ответом или Н-рефлексом. Его часто используют для оценки общей скорости проведения по рефлекторной дуге S1; оценивают те же самые нейроны, которые клинически исследуют путем ахиллова рефлекса. Большеберцовый нерв стимулируют длительным током минимальной силы, достаточной для сокращения мышцы. Цель исследования — возбуждение самых крупных афферентных миелинизированных волокон (предпочтительно длительными стимулами), преимущественно тех, которые иннервируют аннулоспиральные окончания мышечных веретен. За счет этого активируется моносинаптический рефлекс с минимальной латентностью, происходит сокращение трехглавой мышцы голени (икроножной/камбаловидной). Минимальная латентность оказывается достаточно долгой — до 35 мс в зависимости от роста пациента, поскольку сегмент S1 спинного мозга расположен за телом позвонка L1; за счет этого нервный импульс должен пройти путь порядка 130-150 см вниз и вверх. При последовательном повышении силы тока возникает точка, в которой появляются М-волны. М-волны возникают благодаря прямой ортодром-ной активации двигательных концевых пластинок. Антидромное проведение обусловливает постепенное затухание потенциалов действия, нисходящих по эфферентному звену Н-рефлекса.
На верхней конечности проведение по нервным корешкам нерва С6 можно исследовать за счет стимуляции срединного нерва и регистрации сокращений лучевого сгибателя запястья. Корешок С7 можно исследовать путем стимуляции заднего кожного нерва предплечья и регистрации сокращений трехглавой мышцы плеча.
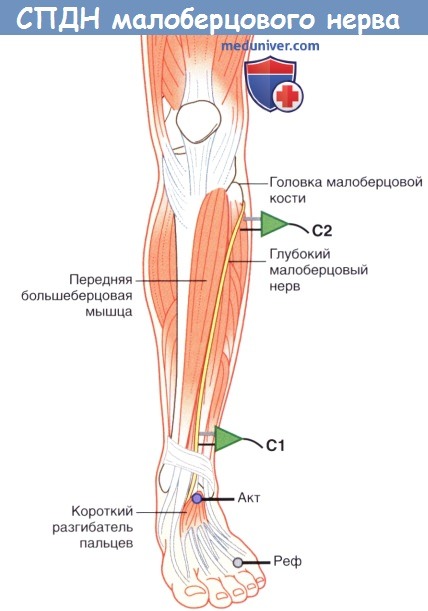
Положение датчика и усилителя при измерении скорости проведения двигательного нерва (СПДН) малоберцового нерва. 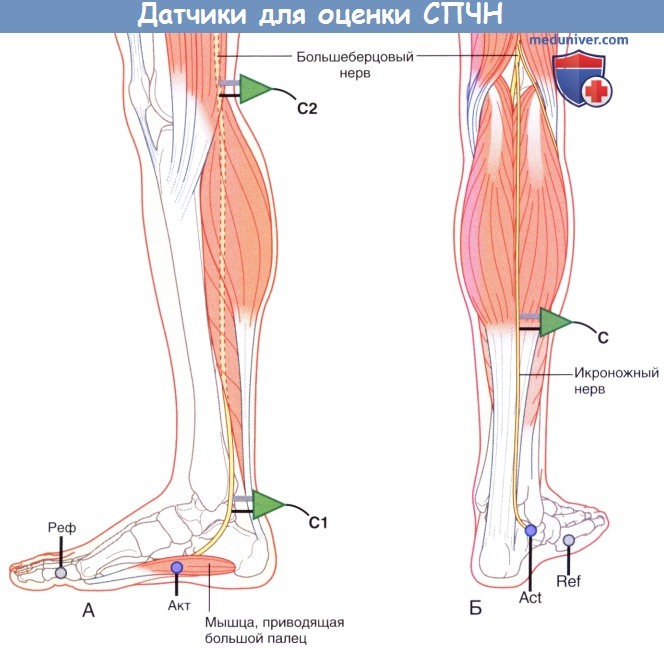
(А) Положение датчика и стимулятора при измерении скорости проведения чувствительного нерва (СПЧН) с большеберцового нерва.
(Б) Положение электродов при записи антидромной скорости проведения чувствительного нерва (СПЧН) с икроножного нерва. 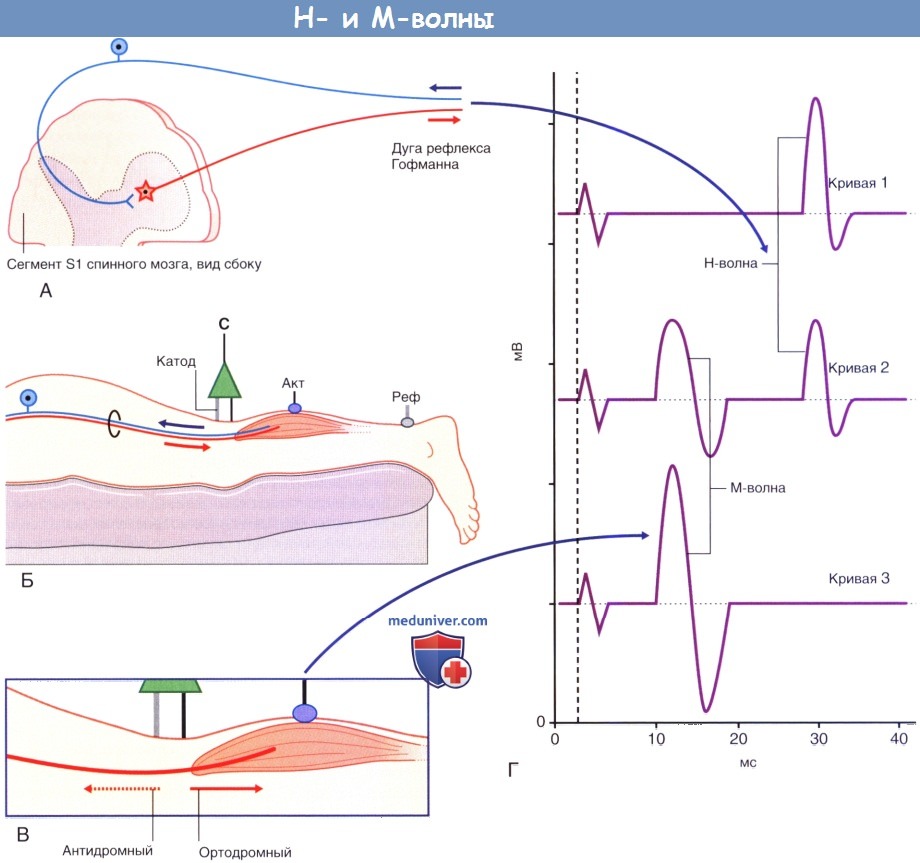
Анатомические предпосылки появления Н- и М-волн.
(А) Появление Н-волны опосредованно моносинаптической рефлекторной дугой, как показано на рисунке.
(Б) Запись СПДМ с S1 сегмента рефлекторной дуги Ахиллова рефлекса. Стимулирующий электрод расположен над большеберцовым нервом; записывающий электрод расположен над трехглавой мышцей.
Оба звена рефлекторной дуги образованы большеберцовой ветвью седалищного нерва.
(В) При повышении силы тока происходит непосредственная активация аксонов, иннервирующих мышцу, из-за чего возникают коротколатентные М-волны.
(Г) Обратите внимание, что по мере увеличение интенсивности стимула Н-волна постепенно исчезает (от кривой 1 до кривой 3) вследствие того,
что ортодромные двигательные импульсы из (А) подавляются антидромными импульсами катода, которые представлены в (В) пунктирной линией.
Редактор: Искандер Милевски. Дата публикации: 13.11.2018
7.2.1. Механизмы восстановления функций при повреждении периферических нервов и сплетений
К основным факторам, определяющим при периферических невропатиях и плексопатиях скорость и степень спонтанного восстановления нарушенных функций (и, следовательно, объем и направленность лечебных вмешательств), относятся следующие:
- степень повреждения нервного проводника;
- уровень поражения;
- характер повреждающего агента.
Реабилитологи чаще всего определяют степень повреждения нерва по 3 категориям согласно классификации H.Seddon [1943]. Иногда используют также классификацию S.Sunderland [1990], выделяющего 5 степеней повреждения нервов; эта классификация основана на классификации H.Seddon, детализируя ее. Согласно классификации H.Seddon, все локальные повреждения нервных стволов делят, в зависимости от сохранности аксона и соединительнотканных структур, на три группы: (1) нейрапраксия; (2) аксонотмезис; (3) нейротмезис. (1) Нейрапраксия (neurapraxia, англ.) - это повреждение нерва, не приводящее к гибели аксона. Часто наблюдается при компрессии нерва (например, "ночной субботний паралич" вследствие компрессии лучевого нерва), при легкой травме нерва. Клинически характеризуется снижением вибрационной, проприоцептивной, иногда тактильной чувствительности. Болевая чувствительность страдает реже. Часто наблюдаются двигательные нарушения и парестезии. Блок проведения нервного импульса, наблюдающийся вследствие локального повреждения миелиновой оболочки, носит преходящий характер и регрессирует по мере восстановления миелина. Восстановление двигательных и чувствительных функций может продолжаться до 6 месяцев.
(2)Аксонотмезис (axonotmesis, англ.) - повреждение нерва, приводящее к гибели аксона при сохранности эпиневрия, периневрия, эндоневрия и шванновских клеток. Нередко наблюдается при закрытых переломах либо вывихах костей конечностей, а также при сдавлениях нервных стволов. Нарушаются двигательные, чувствительные и судомоторные функции нерва. Восстановление функций происходит за счет регенерации аксона. Скорость и степень восстановления зависит от уровня поражения, возраста (у молодых регенерация происходит быстрее) и общего состояния больного. В случаях, когда прорастание аксона происходит медленно, может произойти рубцевание эндоневральной трубки, в которую прорастает аксон, и восстановление не наступает. По этой же причине неблагоприятный прогноз имеется в случаях, когда дефект нервного ствола имеет значительную длину. При благоприятных условиях происходит постепенная невротизация дистального отдела поврежденного нерва, которая продолжается в течение многих месяцев, иногда год и более. Наблюдается восстановление утраченных функций, но не всегда полное.
О) Нейротмезис (neurotmesis, англ.) - разрыв нерва с пересечением аксона и соединительнотканных оболочек нерва. Из-за того, что повреждаются эндоневральные трубки, невозможным становится прорастание в них аксонов, регенерация аксонов приводит к образованию травматической невромы. Прогноз восстановления неблагоприятный. Данная классификация основана на микроскопических изменениях в нервном стволе. Макроскопически различить степень повреждения практически невозможно. Диагностика основана на динамическом клиническом и электрофизиологическом наблюдении. В связи с этим при закрытых травмах нервных стволов отечественные авторы нередко применяют иную классификацию, основанную на выделении следующих 4 форм поражения нервного ствола [Макаров А.Ю., Амелина О.А., 1998]: сотрясение, ушиб, сдавление, тракция. Сотрясение не сопровождается морфологическими изменениями в нерве, нарушения функции нерва кратковременны (не более 1-2 недель) и полностью обратимы. Ушиб нерва характеризуется возникновением мелких кровоизлияний, участков размозжения нервных волокон и пучков, что приводит к полному либо частичному нарушению проводимости, длительным и стойким выпадением функций. При сдавлении нерва степень нарушения проводимости зависит в первую очередь от длительности сдаачения: при своевременном удалении сдвливающих нерв субстратов (гематома, инородное тело, отломок кости и т. д.) может наблюдаться быстрое и полное восстановление проводимости, тогда как при длительном сдавлении в нервном стволе развиваются дегенеративные изменения. Отсутствие восстановления функции в течение 2-3 месяцев является критерием полного анатомического перерыва нерва. Тракция (например, тракдия ветвей плечевого сплетения при вправлении вывиха плеча) обычно сопровождается частичным нарушением функции, однако восстановление проводимости по нерву происходит достаточно длительно (в течение нескольких месяцев).
Чем проксимальнее поражение нервного ствола или сплетения (т.е. чем больше расстояние от места повреждения до периферических окончаний), тем хуже прогноз восстановления функции, поскольку тем больший срок требуется для прорастания нервного волокна и тем больше вероятность развития в эндоневральной трубке периферического отрезка нерва необратимых Рубцовых изменений [Lefferet R., 1985]. Так, например, по данным С.И.Карчикяна [1962], при ранениях седалищного нерва в верхней трети бедра первые движения стопы и пальцев появляются лишь спустя 15-20 месяцев и позже после наложения нервного шва, а при ранениях этого же нерва в нижней трети бедра - через 10-15 месяцев после оперативного вмешательства.
Наихудший прогноз отмечается при повреждениях на корешковом уровне, поскольку корешки спинальных нервов не регенерируют и не могут быть восстановлены хирургическим путем. Поражение корешков (обычно - отрыв корешка на шейном уровне), в отличие от поражения сплетения, характеризуется следующими признаками:
- интенсивная жгучая боль, иррадиирущая вдоль соответствующего дерматома;
- парализация паравертебральных мышц, иннервируемых задними ветвями спинальных нервов;
- паралич мышц лопатки вследствие нарушения функции коротких нервов плечевого пояса (крыловидная лопатка);
- синдром Горнера (при поражении С8-ты корешков);
- трофические нарушения и быстро прогрессирующая мышечная атрофия с грубыми вторичными контрактурами.
Периферические невропатии и плексопатии могут иметь самую различную этиологию (таблица 7.2). В мирное время наиболее частой формой поражений периферических нервов являются туннельные невропатии, составляя около 30-40% от всех заболеваний периферической нервной системы. Туннельная невропатия - это локальное поражение нервного ствола, обусловленное его компрессией и ишемией в анатомических каналах (туннелях) или вследствие внешнего механического воздействия [Лейкин И.Б.,1998]. Предрасполагающие к развитию туннельных невропатий факторы включают генетически обусловленную узость естественных вместилищ нерва, приобретенную узость этих вместилищ вследствие отеков и гиперплазии соединительной ткани при различных заболеваниях (например, сахарном диабете, гипотиреозе, коллагенозах), длительное перенапряжение мышечно-связочного аппарата у лиц определенных профессий, последствия трав, мышечно-тонические и нейро-дистрофические нарушения при рефлекторных синдромах остеохондроза позвоночника, ятрогенные травмирующие воздействия (неправильное наложение гипсовой повязки, кровоостанавливающего жгута). Нарушение функции нерва происходит вследствие как демиелинизации, так и поражения аксона (ухудшение нейротрофического контроля в связи с недостаточностью аксонального транспорта).
Туннельные поражения нервов проявляются в первую очередь болью, чувствительными и вегетативными расстройствами. Двигательные нарушения развиваются лишь у одной трети больных и заключаются, как правило, в снижении мышечной силы, гипотрофии мышц, развитии контрактур. Прогноз восстановления функций при рано начатом лечении обычно благоприятный, однако это восстановление может происходить достаточно длительно, до нескольких месяцев. Кроме того, прогноз зависит от основного заболевания, на фоне которого развилась невропатия, от того, сохраняются ли профессиональные перегрузки конечности. В 30-40% случаев туннельные невропатии рецидивируют [Герман А.Г.и соавт., 1989].
На втором месте по частоте находятся травматические невропатии. Среди причин травматических невропатий прогностически наиболее благоприятными являются резаные ранения, при которых своевременное оперативное вмешательство обеспечивает хороший исход. Тракционные и огнестрельные травмы имеют худший прогноз, поскольку при них нередко измененными оказываются центральный отрезок нерва и нейрон спинномозговых центров, что существенно затрудняет регенерацию нерва. Разрушение нервного ствола на большом протяжении может наблюдаться также при электротравме, при химическом повреждении (случайное введение в нерв различных лекарственных веществ). Весьма неблагоприятно сопутствующее повреждению нерва нарушение кровообращения в конечности (кровотечение либо длительное наложение кровоостанавливающего жгута, тромбоз магистральной артерии), которое может приводить к развитию в мышцах, сухожилиях, суставных сумках, коже и подкожной клетчатке атрофирующего склерозирующего процесса с образованием контрактур. Препятствовать восстановлению движений могут также вторичные изменения в суставах и сухожилиях, которые развиваются вследствие растяжения связок и суставных сумок при пассивном свешивании конечностей в случае вялого паралича или пареза.
При невро- и плексопатиях, развившихся на фоне соматических заболеваний, вследствие иммунных, неопластических, инфекционных, токсических поражений и воздействий прогноз зависит от характера течения основного заболевания либо процесса.
Читайте также:


