Регенерация периферических нервных проводников
При повреждении нервов дегенеративные процессы аксона происходят дистальнее места поражения. Это связано с тем, что аксон является отростком нейрона, и его питание и рост зависят от сомы. Регенеративные процессы периферической нервной системы характеризуются высокой интенсивностью и в большинстве случае обеспечивают полное восстановление структур. В ЦНС, напротив, интенсивность процессов восстановления не высока, и регенерация не является полной.
а) Валлерова (антероградная) дегенерация периферических нервов. Основные этапы процесса дегенерации и их описание представлены на рисунке ниже и в подписи к нему. После разрушения или перерезки нерва в течение первых 48 ч аксоны и миелиновая оболочка под действием протеаз, высвобождающихся из шванновских клеток под влиянием ионов Са 2+ , распадаются на фрагменты элипсоидной формы дистальнее места нарушения целостности нерва. Продукты распада удаляют моноциты, которые перемещаются из кровотока в эндоневрий и превращаются в макрофаги.
Помимо осуществления фагоцитоза, макрофаги стимулируют митотическую активность шванновских клеток. Макрофаги и шванновские клетки выполняют трофическую (питательную) и направляющую функции для регенерирующих аксонов.
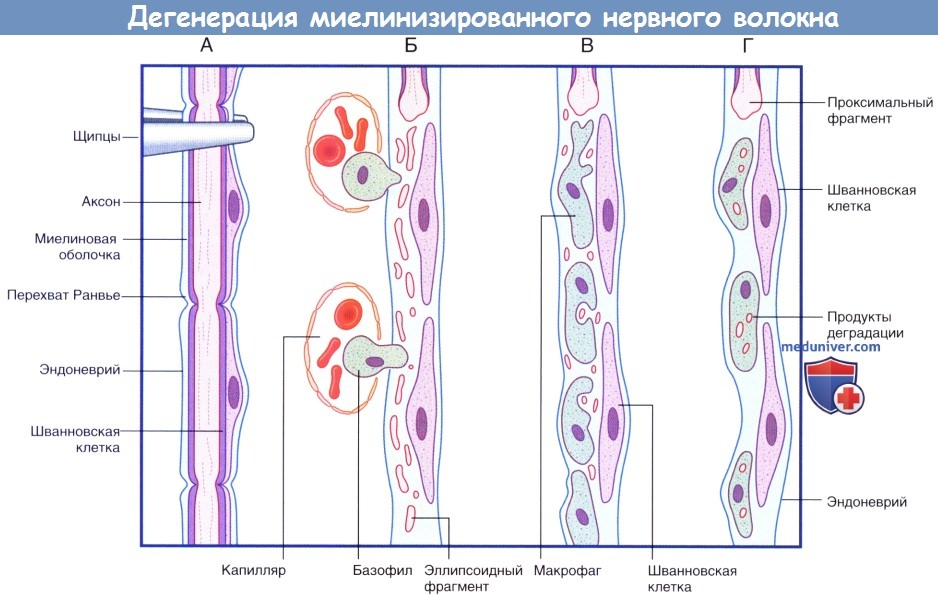
Последовательность процессов при дегенерации миелинизированного нервного волокна.
(А) Сохранное нервное волокно; продемонстрированы четыре сегмента. Выполняют пережатие нервного волокна в верхней части.
(Б) Миелиновая оболочка и аксон распадаются на мелкие частицы и фрагменты эллипсоидной формы. Моноциты проникают в эндоневрий из кровеносного русла.
(В) Мелкие продукты дегенерации поглощают моноциты.
(Г) Происходит практически полное удаление всех продуктов дегенерации. Шванновские клетки и эндоневрий сохранны. Последовательность процессов при регенерации миелинизированного нервного волокна. 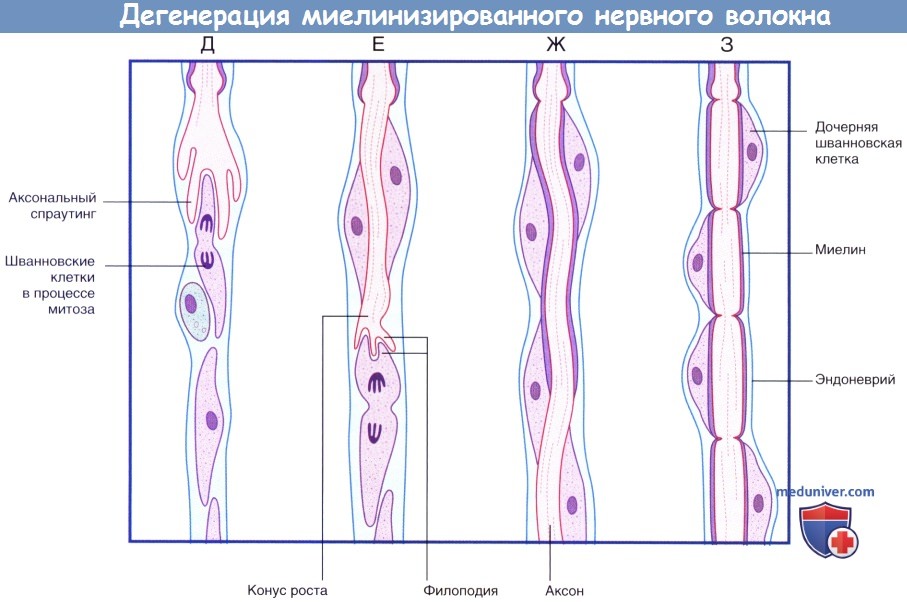
(продолжение) Последовательность процессов при дегенерации миелинизированного нервного волокна.
(Д) Аксональный спраутинг начинается с дистального участка аксона. Спраутинг оказывает митогенное дейсвтие на окружающие шванновские клетки.
(Е) Конус роста продвигается дистально вдоль поверхности шванновских клеток.
(Ж) Миелинизация начинается вдоль проксимального участка регенерирующего аксона.
(З) Общее строение вновь миелинизированного нервного волокна соответствует тем же принципам, однако миелинизированные сегменты характеризуются меньшей длиной.
б) Регенеративные процессы в периферической нервной системе. Основные этапы процесса регенерации представлены на рисунке ниже. После ровного среза нерва спраутинг (разрастание новых ветвей) на конце проксимального отрезка аксона начинается уже спустя несколько часов. Однако в клинической практике повреждения нерва часто происходят при раздавливании или разрыве. В этих случаях происходит отмирание участка нерва длиной 1 см и более, за счет чего спраутинг может продолжаться в течение недели. В случае удачной регенерации происходит тесное соприкосновение проксимального конца аксона со шванновской клеткой дистального конца пересеченного нейрона.
При нарушении формирования этой связи в месте первичного повреждения образуется псевдоневрома, представляющая собой извитые регенерирующие аксоны, погруженные в рубцовую ткань. Ампутационные псевдоневромы — источники сильных болей после ампутаций конечностей.
Регенерация нейронов при повреждении происходит двумя путями в течение нескольких часов после повреждения. На проксимальном конце пересеченного аксона появляются множественные отростки, на конце которых образуются утолщения — конусы роста. На дистальном конце шванновские клетки формируют отростки, направляющиеся навстречу конусам роста. На концах конусов роста формируются напоминающие антенны филоподии, где располагаются поверхностные рецепторы, временно связывающиеся с соответствующими поверхностными молекулами адгезии базальных мембран шванновских клеток. Актиновые филаменты филоподий прикрепляются к поверхностным рецепторам и относительно этих соединений осуществляют дальнейшее продвижение конусов роста.
Конусы роста стимулируют митотическую активность шванновских клеток. Шванновские клетки делятся и миелинизируют наиболее крупные аксоны.
При полном разрыве нервных стволов перед попыткой их восстановления, как правило, выжидают около трех недель, поскольку сразу после повреждения их соединительнотканные оболочки отечны, а в течение этого промежутка времени они становятся немного толще, что позволяет шовному материалу лучше закрепиться. Кроме того, обрезание нервов перед наложением швов приводит к развитию вторичной аксотомии проксимальной части пересеченного аксона. В ходе экспериментальных исследований на животных показано, что вторичная аксотомия стимулирует более интенсивную и длительную регенерацию.
Влияния тела нейрона на пересеченный участок нерва заключаются в следующем:
• Вследствие осмотических изменений перикариона ядро ориентируется эксцентрически.
• Клетки нейроглии заполняют все синаптические щели, изолируя исходный двигательный нейрон от синаптических контактов в сером веществе.
• В исследованиях, проведенных на обезьянах, показано, что после перерезки чувствительных нейронов 30-40 % окончаний дорсальных нервных корешков подвергается валлеровской дегенерации. Регенерация этих нейронов не происходит, поскольку их окончания располагаются в сером веществе головного мозга. Однако некоторые рецепторы восстанавливаются за счет спраутинга сохранных прилежащих нейронов. Данное наблюдение позволяет объяснить явление неполного восстановления чувствительности у таких пациентов.
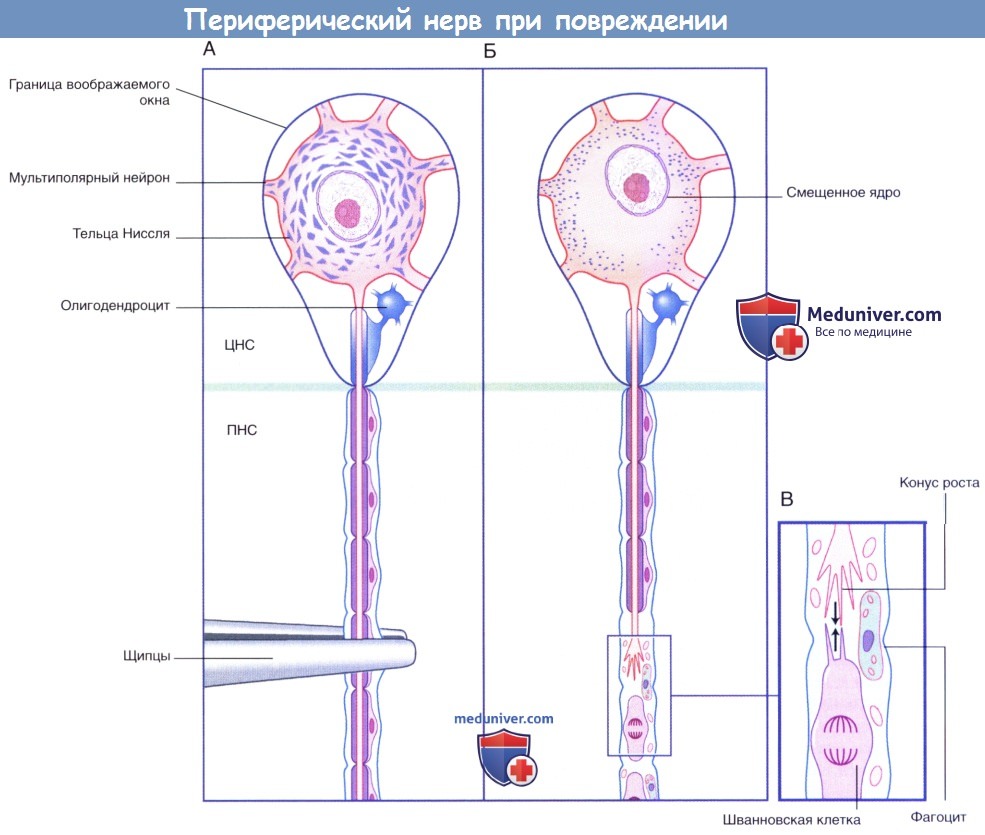
Схематическое изображение процессов, происходящих в периферическом нерве после повреждения.
(А) Двигательный нейрон ЦНС, видимый через воображаемое окно.
(Б) Хроматолизис проявляется фрагментированием и рассеиванием телец Ниссля, а также смещением ядра.
(В) В зоне повреждения в условиях удаления продуктов деградации происходит образование контакта филоподий конуса роста с проксимальными выростами шванновских клеток (указано стрелками).
ЦНС — центральная нервная система; ПНС — периферическая нервная система.
Редактор: Искандер Милевски. Дата публикации: 12.11.2018
Может наступить атрофия мышцы,распат и замещение соед тканью.
Спрутинг-явление.котор возникает в деиннервир мышцее,немиелинизированные терминали аксонов неповрежден нервов прорастают в направлении деиннервир мышце.
2. Патология периферических нервных проводников. Механизмы развития Уоллеровской дегенерации. Регенерация нервных проводников
Нервные проводники:основа-аксон нервной клетки,котор заканчив пресинаптич мем-ой.(аксоцилиндр).Снаружи покрыт слоем миелина-многократно закрученная вокруг цилиндра Швановская клетка(мембрана),поверх миелина-Швановские клетки.
Патология проводников:
2.Воспалит процесс- неврит (воспаление нервного ствола). Полиневрит и мононеврит по механизму:
-паренхиматозный( первично воспал сам асоцилиндр)
-интерстициальный( первич воспал соединит ткан оболочка)
ТРИАДА НЕВРИТА: наруш двигат функции,нарушение чувствит-ти, боли.
3.Нарушение аксонального транспорта (изменение кровоснабжении нерва,отрав ядами, токсины, алкоголь)
4.Утрата миелина( дефицит вит В-12,алкоголь интокс, наруш кровоснабжения)
При перерезе нервного волокна образдва конца нерва-дистальный(периф) и проксималь(централь)
В центральном отрезке-регенерация
В периферич отрезке-Уоллеровская дегенерация, скорость которой зав-т от степени миелинизации (миелин-быстрее)
В 1-ые сут:
Отек,дефрагментация аксоцилиндра->распад на отдельные цилиндры,миелин на капли. Шванновския кл пролиферируют и фагоцитируют оставшиеся цилиндры и миелин, формируют Бюнглеровскую цепочку, которые растут в сторону центр отрезка(ростовые факторы).В это время нарушается проведение нерв имп в волокне-через 50-60 ч –полностью прееращается
Периферич Шванновские клетки растут в сторону центрального отр,а центральн- в сторону периф отрезка, таким образом формируются Бюнглеровская цепочка(коридор, по кот течет аксоплазма)
Аксоны расут по направлению к эффектору под действием:
-хемотаксиса( градиет ростовых факторов)
-гаптотаксиса ( градиент белков адгезии)
Скорость регенерации 1-2 мм/сут. Рост прооисходит до тех пор пока нервное волокно не реиннервирует орган.
Если периф отрезок успевает погибнуть,то он замещ соед тканью. Но если растояние до эффектора небольшое,то центр отросток может дорасти до него, образовать новый синапс.(ПЛАСТИЧНОСТЬ)
В течении 4-12 мес регенерированный аксон увелич в диаметре,миелинизируется. Сначала восстанавлив трофика,а затем функциональные влияние.
Патофизиология синаптической передачи.
Патология пресинапса.1.Нарушение синтеза и упаковки медиатора в теле нейрона. 2. Наруш тока аксоплазмы-нарушение транспорта медиатора. 3.Наруш высвобождения медиатора в синаптич щель(ботулинич токс->нарушает высвобож АХ в синап щель из терминалей; миастения и миастенич синдром Ламберта Итона,при котором есть АТ к структурам Са каналов пресин мем-ны->сниж ток Са->сниж высвобож АХ; избыток магния и дефиц Са->блокир выход АХ; снижение натриево-калиевой АТФ-азы в обл пресинапса)
Патология синаптич щели. В синаптич щели работает антихолинэстераза,которая разрушает АХ на холин и уксусную кислоту. Компоненты медиатора синтезируются в АХ под действием холинацетилазы в обл пресинапса.
Патология: 1.Действие антихолинэстеразных ЛС,2.Наличие АТ против холинэстеразы 3.Нарушение реутилизации продуктов распада АХ 4. Угнетение холинацетилазы
Патология постсинаптич обл.
1.Блокада ХР( кураре-курареподобные ЛС)
2. Наруш синтеза молекул ХР( возникает миастения гравис, на 60 % снижен синтез молек ХР)
3. Десенситизация ( снижение чувствительности) рецепторов к АХ (при повторной частой стимуляции нерва)
4. Блокада постсинаптич рецептора аналогами АХ (сукцинил-холин, котор не разруш-ся антихолинэстеразой, но связыв-ся с рецептором)
5. АТ к рецепторам.
Дата добавления: 2018-08-06 ; просмотров: 370 ;
7.2.1. Механизмы восстановления функций при повреждении периферических нервов и сплетений
К основным факторам, определяющим при периферических невропатиях и плексопатиях скорость и степень спонтанного восстановления нарушенных функций (и, следовательно, объем и направленность лечебных вмешательств), относятся следующие:
- степень повреждения нервного проводника;
- уровень поражения;
- характер повреждающего агента.
Реабилитологи чаще всего определяют степень повреждения нерва по 3 категориям согласно классификации H.Seddon [1943]. Иногда используют также классификацию S.Sunderland [1990], выделяющего 5 степеней повреждения нервов; эта классификация основана на классификации H.Seddon, детализируя ее. Согласно классификации H.Seddon, все локальные повреждения нервных стволов делят, в зависимости от сохранности аксона и соединительнотканных структур, на три группы: (1) нейрапраксия; (2) аксонотмезис; (3) нейротмезис. (1) Нейрапраксия (neurapraxia, англ.) - это повреждение нерва, не приводящее к гибели аксона. Часто наблюдается при компрессии нерва (например, "ночной субботний паралич" вследствие компрессии лучевого нерва), при легкой травме нерва. Клинически характеризуется снижением вибрационной, проприоцептивной, иногда тактильной чувствительности. Болевая чувствительность страдает реже. Часто наблюдаются двигательные нарушения и парестезии. Блок проведения нервного импульса, наблюдающийся вследствие локального повреждения миелиновой оболочки, носит преходящий характер и регрессирует по мере восстановления миелина. Восстановление двигательных и чувствительных функций может продолжаться до 6 месяцев.
(2)Аксонотмезис (axonotmesis, англ.) - повреждение нерва, приводящее к гибели аксона при сохранности эпиневрия, периневрия, эндоневрия и шванновских клеток. Нередко наблюдается при закрытых переломах либо вывихах костей конечностей, а также при сдавлениях нервных стволов. Нарушаются двигательные, чувствительные и судомоторные функции нерва. Восстановление функций происходит за счет регенерации аксона. Скорость и степень восстановления зависит от уровня поражения, возраста (у молодых регенерация происходит быстрее) и общего состояния больного. В случаях, когда прорастание аксона происходит медленно, может произойти рубцевание эндоневральной трубки, в которую прорастает аксон, и восстановление не наступает. По этой же причине неблагоприятный прогноз имеется в случаях, когда дефект нервного ствола имеет значительную длину. При благоприятных условиях происходит постепенная невротизация дистального отдела поврежденного нерва, которая продолжается в течение многих месяцев, иногда год и более. Наблюдается восстановление утраченных функций, но не всегда полное.
О) Нейротмезис (neurotmesis, англ.) - разрыв нерва с пересечением аксона и соединительнотканных оболочек нерва. Из-за того, что повреждаются эндоневральные трубки, невозможным становится прорастание в них аксонов, регенерация аксонов приводит к образованию травматической невромы. Прогноз восстановления неблагоприятный. Данная классификация основана на микроскопических изменениях в нервном стволе. Макроскопически различить степень повреждения практически невозможно. Диагностика основана на динамическом клиническом и электрофизиологическом наблюдении. В связи с этим при закрытых травмах нервных стволов отечественные авторы нередко применяют иную классификацию, основанную на выделении следующих 4 форм поражения нервного ствола [Макаров А.Ю., Амелина О.А., 1998]: сотрясение, ушиб, сдавление, тракция. Сотрясение не сопровождается морфологическими изменениями в нерве, нарушения функции нерва кратковременны (не более 1-2 недель) и полностью обратимы. Ушиб нерва характеризуется возникновением мелких кровоизлияний, участков размозжения нервных волокон и пучков, что приводит к полному либо частичному нарушению проводимости, длительным и стойким выпадением функций. При сдавлении нерва степень нарушения проводимости зависит в первую очередь от длительности сдаачения: при своевременном удалении сдвливающих нерв субстратов (гематома, инородное тело, отломок кости и т. д.) может наблюдаться быстрое и полное восстановление проводимости, тогда как при длительном сдавлении в нервном стволе развиваются дегенеративные изменения. Отсутствие восстановления функции в течение 2-3 месяцев является критерием полного анатомического перерыва нерва. Тракция (например, тракдия ветвей плечевого сплетения при вправлении вывиха плеча) обычно сопровождается частичным нарушением функции, однако восстановление проводимости по нерву происходит достаточно длительно (в течение нескольких месяцев).
Чем проксимальнее поражение нервного ствола или сплетения (т.е. чем больше расстояние от места повреждения до периферических окончаний), тем хуже прогноз восстановления функции, поскольку тем больший срок требуется для прорастания нервного волокна и тем больше вероятность развития в эндоневральной трубке периферического отрезка нерва необратимых Рубцовых изменений [Lefferet R., 1985]. Так, например, по данным С.И.Карчикяна [1962], при ранениях седалищного нерва в верхней трети бедра первые движения стопы и пальцев появляются лишь спустя 15-20 месяцев и позже после наложения нервного шва, а при ранениях этого же нерва в нижней трети бедра - через 10-15 месяцев после оперативного вмешательства.
Наихудший прогноз отмечается при повреждениях на корешковом уровне, поскольку корешки спинальных нервов не регенерируют и не могут быть восстановлены хирургическим путем. Поражение корешков (обычно - отрыв корешка на шейном уровне), в отличие от поражения сплетения, характеризуется следующими признаками:
- интенсивная жгучая боль, иррадиирущая вдоль соответствующего дерматома;
- парализация паравертебральных мышц, иннервируемых задними ветвями спинальных нервов;
- паралич мышц лопатки вследствие нарушения функции коротких нервов плечевого пояса (крыловидная лопатка);
- синдром Горнера (при поражении С8-ты корешков);
- трофические нарушения и быстро прогрессирующая мышечная атрофия с грубыми вторичными контрактурами.
Периферические невропатии и плексопатии могут иметь самую различную этиологию (таблица 7.2). В мирное время наиболее частой формой поражений периферических нервов являются туннельные невропатии, составляя около 30-40% от всех заболеваний периферической нервной системы. Туннельная невропатия - это локальное поражение нервного ствола, обусловленное его компрессией и ишемией в анатомических каналах (туннелях) или вследствие внешнего механического воздействия [Лейкин И.Б.,1998]. Предрасполагающие к развитию туннельных невропатий факторы включают генетически обусловленную узость естественных вместилищ нерва, приобретенную узость этих вместилищ вследствие отеков и гиперплазии соединительной ткани при различных заболеваниях (например, сахарном диабете, гипотиреозе, коллагенозах), длительное перенапряжение мышечно-связочного аппарата у лиц определенных профессий, последствия трав, мышечно-тонические и нейро-дистрофические нарушения при рефлекторных синдромах остеохондроза позвоночника, ятрогенные травмирующие воздействия (неправильное наложение гипсовой повязки, кровоостанавливающего жгута). Нарушение функции нерва происходит вследствие как демиелинизации, так и поражения аксона (ухудшение нейротрофического контроля в связи с недостаточностью аксонального транспорта).
Туннельные поражения нервов проявляются в первую очередь болью, чувствительными и вегетативными расстройствами. Двигательные нарушения развиваются лишь у одной трети больных и заключаются, как правило, в снижении мышечной силы, гипотрофии мышц, развитии контрактур. Прогноз восстановления функций при рано начатом лечении обычно благоприятный, однако это восстановление может происходить достаточно длительно, до нескольких месяцев. Кроме того, прогноз зависит от основного заболевания, на фоне которого развилась невропатия, от того, сохраняются ли профессиональные перегрузки конечности. В 30-40% случаев туннельные невропатии рецидивируют [Герман А.Г.и соавт., 1989].
На втором месте по частоте находятся травматические невропатии. Среди причин травматических невропатий прогностически наиболее благоприятными являются резаные ранения, при которых своевременное оперативное вмешательство обеспечивает хороший исход. Тракционные и огнестрельные травмы имеют худший прогноз, поскольку при них нередко измененными оказываются центральный отрезок нерва и нейрон спинномозговых центров, что существенно затрудняет регенерацию нерва. Разрушение нервного ствола на большом протяжении может наблюдаться также при электротравме, при химическом повреждении (случайное введение в нерв различных лекарственных веществ). Весьма неблагоприятно сопутствующее повреждению нерва нарушение кровообращения в конечности (кровотечение либо длительное наложение кровоостанавливающего жгута, тромбоз магистральной артерии), которое может приводить к развитию в мышцах, сухожилиях, суставных сумках, коже и подкожной клетчатке атрофирующего склерозирующего процесса с образованием контрактур. Препятствовать восстановлению движений могут также вторичные изменения в суставах и сухожилиях, которые развиваются вследствие растяжения связок и суставных сумок при пассивном свешивании конечностей в случае вялого паралича или пареза.
При невро- и плексопатиях, развившихся на фоне соматических заболеваний, вследствие иммунных, неопластических, инфекционных, токсических поражений и воздействий прогноз зависит от характера течения основного заболевания либо процесса.
- Раздел:Термины на Р
- | E-mail |
- | Печать
Регенерация периферического нерва. Наибольшую часть объема нерва занимают соединительнотканные элементы, которые слабо реагируют на травму, затрудняют процесс регенерации вообще и противодействуют организованной продольной регенерации. Кровоснабжение нервов осуществляется посегментно из источников, заключенных в соседних тканях или сосудах. Поверхностные сосуды, идущие в продольном направлении, отдают множественные перфорирующие ветви, образуя сосудистую сеть, обеспечивающую орошение внутренних отделов нерва.
Наружная поверхность нерва состоит из фиброареолярной ткани, называемой адвентицией нерва. Этот слой рыхло прилегает к эпиневрию и не может оставить надежную основу для восстановления структуры нерва.
Упругая ткань, окружающая каждый нервный пучок и составляющая эпиневрий — обязательный элемент нерва, является основой для осуществления восстановительных операций.
Периневрий представляет собой листок, образованный 3-10 слоями клеток эпителиоидного типа и имеющий с внутренней и наружной стороны неэластическую базальную мембрану. Недавние исследования показывают, что этот листок может являться продолжением мягкой оболочки спинного мозга и выполнять защитные функции. Периневрий представляет собой структурный компонент нерва, наиболее устойчивый к растяжению. Однако клинически показано, что эта трубчатая оболочка является хрупкой и легко разрывается при сшивании. Кнутри от указанных листков расположены нервные пучки, каждый из которых может содержать до 10000 аксонов. Эндоневрий является опорной тканью для каждого аксона. Знание строения аксонов, хотя и не имеет важного значения при сегодняшнем уровне развития оперативной техники сшивания нервных стволов, является необходимыми для понимания сущности функционирования периферических нервов, а также процессов их перерождения и регенерации. Каждый аксон окружен шванновскими клетками, которые в зависимости от типа нерва могут образовывать миелиновую оболочку. Наличие последней позволяет осуществлять скачкообразное высокоскоростное проведение импульсов.
После пересечения нерва одновременно развиваются как процессы его перерождения, так и регенерации. Проксимальная культя формирует аксональные выросты уже через 24-48 часов после повреждения, что представляет собой начало регенерации. Между тем изменения в шванновских клетках, являющиеся началом процесса валлеровского перерождения, происходят как в центральной культе, так и в дистальном отрезке нерва; моноциты и сосудистые нерициты проникают сквозь базальную мембрану эндоневральной оболочки для образования новых шванновских клеток и создают условия для появления новых аксональных выростов. Образованные вновь шванновские клетки формируют каналы для прохождения регенерирующих аксональных выростов и очищают эндоневральные трубки от остатков миелина посредством фагоцитоза.
Из одного аксона может образоваться до 4-5 конусов роста и до 10 аксональных выростов. Однако, когда образуется периферический контакт концевой пластинки, сформированным оказывается только один вырост. В каждом аксоне имеются узкие длинные структурные образования, называемые микротрубочками и микрофиламентами. Они необходимы для осуществления аксоплазматического транспорта и связаны с клеточным ядром нейрона. Возбудимость аксона, по-видимому, поддерживается в результате перетекания аксоплазмы и при повреждении внутриклеточных ультраструктурных образований возбудимость утрачивается. Так как аксональные выросты продвигаются в дистальном направлении, они первыми могут пересекать зону между разорванными концами нерва. Эта зона вначале заполняется сгустками фибрина, а затем замещается рыхлым матриксом фибробластов. Со временем этот матрикс уплотняется, что затрудняет прохождение на этом участке аксональных выростов.
Некоторые аксоны не распространяются в дистальном направлении, а беспорядочно отклоняются в пределах щели между концами рассеченного нерва с формированием колбовидной невромы.
Аполипопротеин E (ApoE), синтезируемый шванновскими клетками и макрофагами, также накапливается в дистальном участке поврежденных периферических нервов и связывается с базальной мембраной шванновских клеток (см. рис. 2 ). АроЕ поддерживает жизнеспособность нейронов за счет защиты клеток от окислительного повреждения, а также стимуляции роста и адгезии клеток.

Рис.1. Спраутинг аксонов в ЦНС млекопитающих. (А) Типичная гранулярная клетка зубчатой фасции на ее дендритах во внешнем молекулярном слое (OML) получает множественные сина птические входы от ипсилатеральной энторинальной коры головного мозга и единичные входы от контралатеральной коры и медиальной перегородки. Дендриты внутреннего молекулярного слоя (IML) получают входы от медиальной перегородки и коммиссуральных/ассоциативных волокон. GCL= гранулярный клеточный слой. (В) Удаление ипсилатеральной энторинальной коры приводит к интенсивному росту аксонов нервных клеток энторинальной коры с контралатеральной стороны и замещению ипсилатерального энторинального входа в OML. Наблюдается также спраутинг аксонов, приходящих в DML от медиальной перегородки. Коммиссуральные/ассоциативные волокна в IML расширяют зону иннервации. (С, D) Примеры терминальных разветвлений аксонов от контралатеральной энторинальной коры в OML зубчатой фасции. (С) Норма. (D) Два месяца спустя после повреждения ипсилатеральной энторинальной коры.
Тем не менее, у нокаутных мышей, лишенных АроЕ, регенерация и ремиелинизация периферических аксонов существенно не меняется. Однако мыши с отсутствием АроЕ имеют сниженное число немиелинизированных аксонов и, соответственно, сниженную чувствительность к повреждающим тепловым стимулам.
При повреждении периферического нерва в зоне повреждения активируются факторы, стимулирующие пролиферацию шванновских клеток. Они включают два цитокина: фактор, ингибирующий лейкемию (ФИЛ), и Reg-2, являющийся потенциальным митогеном шванновских клеток (см. рис. 2). Reg-2 специфически экспрессируется в развивающихся и регенерирующих двигательных и чувствительных нейронах, и эта экспрессия усиливается ФИЛ. Антитела к Reg-2 замедляют регенерацию после передавливания седалищного нерва.
Для полного восстановления функции после повреждения нервной системы регенерирующие аксоны должны восстановить связи со своими прежними мишенями. Классические эксперименты Лэнгли, подтвержденные позже исследованиями одиночных клеток, показали, что регенерирующие преганглионарные аксоны нейронов автономной нервной системы реиннервируют соответствующие постганглионарные нейроны. В этом механизме имеет значение, по-видимому, сигнал о позиции нейрона, который оказывает влияние на формирование синапса между нейроном и клеткой-мишенью.

Этот механизм справедлив как для симпатической, так и двигательной системы. Так, если межреберная мышца, извлеченная из передней части грудной клетки, трансплантируется в область шеи, то она преимущественно реиннервируется аксонами шейного симпатического ствола, расположенными в самых передних участках спинного мозга (рис. 3). Наоборот, мышцы, трансплантированные из задних областей тела, имеют тенденцию к реиннервации аксонами более дорзальньгх нейронов. Подобная тенденция установлена и для трансплантации симпатических ганглиев различного исходного расположения. У молодых крыс зависимость от позиции нейрона показана в реиннервации мышц, имеющих множественную иннервацию несколькими сегментами.
Нервно-мышечные синапсы у новорожденных крыс, головастиков и взрослых тритонов после поперечного пересечения двигательного нерва с высокой точностью воссоединяются с исходной синаптической зоной . Одним из механизмов избирательного восстановления синапсов является конкуренция между аксонами. В мышцах саламандры, иннервированных чужим аксоном, чужеродный синапс элиминируется после того, как нормальный нерв восстановил свой синаптический контакт. У взрослых млекопитающих чувствительные, двигательные и постганглионарные аксоны показывают более низкую избирательность по отношению к их исходным мишеням. Чужие нервы при иннервации мышечных волокон могут быть столь же эффективными, как и оригинальные нервные волокна. Более того, чужой нерв может даже вытеснить исходный аксон в интактных мышцах взрослой крысы). Избирательная регенерация у взрослых млекопитающих возможна, если периферический нерв был не перерезан, а передавлен так, чтобы сохранились эндоневрий и базальная мембрана шванновских клеток, окружавших интактные аксоны (см. рис. 4)). При таких условиях регенерирующие аксоны направляются вновь к своим исходным мишеням. Если эндоневрий был разрушен, например при перерезке нерва, регенерация происходит беспорядочно и аксоны часто создают синапсы с неподходящими мишенями.
  |
| Рис. 3. Селективная реиннервация мышц, основанная на сегментарном происхождении. (А) Межреберная мышца из грудного сегмента ТЗ, Т4 или Т5 была трансплантирована на шею взрослой крысы и после удаления верхнего шейного ганглия была реиннервирована преганглионарными аксонами шейного симпатического ствола. Сегментарное происхождение входов было определено регистрацией активности мышц при стимуляции отдельных вентральных корешков, которые соединяют преганглиальные аксоны с нервным стволом. (В) Распределение входов к трансплантированным ТЗ, Т4 и Т5 мышцам. Передние мышцы склонны к реиннервации передними преганглиальными аксонами. |
Первые наблюдения о последствиях формирования синапсов чужим нервом относятся к 1904 году, когда Лэнгли и Андерсон провели выдающееся исследование, показавшее, что мышцы кошки могут иннервироваться преганглионарными холинергическими симпатическими волокнами, которые в норме создают синапсы в автономном ганглии . Было также показано формирование подобных синапсов между автономными нервами лягушки и скелетными мышцами крысы (рис. 4.). Многие свойства нерва и мышцы в таких экспериментах оставались без изменений, несмотря на необычную иннервацию.
Структурой, играющей ключевую роль в регенерации нервно-мышечных синапсов, является синаптическая базальная мембрана, которая находится между нервным окончанием и мышечной мембраной. Синаптическая базальная мембрана представляет собой интенсивно окрашиваемое внеклеточное вещество, состоящее из протеогликанов и гликопротеинов. Как показано на рис. 3А, базальная мембрана окружает мышцу, нервное окончание и шванновскую клетку и погружается в складки постсинаптической мембраны.
МакМахан и его коллеги провели серию элегантных исследований роли синаптической базальной мембраны в дифференцировке нерва и мышцы. Успех их работы базировался на использовании очень удобной экспериментальной модели тонкой кожно-грудной мышцы лягушки, в которой положение концевых пластинок легко различимо в живой мышце. На первом этапе клетки в определенном участке мышцы локально разрушали либо перерезкой нерва и мышечных волокон, либо повторным приложением металлической пластины, охлажденной жидким азотом (рис. 3В). В течение нескольких дней часть мышечных волокон в участке повреждения дегенерировала вместе с нервными окончаниями и была фагоцитирована, но базальная мембрана оставалась при этом интактной (рис. 3C). Место исходного нервно-мышечного соединения могло быть легко распознано по характерной морфологии базальной мембраны мышцы и шванновских клеток, остающихся в зоне синапса, а также по наличию холинэстеразы, сохраняющейся на синаптической базальной мембране и в синаптических складках.
Через две недели после повреждения в зоне синаптической базальной мембраны формировались новые мышечные волокна, контактирующие с регенерирующими аксональными окончаниями. Стимуляция нервов вызывала сокращения вновь образованных мышечных волокон. Почти все регенерированные синапсы локализовались точно на исходных синаптических зонах, что выявлялось после окраски мышцы на присутствие холинэстеразы. Таким образом, был сделан вывод о наличии сигналов, ассоциированных с синаптической базальной мембраной, которые определяют успех регенерации синапсов.
Для дальнейшего исследования природы сигналов, ассоциированных с синаптической базальной мембраной, мышцы повреждали, нерв раздавливали, а регенерацию мышечного волокна предотвращали рентгеновским облучением. Регенерирующие аксоны росли к исходным синаптическим зонам, что выявлялось окраской на холинэстеразу, и формировали активные зоны для освобождения медиатора точно напротив участков базальной мембраны, связанных со вторичными синаптическими складками, — и все это происходило в отсутствие клеточных элементов постсинаптической мишени (рис.3D).
В параллельной серии экспериментов МакМахан и его коллеги продемонстрировали, что синаптическая базальная мембрана в регенерирующих мышечных волокнах содержит факторы, запускающие дифференцировку постсинаптической мембраны. Мышцы повреждались, как было описано ранее, а реиннервация предотвращалась удалением большого сегмента нерва. При регенерации новые мышечные волокна образовывали вторичные складки и кластеры АХ рецепторов и ацетилхолинэстеразы точно в зоне контакта с исходной синаптической базальной мембраной (рис. 4). Таким образом, сигналы, ассоцированные с синаптической базальной мембраной, при регенерации могут инициировать формирование синаптических специализаций как в мышечных волокнах, так и в нервных окончаниях.
Для идентификации сигнала, связанного с базальной мембраной и инициирующего постсннаптическую дифференцировку, МакМахан и его коллеги использовали морского ската Torpedo califomica. Из электрических органов этого животного, родственных скелетной мышце, они приготовили экстракты, содержащие базальные мембраны. Добавленные к культуре мышечных волокон, экстракты симулировали эффекты синаптической базальной мембраны на регенерацию мышечных волокон, а именно индуцировали формирование кластеров АХ рецепторов вместе с другими компонентами постсинаптической мембраны (рис. 5).
Активный компонент экстрактов, названный агрином, был очищен и охарактеризован, а у цыпленка, крысы и ската клонирована соответствующая кДНК.

Результаты гибридизации in situ и иммуногистохимических исследований продемонстрировали, что агрин синтезируется мотонейронами, транспортируется по аксонам и, освобождаясь, индуцирует дифференцировку постсинаптического аппарата в развивающихся нервно-мышечных синапсах. Затем агрин становится частью синаптической базальной мембраны, где участвует в сохранении постсинаптического аппарата и запускает дифференцировку во время регенерации.

Исходная холинэстераза деградировала после заморозки мышцы. Таким образом, выявляемый продукт реакции обусловлен холинэстеразой, синтезированной и аккумулированной в исходной синаптической зоне регенерирующим мышечным волокном.
Специфичный для мышцы рецептор тирозинкиназы, называемый MuSK, образует часть агринового рецептора. Активация MuSK инициирует внутриклеточное фосфорилирование, что служит пусковым сигналом для агрегации АХ рецепторов.
1. Sanes, J. R., and Lichtman, J.W. 1999. Development of the vertebrate neuromuscular junction. Annu. Rev. Neurosci. 22: 389-442.
2. Song, H-J., and Poo, M-M. 1999. Signal transduc-tion underlying growth cone guidance by diffusible factors. Curr. Opin. Neurobiol. 9: 355-363.
3. Walsh, F. S., and Doherty, P. 1997. Neural cell adhesion molecules of the immunoglobulin super-family: Role in axon growth and guidance. Annu Rev. Cell Dev. ВЫ . 13: 425-456.
Читайте также:


