Роль холинэстеразы в нервно мышечной передаче
Существует ряд фармакологических агентов, обладающих способностью резко угнетать активность холинэстеразы. Их называют ингибиторами. К числу таких веществ
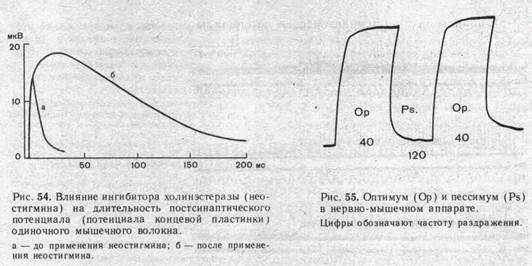
относятся эзерин, простигмин. галантамин. Если на нервно-мышечное соединение действует какое-либо из этих веществ, постсинаптический потенциал увеличивается по своей амплитуде и резко растягивается по времени.
Иллюстрацией этого является приведенная на рис. 54 запись ПКП, зарегистрированного в нервно-мышечном соединении лягушки до (а) и после (б) воздействия на мышцу вещества, угнетающего активность холинэстеразы.
Следует отметить, что и в отсутствие ингибиторов холинэстеразы при условии очень частого раздражения нерва постсинаптические потенциалы (ПКП), вызываемые каждым нервным импульсом, суммируются, поскольку в межимпульсный интервал холинэстераза не успевает полностью расщепить выделяющийся в нервном окончании ацетилхолин. В результате суммации потенциалов постсинаптическая мембрана все более и более деполяризуется.
Деполяризация постсинаптической мембраны при очень частом следовании друг за другом нервных импульсов лежит в основе открытого Н. Е. Введенским пессимального торможения. Это явление часто называют торможением Введенского. Сущность его состоит в следующем. Величина тетанического сокращения скелетной мышцы в ответ на ритмические раздражения нерва возрастает с увеличением частоты стимуляции. При некоторой оптимальной частоте раздражения тетанус достигает наибольшей величины. Если продолжать увеличивать частоту стимуляции нерва, то тетаническое сокращение мышцы начинает резко ослабевать и при некоторой большой пессимальной частоте раздражения нерва мышца, несмотря на продолжающееся раздражение, почти полностью расслабляется. Уменьшение частоты стимуляции тотчас приводит к восстановлению высокого уровня тетанического сокращения (рис. 55).
В нервно-мышечном препарате лягушки торможение Введенского возникает при частоте раздражения, близкой к 100 стимулам в секунду, т. е. при значительно меньших
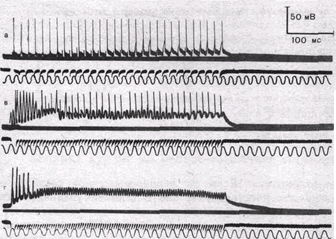
| Рис.56. Суммация постсинапти-ческих потенциалов и стойкая деполяризация постсинаптиче-ской мембраны мышечного волокна при пессимальном раздражении. Внутриклеточные отведения от си-наптической области. Частота раздражения: а — 65 в секунду; б — 125 в секунду; в— 150 в секунду; г — 180 в секунду. Обозначения кривых сверху вниз: потенциалы мышечного волокна, исходный уровень потенциала покоя; потенциалы действия нерва (по Н. М. Шамариной). |
частотах, чем те, которые может воспроизводить нерв (порядка 500) или мышца (порядка 200).
На рис. 56 приведена запись изменения мембранного потенциала мышечного волокна в области концевой пластинки при раздражении нерва ритмическими импульсами оптимальной и пессимальной частот. При редком (оптимальном) ритме каждый импульс попадает в фазу убывания постсинаптического потенциала, вызванного предыдущим импульсом, и в мышечном волокне возникают полноценные потенциалы действия. При частом раздражении постсинаптические потенциалы суммируются, что приводит к стойкой деполяризации постсинаптической мембраны и развитию блока проведения. На важную роль ацетилхолина в развитии пессимума Введенского указывает тот факт, что яды, инактивирующие холинэстеразу и тем самым способствующие накоплению в области синапса ацетилхолина, способствуют возникновению пессимума.
Следует подчеркнуть, что рассмотренный механизм блокирования нервно-мышечного соединения при частом ритме раздражения нерва не является единственным. В тех случаях, когда частота стимулов очень высока, проведение возбуждения с нерва на мышцу может быть блокировано еще на пути к синапсу, в тонких пресинаптических разветвлениях нервных волокон — пресинаптических терминалях, обладающих более низкой лабильностью, чем толстые нервные волокна. Нарушение проведения в этих тонких нервных волокнах ведет к прекращению поступления нервных импульсов к нервному окончанию и тем самым к прекращению выделения ацетилхолина. В данном случае вместо стойкой деполяризации постсинаптической мембраны обнаруживается значительное ослабление или даже полное выпадение постсинаптических потенциалов при неизменном уровне потенциала покоя мышечного волокна.
Дата добавления: 2016-03-27 ; просмотров: 4713 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Медиатор нервного возбуждения ацетилхолин синтезируется в нервных клетках из холина и уксусной кислоты при участии фермента холинэстеразы и ацетилкоэнзима А. По последним данным, фермент в нервных клетках содержится не в клеточных органеллах (митохондриях), а локализуется в цитоплазме преимущественно в растворенном виде. ХЭ обладает высоким сродством к мембранам, которое может играть важную роль в синтезе АХ. Медиатор накапливается в окончаниях нервных волокон, где располагается в синаптических пузырьках — везикулах. Каждый пузырек содержит около 10 000 молекул передатчика.
С помощью электронной микроскопии удалось изучить основные структуры синаптических образований в ЦНС и нервно-мышечных синапсах. Установлено, что нервное окончание отделено от синаптической щели пресинаптической мембраной. Ширина синаптической щели — 20—50 нм. За нею расположена постсинаптическая мембрана. В синаптических образованиях гистохимически обнаружены ферменты ХЭ, гидролизующей АХ. Холинэстераза может быть расположена как на пресинаптической, так и на постсинаптической мембране. Это внеклеточная холинэстераза, играющая основную функциональную роль.
В естественных условиях биологические мембраны поляризованы. Величина мембранного потенциала — 50—90 мВ. Когда нервный импульс, распространяясь вдоль аксона, достигает синаптического окончания и деполяризует его, в синапсе происходит быстрое и обратимое увеличение концентрации ионов кальция. Это приводит к перемещению и слиянию части пузырьков с пресинаптической мембраной и в конечном итоге к процессу экзоцитоза — выбросу медиатора в синаптическую щель.
На один нервный импульс в нервном окончании из пузырьков через синаптическую мембрану высвобождается синхронно примерно 150 квантов ацетилхолина. Молекулы медиатора быстро достигают постсинаптической мембраны и взаимодействуют с холинорецептором (ХР), представляющим собой мембранный комплекс белковой природы, прочно встроенный в липопротеидную структуру мембраны.
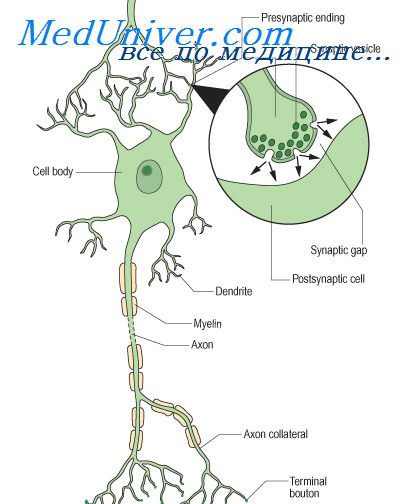
В состав активного центра холинорецептора входит отрицательно заряженный анионный центр, который реагирует с катионной "головкой" ацетилхолина. Второй участок активного центра — эстерофильный — взаимодействует с карбонильной группой и кислородом эфирной связи молекулы АХ. Конформационные изменения в специфических белках, возникающие под воздействием ничтожных количеств медиатора, могут приводить к "открытию" или "закрытию" каналов к определенным ионам (натрия, калия, кальция, хлора), в результате чего возникает деполяризация этой мембраны, которая регистрируется как потенциал концевой пластинки (ПКП).
Все эти процессы осуществляются в очень короткое время. Для изменения конформации холинорецепторов требуются доли миллисекунды, а для транспорта ионов через мембрану — нескольких миллисекунд. Столь быстрое прекращение этих процессов связано со скоростью ферментативного гидролиза АХ. Возможно, что в прекращении действия АХ некоторая роль принадлежит его диффузии из си-наптической щели и процессам десенситизации — снижению чувствительности рецептора к субстрату. Возникшее в результате нервного импульса изменение проницаемости мембраны и перераспределение ионов восстанавливается с помощью натрий-калиевого насоса, суть которого состоит в активном транспорте ионов против их электрохимических градиентов, что возможно благодаря использованию энергии макроэргических соединений.
Кванты ацетилхолина из отдельных пузырьков могут выделяться спонтанно, без нервного импульса. В ответ на действие одного кванта медиатора появляется слабая (0,2—2 мВ), кратковременная (3—4 мс) деполяризация в виде миниатюрного потенциала концевой пластинки (МПКП). Частота МПКП регулируется пресинаптически и составляет один потенциал в секунду.
При действии антихолинэстеразных веществ может нарушаться каждое из перечисленных выше звеньев цепи синаптической передачи возбуждения. Так, частота выделения квантов существенно возрастает при деполяризации нервных окончаний, что приводит к учащению МПКП. Амплитуда МПКП увеличивается под влиянием антихолинэстеразных веществ, задерживающих разрушение АХ вследствие торможения синаптической ХЭ. Использование микроэлектродной техники позволяет регистрировать увеличение амплитуды и длительности МПКП, а также ПКП при воздействии токсических доз ряда ФОП (ДДВФ, афуган, хостаквик) и некоторых карбаматов — карбофуран, пиримор, диоксикарб.
Установление роли ацетилхолина в процессах передачи нервного возбуждения привлекло внимание исследователей к изучению строения и функции ферментов, названных холинэстеразами, обеспечивающих быстрый гидролиз АХ.
В организме человека присутствуют два фермента, относимых к холинэстеразам – группе ферментов из класса гидролаз карбоновых кислот, субстратами которых являются сложные эфиры холина. Фермент ацетилхолин-ацетилгидролаза (К.Ф. 3.1.1.7), тривиальные названия – ацетилхолинэстераза (АХЭ), ацетилхолингидролаза, называемый также “истинная холинэстераза”, или “холинэстераза I”. Обнаружена в эритроцитах, легких, селезенке, нервных окончаниях, сером веществе головного мозга. АХЭ участвует в передаче нервного импульса в синапсе, участвуя в процессе деполяризации нерва.
В сыворотке крови присутствует и другой фермент – ацетилхолин-ацилгидролаза (К.Ф. 3.1.1.8), тривиальное название – холинэстераза (ХЭ), называемый также “псевдохолинэстераза”, “бутирилхолинэстераза”, “холинэстераза II”. В наибольшем количестве ХЭ обнаружена в печени, поджелудочной железе, сердце, белом веществе головного мозга. Определение активности именно этого фермента имеет значение в лабораторной диагностике. Фермент обладает значительной гетерогенностью, известно более 20 аллелей, обеспечивающих разные варианты ХЭ, отличающиеся по активности фермента и чувствительности к ингибиторам.
Определение активности ХЭ нашло применение в хирургии для выявления пациентов с риском пролонгированного ответа на некоторые миорелаксанты. При проведении хирургических операций с применением миорелаксантов, гидролизуемых холинэстеразой, у лиц с генетически сниженной или полностью отсутствующей активностью ХЭ повышается риск развития осложнений, связанных с замедленным разрушением миорелаксанта (длительное апноэ, холинергический шок). Подобные осложнения могут возникнуть и у пациентов с заболеваниями печени, нарушающими синтезХЭ, в отсутствии врожденных генетических дефектов фермента.
Активность фермента ингибируют фосфорорганические соединения и карбаматы, относящиеся к инсектицидам и отравляющим веществам. При подобном отравлении снижение активности ХЭ на 40% вызывает появление первых симптомов, при снижении на 80% возникают нервно-мышечные нарушения. Сильная степень отравления, приводящая к падению активности ХЭ более чем на 80%, представляет угрозу для жизни. Пациенты с генетически обусловленной низкой активностью ХЭ обладают повышенной чувствительностью к таким отравлениям.
В отсутствии генетических причин низкой активности ХЭ, в случаях, исключающих воздействие ингибиторов фермента, любое снижение активности ХЭ в сыворотке крови указывает на нарушение синтеза фермента в печени. Определение активности ХЭ в сыворотке крови, наряду с уровнем альбумина, фибриногена, протромбина является маркером белоксинтезирующей функции печени. Снижение активности на 30–50% наблюдается при остром и хроническом гепатите, понижение активности на 50–70% происходит при прогрессирующем циррозе и карциноме с метастазами в печени.
Показания к исследованию
- Заболевания печени (диагностика и мониторинг терапии);
- диагностика отравления фосфорорганическими соединениями (инсектицидами);
- оценка риска развития осложнений при планировании хирургической операции с применением миорелаксантов, гидролизуемых холинэстразой.
Методы исследования. Определение активности ХЭ в сыворотке крови проводят колориметрическим методом с использованием хромогенов.
Повышенные значения
- Нефротический синдром;
- ожирение;
- маниакально-депрессивный психоз, депрессивные неврозы.
Пониженные значения
- Острые и хронические заболевания печени;
- отравления фосфорорганическими соединениями (инсектицидами);
- наследственные генетические модификации холинэстеразы;
- поздние сроки беременности;
- эмболия легочной артерии;
- дерматомиозит;
- мышечная дистрофия;
- хронические заболевания почек.


Холинэстераза — фермент, являющийся катализатором реакции расщепления холиновых эфиров. Определение активности фермента в кровеносном русле имеет самостоятельное диагностическое значение, но может назначаться вместе с определением активности трансаминаз. Чаще всего биохимическое исследование уровня холинэстеразы применяют в гепатологии для оценки работы печени. Иногда исследование назначается для мониторинга возможных осложнений при хирургических операциях. Для анализа используют сыворотку, выделенную из венозной крови. Определение холинэстеразы производится унифицированным колориметрическим методом. Нормальные показатели фермента колеблются от 5300 до 12900 Ед/л. Готовность результатов — 1 рабочий день.

Холинэстераза — фермент, являющийся катализатором реакции расщепления холиновых эфиров. Определение активности фермента в кровеносном русле имеет самостоятельное диагностическое значение, но может назначаться вместе с определением активности трансаминаз. Чаще всего биохимическое исследование уровня холинэстеразы применяют в гепатологии для оценки работы печени. Иногда исследование назначается для мониторинга возможных осложнений при хирургических операциях. Для анализа используют сыворотку, выделенную из венозной крови. Определение холинэстеразы производится унифицированным колориметрическим методом. Нормальные показатели фермента колеблются от 5300 до 12900 Ед/л. Готовность результатов — 1 рабочий день.
Холинэстераза — фермент из группы гидролаз, который расщепляет эфиры холина. В результате этой реакции образуется холин и кислоты. Существует две разновидности фермента — ацетилхолинэстераза и псевдохолинэстераза. Ацетилхолинэстераза синтезируется в эритроцитах, мышечной и нервной ткани, поэтому играет важную роль в передаче нервных импульсов. Первый тип имеет абсолютную субстратную специфичность (единственный субстрат — ацетилхолин). Второй тип — псевдохолинэстераза — высокомолекулярный белок, синтезируемый в печени. Обычно ее уровень в сыворотке крови пропорционален содержанию альбуминов. Главной функцией псевдохолинэстеразы считается переработка химических веществ, попавших в организм (токсины или медикаментозные препараты).
В большинстве лабораторий холинэстераза определяется унифицированным колориметрическим методом с использованием ацетилхолина хлорида. В медицинской практике исследование применяется в гепатологии, хирургии и анестезиологии.
Показания
Анализы на определение холинэстеразы назначаются для диагностики случаев отравления инсектицидами, используемыми для уничтожения насекомых, или фосфорорганическими химическими веществами. Еще одним показанием к исследованию может быть мониторинг функций печени или выявление динамики в процессе лечения гепатита или цирроза печени.
Подготовка к анализу и забор материала
Для исследования используется сыворотка крови. Взятие крови желательно производить натощак. За 14 часов перед процедурой забора материала важно ограничить физическую активность, не принимать спиртные напитки, избегать стрессовых ситуаций. За час перед анализом нужно исключить эмоциональное и физическое напряжение, также не рекомендуется курить. Перед исследованием можно пить только негазированную воду.
Забор биоматериала обычно проводится в утреннее время перед другими медицинскими процедурами (УЗИ, рентген). Перед анализом необходимо исключить прием медикаментов. В случае если отмену лекарств не рекомендует лечащий врач, следует сказать об этом лаборанту перед забором материала. Когда требуется оценить показатели фермента в динамике, нужно повторить исследование в той же лаборатории.
Для определения активности холинэстеразы производится забор венозной крови с помощью шприца или вакуумной системы. Образец крови доставляют в лабораторию в специализированных боксах. В зависимости от медицинского учреждения и его оборудования анализ может выполняться одним из следующих методов: биологическим, химическим, спектрофотометрическим, колориметрический или электрохимическим. Однако унифицированным является именно колориметрический метод с использованием ацетилхолина хлорида. Данный экспресс-метод производится с помощью индикатора (феноловый красный), который определяет сдвиг pH. Срок проведения анализа — 1 рабочий день.
Нормальные значения
У здоровых людей в сыворотке крови уровень холинэстеразы составляет 5300-12900 Ед/л. У детей до 14-летнего возраста активность фермента колеблется в пределах от 6400 до 15500 Ед/л; у женщин с 15 до 40 лет — 4400-13500 Ед/л, старше 40 лет — 6400-15500 Ед/л; а у мужчин от 14 лет — 6400-15500 Ед/л.
Могут быть незначительные отклонения уровня холинэстеразы от референсных значений в результате естественных причин (например, беременность). Обычно в первом триместре беременности активность фермента повышена, а в третьем — немного снижена, что считается вариантом нормы. В то же время бывают случаи, когда холинэстераза в кровеносном русле может иметь абсолютно нормальные показатели, но у пациента обнаруживается латентный гепатит без видимых клинических признаков. В такой ситуации врач назначает дополнительные анализы и методы исследования.
Повышение уровня
Причинами повышения холинэстеразы в крови может быть сахарный диабет второго типа, миома матки, экссудативная энтеропатия, повышение артериального давления, рак груди, нефроз, лишний вес, злоупотребление спиртными напитками, депрессия, невроз, маниакально-депрессивный психоз или столбняк.
Физиологической причиной повышения холинэстеразы в крови считается беременность. Согласно исследованиям, беременные с артериальной гипотензией, имеющие выраженные клинические признаки вплоть до потери сознания, имеют высокий уровень холинэстеразы. Обычно увеличение активности фермента происходит именно в первом триместре. Если повышенное содержание холинэстеразы сохраняется до родов, это может привести к слабой родовой деятельности из-за пониженной концентрации свободного ацетилхолина.
Снижение уровня
Причинами снижения холинэстеразы в крови считаются патологии печени (гепатит, цирроз или рак), злокачественные онкологические болезни, отравление фосфорсодержащими органическими веществами и инсектицидами или заболевания сердца (инфаркт миокарда), острый инфекционный процесс, анемия, патологии почек, недостаточный вес, мышечная дистрофия.
При использовании миорелаксантов во время хирургической операции, употреблении анаболических стероидных препаратов, оральных гормональных контрацептивов или глюкокортикоидов может быть незначительное понижение активности фермента. Физиологической причиной уменьшения уровня холинэстеразы является третий триместр беременности. Перед родами активность фермента должна немного снижаться, а артериальное давление прийти в норму, что способствует естественному родоразрешению.
Лечение отклонений от нормы
Определение активности холинэстеразы помогает вовремя выявить множество серьезных патологий в организме, а также избежать последствий отравлений инсектицидами и фосфорорганическими соединениями. Для установления точного диагноза пациенту нужно обратиться за консультацией к врачу-гепатологу, хирургу, неврологу или токсикологу в зависимости от симптоматики. Важно понимать, что терапия не назначается только по результатам анализа одного показателя, выработка тактики лечения возможна только после общего обследования. Если отклонения от нормы возникли по физиологическим причинам, лечение не требуется.
Чтобы привести референсные показатели к норме, необходимо снизить вероятность отравления токсичными инсектицидами. Обычно заражение происходит путем их вдыхания или при тактильном контакте, поэтому важно исключить возможность воздействия химикатов (вплоть до смены рабочего места). Также рекомендуется нормализовать режим дня и питание.
Ферменты, относящиеся к классу гидролаз: ацетилхолинэстераза (АХЭ; ацетилхолин — ацетилгидролаза; синоним истинная холинэстераза) и холинэстераза (ХЭ; ацилхолин — ацилгидролаза; синоним: псевдохолинэстераза, бутирилхолинэстераза и др.). Холинэстеразы преимущественно катализируют гидролиз карбоновых эфиров холина. Биологическая роль ацетилхолинэстеразы заключается в быстром гидролитическом расщеплении нейромедиатора ацетилхолина (см. Медиаторы) и участия таким образом в процессе нервно-мышечной передачи нервного импульса (см. Нервная клетка). Функция других холинэстераз в организме человека точно не установлена.
Снижение активности Х. в сыворотке крови служит показателем нарушения белоксинтезирующей функции печени; наблюдается также при бронхиальной астме, инфаркте миокарда, ожогах, травматическом шоке и др. При тиреотоксикозе и некоторых заболеваниях почек активность Х. в сыворотке крови повышается. Определение активности сывороточной Х. очень важно при использовании миорелаксантов типа сукцинилхолина для обеспечения адекватной миорелаксации при общей анестезии. Это связано с тем, что у некоторых лиц обнаружено существование атипических холинэстераз, не способных гидролизовать это производное холина, что ведет к так называемой рекураризации, т.е. повторному угнетению нервно-мышечного синапса после восстановления его функции к концу операции, клинически проявляющемуся повторной миорелаксацией и угнетением дыхания. Одним из мероприятий по предупреждению этого грозного осложнения является своевременная декураризация путем введения антихолинэстеразных препаратов.
Соединения, угнетающие активность холинэстераз, например галантамин, прозерин, физостигмин, используются в качестве лекарственных средств (см. Антихолинэстеразные средства).
Ацетилхолинэстераза содержится в нервной ткани и эритроцитах. Другие холинэстеразы обнаружены в сыворотке крови и печени, слизистой оболочке кишечника, поджелудочной железе. Высокая токсичность фосфорорганических соединений, обладающих свойствами отравляющих веществ нервно-паралитического действия, обусловлена их ингибирующим действием на холинэстеразу. К ингибиторам X. относятся также карбаминовые соединения и холиномиметические вещества.
В качестве унифицированного метода определения активности ацетилхолинэстеразы в сыворотке крови принят фотометрический метод с использованием в качестве субстрата ацетилхолинхлорида, гидролизующегося под действием фермента на холин и уксусную кислоту. В результате этой реакции рН среды сдвигается в кислую сторону, что регистрируется с помощью индикатора (фенолового красного). В норме активность ацетилхолинэстеразы, измеренная этим методом, составляет 45—95 мкмоль/(с․л), или 160—340 мкмоль/(ч․мл).
Активность Х. определяют с использованием в качестве субстрата бутирилтиохолина йодида. В результате реакции образуются тиохолин и масляная кислота (бутират). Тиохолин вчаимодействует с 5,5 (дитио-бис 2-нитробензойной кислотой) с образованием продукта, окрашенного в желтый цвет. Активность Х. сыворотки крови пропорциональна скорости поглощения окрашенного продукта в индикаторной реакции. В норме активность Х. сыворотки крови, определенная этим методом, равна: при 25° — 50—155 мкмоль/(с․л), или 3000—9300 ME; при 30° — 62—191 мкмоль/(с․л), или 3714 — 11 513 ME; при 37° — 88—240 мкмоль/(с․л), или 4659 — 14 443 ME.
ХОЛИНЭСТЕРАЗЫ — ферменты, относящиеся к классу гидролаз: ацетилхолинэетераза (АХЭ; ацетилхолин — ацетилгидролаза; синоним истинная холинэстераза; КФ 3.1.1. 7) и холинэстераза (ХЭ, БуХЭ; ацилхолин — ацилгидролаза; синоним: псевдо-холинэстераза, бутирилхолинэстераза и др.; КФ 3. 1. 1. 8). Холинэстеразы преимущественно катализируют гидролиз карбоновых эфиров холина (см.): (CH3)3N+CH2CH20C(0)R + + Н20 — (CH3)3N+CH2CH2OH + + RGOOH, где R — углеводородный радикал. Биол. роль ацетилхолинэстеразы заключается в быстром гидролитическом расщеплении нейромедиатора ацетилхолина (см.) и участии таким образом в процессе нервно-мышечной передачи нервного импульса (см. Нервная клетка); функция других холинэстераз в организме человека точно не установлена. Активность холинэстераз в сыворотке крови служит дополнительным диагностическим признаком ряда заболеваний. Соединения, угнетающие активность холинэстераз (см. Антихолинэстеразные средства), такие как галантамин (см.), прозерин (см.), физостигмин (см.) и др., используются в медицине в качестве лекарственных средств при лечении глаукомы, для предупреждения и лечения послеоперационной атонии кишечника, мочевого пузыря, для стимуляции родовой деятельности, при миастении и др.
Ацетилхолинэстераза содержится в нервной ткани и в эритроцитах. Другие холинэстеразы обнаружены в сыворотке крови и печени, в слизистой оболочке кишечника, поджелудочной железе.
Впервые активность холинэстеразы была обнаружена в 1926 году в сердце лягушки, а в 1932 году фермент был выделен из сыворотки крови лошади. В 40—50-х годах 20 века было установлено, что высокая токсичность фосфор органических соединений (см.), обладающих свойствами нервно-паралитических отравляющих веществ (см.), обусловлена их ингибирующим действием на холинэстеразу, в молекуле которой они фосфорилируют остаток серина (см.), лишая тем самым фермент возможности связываться с субстратом (см. Фосфорилирование). К ингибиторам холинэстераз относятся карбаминовые соединения (см.) и Xолиномиметические вещества (см.).
Ацетилхолинэстераза с наибольшей скоростью гидролизует ацетилхолин, а также катализирует гидролиз ацетил-р-метилхолина и ацетоксиэтилииперидиния. Катионные фосфорорганические соединения и бис (З-триметиламмоний-5-ги дроке ифенокси)-1,3-пропандийодид (3116 СТ) являются ее ингибиторами. Специфическим субстратом бутирилхолин-эстеразы является бутирилхолин, ингибиторами — диизопропилфтор-фосфат, 10-(1 -диэтиламинопропионил) фенотиазингидрохлорид (ASTRA-1397).
Холинэстеразы обладают тканевой и видовой специфичностью. Они являются простыми белками. Активная поверхность их молекулы имеет эстеразный центр катализа и анионный центр связывания, которые обрамлены гидрофобными областями, определяющими специфичность фермента в отношении субстратов и ингибиторов. При связывании субстрата на активном центре фермента его карбонильная группа через систему водородных связей образует цикл с имидазолом остатка гистидина (см.) и гидроксильной группой остатка серина эстеразного центра холинэстеразы. Перераспределение электронов по этому циклу приводит к ацилированию гидроксильной группы остатка серина. Отщепление ацильной группы протекает с участием воды по аналогичному циклическому механизму. Необратимое ингибирование холинэстераз фосфор-органическими соединениями напоминает механизм гидролиза субстрата ферментом.
Определение активности холинэстераз производят по количеству негидролизованного ацетилхолина, которое измеряют при действии гидроксиламина и хлорного железа FeCl3 с последующим фотометрированием Fe-ацетгидрокеамового комплекса (метод Хестрина), а также по сдвигу величины pH инкубационной смеси, происходящему в результате закисления среды кислотой, образующейся при гидролизе субстрата (метод Мичела и метод Моландера — Фридмана — Ладью); по измерению количества тиохолина, образующегося при гидролизе ацетилтиохолина, с помощью хромогенного реагента 5,5-дитиобис-2-нитробензойной кислоты (метод Эллмана).
Снижение активности холинэстеразы в сыворотке крови служит показателем нарушения белоксинтезирующей функции печени, это наблюдают также при бронхиальной астме, ревматическом полиартрите, инфаркте миокарда, ожогах, травматическом шоке и др. При тиреотоксикозе и некоторых заболеваниях почек активность холинэстеразы в сыворотке крови повышается. Определение активности сывороточной холинэстеразы очень важно при использовании миорелаксантов (см.) типа сукцинилхолина для обеспечения адекватного наркоза (см.), так как у некоторых людей обнаружено существование атипических холинэстераз, неспособных гидролизовать это производное холина, что ведет к так наз. рекураризации, то есть повторному угнетению нервно-мышечного синапса после восстановления его функции к концу операции, клинически проявляющемуся повторной релаксацией и угнетением дыхания. Одним из мероприятий по предупреждению этого грозного осложнения является своевременная декураризация путем введения антихолинэстеразных препаратов.
Реактиваторы холинэстераз. Антагонисты фосфорорганических соединений, способные восстанавливать активность холинэстераз путем де-фосфорилирования молекулы инактивированного фермента, получили название реактиваторов холинэстераз. В химической структуре всех реактиваторов холинэстераз присутствует оксимная группировка (-NOH), которая ответственна за реактивацию фермента, поэтому эти соединения часто для краткости называют просто оксимами. К реактиваторам холинэстераз принадлежат оксимы, содержащие четвертичные ониевые группы (пралидоксимйодид — 2-ПАМ, пралидоксимхлорид, протонам — P2S, дипироксим. тримедоксим — ТМБ-4, токсогонин и др.), и оксимы, не содержащие четвертичных ониевых групп (моноизонитрозоацетон — МИНА, изонитрозин, диэтиксим и др.).
По характеру своего фармакологического действия реактиваторы холинэстераз являются антидотами (см. Антидоты ОВ) фосфорорганических соединений, обладающих антихолин-эстеразным эффектом. Восстанавливая активность холинэстераз в органах, функция которых была нарушена в результате прекращения гидролиза синаптического ацетилхолина, реак-тиваторы холинэстераз способствуют восстановлению синаптической передачи до уровня, совместимого с жизнью. Было установлено, что при создании в организме достаточных концентраций реактиваторов холинэстераз снимался нервно-мышечный блок, вызванный угнетением холинэстеразы, уменьшалась брадикардия, восстанавливалось дыхание, исчезали другие патогенетически значимые нарушения, возникающие при отравлении фосфорорганическими соединениями.
Реактиваторы холинэстераз способны восстанавливать активность как бутирилхолинэстеразы, так и ацетилхолинэстеразы, однако терапевтическое значение имеет только восстановление активности ацетилхолинэстеразы как фермента, ответственного за гидролиз синаптического ацетилхолина.
В зависимости от выраженности центральных и периферических эффектов реактиваторы холинэстераз делят на две группы: преимущественно периферического действия и смешанного действия (центрального и периферического). К первым относятся моно- и бисчетвертичные оксимы, которые из-за низкой липофильности плохо проникают через гема-то-энцефалический барьер (см.) и поэтому не реактивируют или в незначительной степени реактивируют ацетилхолинэстеразу мозга. Третичные оксимы легко проникают через гистогематические барьеры и в равной степени реактивируют холин-эстеразу мозга и периферических нервных окончаний, являясь, таким образом, реактиваторами смешанного действия. Иногда их называют реактиваторами холинэстераз центрального действия, подчеркивая этим их отличие от реактиваторов только периферического действия.
Биохимический механизм действия реактиваторов холинэстераз основан на взаимодействии молекулы оксима с фосфорилированным ферментом. Этот процесс предположительно может протекать в две стадии. На первой стадии реактиватор связывается с фосфорилированной группой ингибированного фермента, на второй стадии происходит упрочение этой связи в результате нуклеофильной атаки оксимом атома фосфора, что приводит к разрыву ковалентной связи между фосфорильной группой и ферментом и восстановлению его активности. Процесс реактивации холинэстеразы происходит в соответствии со следующим уравнением: А“ + НЕР E. В. Розенгарт; С. H. Голиков (реактиваторы холинэстераз), Р. В. Бережной (суд.).
Читайте также:


