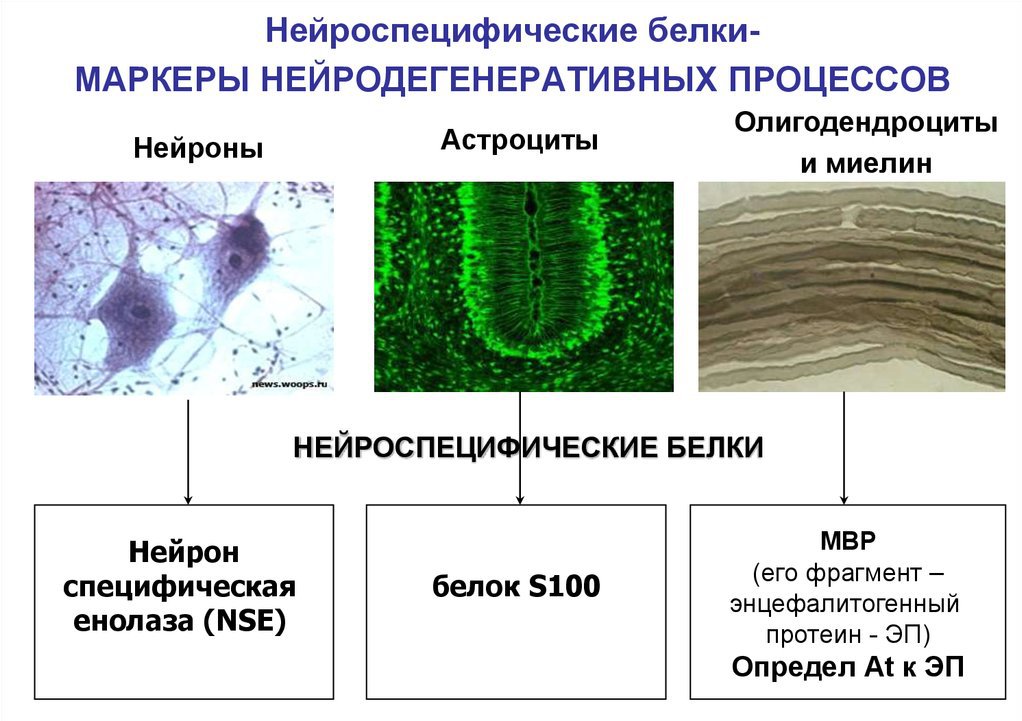
Специфические белки нервной ткани s 100
Белки s100 представляют собой семейство низкомолекулярных тканеспецифичных кальций-связывающих протеинов модуляторного действия, принимающих участие во многих физиологических процессах организма. Название характеризует способность соединений этой группы полностью растворяться в 100%-ном растворе сульфата аммония при нейтральных значениях pH.
В настоящее время известно 25 представителей этого семейства, которые характерны для разных тканей. Данная особенность говорит о том, что мозгоспецифические белки s100 — это протеины, присутствующие в клетках головного мозга и принимающие участие в нейрофизиологических процессах.
История открытия
Первый s100-протеин был выделен в 1965 году из бычьего мозга учеными Муром и Грегором. В дальнейшем белки этого семейства были найдены у млекопитающих, птиц, рептилий и человека. Изначально считалось, что s100 присутствует только в нервной ткани, но с развитием иммунологических методов протеины данной группы стали обнаруживать и в других органах.
Общая характеристика и топография
Белки семейства s100 присутствуют только у позвоночных животных и у человека. 15 из 25 протеинов этой группы являются мозгоспецифическими, большая часть которых вырабатывается астроглиальными клетками ЦНС, однако некоторая доля присутствует и в нейронах.
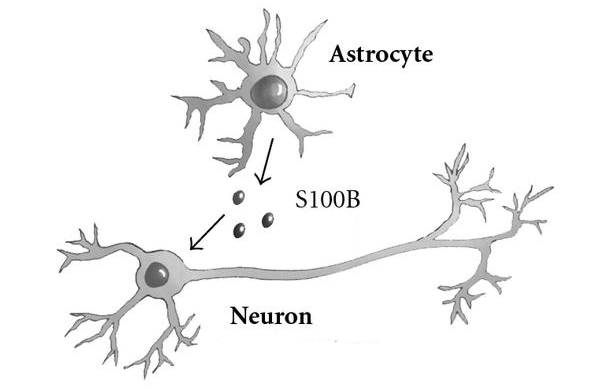
Установлено, что 90% всей фракции s100 в организме растворено в цитоплазме клеток, 0,5% локализовано в ядре и 5-7% связано с мембранами. Небольшая часть протеина содержится во внеклеточном пространстве, в том числе в крови и спинномозговой жидкости.
Протеин группы s100 присутствует во многих органах (кожа, печень, сердце, селезенка и др.), но в головном мозге его в сто тысяч раз больше. Самая высокая концентрация наблюдается в мозжечке. Белок s100 также активно вырабатывается в меланоцитах (клетках кожной опухоли). Это стало причиной использования данного соединения в качестве маркера тканей эктодермального происхождения.
Химически белки s100 представляют собой димеры с молекулярной массой 10-12 дальтон. Эти протеины имеют кислую природу, поскольку содержат большое количество (до 30%) остатков глутаминовой и аспарагиновой аминокислот. В состав молекул s100 не входят фосфаты, углеводы и липиды. Эти белки выдерживают нагревание до 60 градусов.
Структура и пространственная конформация
По структуре все представители семейства s100 являются глобулярными белками. В состав одной димерной молекулы входит 2 полипептида (альфа и бета), соединенные друг с другом нековалентными связями.
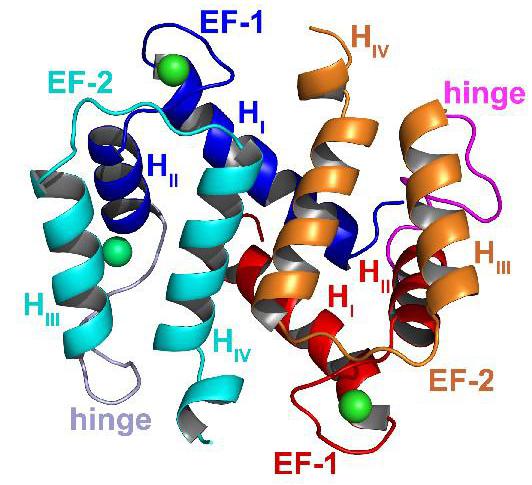
Большинство представителей семейства являются гомодимерами, образованными двумя одинаковыми субъединицами, но встречаются и гетеродимеры. Каждый полипептид в составе молекулы s100 имеет кальций-связывающий мотив, названный EF-рукой. Он построен по типу спираль-петля-спираль.
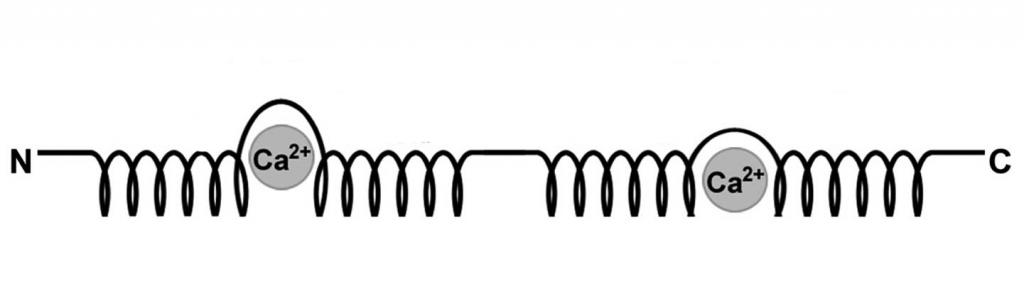
Белок s100 содержит 4 α-спиральных сегмента, центральную шарнирную область переменной длины и два концевых вариабельных домена (N и С).
Особенности действия
Сами по себе белки s100 не обладают ферментативной активностью. Их функционирование основано на связывании ионов кальция, которые задействованы во многих межклеточных и внутриклеточных процессах, в том числе сигнального характера. Присоединение Ca 2 + к молекуле s100 приводит к ее пространственной перестройке и открытию целевого протеин-связывающего центра, посредством которого осуществляется взаимодействие с другими протеинами.
Таким образом, s100 не относятся к белкам, основная задача которых заключается в регуляции концентрации Ca 2 + . Протеины этой группы являются сигнал-преобразующими кальций-зависимыми биологически активными модуляторами, влияющими на внутриклеточные и внеклеточные процессы через связывание с белками-мишенями. В качестве последних могут выступать и нейромедиаторы, с чем связано влияние s100 на передачу нервных импульсов.
В настоящее время выявлено, что в роли регуляторов для некоторых s100 вместо Ca 2 + выступают ионы цинка и/или меди. Присоединение последних может как непосредственно влиять на активность протеина, так и изменять его сродство к кальцию.
Функции
Полноценной картины биологической роли мозгоспецифических белков s100 в организме пока не существует. Тем не менее выявлено участие протеинов этой группы в таких процессах:
- регуляция метаболических реакций нервной ткани;
- репликация ДНК;
- экспрессия генетической информации;
- пролиферация глиальных клеток;
- защита от оксидативного (связанного с кислородом) повреждения клеток;
- дифференцировка незрелых нейронов;
- гибель нейронов через апоптоз;
- динамика цитоскелета;
- фосфорилирование и секреция;
- передача нервного импульса;
- регуляция клеточного цикла.

В зависимости от разновидности и места локализации мозгоспецифические протеины s100 могут оказывать как внутриклеточные, так и внеклеточные воздействия. Эффект некоторых белков зависит от концентрации. Так, широко известный белок s100B при нормальном содержании проявляет нейротрофическую активность, а при повышенном — нейротоксическую.
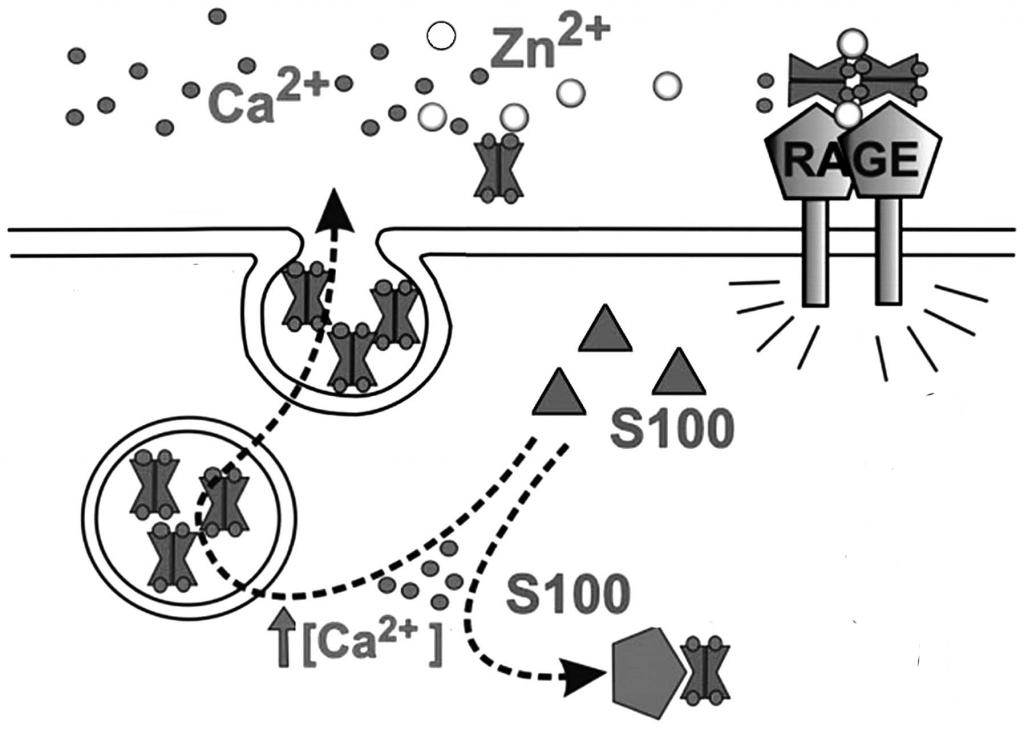
Внеклеточные мозгоспецифичные протеины s100 могут участвовать в воспалительных реакциях, регулировать дифференцировку глии и нейронов, а также запускать апоптоз (программируемую смерть клеток). Важность s100 была доказана в эксперименте in vitro, в котором нейроны не выживали без присутствия этого белка.
Диагностическое значение s100
Диагностическое значение s100 основано на связи его концентрации в сыворотке крови (или спинномозговой жидкости) с патологиями ЦНС и онкологическими заболеваниями. Установлено, что при повреждении глиальных клеток этот белок выходит в экстрацеллюлярное пространство, откуда поступает в спинномозговую жидкость и далее — в кровь. Таким образом, на основании повышения концентрации s100 в сыворотке можно сделать вывод о ряде патологий головного мозга. Связь между содержанием этого белка в крови и заболеваниями ЦНС была подтверждена экспериментально.
К повышению концентрации s100 во внеклеточных жидкостях приводят не только из-за разрушения клеточных преград синтезирующих этот белок клеток. Первой реакцией на многие патологии мозга является так называемый глиальный ответ, частью которого является увеличение интенсивности секреции s100 астроцитами. Увеличение содержания этого белка в крови может так же свидетельствовать о нарушении гематоэнцефалического барьера.
Контроль уровня s100 позволяет оценить степень повреждения мозга, что имеет большое значение в медицинском прогнозировании. Диагностическая связь между количеством этого протеина и нейропатологией напоминает корреляцию концентрации с-реактивного белка с системным воспалением.
Использование в качестве онкомаркера
В качестве онкомаркера белок s100 начали использовать в начале 1980-х. В настоящее время этот метод является эффективным для раннего выявления рака, рецидивов или метастаз. Наиболее часто s100 применяют в диагностике меланомы или нейробластомы.
Необходимо различать, когда анализ на этот белок проводят для определения патологий ЦНС или других болезней, а когда — для выявления рака. Если ориентировка идет именно на онкомаркер, расшифровка белка s100 должна учитывать и другие возможные причины повышения концентрации исследуемого вещества в крови. При интерпретации результатов обязательно обращают внимание на метод анализа, поскольку от него зависят границы референсного интервала (показателей нормы).
Основной недостаток маркера s100 заключается в его низкой селективности, поскольку повышение концентрации этого белка в крови и СМЖ может быть связано со многими патологиями, не обязательно раковой природы. Поэтому нельзя предавать протеину s100 определяющее диагностическое значение. Тем не менее этот белок прекрасно зарекомендовал себя в качестве сопутствующего онкологического маркера.
Уровень присутствия в сыворотке крови
В норме белок s100 должен присутствовать в сыворотке в количестве менее 0,105 мкг/л. Данное значение соответствует верхней границе концентрации у здорового человека. Превышение допустимого уровня (ДУ) s100 может свидетельствовать о:
- ДЦП;
- травме мозга;
- развитии злокачественной меланомы (либо ее рецидиве);
- наличии беременности;
- нейробластоме;
- дерматомиозите;
- охватывающих большие площади ожогах.
Уровень белка также может повышаться при стрессе или длительном нахождении организма в зоне ультрафиолетового излучения. Концентрация в крови определяется соответствующим анализом.
Выявление в организме
Выявить присутствие s100 в сыворотке крови можно несколькими способами, включая:
- иммунорадиометрический анализ (IRMA);
- масс-спектроскопию;
- вестерн-блот;
- ELISA (иммуноферментный анализ);
- электрохемилюминесценцию;
- количественную ПЦР.
Все эти аналитические методы являются высокочувствительными и позволяют очень точно определить количественное содержание s100. Так как этот белок характеризуется коротким периодом полураспада (30 минут), высокая концентрация в сыворотке возможна только при постоянном поступлении из пораженных тканей.
В клинической диагностике чаще всего используют автоматизированный электрохемилюминесцентный иммунологический анализ на белок s100. Исследование сочетает использование антител к выявляемому протеину со световой маркировкой. Прибор определяет концентрацию s100 по интенсивности хемилюминесцентного излучения.
Антитела к белку s100
В медицине антитела к протеину s100 имеют 2 сферы практического применения:
- диагностическую — применяют в иммунологических методах для выявления концентрации этого белка в сыворотке или СМЖ (в данном случае s100 является антигеном);
- лечебную — введение антител в организм применяется в терапии некоторых заболеваний.

Антитела проявляют свой эффект через модулирующее воздействие на протеины s100. Известным препаратом на такой основе является "Тенотен". Антитела к s100 оказывают благоприятное воздействие на нервную систему, улучшают передачу импульса. Кроме того, такие препараты способны купировать симптоматические проявления нарушений вегетативной функции в работе пищеварительной системы.
Биохимия нервной системы изучает химический состав нервной ткани и особенности ее метаболизма. Специфика нервной ткани определяется гематоенцифаличним барьером (ГЭБ). Он обеспечивает избирательную проницаемость различных метаболитов и способствует накоплению отдельных веществ в нервной ткани, поэтому ее внутренняя среда значительно отличается по химическому составу от других тканей. Характерные особенности нервной ткани определенны ее функциями в целом организме и проявлением в ее химическом составе и метаболических процессах, которые ей присущи.
Серое вещество головного мозга представлено преимущественно телами нейронов, белое — аксонами, поэтому эти отделы различаются по химическому составу.
Серое вещество содержит больше воды. Доля сухого остатка в ней составляет 16%, половину составляют белки, треть — липиды. Белое вещество мозга отличается меньшим количеством воды (70%) и большим содержанием сухого остатка (30%), в котором липидов вдвое больше, чем белков.

Химический состав нервной ткани
Количество белков в головном мозге составляет около 40%. По растворимости они делятся на:
а) растворимые в воде;
б) растворимые в солевых растворах;
Серое вещество содержит больше водорастворимых белков, белое — наоборот, нерастворимых. С помощью современных биохимических методов исследования в ткани мозга найдено около 100 растворимых белков. Белки нервной ткани делятся на простые и сложные.
К простым белкам относят нейроальбумины, составляющие 90% всех растворимых белков нервной ткани. Они образуют комплексы с липидами, нуклеиновыми кислотами, углеводами, являются основными компонентами фосфопротеина, а в свободном состоянии практически не встречаются. Количество нейроглобулинов составляет около 5% от всех растворимых белков. Главными представителями катионных белков нервной ткани является гистоны, которые разделяют на 5 фракций в зависимости от содержания в их составе остатков лизина, аргинина, глицина. Нейросклеропротеины (нейроколагены, нейронеластины, нейростромины) — структурноопорные белки, на долю которых приходится 8-10% от количества простых белков нервной ткани. Они локализованы в периферийной нервной системе и белом веществе головного мозга.
Белки представлены нуклеопротеинами, липопротеинами, протеолипидами, фосфопротеинами, гликопротеинами и др. В ткани мозга также содержатся сложные надмолекулярные образования — липонуклеопротеины, липогликопротеины, гликолипонуклеопротеиновые комплексы.
Нуклеопротеиды относятся к рибонуклеопротеинам или к дезоксирибонуклеопротеинам, которые растворяются в воде, солях, лугах.
Липопротеины составляют значительную часть водорастворимых белков нервной ткани. Их липидный компонент — это в основном фосфоглицериды и холестерин.
Протеолипиды — белковолипидные комплексы — нерастворимые в воде, но растворимы в органических растворителях. В основном протеолипиды сосредоточены в миелине, которые в небольшом количестве содержатся в синаптических мембранах и синаптических пузырьках.
Фосфопротеины головного мозга составляют 2% от общего количества сложных белков. Они — компоненты мембран различных морфологических структур нервной ткани.
Гликопротеины — это гетерогенная группа сложных белков. В зависимости от соотношения белкового и углеводного компонентов их разделяют на:
а) гликопротеины, содержащие от 5 до 40% углеводов, их белковая составляющая представлена альбуминами и глобулинами;
б) гликолипопротеины, в которых доля углеводов составляет от 40 до 80%, а также имеющийся липидный компонент.
а) белок S100 (белок Мура) — принадлежит к семейству кислых низкомолекулярных белков с большим содержанием остатков глутаминовой и аспарагиновой кислот. Это нейроспецифический протеин, хотя некоторые его изоформы случаются в других тканях. В ЦНС идентифицировано 18 изоформ белков S100, которые сосредоточены в основном в нейроглии, в нейронах их не более 10-15%. Белки Мура относят к Са, Zn, Cu связывающих протеинов кальмодулинового типа с разнообразными функциями.
— фосфорилирования других белков и их ферментативную активность;
— внутриклеточный и аксональный транспорт;
— деление клеток и транскрипцию;
— подвижность и сократительную активность клеток;
— процессы пролиферации и апоптоза;
— клеточный метаболизм и др.
Белки семейства S100 как нейроспецифические имеют отношение к высшим функциям мозга — мышления, памяти, внимания, интеллекта. Увеличение количества белков S100 в крови свидетельствует о нарушении метаболических процессов в головном мозге, которые возникают при болезни Альцгеймера, шизофрении, сосудистых, злокачественных заболеваниях, алкоголизме, вследствие возрастных изменений и др.
б) белок 4312 — кислый протеин, который в небольшом количестве содержится в нейронах и нейроглии. Биологическая роль его не выяснена;
в) белок 10В — участвует в процессах памяти;
г) белки мембран синаптических пузырьков — синапсин и синаптин, синаптофизин участвуют в связывании с поверхностью синаптических пузырьков компонентов цитоскелета, регулировании высвобождения нейромедиатора из пузырьков в синаптическую мембрану.
В нервной ткани находятся неспецифические ферменты, регулирующие основные метаболические пути обмена углеводов, липидов, белков: изоферменты лактатдегидрогеназы, альдолаза, гексокиназа, малатдегидрогеназа, глутаматдегидрогеназа, кислая фосфатаза, моноаминоксидаза и другие.
К нейроспецифическим ферментам нервной ткани относят: энолазу, изоферменты КФК (КФК), глутаматдекарбоксилазы, аргиназу, лейцинаминопептидазы, ацетилхолинэстеразу.
Характерной особенностью нервной ткани является высокое содержание липидов. Липиды нервной ткани подразделяют на две группы:
1) липиды серого вещества, входящие в состав нейронных мембран;
2) липиды белого вещества, из которых построен многослойный миелиновой футляр.
Большинство липидов серого вещества аналогичны мембранным липидам других тканей.
Миелиновые структуры характерны только для нервной ткани. Типичными липидами миелина являются: холестерол, сфинголипиды, фосфолипиды. В эмбриональный период развития количество миелина в мозге незначительное, но сразу после рождения синтез миелина значительно увеличивается. Миелиновая оболочка, образовавшаяся вокруг нервных волокон, остается стабильной на протяжении всей жизни. Специфическая природа липидов нервной ткани определяет ее характерные особенности. В составе липидов нервной ткани отсутствуют нейтральные жиры, низкая концентрация жирных кислот, значительное количество сложных фосфо и гликолипидов. Белое и серое вещества мозга различаются по качественному составу липидов. В сером веществе на долю фосфолипидов приходится около 60% от общего содержания липидов, в белой — 40%. В белом веществе количество холестерола, сфингомиелины, цереброзидов выше, чем в сером веществе мозга.
Холестерол синтезируется в мозге лишь в период его интенсивного развития. В мозге взрослых людей этот процесс не происходит из-за очень низкой активности ключевого фермента синтеза холестерина — ОМГ-КоА-редуктазы. Эфиры холестерина локализуются только в участках интенсивной миелинизации.
Липиды нервной ткани образуют с белками сложные протеолипидные комплексы.
— структурная — образуют клеточные мембраны нейронов, является составной миелина;
— диэлектрическая — обеспечивают электрическую изоляцию за счет миелина;
— защитная — ганглиозиды как антиоксиданты ингибируют перекисное окисление липидов;
— регуляторная — инозитфосфатиды участвуют в передаче гормонального сигнала.
По своему соcтаву и процессам метаболизма нервная ткань значительно отличается от других тканей.
НЕЙРОН
Нейрон - это функциональная единица нервной системы, он состоит из тела (сомы), многочисленных ветвящихся коротких отростков – дендритов и одного длинного отростка – аксона, длина которого может достигать несколько десятков сантиметров. Аксоны и дендриты оканчиваются синаптическими образованиями. Дендриты, проводят нервный импульс по направлению к телу клетки, а аксон, проводит его от сомы. Таким образом, дендриты и аксоны отвечают соответственно за получение и передачу сигнала. Тело нейрона является трофическим центром, нарушение целостности которого ведет клетку к гибели.
Тело нейрона окружено плазматической мембраной – плазмалеммой. Плазмалемма выполняет структурную функцию, служит барьером для поддержания внутриклеточного состава (клеточные органеллы, везикулы нейромедиаторов, метаболиты), играет активную (ионные насосы, ферменты) и пассивную (ионные каналы, высвобождение нейромедиатора) роли в создании мембранного потенциала, транспорте веществ через мембрану и передаче нервного импульса.
Внутри нейрон заполнен нейроплазмой(цитоплазмой). Объем нейроплазмы аксона и дендритов, может в несколько раз превышать объем нейроплазмы в теле нейрона. Нейроплазма содержит все основные органеллы клетки.
ХИМИЧЕСКИЙ СОСТАВ НЕРВНОЙ ТКАНИ
В связи с различием строения, серое и белое вещество нервной ткани отличаются по химическому составу.
-В сером веществе воды больше, чем в белом.
-В сером веществе белки составляют половину плотных веществ, а в белом веществе – одну треть.
-В белом веществе на липиды приходится более половины сухого остатка, а в сером – лишь около 30%.
Химический состав серого и белого вещества головного мозга человека
| Компонент | Серое вещество, % | Белое вещество,% |
| Вода | 84,0 | 70,0 |
| Сухой остаток | 16,0 | 30,0 |
| Белки | 8,0 | 9,0 |
| Липиды | 5,0 | 17,0 |
| Минеральные вещества | 1,0 | 2,0 |
Белки нервной ткани
В головном мозге на белки приходиться 40% сухой массы. В настоящее время выделено более 100 белковых фракций нервной ткани (методами хроматографии, электрофореза и экстракции буферными растворами).
В нервной ткани содержатся простые и сложные белки.
Простые белки
Нейроальбумины –основные растворимые белки (89-90%) нервной ткани, являются белковым компонентом фосфопротеинов, в свободном состоянии встречаются редко. Легко соединяются с липидами, нуклеиновыми кислотами, углеводами и другими небелковыми компонентами.
Нейроглобулины,содержатся в небольшом количестве (в среднем 5%).
Катионные белки- основные белки (рН 10,5 – 12,0), например, гистоновые. При электрофорезе они движутся к катоду.
Нейросклеропротеины (опорные белки).Например,нейроколлагены, нейроэлластины, нейростромины и др. Они составляют 8-10% от всех простых белков нервной ткани, локализованы в основном в белом веществе головного мозга и ПНС, выполняют структурно-опорную функцию.
Сложные белки
Сложные белки нервной ткани представлены: нуклеопротеинами, липопротеинами, протеолипидами, фосфопротеинами, гликопротеинами и т.д.
Гликопротеины –содержат олигосахаридные цепи, которые придают специфические отличия клеточным мембранам. Нейроспецифические гликопротеины участвуют в формировании миелина, в процессах клеточной
адгезии, нерорецепции и взаимном узнавании нейронов в онтогенезе и при регенерации.
Протеолипиды –в наибольших количествах содержатся в миелине и в небольших количествах - в синаптических мембранах и синаптических пузырьках.
Нейроспецифические белки
В цитоплазме нейронов присутствуют кальцийнейрин, белок 14-3-2, белок S-100, белок Р-400.
Белок S-100 (или кислый белок), содержит много глутаминовой и аспарагиновой кислот, гомологичен мышечному тропонину С, находиться в цитоплазме или связан с мембранами. На 85-90% он сосредоточен в нейроглии, и на 10-15% в нейронах. Участвует в развитии нервной системы и ее пластичности. Концентрация S-100 возрастает при обучении животных.
Белок 14-3-2 -кислый белок, который преимущественно локализован в нейронах ЦНС.
Белок Р-400находится в мозжечке мышей, где, возможно, отвечает за двигательный контроль.
К сократительным белкам нейронаотносятсянейротубулин, нейростенин, актиноподобные белки (кинезин и др.). Они обеспечивают ориентацию и подвижность цитоскелета (микротрубочек и нерофиламентов), активный транспорт веществ в нейроне, участвуют в работе синапсов.
В нейронах имеются белки, осуществляющие гуморальную регуляцию. Это некоторые гликопротеины гипоталамуса, нейрофизины и подобные им белки.
На мембране нейронов расположены нейроспецифические поверхностные антигены (NS1, NS2, L1) с неизвестной функцией и факторы адгезии клеток(N-САМ), важные для развития нервной системы.
Нейроспецифические белки участвуют в осуществлении всех функций нервной системы - генерации и проведении нервного импульса, процессах переработки и хранении информации, синаптической передаче, клеточном узнавании, рецепции и др.
Определение в крови белка S-100, используемое для диагностики, оценки прогноза и контроля лечения некоторых онкологических, неврологических, воспалительных и других заболеваний.
- Протеин S-100
- Онкомаркер меланомы
- S-100 protein
- S100 protein
Диапазон определения: 0,005 - 195 мкг/л.
Мкг/л (микрограмм на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Белки S-100 – это небольшие кальций-связывающие белки, относящиеся к тому же суперсемейству, что и кальмодулин, и тропонин C. В настоящий момент известно около 25 белков S-100. В организме человека они выполняют самые разнообразные функции: необходимы для роста и дифференцировки клеток, транскрипции, фосфорилирования белков, секреции, сокращения мышечного волокна и других процессов. Они регулируют клеточный цикл и апоптоз и могут поэтому участвовать в процессе онкогенеза. Концентрация белков S-100 изменяется при многих злокачественных заболеваниях, что может быть использовано для диагностики и прогноза опухолей.
Наибольшее диагностическое значение белок S-100B имеет в отношении меланомы. Белок S-100B является стандартным иммуногистохимическим маркером, который рутинно используется при патоморфологической диагностике меланомы. Также он выделяется злокачественными меланоцитами в кровь, где может быть измерен. На данный момент белок S-100B – это наиболее изученный биомаркер меланомы. Показано, что уровень белка S-100B хорошо соотносится с клинической стадией меланомы. Так, наиболее высокая концентрация этого биомаркера наблюдается при диссеминированных опухолях. Концентрация белка S-100B находится в пределах нормы у здоровых лиц и людей с доброкачественными новообразованиями кожи, но повышена в 1,3 %, 8,7 % и 73,9 % случаев меланомы на стадии I/II, III и IV соответственно. Учитывая, что на ранней стадии меланомы повышение уровня S-100B наблюдается редко, этот биомаркер не используется для скрининга меланомы. Белок S-100B также применяется для оценки прогноза меланомы: повышение уровня S-100B связано с более агрессивным течением болезни. В исследованиях доказана корреляция между уровнем белка S-100B и толщиной по Бреслоу – другим хорошо известным прогностическим фактором. Сочетание этих двух прогностических факторов позволяет получить более точную оценку прогноза заболевания. Так, повышение концентрации белка S-100B более 0,22 мкг/л в сочетании с толщиной по Бреслоу более 4 мм свидетельствует о диссеминации опухоли с чувствительностью 91 % и специфичностью 95 %. Исследование концентрации белка S-100B также используется для контроля лечения меланомы. Нарастание уровня этого биомаркера свидетельствует о прогрессировании меланомы, и наоборот, снижение его концентрации – о ее регрессе. Показано, что информативность биомаркера S-100B для оценки лечения меланомы выше, чем информативность другого биомаркера меланомы – лактатдегидрогеназы (ЛДГ). Повышение белка S-100B наблюдается также при астроцитоме, опухолях почек и некоторых разновидностях лейкозов, а также при заболеваниях почек, печени (в том числе метастазах различных опухолей в печень), различных воспалительных и инфекционных заболеваниях.
Другие белки S-100 также могут иметь определенное клиническое значение при диагностике других видов рака. Так, например, белок S-100A4 может быть использован для оценки прогноза рака молочной железы, желудка, мочевого пузыря, поджелудочной железы и легкого. Белок S-100A7 является биомаркером рака легкого и яичника. Белок S-100A9 может быть использован для дифференциальной диагностики рака предстательной железы и доброкачественной гиперплазии простаты.
Возможность применения белков S-100 в клинической практике была показана не только при злокачественных заболеваниях, но и при широком спектре других патологий.
В головном мозге белок S-100B преимущественно продуцируется астроцитами, а его усиленный синтез свидетельствует об активации астроцитов в ответ на повреждение нервной ткани на фоне гипоксии или гипогликемии. Повышение уровня белка S-100B в крови и спинномозговой жидкости наблюдается при травматическом повреждении головного мозга. Показано, что определение концентрации S-100B позволяет отобрать пациентов с черепно-мозговой травмой легкой степени тяжести, действительно нуждающихся в проведении КТ, и избежать до 30 % ненужных исследований. Ученые обнаружили, что повышение уровня белка S-100B более 0,1 мкг/л является чувствительным маркером патологических изменений на КТ головного мозга. Другие примеры использования белка S-100B в неврологии:
- повышенный уровень этого биомаркера у новорождённых свидетельствует в пользу гипоксемической/ишемической энцефалопатии при наличии асфиксии новорождённых;
- повышенный уровень этого биомаркера (более 0,3 мкг/л) является неблагоприятным прогностическим фактором у пациентов со спонтанным субарахноидальным кровоизлиянием;
- уровень белка S-100B повышен у пациентов с системной красной волчанкой с поражением нервной системы.
Синтез белка S-100A1 характерен для миокарда, где этот белок участвует в процессе сокращения миофибрилл. Синтез S-100A1 усилен при гипертрофии правого желудочка и снижен при тяжелой сердечной недостаточности. У пациентов с острым инфарктом миокарда отмечается повышение уровня S-100A1 в крови. Сочетание оценки по шкале Глазго менее 6 баллов, повышенного уровня нейронспецифической энолазы (NSE) более 65 нг/мл и белка S-100 более 1,5 мкг/л через 48-72 часа после сердечно-легочной реанимации при остановке сердца является высокоспецифичным индикатором неблагоприятного неврологического исхода и когнитивной дисфункции.
Белки S100A8, S100A9 и S100A2 преимущественно синтезируются фагоцитами и выполняют разнообразные функции, связанные с воспалением. Концентрация этих белков отражает активность воспалительных заболеваний, таких как ревматоидный артрит, хронический бронхит и муковисцидоз.
Таким образом, белок S-100 является неспецифичным биомаркером, вследствие чего его иногда сравнивают с С-реактивным белком – другим неспецифичным, но широко используемым биомаркером заболеваний разной этиологии. Так как возможен ложноположительный результат исследования на белок S-100, во избежание диагностических ошибок рекомендуется проведение повторных анализов.
Для чего используется исследование?
- Для диагностики, оценки прогноза и контроля лечения некоторых онкологических, неврологических, воспалительных и других заболеваний.
Когда назначается исследование?
- В онкологии – при диагностике меланомы и некоторых других злокачественных опухолей;
- в неврологии – при наличии черепно-мозговой травмы, асфиксии новорождённого, нейродегенеративных заболеваний (например, болезни Альцгеймера);
- в кардиологии – при сердечной недостаточности и острой ишемии;
- в ревматологии: при наличии ревматоидного артрита, системной красной волчанки, псориаза и других аутоиммунных заболеваний.
Что означают результаты?
Референсные значения: 0 - 0,11 мкг/л.
Причины повышения уровня S-100:
- злокачественные новообразования (меланома, рак молочной железы, поджелудочной железы, желудка, мочевого пузыря, легкого, яичника, предстательной железы);
- заболевания сердца (гипертрофия миокарда, острая ишемия);
- заболевания головного мозга (черепно-мозговая травма, субарахноидальное кровоизлияние, ишемия);
- воспалительные и аутоиммунные заболевания (ревматоидный артрит, системная красная волчанка, псориаз).
Причины понижения уровня S-100:
- эффективное лечение заболевания;
- сердечная недостаточность тяжелой степени тяжести (белок S-100A1).
Что может влиять на результат?
- Стадия рака;
- объем повреждения клеток, синтезирующих белок S-100.
- Белок S-100 является неспецифичным биомаркером.
- Нейронспецифическая энолаза (NSE)
- Лактатдегидрогеназа (ЛДГ) общая
- Лабораторные маркеры рака молочной железы
- Лабораторные маркеры рака легких
- Лабораторные маркеры рака толстой кишки
Кто назначает исследование?
Онколог, нефролог, кардиолог, ревматолог, терапевт, врач общей практики.
Литература
- Palmer SR, Erickson LA, Ichetovkin I, Knauer DJ, Markovic SN. Circulating serologic and molecular biomarkers in malignant melanoma. Mayo Clin Proc. 2011 Oct;86(10):981-90. Review.
- Chen H, Xu C, Jin Q, Liu Z. S100 protein family in human cancer. Am J Cancer Res. 2014 Mar 1;4(2):89-115. eCollection 2014. Review.
- Sedaghat F, Notopoulos A. S100 protein family and its application in clinical practice. Hippokratia. 2008;12(4):198-204.
Читайте также:


