Стволовые клетки нервного гребня и их производные
Во время нейруляции только млекопитающие формируют уникальный провизорный орган - нервный гребень(НГ) по всему длиннику зародыша - от промежуточного мозга до сакральных сомитов и ниже. НГ состоит из двух тяжей плюрипотентных зародышевых клеток между эктодермой и нервной трубкой, которые возникают за счет сигналов, возникающих одновременно в нервной трубке и прилегающей эктодерме. Клетки будущего НГ мигрируют из нервных складок - растущих концов открытой нервной трубки. Совместная инкубация эксплантатов нервной пластинки и эпидермиса достаточна для образования клеток НГ в обоих кусочках ткани (LaBonneC.,Bronner-Fraser M.,1999). Момент появления клеток НГ определяют по мРНК двух маркерных генов –Slug , Snail, позднее Pax-3. Точную комбинацию сигналов, запускающих появление клеток НГ как in situ, так in vitro пока не удалось определить. Блокада рецепторов для FGF частично приостанавливала появление клеток НГ. Появление гликопротеина Noelin1 на поверхности клеток маркирует первые клоны НГ в нервной трубке. Ретровирусная сверхэкспрессия Noelin1 ведет к длительному образованию и миграции клеток НГ в нервной трубке зародышей млекопитающих (Christiansen J.H., Coles E.G., Wilkinson D.G., 2000)
Показательно, что клетки НГ невозможно получить лабораторным путем – из ЭСК, НСК или клеток первичной эктодеомы. Фетальная ткань мозга остается единственным источником клеток НГ. Еще долгие годы фетальная ткань мозга будет служить источником для выделения уникальных провизорных линий из разных органов. Например, аорта фетусов служит уникальным банком ангиобластов, которые невозможно выделить из других тканей.
В головном отделе из клеток НГ образуются ганглии черепно-мозговых нервов, слуховой, вестибулярный и цилиарный ганлии. Часть клеток головной части НГ идет в стволовые клетки сосудистых сплетений (chorioid plexuses). Значительная часть клеток НГ дифференцируется в астроциты, микроглию и олигодендроциты. Подобно строме эти клетки в дальнейшем вырабатывают ростовые факторы (bFGF,EGF,TGF-alpha, NGF, PDGF, HGF, ILGF-1, NGF, NT3, GGF), адресованные стволовым и прогениторным клеткам (Mentlein R., Kendall M., 1999). Одновременно клетки НГ играют роль "провизорной мезенхимы", поддерживающей развитие среднего и заднего мозга. Локальное удаление головной части клеток НГ вело к массированному апоптозу нейроэпителия и аномалиям прозомеров (Etcheveres H.C., Couly G., Vincent C. et al, 2000 ). Головная часть клеток НГ служила донором стволовых клеток для образования глакомышечных клеток, перицитов всей артериальной и венозной системы лица и шеи (Etchevers H.C., Vincent C., Le Douarin N.M. et al., 2001).
Для эпителиомезенхимальной трансформации характерно изменение спектра поверхностных молекул адгезии. Если в центре клона промиграторные клетки плотно сцеплены молекулами N-кадхерина, то мигрирующая популяция прогениторных клеток НГ экспонировала кадхерин-6 и кадхерин-11 (Simmoneau L., Kitagawa M., Suzuki S. et al, 1995). Во время эпителио-мезенхимальной трансформации в клетках головной части НГ активировался Нох-7 ген. Характерно, что у части клеток хориодного сосудистого пучка, которые мигрировали в головной мозг и встраивались в слой эпендимы, происходила активация близкого Нох-7 гена (MacKenzie A., Ferguson M.W., Sharpe P.T., 1991).
Пересадки плюрипотентных клеток проамниона (внеэмбриональной эктодермы) между эктодермой и нервной трубкой зародыша также вели к появлению клеток НГ из клеток трансплантата. Это доказало решающую роль сигналов микроокружения в первичном возникновении клеток НГ. Обнаружен критический период, когда концентрация сигналов, способствующих образованию клеток НГ, достигала максимума (Ruffins S., Bronner-Fraser A.M., 2000). Локальные инъекции SHH блокировали появление эндотелин-позитивных и Slug+ прогениторных клеток. Noggin, Bmp-4, BMP-7 не влияли на появление клеток НГ. Как в случае нервной трубки, появление первых клонов стволовых клеток НГ было сопряжено с активацией одного из Sox- генов (Sox-10). Гены этого семейства отвечают за плюрипотентность стволовых клеток (Cheng Y., Cheung M., Abu-Elmagd M.M. et al., 2000 ). Промиграторные прогениторные клетки клонов НГ также сохраняли плюрипотентность. Подтверждением служил тот факт, что клоны плюрипотентных клеток НГ удалось выделить как из периферических нейронов симпатической парасимпатической НС, так и периферических ганглиев. Мигрируя на десятки см на периферию, часть прогениторных клеток сохраняла мультипотентность. Однако большинство одиночных мигрирующих клеток, покидающих клон, сохраняли более ограниченную коммитацию к дифференцировке.
Клетки головного отдела НГ мигрировали дорзовентрально, формируя костно-мышечный и хрящевой каркас, соединительную ткань лицевого черепа и шеи (включая хрящи гортани, уха, внутреннего уха, строму тимуса, нейроэпителий щитовидной железы, зачатки зубов). Взаимодействия мигрирующих клеток головной части НГ и эпителия тимуса приводили к локальной экспрессии транскрипционных факторов Hoxa3, Pax1 и Wnt, необходимых для созревания вилочковой железы. Внутриутробные аномалии развития и дефект миграции клеток НГ ответственны за развитие некоторых врожденных иммунодефицитов (типа синдрома DiGeorge).
Клетки НГ, расположенные между миотомами и спинальным отделом нервной трубки, были донорами клеток ганглиев периферической симпатической и парасимпатической нервной системы, проводящей системы и клапанов сердца, нейросекреторных клеток надпочечников, гладкомышечных клеток артерий, меланоцитов кожи, чувствительных нейронов спинного мозга, шванновских клеток. Сегментация НГ на отделы шла с помощью eph-лиганда и eph- рецепторов. Граница раздела сегментов НГ, как и в нервной трубке, проходила по бислою eph-R- eph-L клеток. Пересаженные клетки НГ от раннего зародыша перепела в мозг зародыша крысы мигрировали в кости и мышщы лицевого черепа, пока территории мозга не были поделены бислоями клеток содержащих пару eph-R-eph-L. Клетки зародыша перепела более поздних сроков развития мигрировали в сердце, вегетативные ганглии тонкого кишечника и кожу (меланоциты) крысы-реципиента.
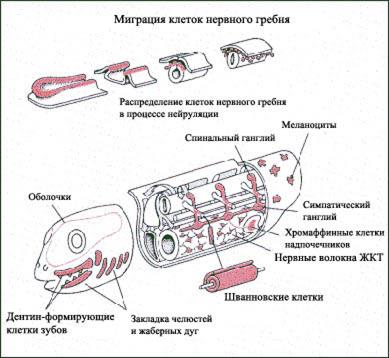
Рис 2-10. Миграция и распределение клеток нервного гребня
Экспрессированные гены AP-1, Wnt-1 Wnt-3 служили маркерами миграторных популяций НГ. Рост клонов НГ имел как признаки сходства, так и отличия от роста клонов НСК эктодермального происхождения. В отличие от суспензионных клонов НСК, большинство клонов НГ прикреплялось к подложке.
В середине эмбриогенеза нейроэпителиальная выстилка спинного мозга крысы сохраняла клоны провизорных клеток, из которых возникали как клоны НГ , так и суспензионные клоны НСК. Поэтому принято думать, что часть общих некоммитированных предшественников сохраняется в спинном мозге со стадии нервной трубки. В культуре только ВМР-2, ВМР-4 стимулировали образование клонов НГ из спинального нейроэпителия зародышей крыс. Не исключено, что высокое содержание ВМР-2, ВМР-4, генерируемое аортой, влияло на автономный нейрогенез цепочки симпатических ганглиев из мигрирующих клеток НГ. Автономный нейрогенез ганглиев из пришлых прогениторных популяций НГ имел место в сердце, лёгких, где локальная концентрация ВМР высока, как и в аорте.
Клетки НГ в клонах экспрессировали N-кадхерин и кадхерин-6. Мигрирующие прогениторные клетки, покидавшие клон, окрашивались кадхерином-7 и кадхерином-11. Мигрирующие клетки НГ отличались экспрессией нового класса сигнальных G-белков - Rho ГТФ-азы. Смена молекул адгезии на поверхности клеток НГ происходила с помощью экспрессии двух Нох-генов: Msx1 и Msx2 (Linecum J.M., Fannon A., Song K. et al., 1998). Региональное включение Msx-1 , Msx-2 опосредовало множество функций, в том числе закладку зубных зачатков и отростков верхнего нёба. Эти гены экспрессировались также в межфаланговой ткани конечностей, которая подвергалась апоптозу. В эпидермисе кожи, волосяных фолликулах гены Msx-1/Msx-2 контролировали численность клеток (число клеточных слоев) в ткани. Экспрессия кадхерина-11 связана с появлением нового белка внутри клеток - бета-катенина, медиатора сигналов через кадхерин-11. Появление бета-катенина подготавливало почву для включения генов семейства Wnt.
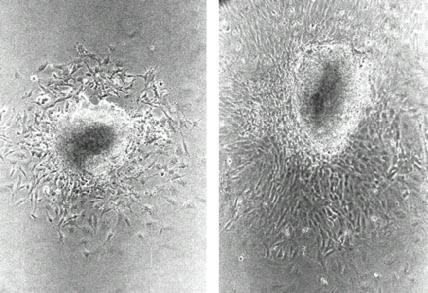
Рис 2-11 Фазово-контрастная микроскопия клеток НГ в культуре
Методом конечных разведений было доказано, что диссоциированные прогениторные клетки содержат клон-инициирующие клетки. Фенотипически идентичные промиграторные прогениторные клетки имели разную генетическую потенцию. Фенотипическая гетерогенность прогениторных клеток внутри клонов сочеталась с высокой пластичностью клеток, которая проявлялась при трансплантации.
Нейрогенез из плюрипотентных клеток НГ шел через ту же цепочку генов, что и нейрогенез из НСК нервной трубки: коэкспрессия Wnt-1/Wnt-3 необходима для экспансии прогениторных популяций. В ряде ситуаций в цепочку включался Mash1 (для некоторых специализированных линий в сочетании с нейрогенинами -Ngn1,Ngn2) (Ikeya M., Lee S.M., Jihnson J.E. et al., 1997). Комбинации TGF-beta, BMP-2, BMP-4, bFGF, EGF индуцировали дифференцировку прогениторных клеток НГ в сенсорные нейроны, нейроны вегетативных ганглиев, гладкомышечные клетки, клетки проводящей системы.
Phox2b запускал дифференцировку прогениторных клеток НГ в адренэргические нейроны ганглиев. Через последнюю транскриптазу активировалась экспрессия генов ферментативной цепи окисления тирозина в гидрокси - медиаторы. Точные комбинации сигналов для индукции моноспецифической дифференцировки не опубликованы в открытой печати. Клоны НГ, изолированные из головного мозга, имели максимальную потенцию к дифференцировке в нейроны. Клоны НГ, изолированные из ростральных отделов спинного мозга чаще всего дифференцировались в меланоциты.
В случае дифференцировки прогениторных клеток НГ в меланобласты у клеток формировался сложный комплекс рецепторов для длительной навигации. Во-первых, экспонировался рецептор с-kit для SCF. Мигрирующие предшественники меланоцитов вырабатывали SCF, который разрозненные клетки собирал в пласт . Часть клеток содержала два новых рецептора ( c-kit- рецептор тирозиновой киназы и рецептор эндотелина-3 одновременно) (Guo C., Wherle-Haller B., Rossi J. et al., 1997). Многие клетки экспрессировали рецептор для PDGF. Синхронно активировалась экспрессия Wnt1, Wnt3a, а также транскриптазы MITF, необходимых для включения цепочки генов синтеза меланина (Pou L., Panthier J.J., Arnheiter H., 2000). Трансгенные мыши с лишней дозой гена Wnt-1 имели гиперпигментацию кожи за счет увеличения численности меланоцитов. В прогениторных клетках НГ, мигрирующих в проводящую систему миокарда, активировалась транскриптаза HAND1 (Riley P.R., Gersenstein M., Dawson K. et al, 2000).
Подавляющая часть шванновских клеток периферической нервной системы возникала из стволовых клеток НГ. Сами резервы стволовых клеток для генерации новых шванновских клеток сохранялись в нервных волокнах, частично в спинном мозге. В эмбриогенезе первые предшественники олигодендроцитов в спинном мозге появлялись у зародышей человека 45 дня развития ( Rogister B., Ben-Hur T., Dubois-Dalcq M.,1999). Предшественники олигодендроцитов экспрессировали рецептор для PDGF. Характерен фокальный рост предшественников. Как in vitro , так и in vivo образование предшественников олигодендроцитов запускалось SHH. На первом этапе прогениторные клетки чаще созревали в астроглию, если в микроокружении преобладали следующие сигналы: PDGF, BMP-2/4, CNTF. Комбинация PDFG+ bFGF, или PDGF+GGF направляли рестрикционную пролиферацию прогениторных клеток в сторону олигодендроцитов. Переход к постмитотическому созреванию клеток связан с экспрессией р27 и р21 –ингибиторов циклин-зависимой киназы (Cdk). Механизм запуска миелинизации остается нерасшифровнным. Комбинация Т3 и IGF-1 запускала экспрессию генов белков миелина. Если активировался ген MBP (myelin basic protein) и PLP, то ингибировался ген Krox-24. Трансплантация предшественников олигодендроцитов в боковые желудочки резко увеличивала число донорских миелин+клеток в зонах демиелинизации мозга крыс. В отличие от НСК, предшественники олигодендроцитов более эффективно мигрировали по белому веществу и накапливались в участках демиелинизации ( Learish R.D., Brustle O., Zhang S.C. et al., 1999).
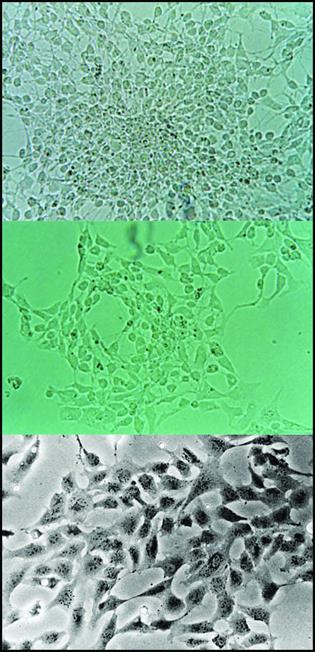
Рис 2-12. Преконфлуентная культура прикреплённых нейромезенхимальных клеток под фазовоконтрастным микроскопом.
Часть клонов удавалось многократно пассировать, причем клетки внутри сфер сохраняли : а) способность инициировать клонообразование, б) плюрипотентность (способность дифференцироваться в нейроны, глию, шванновские клетки, миофибробласты и даже хрящ. Обычно клоны НГ в культуре подвергались смешанной дифференцировке. Моно-дифференцировка клонов НГ в культуре в нейроны шла с помощью комбинации ВМР-2 и ВМР-4. ВМР индуцировал экспрессию Mash-1 в постмитотических клетках. Монодифференцировку клонов НГ в глию получали добавлением GGF (нейрегулина). Гладкомышечные клетки из прогениторных популяций НГ получали добавлением TGF-beta. Glial growth factor (GGF) - митоген и индуктор образования шванновских клеток - ингибировал дифференцировку прогениторных клеток НГ в нейроны. При пересадке клонов стволовых клеток НГ в мозг зародышей донорские клетки ограниченно дифференцировались в холинэргические нейроны как в головном мозге, так и на периферии (White P.M., Morrison S.J., Orimoto K. et al., 2001). Другие исследователи также отмечали ограниченную пластичность клонов НГ при их пересадке в мозг и другие ткани реципиента (по сравнению с клонами НСК, выделенных из перивентрикулярных отделов мозга) (Shah N.M., Anderson D.J., 1997). Исключение составляли стволовые клетки нейроэпителиальной выстилки спинного мозга, которые содержали предшественники ЦНС и клеток периферической нервной системы. В общей массе изолированных клеток встречались клоны, которые прокрашивались как на нестин, виментин, так и Р75 (Mujtaba T., Mayer-Proschel M., Rao M.S., 1998 ). Предполагается, что часть стволовых клеток спинальной части НГ мигрировала в нервную трубку. Поэтому потенции к регенерации спинного мозга выше, чем головного мозга за счет химеризации клетками нейромезенхимы.
Важно подчеркнуть, что потенции стволовых клеток НГ в генерации костно-хрящевых структур черепа, тимуса, щитовидной железы, ганглиев, проводящей системы сердца уникальны и не могут быть замещены другими фетальными клетками. Пересадки НСК эктодермального происхождения не в состоянии заменить функций прогениторных клеток НГ. Вторая важнейшая особенность прогениторных клеток НГ - это высокая скорость и плотность миграции клеток на рекордные расстояния. Уникальные возможности нейромезенхимальных клеток в плане направленной миграции в организме привлекают внимание медиков с целью репарации клеточных дефектов тимуса, уродств костно-мышечной системы лица, а также репарации проводящей системы сердца.
Поскольку периферическая часть нервной системы формирует значительное число адренэргических нейронов для симпатических ганглиев и коры надпочечников, актуальными остаются поиски " программ", эффективно управляющих монодифференцировкой постмитотических прогениторных клеток НГ. Практически каталогизирован список генов-участников : Ret, Phox2a, Phox2b, ген тирозингидроксилазы (Young H.M., Ciampoli D., Hsuan J. et al., 1999).
Наследственные дефекты миграции клеток НГ только начали изучаться. Например наследственная болезнь Ваарденбурга связана с дефектами пигментации кожных покровов и отсутствием вегетативных ганглиев в кишечнике на почве мутации рецептора к эндотелину-3 (Newgreen D.F., Murphy M., 2000 ). В настоящее время стволовые клетки НГ нашли новое неожиданное применение в лечении наследственной мышечной дистрофии, обусловленной дефектом гена дистрофина. Хорошо известно, что у пациентов с дистрофией Дюшенна избирательно поражаются мышцы конечностей, но не лица, глаз и гортани. Оказалось, что вся мышцы лица и шеи, возникшие из клеток НГ, синтезируют утрофин (эмбриональный дериват дистрофина) для функции. Поэтому все мышцы лица и шеи пациентов оcтаются неповрежденными. В настоящее время предпринимаются пересадки фетальных миобластов, лабораторно полученных из клеток НГ с целью реконструкции мышц пациента из донорских клеток, резистентных к заболеванию. (Black H., 2000). Для целей трансплантации получены первые бессмертные линии стволовых клеток НГ (Rao M.S., Anderson D.J., 1997).
Дата добавления: 2015-07-18 ; просмотров: 722 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
У всех позвоночных сразу за гаструляцией следует процесс нейруляции, который на самом деле может начинаться еще до завершения гаструляционных движений.
При нейруляции обширная зона дорзальной эктодермы, простирающаяся от переднего до заднего конца животного, утолщается и перемещается с поверхности внутрь зародыша, образуя закладку центральной нервной системы, тогда как окружающая ее эктодерма, стягиваясь со всех сторон, сходится на срединной дорзальной линии зародыша и сливается. Головной и спинной мозг представлены на этой стадии толстостенной трубкой. Между этой нервной трубкой и лежащей выше эпидермальной эктодермой находится тяж — клеток, называемый нервным гребнем. На более ранней стадии эти клетки образуют две полоски, отделяющие утолщенную нервную пластинку от окружающей ее эктодермы. Во время нейруляции морфогенетические движения соединяют эти полоски вместе. Само собой разумеется, что нервный гребень представляет собой часть эктодермы.
Нервный гребень — это временное скопление клеток, которое распадается вскоре после возникновения. Большинство клеток нервного гребня начинает мигрировать по направлению к вентральной стороне зародыша сразу после завершения нейруляции. Первые исследователи, применяя гистологические методы, без труда установили, что при нормальном развитии клетки нервного гребня участвуют в образовании спинных корешков головных и туловищных ганглиев, однако многие клетки нервного гребня ускользали от их внимания, поскольку они включаются в мезенхиму, из которой у зародышей позвоночных развивается своего рода рудиментарная соединительная ткань. Тем не менее некоторые исследователи предполагали, что клетки нервного гребня принимают участие в образовании тех частей хрящевого скелета головы, которые у позвоночных палеозоя были связаны, а у ныне живущий позвоночных связаны, с жаберными дугами и называются спланхнокраниумом. Тем эмбриологам, которые считали, что все ткани скелета происходят из мезодермы, это предположение представлялось ошибочным. Противоречивость взглядов явилась одной из причин интенсивного изучения судьбы нервного гребня, особенно у амфибий. В результате было получено много убедительных данных о его развитии, однако и до настоящего времени некоторые вопросы остаются еще без ответа.
У некоторых амфибий эктодермальные клетки в определенный период четко отличаются от мезодермальных и энтодермальных клеток тем, что в них присутствуют пигментные гранулы, ранее придававшие анимальному полушарию яйца характерный вид. В связи с этим на неокрашенных или слабо окрашенных срезах зародышей на стадиях после завершения нейруляции можно проследить миграцию клеток нервного гребня. Эти наблюдения, дополненные исследованиями с применением прижизненных красителей, не оставляют сомнений в том, что клетки нервного гребня участвуют в образовании скелета головы. Однако этими способами распознавания клеток нервного гребня можно пользоваться только на самых ранних стадиях развития, и ни один из них не дает нам полной уверенности в том, что отдельные клетки нервного гребня идентифицированы правильно, если они перемешаны с клетками другого происхождения. Опыты по пересадке клеток с ядрами, меченными 3 Н-тимидином, так же как и опыты по межвидовым пересадкам клеток нервного гребня, дали дополнительные сведения о судьбе этих клеток. Стало ясно, что нервный гребень дает начало многим тканям; из его производных развиваются шванновские клетки, которые образуют миелиновую оболочку периферических нервных волокон, клетки соединительной ткани хвостового плавника у личинок амфибий, важные элементы симпатической нервной системы и мозгового вещества надпочечников. Если у зародыша удалить определенный участок нервного гребня, то на более поздних стадиях развития у такого зародыша в соответствующем участке не разовьются хроматофоры. Поведение клеток нервного гребня при культивировании их in vitro также показывает, что хроматофоры образуются именно из них.
Все клетки ранних зародышей амфибий содержат некоторое количество желтка. Пока этот запас не израсходуется, клетки можно культивировать в простых солевых растворах без добавления органических питательных веществ. В таких условиях у части клеток нервного гребня развиваются отростки, а цитоплазма заполняется меланином. Эти клетки весьма сходны с меланоцитами, которые придают коричневую или черную окраску коже многих позвоночных. Таким образом, подтверждаются данные экспериментов по удалению участков нервного гребня, и мы можем с уверенностью сказать, что именно из клеток нервного гребня образуются меланоциты. Однако эксперименты, в которых после полного удаления нервного гребня в области головы и хвоста появляются, хотя и с опозданием, многочисленные меланоциты, показывают, что меланоциты образуются не только из клеток нервного гребня, но, вероятно, также из клеток, мигрирующих из нервной трубки. Имеет ли место такое явление при нормальном развитии, остается пока не вполне ясным.
Нервный гребень интересен во многих отношениях. Ни сам гребень, ни его производные не обнаружены у современных представителей родственных позвоночным бесчерепных хордовых Branchiostoma и асцидий, хотя их раннее зародышевое развитие во многом сходно с развитием позвоночных. По-видимому, нервный гребень — приобретение самых первых черепных позвоночных. Парадоксально, что эти данные разрушают старые представления о том, что определенные виды тканей происходят только из определенных зародышевых листков, и одновременно порождают такие же мысли, но в менее категоричной форме.
Эволюционная история древних позвоночных, восстановленная частично по остаткам ископаемых животных, а частично по данным сравнительной анатомии ныне живущих форм, свидетельствует о том, что по мере того, как у животных увеличивался рот, элементы, которые ранее поддерживали передние жабры, начинали функционировать как челюсти. То, что хрящи жаберных дуг и хрящи челюстей у ныне живущих амфибий имеют общее происхождение — и те и другие развиваются из нервного гребня, — подтверждает эту точку зрения. Такое же происхождение имеют два маленьких палочковидных хряща (трабекулы), лежащие под передним мозгом. Это еще раз убедительно свидетельствует о том, что ранее существовали позвоночные животные с жаберной щелью, находившейся перед той щелью, которая у современных акул является первой. Вероятно, трабекулы представляют собой сместившиеся остатки скелета этой пары жабр, которые у ныне живущих позвоночных принимают участие в формировании эмбриональной черепной коробки.
Нервный гребень вызывает также и более непосредственный интерес. Меланоциты, происходящие из нервного гребня, распознать очень легко (их отличие от других клеток отражено в самом названии), а поэтому их распространение в коже, особенно у амфибий, можно изучать in vivo. Даже в том случае, если бы меланоциты всегда распределялись равномерно по поверхности тела животного, вопросы, возникающие в связи с этим, казались бы весьма заманчивыми. Что побуждает клетки мигрировать? Является ли движение клеток случайным или оно заранее предопределено? Что заставляет клетки прекращать миграцию? Однако их распределение не всегда равномерно; у некоторых видов они собираются группами, определяя своеобразный узор окраски животного. А это ставит перед нами новые вопросы, ответить на которые еще более сложно.
Если, например, будущие меланоциты способны взаимно отталкиваться друг от друга, то они будут двигаться до тех пор, пока не распределятся в поверхностном слое зародыша почти равномерно, и затем остановятся. Есть данные о том, что они и в самом деле ведут себя подобным образом in vitro. Если, кроме того, в одних тканях скорость движения меланоцйтов уменьшается, а в других нет, то естественно, что меланоциты будут задерживаться и концентрироваться там, где их движение замедлено. В пользу существования такого механизма свидетельствуют некоторые данные. Исследование нервного гребня послужило важным стимулом к развитию целого направления в цитологии, занимающегося изучением причин клеточных перемещений или причин отсутствия таких перемещений.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Нейруляция – образование осевых органов хорды и саммитов. Над энтодермой находится хордальный и мезодермальный материал, выше – нервная пластинка и эпидермальная эктодерма. Хордальный материал индуцирует материал эктодермы, лежащий над хордой, заставляя его утолщаться и превращаться в нервную пластинку. Нервная пластинка образует нервные валики, которые затем образуют нервную трубку. Передняя часть нервной трубки → головной мозг, туловищная → спинной мозг, а его полость – спинномозговой канал.
На переднем конце возникают локальные вздутия, образующие три мозговых пузыря – передний, средний и задний мозг. Далее передние и задние мозговые пузыри подразделяются на два вторичных мозговых пузыря, → возникает 5 сообщающихся между собой мозговых пузырей: конечный, промежуточный, средний, задний, добавочный (на 2 неделе).
Из нервной трубки образуются нейроциты и нейроглия головного и спинного мозга, сетчатка глаза и органы обоняния.
Из нервного гребня образуются нейроны клеток глии сенсорной симпатической и парасимпатической нервной системы, мозговое вещество надпочечников, пигментные клетки эпидермиса, скелетные и соединительно-тканные компоненты головы.
По мере того, как концы энтодермы загибаются в вентральном направлении и перемещаются к центру зародыша, формируется передняя кишка и задняя кишка, представляющие собой части будущей пищевой трубки. На месте будущего ротового отверстия образуется эктодермальное углубление – стомодэум. Эктодермальный эпителий крыши ротовой пластинки образует выступ – карман Ратхе, который растет на встречу нейральному выросту дна зачатка промежуточного мозга. Эти два эктодермальных зачатка взаимодействуют друг с другом и вместе образуют гипофиз. Их кармана Ратхе развивается железистая часть гипофиза, из воронки – его нервная часть.
18. Производные сомитов, спланхнотомов. Мезенхима.
Мезодерма (мезенхимные клетки) дифференцируются в мышцы, обеспечивают перистальтику. Производные мезодермы: скелетные мышцы, сердце, кровеносные сосуды, мочеполовая система.
Мезодерма: саммиты, спланхнотомы, нефрогонотомы. Внутри них образуются зачатки будущих полостей тела, → клеточный материал спланхнотомов делится на 2 листка: наружный париетальный и внутренний висцеральный. Из париетального листка спланхнотомов развивается гладкая мышечная ткань кишечника. Из висцерального – образуются мускульные волокна стенок кровеносных сосудов, а также мышцы сердца. Сначала сердце имеет вид полой однокамерной трубки. Задолго до полного сформирования их камер еще, прежде чем сформировались периферические сосуды, начинается ритмическая пульсация сердца. Участки спланхнотомов, находящиеся рядом с саммитами, развиваются нефрогонотомы (мочеполовая система). При образовании мезонефроса (еще есть пронефрос, метанефрос) устанавливается непосредственная связь почечных канальцев с кровеносной системой. На поверхности первичных почек образуются небольшие половые валики, из которых образуются гонады (♀ и ♂). К первично-половым гонадам мигрируют зачатки первично-половых клеток из желточного мешка. Клетки железы пересыпаны этими первично-половыми клетками являются источниками для развития спермиев и яиц. Клетки гонад дифференцируются: клетки Сертоли, фаликулярные клетки. Производные спланхнотомов: сердечнососудистая система, гладкая мышечная ткань, лимфатическая, выделительная системы, ♀ и ♂ гонады.
Производные саммитов: дерматом (дерма кожи), миатом (поперечнополосатая мышечная ткань), склератом (скелет).
Мезенхима — эмбриональный зачаток, служащий источником развития соединительной ткани, крови, скелета и гладкой мышечной ткани. Мезенхима состоит из рыхло лежащих клеток с отростками и межклеточной жидкости, располагающихся в первичной полости тела в промежутках между зародышевыми листками.
У позвоночных мезенхима возникает из сомитов в местах разрыхления их участков — дерматомов и склеротомов, а также в результате выселения клеток из висцерального и париетального листков спланхнотомов. Происходящая из дерматомов мезенхима дифференцируется в соединительнотканную основу кожи (собственно кожу, или дерму). Склеротомы дают начало скелетогенной мезенхимы, дифференцирующейся в хрящевую и костную ткани. Выселяющиеся из спланхнотомов клетки мезенхимы образуют соединительную ткань, кровеносные и лимфатические сосуды, клетки крови и лимфы, гладкую мышечную ткань внутренностей. Таким образом, мезенхима в целом является у позвоночных зачатком всей обширной группы тканей внутренней среды. Развивающаяся из нее же, гладкая мышечная ткань по многим свойствам ближе к соединительной ткани, чем к скелетно-мышечной. У позвоночных и у человека некоторая часть мезенхимы образуется не из мезодермы, а из нейроэктодермального зачатка, а именно нервного гребня, или ганглиозной пластинки (эктомезенхима, или нейромезенхима). Из нее возникают хроматофоры (пигментные клетки), некоторые хрящи гортани, возможно пульпа зубов и клетки — образователи дентина (одонтобласты).
Производные энтодермы.
Из энтодермы образуется первичная кишка. → Пищеварительная, дыхательная системы, железы.
Энтодермальная часть пищевой трубки начинается в глотке, здесь у зародыша млекопитающих образуется 4 пары глоточных карманов: 1 пара – слуховые полости среднего уха, евстахиевы трубы. 2 пара – стенки миндалин. 3 – тимус. 3 и 4 – паращитовидные железы. Между 2 парой глоточных карманов формируются дивертикулы щитовидной железы, которые мигрируют в область шеи.
Позади глотки пищеварительная трубка сужается, переходя в пищевод, за которым следует желудок, тонкий кишечник и толстый кишечник. Энтодермальные клетки образуют только выстилку пищеварительной трубки и ее желез.
Энтодерма образует выстилку 3-х дополнительных органов: печеночный дивертикул (вырост), поджелудочная железа (слияние четко выражено дорзального и вентрального дивертикулов).
Легкие являются производными пищеварительной трубки, в центре задней области глотки появляется ларинготрахеальная борозда, которая дает две главные ветви, образующие легкие – эволюционное новшество, последними из органов млекопитающих завершают свою дифференцировку. Для созревания легких альвеолярные клетки секретируют ПАВ – сурфактант, не дает слипаться альвеолам.
20. Внезародышевые образования.
В процессе эмбриогенеза человека формируются следующие внезародышевые органы: амнион, желточный мешок, аллантоис, хорион и плацента. В их образовании участвуют все три зародышевых листка, а также ткани материнского организма (материнская часть плаценты).
Трофобласт. В результате первого деления дробления зиготы формируются неравнозначные бластомеры. В частности, мелкие светлые бластомеры активно пролиферируют и сравнительно быстро создают для темных бластомеров внешнее покрытие, именуемое трофэктодермой бластоцисты. Последняя является источником развития трофобласта, который возникает в процессе взаимодействия зародыша со слизистой оболочкой матки. Трофэктодерма из одного слоя клеток превращается в трофобласт. Наружная его часть преобразуется в симпласт (симпластотрофобласт) — в этой части исчезают межклеточные границы, и ядра клеток оказываются в общей симпластической плазме. Внутренняя часть трофобласта сохраняет клеточное строение, в связи с чем называется цитотрофобластом (или слоем Лангганса). Цито- и симпластотрофобласт структурно и метаболически связаны и совместно с мезенхимой формируют ворсинки хориона, создавая для них внешнее клеточно-симпластическое покрытие. Трофобласт обеспечивает имплантацию зародыша и формирование важнейшего внезародышевого (провизорного) органа — плаценты. Имплантация зародыша активизирует пролиферативные и миграционные процессы в эмбриобласте. Это приводит к развитию других внезародышевых органов — амниона, желточного мешка, аллантоиса и хориона (в период с 7-х по 14-е сутки эмбриогенеза).
Амнион (водная, амниотическая оболочка), представляет собой полый орган (мешок), заполненный жидкостью (околоплодными водами), в которой находится и развивается зародыш. Основная функция амниона — выработка околоплодных вод, которые обеспечивают оптимальную среду для развития зародыша и предохраняют его от высыхания и механических воздействий. Амнион возникает из материала эпибласта путем образования в его толще полости — амниотического пузырька. В процессе развития эпителий амниона (сначала однослойный плоский) на 3-м месяце эмбриогенеза преобразуется в призматический. Располагается эпителий на базальной мембране, под которой находится более плотный слой соединительной ткани. Далее располагается губчатый слой рыхлой волокнистой соединительной ткани, пространственно связанный со стромой гладкого и ворсинчатого хориона. Эпителиоциты амниона обладают секреторной (в плацентарной части) и всасывающей (во внеплацентарной части) активностью. Амниотическая жидкость постоянно обменивается, имеет сложный химический состав, изменяющийся в ходе развития плода. Помимо указанных выше функций, амниотическая жидкость имеет важное значение для формообразовательных процессов — развития ротовой и носовой полостей, органов дыхания, пищеварения. Количество вод с течением беременности увеличивается и к родам достигает 0,5-1,5 л, коррелируя с длиной и массой плода и сроком беременности. В околоплодных водах могут определяться клетки эпидермиса, эпителия ротовой полости и вагинального эпителия плода, эпителия пуповины и амниона, продукты секреции сальных желез, пушковые волосы. Желточный мешок у человека (пупочный, или пуповинный пузырек) — рудиментарное образование, утратившее функцию вместилища питательных веществ. До 7-8-й недели эмбриогенеза основная его функция — кроветворная. Кроме того, в стенке желточного мешка появляются первичные половые клетки — гонобласты, которые мигрируют в него из области первичной полоски. Источниками развития тканей желточного мешка являются внезародышевая энтодерма и внезародышевая мезенхима. Стенка желточного мешка выстлана желточным эпителием — особым подтипом эпителия кишечного типа. Эпителий состоит из одного слоя кубических или плоских клеток энтодермального происхождения со светлой цитоплазмой и круглыми интенсивно красящимися ядрами. После формирования туловищной складки желточный мешок связывается с полостью средней кишки посредством желточного стебелька. Позднее желточный мешок обнаруживается в составе пупочного канатика в виде узкой трубочки.
Пупочный канатик образуется в основном из мезенхимы, находящейся в амниотической ножке и желточном стебельке. В его формировании принимают участие также аллантоис и растущие по нему сосуды. С поверхности все эти образования окружены амниотической оболочкой. Желточный стебелек и аллантоис быстро редуцируются, и в пупочном канатике новорожденного обнаруживаются лишь их остатки. Сформированный пупочный канатик — упругое соединительно-тканное образование, в котором проходят две пупочные артерии и пупочная вена. Он образован типичной студенистой (слизистой) тканью, в которой содержится огромное количество гиалуроновой кислоты. Именно эта ткань, получившая название вартонова студня, обеспечивает тургор и упругость канатика. Покрывающая поверхность канатика амниотическая оболочка срастается с его студенистой тканью. Значение этой ткани чрезвычайно велико. Она предохраняет пупочные сосуды от сжатия, обеспечивая тем самым непрерывное снабжение эмбриона питательными веществами, кислородом. Наряду с этим студенистая ткань препятствует проникновению вредоносных агентов из плаценты к эмбриону внесосудистым путем и выполняет, таким образом, защитную функцию.
Аллантоис представляет собой небольшой пальцевидный отросток энтодермы, врастающий в амниотическую ножку. У человека аллантоис не достигает большого развития, но его значение в обеспечении питания и дыхания зародыша всё же велико, так как по нему к хориону растут сосуды, конечные разветвления которых залегают в строме ворсин. На 2-м месяце эмбриогенеза аллантоис редуцируется.
Хорион. Ворсинчатые разрастания трофобласта, именуемые позднее хорионом, состоят из двух структурных компонентов — эпителия и внезародышевой мезенхимы. Слизистая оболочка в той части, которая после имплантации войдет в состав плаценты — основная отпадающая оболочка, разрастается сильнее, чем в других участках — пристеночная отпадающая оболочка и сумочная отпадающая оболочка, отделяющая зародыш от полости матки. В дальнейшем это различие выступает все более отчетливо, причем ворсины в области пристеночной и сумочной оболочек вообще исчезают, а в области основной отпадающей оболочки заменяются сильно разветвленными вторичными ворсинами, строму которых образует соединительная ткань с кровеносными сосудами. С этого момента хорион разделяется на два отдела — ветвистый и гладкий. В области расположения ветвистого хориона формируется плацента. За счет основной отпадающей оболочки образуется материнская часть плаценты, а за счет ветвистого хориона — ее плодная часть. Ветвистый хорион к 3 месяцам приобретает вместе с основной отпадающей оболочкой типичную для сформированной плаценты дискоидальную форму.
Последнее изменение этой страницы: 2016-08-06; Нарушение авторского права страницы
Читайте также:


