Тучные клетки нервная система
Регуляция функций тучных клеток
При выраженных и разнообразных регуляторных влияниях тучных клеток (ТК), естественно, что, в свою очередь, они также находятся под регуляторными влияниями других клеток и цитокинов.
На всех этапах созревания ТК, включая и зрелые формы, важнейшую роль в их дифференцировке и функционировании играет SCF, рецепторы для которого (c-kit), как отмечалось выше, ТК сохраняют на протяжении всего периода жизни и который является не только фактором дифференцировки ТК, но их фактором роста, а также хемоаттрактантом.
Синергизм с SCF в регуляции тучных клеток человека проявляет IL-4 (действие этого инерлейкина на ТК дозозависимо), усиливающий выделение гистамина, лейкотриена С4, IL-5; предполагается, что IL-4 участвует в сохранении способности ТК ткани к пролиферации.
Несмотря на то что IL-4 — потентный плейотропный цитокин, активирующий клетки, его действие на ТК при определенных условиях проявляется усилением гибели клеток — процесс, который на молекулярном уровне осуществляется с включением генов, регулирующих STAT-6.
Существенная роль в регуляции тучных клеток принадлежит интерферонам, дифференцированно регулирующим выделение гистамина из ТК в зависимости от локализации. Например, предобработка перитонеальных ТК IFNа/в или IFNye большой степени снижала антигенстимулированное выделение гистамина без влияния на ТК интерстициальной оболочки.
Значительное место в регуляции активности тучных клеток принадлежит также IL-1 и IL-6. IL-1а стимулирует рост ТК с включением механизма, зависимого от фибробластов, и взаимодействие с SCF/c-kit в этом процессе может иметь решающее значение. IL-1 усиливает регуляцию выделения многих цитокинов, которые продуцируются ТК.
IL-6 стимулирует адгезию ТК к экстрацеллюлярному матриксу и таким образом способствует их накоплению в участках воспаления, усиливая экспрессию интегринов, в то время как TNFa, IFNa и IFNy тормозят этот процесс.
В регуляторных влияниях IL-6 существенное значение имеют эффекты IL-10, который ингибирует выделение IL-6, а степень этой ингибиции зависит от особенности стимула, имеет важное значение для регуляции тучных клеток при воспалительных процессах, зависимых от IL-6; как ростовой фактор ТК действует IL-10, и эта его способность в комплексе с IL-3 и IL-4 весьма существенна для регуляции, так как ТК человека являются активным источником IL-6.
Свойствами хемоаттрактантов ТК обладают IL-3, TNF, анафилотоксины С3а, С5а, а также фактор роста нервов.
К активным регуляторам тучных клеток относится и мономерный IgE после его связывания с FceRI, что сопровождается усилением роста, выживаемостью и супрессией апоптоза ТК без усиления синтеза ДНК; указанный антиапоптотический эффект требует постоянного наличия IgE, происходит без участия Fas/FasL или молекул семейства Bel, очевидно, с включением еще неизвестных механизмов.
Результатом связывания IgE с FceRI ТК является и секреция продуктов с иммунорегуляторными эффектами, многие из которых способны осуществлять регуляцию аутокринным путем Этот важный механизм регуляции, как отмечают авторы, характерен также для базофилов, он может осуществляться как прямо, так и опосредованно.
Современный уровень исследований позволил установить, что для цитокинозависимой экспрессии FceRI необходима последовательная стимуляция белка активации (АР-1), а также активность регуляторной киназы-1/2 (ERK-1/2) и протеинкиназы С.
Некоторые лейкоциты, в частности лимфоциты, моноциты, а также тромбоциты, выделяют фактор, способствующий высвобождению гистамина (histamine rellising factor — HRF). Указанный фактор относится к семейству хемокинов и содержит несколько компонентов с хемотаксической активностью.
Под его влиянием, согласно последним данным, происходит IgE-независимое выделение гистамина ТК и базофилами, усиливается экспрессия IL-1 и IL-6 В-лимфоцитами.
Тучные клетки и нервная система
Рассматривая биологическое значение тучных клеток, нельзя обойти вниманием еще один очень существенный вопрос. Речь идет о взаимоотношении ТК и клеток нервной системы. Как известно, функционирование всех клеток системы иммунитета зависит от нейроиммунологических взаимодействий; многие из них продуцируют цитокины, которые влияют на нервные клетки, а ТК являются одним из наиболее активных участников этого взаимодействия. Такое заключение базируется на следующих объективных фактах.
Первое, многие цитокины и медиаторы, продуцируемые ТК, особенно гистамин, GM-CSF, IL-8, IL-13, лейкемический ингибиторный фактор (LIF), влияют на рост и дифференцировку нервных клеток. В связи с тем, что количество LIF резко увеличивается при повреждении тканей, в частности нервной, и при образовании нейром, он получил еще одно название — фактор травмы.
Второе, ряд факторов, продуцируемьгх клетками нервной системы, модулируют функции ТК; к ним относятся некоторые нейропептиды, в частности субстанция Р, нейротонин и др.
Все перечисленные разнообразные факторы тучных клеток и нервных клеток создают своеобразную уникальную систему взаимодействия, значение которой в функционировании как иммунологической, так и нервной системы нельзя недооценивать.
Действие факторов, продуцируемых ТК, на нервные клетки разнообразно. Так, LIF — полипотентный цитокин, регулирует воспаление и иммунологический ответ, играет роль в развитии нейронов, гемопоэзе, метаболизме мозга и острофазного ответа; продукция этого фактора усиливается под влиянием стимуляторов ТК.
Далее, если IL-6 индуцирует рост нервных клеток, то TNFa способствует их повреждению.
Особое место во взаимодействии между тучными клетками и нервной системой занимают фактор роста нервных клеток (NGF) и гистамин, которые проявляют выраженную биологическую активность как в отношении ТК, так и нервных клеток, так как, во-первых, рецепторы к ним экспрессируют ТК и нервные клетки, а Н3-рецептор впервые был идентифицирован именно на нервных клетках J. Arrang в 1983 г., во-вторых, NGF продуцируется тучными клетками, эозинофилами и некоторыми лимфоцитами, а гистамин — ТК, нервными клетками, эозинофилами, базофилами.
NGF несет ответственность за выживаемость нейронов, а его концентрация увеличивается в участках воспаления параллельно с увеличением количества ТК; этот фактор влияет на дифференцировку, хемотаксис и выделение медиаторов преимущественно клетками воспаления, и поэтому рассматривается как модулятор воспаления и ремоделирования ткани, предполагается его участие в контроле за адренокортикоидной активностью.
Одной из важных особенностей NGF является то, что он проявляет себя как фактор дифференцировки ТК, влияет на их выживаемость и функционирование, защищает от апоптоза, увеличивает их количество in vivo, индуцирует продукцию ПГЕ2, а в низких дозах — продукцию LIF, не влияя на пролиферативную активность тучных клеток. Согласно имеющемуся представлению, локально продуцируемый NGF может играть важную роль в накоплении ТК при различных патологических процессах.
Совсем недавно стало известно, что наряду с NGF ТК продуцируют нейротрофины, в частности нейротрофин-4, который так же, как и NGF, играет важную роль в патофизиологии воспалительных заболеваний. Интерес к изучению NGF и его роли в нейроиммунологических взаимоотношениях показал, что ТК могут быть одной из наиболее важных клеточных популяций, отвечающих за это взаимодействие.
Более того, было показано, что NGF несет ответственность за увеличение количества тучных клеток, но не за пролиферацию и гипертрофию нервных клеток. Несмотря на то что эти данные получены при изучении локального воспалительного процесса (аппендикс), можно допустить экстраполяцию действия NGF на ТК и при других воспалительных процессах.
Сведения о NGF позволяют заключить, что он является ключевым фактором выживаемости ТК соединительной ткани и очень важным компонентом взаимоотношений между нервной, иммунной и эндокринной системами.
Подобно различным продуктам ТК, продукты нервных клеток также по-разному влияют на функции тучных клеток. Однако характер их влияния зависит от локализации ТК. Например, нейротонин индуцирует гиперплазию ТК соединительной ткани, но его эффект на тучные клетки кожи значительно меньше.
Гистамин, так же, как и NGF, продуцируется ТК и нервными клетками.
Что касается продукции гистамина, а также TNFa, то ТК практически не имеют конкурентов как самый мощный источник этих цитокинов. Если же принять во внимание тот факт, что большое количество клеток системы иммунитета и нервных клеток экспрессирует рецепторы для гистамина, то не будет ошибочным вывод о том, что гистамин является очень важным связующим звеном во взаимоотношениях нервной и иммунной систем.
Поэтому не случайно именно воздействуя на рецепторы гистамина с помощью различных фармакологических средств возможна модуляция функций соответствующих клеток как нервной, так и иммунной системы.
На рис. 42 схематически изображено взаимодействие тучных клеток и нервных клеток.

Рис. 42. Взаимодействие тучных и нервных клеток
Участие во врожденном и приобретенном иммунитете, ремоделирование тканей
Современные представления о физиологической роли ТК свидетельствуют об их участии во врожденном и приобретенном иммунитете. Эта роль прежде всего проявляется в защите против различных бактерий и вирусов, что убедительно доказано во многих экспериментах на животных.
Данное направление исследований является сравнительно новым, имеющиеся факты получены преимущественно в опытах на мышах, что оправдывает точку зрения отдельных авторов о необходимости получения столь же убедителных доказательств и в отношении ТК человека.
Для участия во врожденном и приобретенном иммунитете тучных клеток располагают достаточно большими возможностями. Прежде всего это связано с их способностью осуществлять презентацию антигена.
Еще в начале 1980-х годов было отмечено, что после фагоцитирования антигена в ТК либо образуется прочный комплекс антигена с гранулами ТК и последующим его выделением при дегрануляции, либо после пиноцитоза антиген сохраняется в ТК.
Установление этого факта имело очень важное значение, так как позволяло рассматривать тучные клетки в качестве дополнительного депо антигена. Такая способность к длительному сохранению антигена с последующим его выделением создавала условия для длительной антигенной стимуляции. В дальнейшем, когда было показано, что ТК связывают маннозоспецифический лектин, который экспрессируется энтеробактериями, фагоцитирует их и убивает, было сделано обоснованное предположение, что ТК способны осуществлять процессинг и представлять антиген.
Вскоре появились доказательства того, что презентация антигена (бактерий) сопровождается экспрессией В7.1, В7.2, HLA-DR, НLA-DP, HLA-DQ. Уже в текущем столетии на примере изучения ТК костного мозга и перитонеального экссудата, которые экспрессируют антигены II класса главного комплекса гистосовместимости (ГКГ), было доказано, что тучные клетки представляют антигенные пептиды СD4+Т-лимфоцитам.
Эта исключительно важная способность ТК обеспечивается и наличием в них внутриклеточных компартментов, где и осуществляется процессинг. Очень важно подчеркнуть, что процесс презентации происходит с участием FceRI или FcyRI; его молекулярную основу составляют активация Р1-3 киназы, ослабление фосфорилирования и индукция внутриклеточных сигналов, необходимых для презентации.
Весьма интересен факт, полученный при изучении презентации аллергенов моноцитами, согласно которому презентация при участии FceRI (взаимодействие с антигенспецифическими антителами) на 100-1000 порядков превышает эффективность презентации при участии FcyRI.
К сожалению, вопрос о способности ТК к презентации опухолевых антигенов еще не стал предметом исследований, несмотря на то что доказательства такой возможности очень важны прежде всего с позиций регуляции противоопухолевой защиты при массивном скоплении ТК в участках развития злокачественного процесса (речь идет прежде всего об эпителиальных опухолях ротовой полости, дыхательных путей, желудочно-кишечного тракта, а также кожи).
Как выяснилось в последние годы, тучных клеток экспрессируют рецепторы, которые могут взаимодействовать с бактериями и грибками. К ним относятся гликопротеин CD48 и TOLL-подобные рецепторы. CD48 ТК взаимодействуют с бактериальной адгезивной молекулой (FimH), которую экспрессируют некоторые бактерии.
Механизмы регуляции этого взаимодействия в настоящее время до конца неизвестны, но показано, что комплемент, CD11b, CD18 и Jak2-тирозинкиназа играют роль в участии ТК во врожденном иммунитете.
TOLL-like-подобные рецепторы, в частности TLR2 и TLR4, активируют ТК человека. Первые доказательства этого были получены при изучении их ответа (использовали различные стимулы) на некоторые бактерии и продукты их жизнедеятельности.
В результате совсем недавно было показано, что указанные рецепторы дифференцированно реагируют на различные стимулы и процесс взаимодействия рецепторов с бактериями происходит с выделением не только TNFa, но и IL-5, IL-10 и IL-13. Представления по этому вопросу расширяются: стал известен еще один тип рецепторов — TLR6 и выявлены некоторые закономерности молекулярных основ их активации.
Показана и роль тучных клеток в борьбе не только с бактериальными, но и с вирусными инфекциями. В частности, в борьбе с вирусными инфекциями очень важную роль играют такие традиционные медиаторы ТК, как лейкотриены, гистамин, протеазы, а также цитокины и хемокины, которые могут появляться независимо от классического пути дегрануляции ТК.
В настоящее время ответ ТК на бактериальные и вирусные инфекции изучен еще не в полной мере. Тем не менее уже сейчас нельзя не согласиться с J. Marshall: понимание уникальных особенностей тучных клеток тканей и их цитокинового ответа на действие патогенов, а также продуктов их жизнедеятельности имеет важное значение при терапевтических воздействиях на локальный иммунологический ответ.
Рассматривая положительную роль ТК во врожденном и приобретенном иммунитете, нельзя не принимать во внимание и возможность негативной роли ТК. В частности, не исключена ситуация, при которой ТК фагоцитируют микроорганизмы, но не убивают их.
В результате тучные клетки становятся не только источником патогенов, но и токсинов, которые последние выделяют, и могут прерывать продукцию цитокинов. К сожалению, механизмы выживаемости микроорганизмов в ТК еще неизвестны, и можно лишь предположить, что это обусловлено наличием каких-то дефектов внутриклеточных систем ТК.
Выше упоминалось, что ТК принимают участие в ремоделировании тканей. В последние годы информация по этому вопросу значительно расширилась и есть основания полагать, что понятие "ремоделирование" следует понимать как различные формы участия тучных клеток в обеспечении тканевого гомеостаза как в норме, так и при патологии.
Основными компонентами процесса ремоделирования являются продукты ТК, среди которых в первую очередь следует отметить матриксные металлопротеиназы, гистамин, TNFa. Значение матриксных протеиназ определяется не только их непосредственным действием, но и включением во взаимодействие с другими компонентами регуляции в ответ на изменение внешней среды. Сериновые протеазы с трипсиноподобным эффектом (триптаза), а также химотрофинподобные (химаза) включаются в ответ на инфекцию.
Матриксные металлопротеиназы играют большую роль в ремоделировании эндометрия матки в период нормального менструального цикла и рассматриваются как ключевой фермент этого процесса.
Очень существенна роль ТК и продуктов их дегрануляции в заживлении кожи, что показано в опытах на кошках и собаках, когда избыток или дефицит продукции дегрануляции ТК замедляет процесс заживления ран и образования грануляций.
Обсуждается и роль тучных клеток, в частности гистамина и цитокинов, выделение которых они индуцируют на ранних этапах беременности.
Наряду с ремоделирующими эффектами, которые осуществляются ТК, при указанных выше физиологических состояниях, а также повреждении появились данные об их важной роли и при таких патологических процессах, как атеросклероз. Так, в 2003 г. опубликовано первое сообщение о том, что ТК могут влиять на течение атеросклероза, в частности на состояние атеросклеротических бляшек.
Подтверждением этому являются данные о том, что в участках бляшек ТК дегранулируются, этот процесс сопровождается выделением TNFa, снижением экспрессии Bel, апоптозом большинства эндотелиальных клеток; TNFa вызывает эрозию и разрушение атеросклеротических бляшек с включением апоптоза смежных эндотелиальных клеток.
Аналогичные результаты были получены и другими авторами, показавшими, что в атеросклеротических бляшках находится, как минимум, один клон тучных клеток, выделяющих и продукты гранул, и растворимый TNFa, которые могут быть необходимы для эрозии атеросклеротических бляшек путем апоптоза эндотелиальных клеток. Несмотря на то что этот механизм описан в отношении атеросклеротических бляшек, его изучение при опухолевом процессе также может представлять несомненный интерес.
Можно полагать, что широкие возможности ТК в поддержании тканевого и иммунологического гомеостаза в норме и при патологии обеспечиваются их способностью опосредовать комплекс механизмов, включающих нервные и эндокринные пути регуляции.
Рис. 43 и табл. 7 обобщают сведения об участии ТК в поддержании тканевого и иммунологического гомеостаза.

Рис. 43. Основные функции тучных клеток
Таблица 7. Общая характеристика тучных клеток 

Описанные в 1878 году Паулем Эрлихом тучные клетки в основном рассматривались как эффекторы аллергии. Но в последние два десятилетия они получили широкое признание благодаря участию во многих физиологических и патологических процессах. Универсальные эффекторные клетки иммунной системы способствуют как врожденному, так и адаптивному иммунитету к патогенам, но также оказывают пагубное действие в контексте воспалительных заболеваний.
Тучные клетки: основное понятие в иммунологии, строение и где они находятся?
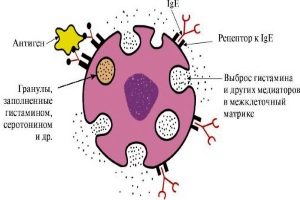
Тучные клетки, известные как мастоциты/лаброциты или тканевые базофилы, являются иммунными клетками миелоидной линии и присутствуют в соединительных тканях по всему телу.
Хотя мастоциты были впервые описаны более века назад, их происхождение оставалось спорным в течение нескольких десятилетий. Из-за их связи с соединительной тканью изначально предполагалось, что они были получены из недифференцированных мезенхимальных клеток. В качестве предшественников были предложены лимфоциты, мультипотентные предшественники и миелоидные клетки. Из-за морфологического и физиологического сходства базофилы также указывались как предшественники. Но два типа развиваются из разных гематопоэтических линий.
Филогенетические исследования указывают на возможный примитивный аналог тучных клеток у Ciona intestinalis – личиночнохордовый, рассматриваемый как модель-предок цефалохордатов и позвоночных. Эта примитивная клетка имеет сходство с мастоцитом: содержит метахроматические, электронно-плотные гранулы, также способна высвобождать гистамин и простагландины после активации. Соответственно, мастоциты могли появиться задолго до развития адаптивного иммунного ответа.
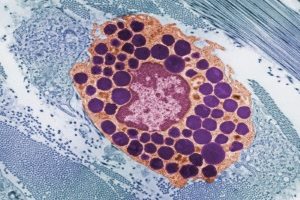
Морфологическая особенность тучных клеток – большое содержание в цитоплазме гранул, заполненных многочисленными секреторными соединениями, включая гепарин (отрицательно заряженный полисахарид) или хондроитинсульфатные протеогликаны типа серглицина. Функционально протеогликаны мастоцитов способствуют хранению других соединений в гранулах, включая биоактивные моноамины и различные специфические к клеткам протеазы. Кроме того, было показано, что протеогликаны гранул регулируют ферментативную активность протеаз и способствуют апоптозу. Мастоциты имеют поразительное метахроматическое окрашивание различными катионными красителями (как окраска толуидиновым синим).
Гематопоэтическое происхождение тучной клетки было подтверждено после аллогенной трансплантации костного мозга у лейкемического пациента. Через 198 дней после трансплантации мастоциты, выделенные из костного мозга реципиентов, отображали генотип донора.
- Классификация: гематогенный дифферон; клетки иммунной системы.
- Происходят из плюрипотентных клеток-предшественников костного мозга и созревают под влиянием c-kit лиганд (CD11–рецепторный тирозинкиназный белок, который у человека кодируется геном KIT) и фактора стволовых клеток в присутствии других отчетливых факторов роста, обеспечиваемых микроокружением ткани, где они находятся.
- В нормальных условиях зрелые мастоциты не циркулируют в кровотоке.
- Однако предшественники мастоцитов мигрируют в ткани и дифференцируются под влиянием фактора стволовых клеток и различных цитокинов.
Где находятся тучные клетки? Присутствуют в слизистых и эпителиальных тканях в организме, за исключением центральной нервной системы и сетчатки (составляют 10% от клеток рыхлой волокнистой соединительной ткани). Расположены в местах поступления антигена в областях под эпителием в соединительной ткани, окружающей клетки крови, гладкие мышцы, слизистые и волосяные фолликулы (желудочно-кишечный тракт, кожа, респираторный эпителий) – иначе говоря, находятся в тесном контакте с внешней средой, в местах потенциального проникновения возбудителей. Поэтому они идеально подходят для участия в раннем распознавании патогенов.
Какие функции выполняют мастоциты в организме?
Активация и дегрануляция тучных клеток модулирует многие аспекты физиологических и патологических состояний. Известно, что в отношении нормальных физиологических функций они регулируют вазодилатацию (расширение кровеносных сосудов), сосудистый гомеостаз, врожденные и адаптивные иммунные реакции, ангиогенез и детоксикацию. С другой стороны, играют роль в патофизиологии многих заболеваний: аллергии, бронхиальной астме, анафилаксии, желудочно-кишечных расстройств, многих видов злокачественных новообразований, сердечнососудистых заболеваний, синдрома сжигания рта (расстройство активации мастоцитов в ткани полости рта, языка).
- Участвуют в повышении ангиогенеза (росте кровеносных сосудов). Секретируют проангиогенные факторы, выделяют протеазы и гепарин (высвобождаются проангиогенные факторы, которые связываются с гепарином). Гистамин, высвобождаемый мастоцитами, индуцирует проницаемость микроциркуляции, которая также индуцирует развитие кровеносных сосудов.
- Способствуют гомеостазу в иммунной системе. Они служат первой линией защиты от антигенов, поступающих в организм из-за их расположения в коже и слизистой оболочке. Особенно важна их роль в гомеостазе комменсальных бактерий кишечника. Пищеварительная система постоянно подвергается воздействию различных антигенов, таких как бактерии (комменсальные и патологические) и пищевые антигены.
- Играют важную роль во врожденном и адаптивном иммунитете. Они распознают вредные антигены путем непосредственного связывания с патогенами или с патоген-ассоциированным молекулярным фрагментом.
Также регулируют функции многих типов клеток (дендритные, макрофаги, Т-клетки, В-лимфоциты, фибробласты, эозинофилы, эндотелиальные, эпителиальные). Играют важную роль в регуляции роста костной ткани, ремоделировании, минеральном гомеостазе.
Что такое стабилизаторы мембран лаброцитов?
Натрия кромогликат (кромолин-натрий) доступен в интразальной форме и считается препаратом первой линии для управления легких аллергических реакций дополнительно к другим композициям. Применяют его до 4х раз в день, относительно свободен от побочных эффектов. Кромолин-натрий также используется в качестве перорального препарата при лечении редкого заболевания мастоцитоза (тучноклеточный лейкоз), для которого характерна пролиферация (чрезмерное накопление) тучных клеток в пораженной ткани, и при пищевой аллергии.
Недокромил натрия – более мощное средство – применяется в качестве ингаляционного средства для лечения астмы.
Другой стабилизатор – кетотифен – отличается от кромонов совместным антигистаминным эффектом. Препарат предназначен для профилактического лечения аллергической астмы, ринита и аллергического конъюнктивита, проявлений пищевой аллергии.
Механизм действия блокаторов в организме человека и названия торговых препаратов
Стабилизаторы тучных клеток – хромоновые препараты. Потенциальный фармакодинамический механизм – блокирование IgE-регулируемых кальциевых каналов. Без внутриклеточного кальция везикулы гистамина не могут сливаться с клеточной мембраной и дегранулировать. В качестве ингаляторов средства используются для лечения астмы, как назальные спреи – при сенной лихорадке (аллергический ринит), как глазные капли – для аллергического конъюнктивита. В оральной форме – при лечении мастоцитоза.
Список (фармакология: ингибиторы дегрануляции мастоцитов) – примеры:
- Кромоглициновая кислота.
- Кетотифен.
- Кверцетин.
- Бета-адреномиметики.
- Метилксантины.
- Пемироласт.
- Олопатадин.
- Меполизумаб.
- Омализумаб.
- Недокромил.
- Азеластин.
- Траниласт.
- Витамин D.
За последнее десятилетие выявлен широкий спектр соединений стабилизаторов мастоцитов – природных, биологических и синтетических источников для лекарств, которые уже используются в клинических целях и для других показаний, кроме аллергий. Во многих случаях точный метод действия молекул неясен, но все вещества демонстрируют активность в том, что подразумевает стабилизация и, следовательно, могут иметь потенциальные терапевтические показания для лечения аллергических и подобных заболеваний, при которых интенсивно участвуют мастоциты. Однако из-за их гетерогенности и молекулярных целей потенциал любого нового стабилизатора может быть реализован только после оценки его свойств в расширенном диапазоне доклинических моделей in vitro, ex vivo и in vivo: эффективность и токсичность, побочные эффекты и противопоказания.
Тучные клетки и гистамин. Роль гормона в воспалении бронхов
Гистамин активирует четыре рецептора, связанные с белком G (связывающий иммуноглобулины), а именно H1, H2, H3 (выраженный, главным образом, в головном мозге) и сравнительно недавно идентифицированный H4. В то время как активация H1 и H2, в основном, связана с некоторыми аллергическими расстройствами, опосредованными тучными клетками и базофилами, селективная экспрессия H4 на иммунных клетках раскрывает новые роли гистамина (возможно полученного из тучных клеток и базофилов) при аллергических, воспалительных и аутоиммунных расстройствах. Таким образом, глубокий анализ высвобождения гистамина мастоцитов и базофилов, его биологических эффектов позволяет выявить новые терапевтические пути для широкого спектра расстройств.
Образуемый гистамин – важный медиатор в патогенезе бронхиальной астмы и аллергического ринита. Высказано предположение, что астму и аллергический ринит следует рассматривать как одну болезнь дыхательных путей: коморбидность астмы и аллергического ринита очень высокая в процентах (70-80%), и они имеют сходное аллергическое воспаление. Легкая активация рецептора биогенного амина приводит к бронхоспазму и обструкции дыхательных путей.

В зависимости от степени плазматические уровни гистамина соотносятся с тяжестью астмы, при активации рецептора гистамина наблюдается нестабильность или увеличение проницаемости сосудов, продуцирование слизи и сокращение мышечных клеток гладкой мускулатуры. Препараты H1-блокаторы рекомендуют в качестве первой линии для лечения бронхиальной астмы и аллергического ринита (наиболее популярный и самый продаваемый в мире H1-блокатор третьего поколения – фексофенадин). Но гистамин может играть разные роли в воспалении аллергических дыхательных путей через рецепторы H1, H2 и H4 в иммунных клетках, включая Т-лимфоциты и дендритные клетки. Поэтому необходимо проводить больше исследований в этой области.
Что такое дегрануляция мастоцитов и как происходит этот процесс?
Дегрануляция – клеточный процесс, высвобождающий антимикробные цитотоксические или другие молекулы из секреторных везикул (гранул). Используется различными клетками, вовлеченными в иммунную систему, основная цель которых – уничтожить вторгающиеся микроорганизмы.
Метод дегрануляции тучных клеток:
- В течение нескольких минут после стимуляции мастоциты высвобождают предварительно сформированные медиаторы, присутствующие в цитоплазматических гранулах (гистамин, триптаза и химаза), предварительно сформированный фактор некроза опухоли-альфа.
- После они могут продуцировать липидные.
- В течение нескольких часов можно наблюдать транскрипционную повышающую регуляцию цитокинов и хемокинов.
- Каждый из ответов возникает самостоятельно или вырабатывается в комбинации в зависимости от стимула.
Какие медиаторы высвобождаются при защитном явлении тучных клеток?
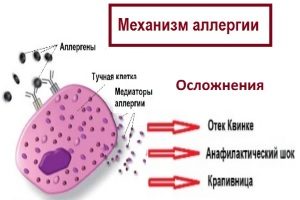
Уникальный, стимулирующий специфический набор мастоцитов высвобождается через дегрануляцию после активации рецепторов клеточной поверхности. Медиаторы тучных клеток, которые высвобождаются во внеклеточную среду во время дегрануляции тучных клеток, включают серотонин, сериновые протеазы, гистамин (2-5 пикограмм на мастоцит) протеогликаны, главным образом гепарин (активный как антикоагулянт) и некоторые протеогликаны хондроитинсульфата, лизосомные ферменты, цитокины…
Многие из медиаторов, которыми богаты мастоциты, привлекают лейкоциты (эозинофилы, базофилы, Т-хелперы 2, нейтрофилы) к месту воспаления и усиливают воспалительный ответ. Предупреждающие медиаторы показывают повышение проницаемости кровеносных сосудов, так что иммунные клетки могут перемещаться из кровотока в пораженную ткань. После дегрануляции они ресинтезируют медиаторы и повторно заполняют гранулы.
Мастоциты являются потенциальными источниками гистамина в яичнике. В нескольких исследованиях были обнаружены изменения количества и дегрануляции в яичнике во время цикла.
Читайте также:


