Вирус энцефалита леса семлики
Определение. Зоонозная природно-очаговая арбовирусная инфекционная болезнь с трансмиссивным механизмом передачи возбудителя (комариная), характеризующаяся лихорадкой, экзантемой, явлениями энцефалита.
Этиология. Возбудитель — РНК-содержащий арбовирус из семейства Togaviri- dae рода Alphavirus комплекса Семлики. По строению и биологическим свойствам близок к вирусам Синдбис, карельской лихорадки, обладает антигенным родством с вирусами Майяро, Чикунгунья, О’Ньонг-Ньонг. Характеризуется гемагглюти- нирующей и гемолитической активностью.
Отнесен ко II группе патогенности.
Эпидемиология. Резервуар и источники возбудителя точно не установлены, предположительно — птицы и комары. Период заразительности источника неопределенно долгий.
Механизм передачи возбудителя трансмиссивный, переносчики — комары родов Aedes, Anopheles, Culex.
Восприимчивость и иммунитет. Естественная восприимчивость людей, по- видимому, не очень высокая. После заболевания остается напряженный гуморальный иммунитет.
Особенности эпидемического процесса. Болезнь получила название от местности (лес Семлики в округе Бвамба в Уганде), где вирус был выделен от комаров. Впоследствии он был изолирован от комаров в Кении и Камеруне, а также в Приморском крае России и в Казахстане. Заболевания людей носят спорадический характер. Антитела к вирусу леса Семлики выявлены у значительного процента лиц в различных районах Африканского континента, а также в Малайзии, на о. Калимантан, в Индии. Антитела, обнаруженные в Бразилии, могли быть индуцированы местным вирусом Майяро, имеющим антигенное родство с вирусом леса Семлики. Известны случаи лабораторного заражения.
Клиника. Инкубационный период не определен. Основные признаки: лихорадка, интоксикационный синдром, денгеподобная клиника, явления энцефалита.
Диагноз. Дифференциальную диагностику проводят с менингитами и энцефалитами иной этиологии, сосудистыми поражениями головного мозга, комами различного генеза, опухолями и абсцессами головного мозга, полиомиелитом.
Лабораторная диагностика основана на изоляции вируса посредством заражения в мозг новорожденных белых мышей и культуры клеток. Из серологических методов используют PH, РТГА, РСК в парных сыворотках, взятых в первые дни и на 3-й неделе заболевания.
Лечение. В острой стадии заболевания показаны противовирусные препараты (итерферон, реоферон и др.). Проводят дезинтоксикационную (растворы белков, глюкозы, электролитов) и дегидратационную (фуросемид, или лазикс, манни- тол и др.) терапию. При явлениях отека мозга назначают кортикостероиды (преднизолон из расчета 2 мг/кг массы тела в сутки). В качестве противосудорожных средств применяют 25 % раствор магния сульфата, 1 мл 2,5 % раствора аминазина, 2 мл 1 % раствора димедрола и др. Нарушения дыхания являются показанием к оксигенотерапии. При бульбарных расстройствах назначают сердечно-сосудистые и возбуждающие дыхание средства. Показано назначение витаминов группы В, аскорбиновой кислоты. Реконвалесценты подлежат длительной диспансеризации.
Профилактика. Борьба с комарами и применение мер индивидуальной защиты от них. Меры иммунопрофилактики не разработаны.
Противоэпидемические мероприятия не регламентированы.
В структуре альфавирусов выявлено три антигенных домена, ответственных за видовую специфичность, внутригрупповые и внутриродовые связи. Два из них локализованы в структурных белках оболочки, один — связан с белком нуклеокапсида. Белки оболочки и нуклеокапсида антигенно не связаны между собой. За нейтрализующую активность альфавирусов ответственны гликопротеины Е1 и Е2.
На гликопротеинах Е1 и Е2 идентифицированы соответственно четыре и три эпитопа нейтрализации. Моноклональные антитела к нейтрализующим эпитопам Е2 обладали более выраженным профилактическим действием, чем антитела к нейтрализующим эпитопам Е1.
Нейтрализующие антитела к белку Е2 вируса леса Семлики не реагировали в РТГА и РСК. Установлено участие Е1 вируса Синдбис в клеточном иммунном ответе. Так, антитела к белку Е1 не нейтрализовывали вирус, но оказывали протективное действие в результате зависимого от антител цитолиза инфицированных клеток. Пепломеры вируса леса Семлики, ответственные за сплавление оболочки вириона с клеточной мембраной, состоят из двух трансмембранных белков Е1 и Е2, а также белка Е3, расположенного на поверхности вириона.
В гликопротеинах Е1 и Е2 вируса ВЭЛ идентифицировано по пять сайтов связывания МАТ.

Изучение гомологии нуклеиновых кислот различных альфавирусов показало, что у антигенно тесносвязанных вирусов она составляет 13%, у других вирусов этого рода - не менее 1%. Наличие серологического родства при ограниченной гомологии генома можно объяснить исходя из допущения, что антигенные детерминанты ограничены небольшим количеством аминокислот. Действительно, как показали исследования с моноклональными антителами, большинство альфавирусов сходны по участкам консервативного эпитопа на нуклеокапсидном белке. К немногим исключениям из этого правила относится вирус ВЭЛ.
Между вирусами энцефаломиелита лошадей (ЭМЛ) существует перекрестный иммунитет. Лошади, иммунные к вирусу восточного ЭМЛ, оказались полностью устойчивыми к вирусу ВЭЛ, а иммунные к вирусу западного ЭМЛ — частично защищенными против ВЭЛ [1613]. За антигенный перекрест вирусов ВЭЛ и восточного ЭМЛ ответственны сайты Е1 -1, Е1-3 и Е1-5. Эпитопы гликопротеина Е1 ВЭЛ антигенно сходны с эпитопами белка Е вируса клещевого энцефалита.
Вирус краснухи (рубивирус) антигенно не связан ни с одним из вирусов семейства и классифицируется как тогавирус исключительно на основе структуры.
Сферические частицы диаметром 60—70 нм. Нуклеокапсид 30—35 нм в диаметре окружен оболочкой клетки хозяина. Все штаммы слабо температурочувствительны, урожай вируса при 35°С больше, чем при 37°С. Вирус краснухи размножается более медленно, чем альфавирусы: эклипс фаза длится 10—12 часов, максимальное накопление через 30—48 часов и составляет 10 ИД50 на 1 клетку, тогда как у вируса Синдбис эти показатели соответственно равны 4 и 8 часам и 104ИД50 на 1 клетку.
Структурные белки оболочки вируса краснухи транслируются в виде полипротеина (р 110), в результате расщепления которого образуются капсидный белок (33 кД) и два гликопротеина Е1 (58 кД) и Е2 (42-47 кД).
В гликопротеине Е1 вируса краснухи обнаружено три эпитопа, связанных с ГА-активностью и нейтрализацией вируса антителами. Они расположены в области аминокислот 245—285 белка Е1.
Для краснухи характерен длительный иммунитет после первичной вакцинации.
На Тайване при заболевании людей гепатитом Е изучали возможную причастность свиней к данному заболеванию. Штаммы вируса гепатита Е, выделенные от человека и свиней, относились к одной филогенетической группе и позволили заключить, что свиньи могут служить резервуаром данного вируса.
Тогавирусы (от лат. toga— плащ) — семейство РНК-содержащих оболочечных вирусов, относящихся к экологической группе арбовирусов, кроме вируса краснухи (табл. 4.13). Переносятся комарами. Арбовирусные инфекции сопровождаются лихорадкой, энцефалитом, миалгией, сыпью и увеличением лимфоузлов.
Структура. Вирион тогавирусов — сферический диаметром 50-70 нм. Икосаэдрический капсид окружен оболочкой со встроенными гликопротеиновыми шипами (рис. 4.48), включающими El, Е2, иногда ЕЗ: гликопротеин Е1 — гемагглютинин; гликопротеин Е2 участвует в прикреплении вируса к клетке и вызывает образование вируснейтрализующих антител. Геном вируса — однонитевая линейная плюс- РНК, которая связана с нуклеокапсидным белком С. Оболочка и нуклеокапсид скреплены с помощью белка С.
Репродукция. Вирус леса Семлики (рис. 4.49) прикрепляется к рецепторам клетки (1) с помощью шипов (гликопротеин Е2) и попадает в нее путем рецептор-опосредованного эндоцитоза: окаймленная ямка — окаймленный пузырек — эндосома — лизосома. Оболочка вируса сливается с мембраной эндосомы при подкислении среды, в результате чего капсид и геном освобождаются (2), попадая в цитоплазму, где вирусный геном (плюс-РНК) связывается с рибосомами (3) как иРНК. Происходит трансляция полипротеина (4), который впоследствии расщепляется на 4 неструктурных белка (NSP 1-4), включая РНК-зависимую РНК-полимеразу (репликазу). Эта полимераза транскрибирует геном (плюс-РНК) в минус-нить РНК (матрицу), на которой (5) синтезируются копии РНК двух размеров: полная плюс-нить 49S геномной РНК; 26S иРНК, соответствующая трети генома, кодирующая белок С капсида (6), а также гликопротеины оболочки — Е1-3, которые синтезируются на рибосомах, связанных с мембранами эндоплазматического ретикулума, затем включаются в мембрану и гликозилируются. Белки оболочки после дополнительного гликозилирования в аппарате Гольджи транспортируются в плазматическую мембрану (7). Белок С связывается с синтезированной геномной РНК с формированием нукпеокапсида (8), который взаимодействует с мембраной клетки, содержащей вирусные гликопротеины, и выходит из клетки почкованием (9) через плазматическую мембрану.

Рис. 4.49. Схема репродукции вируса леса Семлики
Микробиологическая диагностика. Исследуют кровь (при вирусемии), цереброспинальную жидкость, мочу. Вирусологический метод: заражение куриного эмбриона, культуры клеток куриных фибробластов; внутримозговое заражение мышей сосунков. Вирус идентифицируют в РТГА, РСК, PH. Серологический метод: определение нарастания титра антител в парных сыворотках с помощью РСК, РТГА, PH, ИФА.
Специфическая профилактика. Применяют убитые и живые вакцины.
Краткая характеристика основных представителей.
Вирусы Венесуэльского энцефаломиелита лошадей, Восточного энцефаломиелита лошадей, Западного энцефаломиелита лошадей — РНК-содержащие вирусы рода Alphavirus семейства Togaviridae; вызывают арбовирусную инфекцию (переносятся комарами в Америке, США). Клинические проявления в виде лихорадки, энцефалита, менингоэнцефалита.
Вирус Карельской лихорадки — РНК-содержащий вирус рода Alphavirus семейства Togaviridae; вызывает арбовирусную инфекцию (переносится комарами) в виде лихорадки, энцефалита, артралгии, миалгии и пятнисто-папулезной сыпи.
Рис. 4.48 Схема строения тогавируса
Вирусы: Синдбис; Венесуэльского, Восточного, Западного энцефаломиелитов лошадей; Карельской лихорадки; Чикунгунья; 0 Ньонг-Ньонг; леса Семлики
Вирусы сферические (50-70 нм), имеют оболочку, икосаэдрический капсид и однонитевую линейную плюс-РНК. Репродукция — в цитоплазме. Сборка
— почкование через клеточную мембрану.

Таблица 4.13. Характеристика семейства Togaviridae
Вирус леса Семлики — РНК-содержащий вирус рода Alphavirus семейства Togaviridae; вызывает арбовирусную инфекцию (переносится комарами) в виде лихорадки, экзантемы, энцефалита, артралгий.
Микробиологическая диагностика. Вирус выделяют на культуре клеток и идентифицируют в РТГА при исследовании смыва из носоглотки, крови, мочи, кала больного или тканей погибшего плода. Серодиагностика направлена на выявление антител (IgM, IgG) против возбудителей в РСК, РТГА, ИФА, РИА, реакции радиального гемолиза. В парных сыворотках выявляют нарастание титра антител.
Лабораторно подтвержденная краснуха в первые 12 недель беременности — показание к проведению аборта.
Специфическая профилактика. Применяют живые и убитые вакцины. Имеются ассоциированные вакцины (против кори, паротита, краснухи) и моновакцины. Целесообразно иммунизировать девочек 12-14 лет и женщин детородного возраста при отсутствии у них антител против вируса краснухи. Вакцины нельзя вводить беременным женщинам. Следует избегать беременности в течение 3 месяцев после введения живой вакцины.
Появление вируса СПИДа, Эбола и любых других вирусов из тропических лесов представляется естественным следствием разрушения тропической биосферы. Появляющиеся вирусы выходят на поверхность из мест, где повреждена экологическая обстановка. Многие из них приходят из разорванных границ тропических дождевых лесов или из тропической саванны, которую быстро заселяют люди. Тропические дождевые леса — глубокие резервуары жизни на планете, они содержат большую часть видов растений и животных. Дождевые леса также являются крупнейшим резервуаром вирусов, так как все живые существа несут в себе вирусы. У выходящих из экосистемы вирусов есть тенденция распространяться по человеческой популяции волнами, словно эхо от умирающей биосферы. Вот названия некоторых новых вирусов: ласса, вирус Рифтовой долины. Оропуш, Росио, Ку-вирус, Гуанарито, вирусный лошадиный энцефалит, оспа обезьян, лихорадка Денге, Чикунгунья, Хантавирусы, Мачупо, Хунин, похожие на бешенство штаммы, мозговой вирус леса. И ВИЧ — быстро распространяющийся вирус, все сильнее проникающий в человеческий вид, и конца ему не видно. Вирус леса Семлики. Конго-крымская геморрагическая лихорадка. Вирус Синдбис. О’нионгнионг. Безымянный вирус Сан-Паулу. Марбург. Суданский эболавирус. Заирский эболавирус. Рестонский эболавирус.
СПИД, пожалуй, худшая экологическая катастрофа XX века. Вирус, вызывающий СПИД, вполне мог попасть в человеческую расу от африканских приматов, от мартышек и человекообразных обезьян. Например, ВИЧ-2 (один из двух основных штаммов ВИЧ) может быть мутантным вирусом, который попал в нас от африканской обезьяны, известной как черномазый мангобей, возможно, когда охотники на обезьян или трапперы касались окровавленной ткани. ВИЧ-1 (другой штамм), возможно, мы получили от шимпанзе — вероятно, когда охотники разделывали шимпанзе. Штамм обезьяньего вируса, вызывающего СПИД, недавно полученный от шимпанзе в Габоне, в Западной Африке, до сих пор является самым близким к ВИЧ-1, когда-либо найденным в животном мире.

Вирус, вызывающий СПИД, был впервые замечен в 1980 году в Лос-Анджелесе врачом, который понял, что его пациенты-геи умирают от инфекционного агента. Если бы кто-нибудь в то время предположил, что эта неизвестная болезнь у геев в Южной Калифорнии произошла от диких шимпанзе в Африке, медицинское сообщество дружно рассмеялось бы. Теперь уже никто не смеется. Я нахожу чрезвычайно интересным рассмотреть идею о том, что шимпанзе — это исчезающее тропическое животное, а затем рассмотреть идею о том, что вирус, который перешел от шимпанзе, внезапно перестал быть опасным вообще. Можно сказать, что вирусы тропических лесов чрезвычайно хорошо заботятся о своих собственных интересах.
Вирус, вызывающий СПИД, очень быстро мутирует, он постоянно меняется. Это гипермутант, оборотень, спонтанно изменяющий свой характер в процессе движения через популяции и через индивидуумов. Он мутирует даже в ходе одного заражения, и человек, умирающий от ВИЧ, обычно заражается несколькими штаммами, спонтанно возникающими в организме. Тот факт, что вирус быстро мутирует, означает, что для него будет очень трудно разработать вакцину. В более широком смысле это означает, что вирус, вызывающий СПИД, является естественным пережитком изменений в экосистемах. ВИЧ и другие появляющиеся вирусы выживают после крушения тропической биосферы, потому что они могут изменяться быстрее, чем в их экосистемах происходят любые изменения. Они, должно быть, хорошо умеют избегать неприятностей, если некоторые из них существуют уже четыре миллиарда лет. Я склонен думать о крысах, бегущих с тонущего корабля. Я подозреваю, что СПИД может не быть выдающимся проявлением силы природы. Может ли человеческая раса на самом деле поддерживать население в 5 млрд или больше без катастрофы с горячим вирусом, остается открытым вопросом. Ответ кроется в лабиринте тропических экосистем. СПИД — это месть дождевого леса. И это только начало.
Многоликий вирус. Тайны скрытых инфекций
Председатель – В. А. Садовничий Заместители председателя – С. Н. Деревянко и И. В. Ильин Члены совета: И. А. Алешковский, А. И. Андреев, Н. Н. Андреев, К. В. Анохин, Е. Л. Вартанова, К. С. Деревянко, Б. Л. Еремин, Ю. И. Журавлев, А. А. Зализняк, Ю. П. Зинченко, Ю. А. Золотое, Д. С. Ицкович, А. А. Каменский, С. П. Капица, В. П. Карликов, С. П. Карпов, Н. С. Касимов, А. Е. Кибрик, М. П. Кирпичников, Н. П. Красинская, М. А. Кронгауз, В. В. Лунин, Е. И. Майорова, Д. Е. Перушев, А. Е. Петров, В. А. Плунгян, Д. Ю. Пущаровский, В. А. Рубаков, В. П. Скулачев, В. Б. Спиричев, В. А. Твердислов, В. А. Ткачук, В. И. Трухин, A. M. Черепащук, СО. Шмидт, Я. Л. Шрайберг, А. Ю. Шутов, Л. Е. Этинген, В. Л. Янин
Ведущий редактор проекта Н. Красинская
Все права защищены. Никакая часть электронной версии этой книги не может быть воспроизведена в какой бы то ни было форме и какими бы то ни было средствами, включая размещение в сети Интернет и в корпоративных сетях, для частного и публичного использования без письменного разрешения владельца авторских прав.
Электронная версия книги подготовлена компанией ЛитРес (www.litres.ru)
Перед вами книга, посвященная истории зарождения и бурного развития нового направления в инфектологии – учения о так называемых медленных инфекциях, которому суждено было сыграть выдающуюся роль в науке о возбудителях инфекционных заболеваний. Для медленных инфекций характерны многолетний инкубационный период, длительное течение, своеобразие поражения органов и тканей и обязательный смертельный исход.
Продолжительные исследования медленных инфекций принесли результаты. Так, удалось установить, что их возбудителями могут быть давно известные вирусы, вызывающие острые лихорадочные заболевания. В то же время возбудители ряда медленных инфекций способны скрытно существовать в организме животного или человека всю его жизнь, никак себя не обнаруживая и не нанося никакого вреда.
Более того, исследования медленных инфекций, начатые в середине XX века в рамках науки о вирусах – вирусологии, спустя 30 лет позволили открыть совершенно новый класс возбудителей этих болезней человека и животных – так называемый инфекционный прионный белок.
За последние годы в данной области накоплен большой и интересный материал – открыты новые медленные инфекции человека и животных, изучены причины и механизмы развития ряда ранее известных подобных заболеваний, пополнены знания о распространении медленных инфекций на земном шаре и, что самое главное, разработаны меры предупреждения некоторых из этих смертельно опасных заболеваний.
Особый интерес в книге вызывает раздел, посвященный проблемам старения. Казалось бы, что может быть общего между ними и исследованиями в области инфектологии… Однако, как это уже неоднократно случалось в процессе научного поиска, исследователь обнаруживает феномены, выходящие за рамки данного изыскания, тем самым открывая двери в еще непознанное. Также и автор данной книги мастерски выстраивает цепочку, ведущую от проблемы прионных болезней к вопросам старения и смерти, результатом чего является открытие фактора старения млекопитающих, в том числе и человека.
В книге действуют конкретные исторические лица, а события происходят в обстановке, которую никто ранее не описывал столь профессионально в научно-популярной литературе. Именно поэтому книга представляет интерес не только для широкого круга читателей, но и для специалистов разного профиля – вирусологов, микробиологов, эпидемиологов, инфекционистов, невропатологов, педиатров и даже геронтологов.
Автором книги – известным специалистом в области медленных инфекций профессором В. А. Зуевым – открыта одна из медленных инфекций человека и животных – гриппозная. Его перу принадлежит ряд монографий на эту тему. В. А. Зуев был непосредственным участником некоторых до сих пор нигде, кроме этой книги, не описанных событий. А потому, в связи с ее документальностью, книга читается на одном дыхании.
Глава первая. Грозные встречи
В Древнем Риме было несколько храмов, посвященных Янусу – божеству всех начал. Самый известный из них располагался на Форуме. В дни мира его ворота были всегда закрыты и открывались только при объявлении войны.
На некоторых этрусских изображениях у Януса четыре лица…
…Город гудел, как растревоженный улей. Толпы людей, теснившихся на улицах, с искаженными безумным страхом лицами, толкаясь и крича, стремились как можно скорее покинуть городские стены. Казалось, разум оставил этих людей и его место занял беспредельный страх. Страх смерти!
Черная оспа! Эпидемии этой страшной болезни охватывали на протяжении веков сначала страны Азии, а затем Европы и Америки. Особое распространение оспа получила в XVI–XVIII веках. Опустошенные города Перу, 3,5 миллиона погибших от оспы в Мексике, 60 миллионов больных в Европе, наполовину вымершее население в Сибири – таковы масштабы жертв этой болезни за одно лишь XVIII столетие.
В те времена из каждых четырех слепых трое теряли зрение в результате перенесенной оспы. Что говорить о достаточно давних временах, когда в 20-е годы XX века в нашей стране развивались тяжелейшие эпидемии оспы, охватывавшие до 200 тысяч человек в год.
1801 год. Первый консул Франции Наполеон Бонапарт получает известие о поражении своих войск на острове Гаити. Высадившиеся на остров завоеватели легко одержали победу над плохо вооруженными туземцами; однако вскоре среди французских солдат началась повальная тяжелая болезнь, сопровождавшаяся высокой температурой, сильными головными болями и болями в спине, рвотой с кровью (черная рвота), бредом. Из-за высокой смертности французы потеряли большую часть войска. Туземцы воспользовались этим обстоятельством и в результате внезапного нападения полностью разгромили захватчиков.
Названия некоторых арбовирусов отражают характер связанных с ними болезней — вирус желтой лихорадки, вирус денге и др. Позже вирусы стали называть по географической области, где они были выделены. Так появилось множество обозначений — вирусы энцефалита Сент-Луи, Омской лихорадки, Синдбис, Укуниеми, Чикунгунья, лихорадки Западного Нила, Конго-Крымской лихорадки, Карельской лихорадки, Калифорнийского энцефалита, Венесуэльского энцефалита и т.д. Сейчас известно около 500 арбовирусов, из них примерно 100 поражают человека.
Большинство арбовирусов принадежит семействам Togaviridae, Flaviviridae и Bunyaviridae. Единичные арбовирусы есть среди семейств Reoviridae, Rhabdoviridae и Picornaviridae. Все они являются РНК-вирусами. Индивидуальные серотипы (виды) Togaviridae, Flaviviridae и Bunyaviridae отличаются друг от друга по тесту нейтрализации с иммунными сыворотками. Для их определения пользуются моноклональными антителами, которые дифференцируют эпитопы, недоступные для поликлональных антител. Серотипы неоднородны. Это проявляется в реакциях торможения гемагглютинации, связывания комплемента и иммуноэнзимного анализа. Серотипы, дающие выраженные перекрестные реакции, объединены в антигенные комплексы, или серогруппы. На этом основании выделено 7 групп (комплексов) тогавирусов (альфавирусов), 8 — флавивирусов и 14 — буньявирусов. Антигенные связи отражают происхождение от единого источника, однако дальнейшее разделение происходит в 10—100 раз медленнее, чем у других РНК-вирусов, не связанных с членистоногими.
Выделяют три категории арбовирусных инфекций:
- лихорадки с развитием артралгий и сыпи;
- геморрагические лихорадки с кровоизлияниями в коже, слизистых оболочках и различных органах;
- энцефалитные синдромы.
Болезнь может протекать с гриппоподобными (неспецифическими) симптомами или вообще не развиваться, ограничиваясь образованием антивирусных антител. Таких случаев большинство, и в среднем свыше 90% заражений протекают бессимптомно. Для многих арбовирусов число инаппарантных форм составляет 300:1—1000:1, демонстрируя штаммовую неоднородность, зависимость от условий заражения и масштаб устойчивости к арбовирусам. К манифестным формам более чувствительны пожилые и дети. Один и тот же вирус может вызвать неодинаковые синдромы у разных людей.
Общая схема арбовирусных инфекций показана на рис. 1. Заболевания возникают после укуса членистоногих, слюна которых содержит инфицирующую дозу вируса. Проникая через кожу, вирусы реплицируются местно и в регионарных лимфоузлах, после чего поступают в кровь (первичная вирусемия). Высвобождение вируса из клеток селезенки, печени, лимфатических узлов и сосудистого эндотелия создает вторичную вирусемию и может спровоцировать гриппоподобную симптоматику. Через неделю (после появления достаточного количества нейтрализующих антител) вирусемия исчезает. Инфекция обычно на этом заканчивается, но иногда возбудитель успевает достичь дополнительных мишеней — центральной нервной системы, кожи, мышц, суставов и т.д. Способность разных клеток воспринимать и поддерживать вирусную инфекцию сильно отличается.
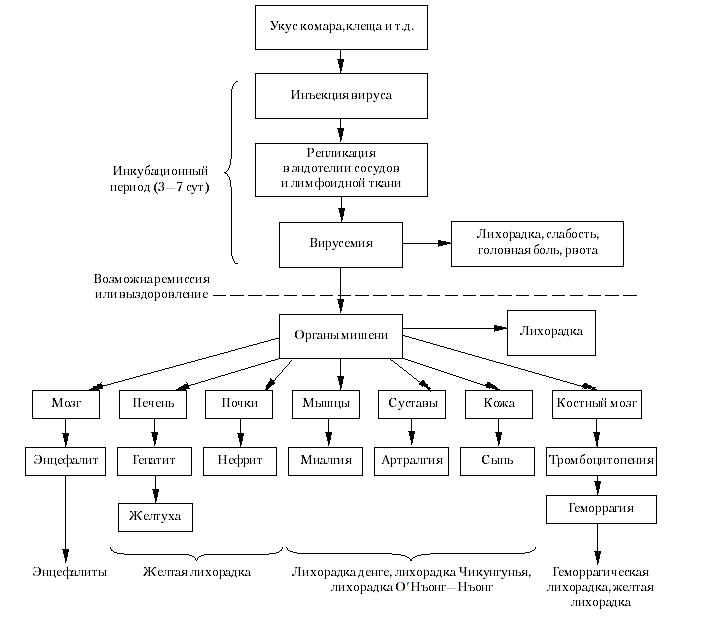
Рис. 1. Схема патогенеза арбовирусных инфекций
Между началом основного синдрома и неспецифической фазой может быть короткий промежуток облегчения, и тогда болезнь протекает в виде двух фаз. Специфические симптомы начинаются через 7—10 дней после заражения и (в зависимости от вируса и хозяина) продолжаются неделю или дольше, заканчиваясь выздоровлением, ремиссией или смертью. Геморрагический синдром сопровождается кровоизлияниями — мелкоточечной сыпью (петехии на коже и слизистых оболочках), кровотечением из носа, кровавой рвотой и калом, кровоизлияниями во внутренние органы. Скорее всего, это связано с тромбоцитопенией и диссеминированной коагулопатией. Смертность при геморрагических лихорадках колеблется от 1 до 15%, но может быть и выше.
При энцефалитах арбовирусы размножаются в нейронах головного мозга, вызывая образование зон некроза, окруженных микроглиальными клетками. Такие же скопления появляются вокруг многих церебральных сосудов. Одновременно возникает асептический менингит с аккумуляцией мононуклеаров в субарахноидальном пространстве и гиперемией прилежащих капилляров. Энцефалит (точнее менингоэнцефалит) начинается с подъема температуры, головной боли и ригидности шейных мышц. Прогрессируя, это ведет к спутанности сознания и неврологическим симптомам — тремору, патологическим рефлексам, парезам и параличам, нистагму, атаксии, конвульсиям, коме. Смертность достигает 80%. Нервные последствия (парезы и пр.) остаются у многих больных, но через несколько месяцев проходят. Нетрудоспособность, хроническая усталость, дефицит памяти и концентрации внимания могут сохраняться годами.
Большинство арбовирусов культивируются в различных клетках и патогенны для новорожденных мышей. Поэтому заражение культуры клеток и мышей остаются главными методами диагностики арбовирусных инфекций. Из других способов используется определение IgM- и IgG-антител и обратнотранскриптазная полимеразная цепная реакция — ПЦР (поиск вируса в циркуляции).
Для профилактики арбовирусных инфекций большое значение имеют экологические подходы, прежде всего борьба с комарами и клещами. При некоторых инфекциях применяют убитые или живые аттенуированные вакцины.
Семейство Togaviridae (от лат. toga — плащ) включает два экологически обособленных рода — альфавирусы (Alphavirus) и рубивирус (Rubivirus). Альфавирусы — типичные арбовирусы, передающиеся через кровососущих членистоногих. Рубивирус, или вирус краснухи, представляет собой сугубо человеческий вирус; инфицирование происходит воздушно-капельным путем, не требуя участия кровососущих переносчиков. Ниже речь пойдет об альфавирусах, ибо вирус краснухи не относится к арбовирусам.
Вирионы являются сферическими образованиями, 60—70 нм в диаметре, с кубическим (икосаэдрическим) нуклеокапсидом, заключенным в липидно-белковую оболочку (суперкапсид). Геномной молекулой служит однонитчатая РНК длиной около 12 кбайт. Она действует как мРНК и обладает способностью самостоятельно инфицировать клетки, т.е. является плюс-РНК. Капсид образован С-белком (от англ. capsid); в суперкапсиде имеются короткие шипы, состоящие из гликопротеинов Е1 и Е2 (от англ. envelope). Третий протеин (Е3) удается обнаружить только у вируса леса Семлики; в остальных случаях он теряется в виде растворимого белка. Е1 определяет способность альфавирусов агглютинировать эритроциты птиц (гусей) и перекрестно реагировать в реакции торможения гемагглютинации (для штаммов одного антигенного комплекса). Е2 тоже вызывает гемагглютинацию, но она более специфична, чем у Е1. К тому же Е2 служит мишенью для антител, нейтрализующих альфавирусы. Нейтрализующие тесты определяют разделение вирусов на типы или виды внутри антигенных комплексов.
С мутациями в генах, кодирующих Е1 и Е2, связаны колебания вирулентности тогавирусов (альфавирусов), что в известной мере объясняется изменением рецепторной активности вирионов. Идентифицировано несколько клеточных белков, реагирующих с альфавирусами. Степень их аффинности и функциональной активности различна, но, действуя вместе, они обеспечивают поглощение вириона. Дальнейшие события происходят в клеточной цитоплазме. В кислой среде вирион, используя сайты слияния Е1, образует стыковку между суперкапсидом и эндосомальной мембраной. Это ведет к высвобождению РНК, которая, действуя как мРНК, производит полипротеин для четырех неструктурных белков, в том числе для РНК-зависимой РНК-полимеразы. РНК-полимераза обеспечивает продукцию новых копий вирионной и субгеномной РНК, дающей начало структурным (вирионным) белкам. Они транспортируются в плазматическую мембрану; сюда же подходят готовые нуклеокапсиды. После связывания Е2- и С-белков происходит почкование новых вирионов и разрушение клетки. В культуре тканей полная деструкция клеточных монослоев наступает через 48—72 ч.
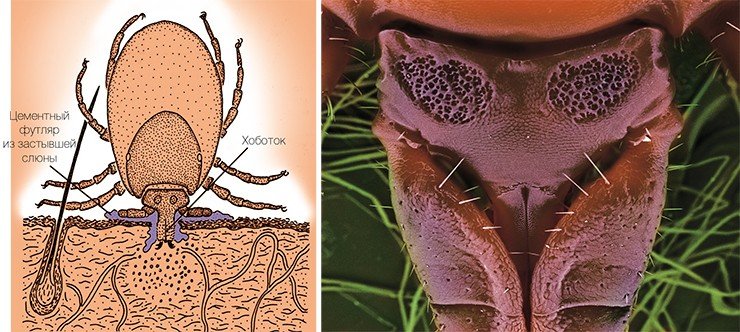
Среди переносчиков инфекционных заболеваний человека клещи занимают второе место после комаров: на сегодня выявлено не менее трех вирусных, 22 бактериальные и несколько протозойных инфекций, которые переносятся иксодовыми клещами. Ситуация зачастую осложняется тем, что при укусах клещи способны передавать человеку одновременно разные виды бактерий, вирусов и простейших, вызывая смешанные инфекции, часто протекающие в более тяжелых формах. Дополнительный риск заражения возникает из-за возможной циркуляции патогенов в сельскохозяйственных и домашних животных (например, инфекционные агенты могут сохраняться в молочных продуктах), а также при переливаниях крови и трансплантации органов. Наиболее опасными среди инфекций, переносимых клещами, считаются клещевой энцефалит, иксодовый клещевой боррелиоз, эрлихиоз, риккетсиоз и бабезиоз. Для России наиболее социально значимыми инфекционными агентами являются боррелии и конечно же вирус клещевого энцефалита, о котором пойдет речь ниже.
Таежная инфекция
В 30-х гг. XX в. шло интенсивное освоение Дальнего Востока: строились дороги, вырубались леса, из-за напряженных отношений с Японией в тайге дислоцировались крупные военные части. Врачи, работавшие в то время в Приморском крае, стали регулярно сообщать о неизвестной тяжелой болезни, поражающей как местных жителей, так и военных. Заболевание, считавшееся новой разновидностью тяжелого гриппа, сопровождалось резким повышением температуры и часто приводило к параличам и даже гибели заболевших.
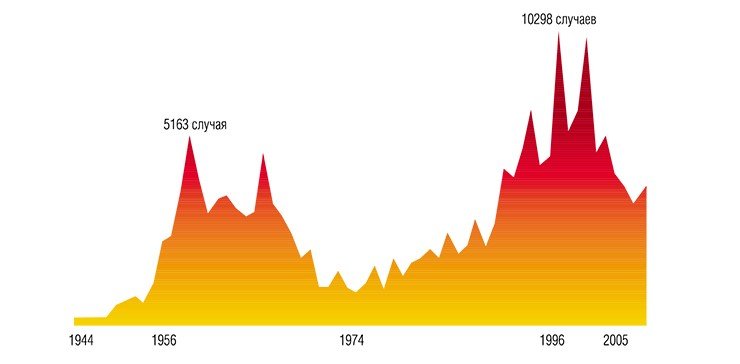
Правильно диагностировать неизвестную болезнь удалось лишь в 1935 г. местному врачу А. Г. Панову. Заболевание оказалось воспалением мозга, т. е. энцефалитом, похожим по симптомам на описанный ранее японский энцефалит. В 1936 г. врачи дальневосточной пастеровской станции пытались выделить возбудителя заболевания, вводя мышам в мозг эмульсию мозга людей, погибших от энцефалита. Но, несмотря на то, что у мышей появлялись признаки заболевания, исследования не увенчались успехом.
В январе 1937 г. военные медики обратились в Наркомздрав СССР, где и было принято решение об организации на Дальний Восток научной экспедиции под руководством Л. А. Зильбера. В тяжелых полевых условиях была развернута настоящая вирусологическая лаборатория. Ученые свою задачу выполнили: патоген, вызывающий тяжелые заболевания центральной нервной системы, был успешно выделен и описан. Кроме того, была четко установлена определяющая роль иксодовых клещей в передаче инфекционного агента. Выяснилось, что источником заражения клещей служили дикие позвоночные животные, на основе чего были разработаны рекомендации по необходимым профилактическим мерам.
К сожалению, это поистине блестящее открытие, ставшее важной вехой в истории вирусологии, не обошлось без жертв среди самих участников научной экспедиции. Так, М. П. Чумаков – будущий академик и создатель Института по изучению полиомиелита – перенес тяжелейшую форму инфекции, перешедшую у него в хроническую пожизненную форму; последствием заболевания у В. Д. Соловьева стала шестимесячная слепота.
Опасный сосед
Что на сегодня известно о вирусе клещевого энцефалита (ВКЭ)? Вирус относится к достаточно старому в эволюционном плане семейству флавивирусов (Flaviviridae), включающему более 70 вирусов животных и человека, в том числе такие опасные, как вирус желтой лихорадки, японского энцефалита, вирус лихорадки Денге и вирус гепатита C.

Лев Александрович ЗИЛЬБЕР (1894—1966) – один из основоположников медицинской науки в СССР. С его именем связаны фундаментальные исследования изменчивости у бактерий и природы иммунитета, организация первых в стране вирусологических центров, создание и экспериментальная разработка вирусо-генетической теории происхождения опухолей, а также совершенно нового направления – иммунологии рака.
За работу по выявлению возбудителя и переносчика весенне-летнего энцефалита в 1937 г. был награжден премией Наркомздрава СССР, но в том же году арестован по ложному обвинению, что экспедиция, которую возглавлял Зильбер, тайно распространяла японский энцефалит на Дальнем Востоке, и освобожден лишь через полтора года. В короткий промежуток времени между освобождением и новым арестом работал над монографией об эпидемических энцефалитах, подготовил несколько статей.
Основным природным резервуаром ВКЭ служат мелкие млекопитающие (полевки, мыши, насекомоядные). Вирус способен заражать животных и размножаться в их организме, однако заболевание протекает у них зачастую без видимого вреда для здоровья. Переносчиками вируса являются клещи, питающиеся кровью лесных зверьков, – европейский лесной клещ, таежный, луговой клещи, а также ряд других, более редко встречающихся видов. ВКЭ может размножаться и в их организме. Точно не известно, был ли вирус первоначально связан только с клещами, или только с позвоночными животными, но в процессе эволюции он приспособился к существованию в организмах как тех, так и других.
В настоящее время вирус клещевого энцефалита встречается в лесных регионах по всей территории Евразии от Атлантического океана до Тихого, причем в целом область его распространения совпадает с ареалами европейского лесного и таежного клещей. В последние десятилетия ареал ВКЭ неуклонно расширяется, что связано с усилением хозяйственной деятельности человека. Так, заброшенные лесные вырубки зарастают мелкими кустарниками и заболачиваются, что создает идеальные условия для обитания мелких млекопитающих и связанных с ними клещей.
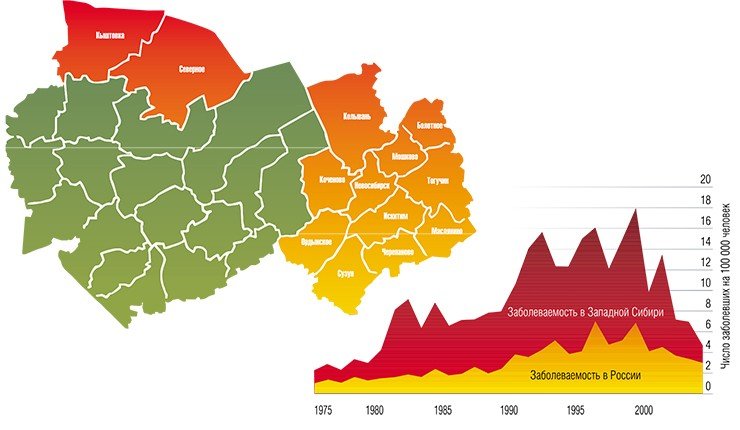
Кроме того, все большее число людей предпочитает проводить свободное время на природе, отдыхая или работая на приусадебных участках. В той же Новосибирской области около 75% населения проживает на территории, условия которой благоприятны для жизни клещей, здесь же сосредоточена и основная масса летних оздоровительных учреждений, зон массового отдыха, садово-дачных участков.
В Институте химической биологии и фундаментальной медицины были исследованы 95 штаммов вируса клещевого энцефалита из коллекции Института систематики и экологии животных СО РАН, выделенных от взрослых особей таежного клеща, собранных с растительности в восточной части Новосибирской области в 1980—2001 гг.
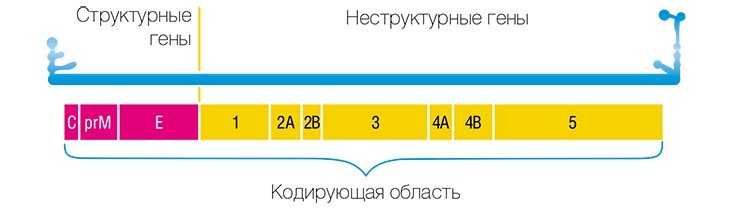
Анализ нуклеотидных последовательностей фрагмента гена Е, кодирующего белок оболочки вируса, показал, что все штаммы соответствуют сибирскому генетическому типу.
С другой стороны, в крови людей, госпитализированных с подозрением на клещевые инфекции, в совместных исследованиях с новосибирскими медиками были обнаружены изоляты ВКЭ, относящиеся к дальневосточному генетическому типу.
Ранее считалось, что этот тип вызывает только тяжелые формы заболевания, тогда как сибирский – преимущественно хронические. Наши исследования, подтвержденные данными других авторов, показали, что вирус дальневосточного генетического типа способен вызывать различные формы клещевого энцефалита, начиная от самых тяжелых и заканчивая стертыми, никак не проявляющимися.
Геном вируса клещевого энцефалита был расшифрован в 1989—1990 гг. практически одновременно в нашей стране (в том числе и в Институте химической биологии и фундаментальной медицины СО РАН (Pletnev et al., 1990)) и за рубежом (Mandl et al., 1989). На сегодня выделено три генетических типа вируса, различающихся по своим свойствам: дальневосточный, сибирский и западноевропейский. Такая привязка генетического типа к географическому местоположению достаточно условна, поскольку в одном регионе могут встречаться штаммы, относящиеся к разным типам.
Для вируса клещевого энцефалита, как и для большинства других вирусных инфекций, не существует высокоспецифических методов лечения – в этом заключается его опасность. Лечение всех вирусных заболеваний направлено в основном на стимуляцию иммунитета и устранение внешних симптомов заболевания, а дальше организм должен сам справляться с инфекцией. ВКЭ опасен еще и тем, что способен вызывать хронические формы заболевания, а его последствиями могут быть параличи и инвалидность. Поэтому важнейшим делом в исследовании этого инфекционного агента является разработка методов диагностики и профилактики заболевания.
Диагностика и профилактика
В клинической диагностике вируса клещевого энцефалита наиболее распространены серологические методы, с помощью которых в крови пациента определяют наличие антител, специфических защитных белков, или наличие самого агента. Однако чувствительность этих методов не слишком высока, к тому же существует вероятность ошибки из-за возможных перекрестных реакций с другими патогенами. Кроме того, с их помощью невозможно получить подробную характеристику самого возбудителя (например, определить его генетический тип).
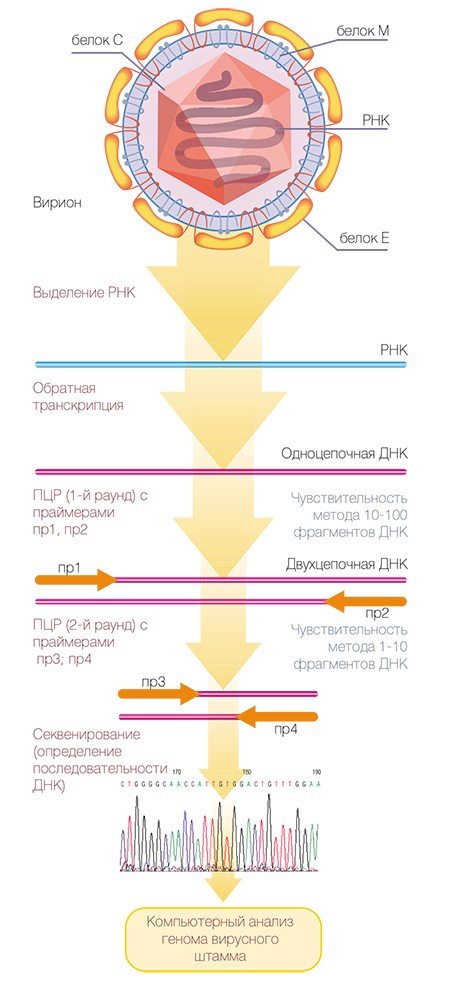
Молекулярно-генетические методы, направленные на специфическое распознавание генетического материала вируса, обладают более высокой чувствительностью. Особенно это относится к методу полимеразной цепной реакции** (ПЦР), благодаря которой можно размножить, а потом идентифицировать ничтожное количество наследственного материала вируса, что позволяет провести диагностику в течение первых дней после заражения. Однако при некоторых обстоятельствах достоинства могут переходить в недостатки: генодиагностика ВКЭ молекулярно-генетическими методами благодаря высокой чувствительности может также приводить к ошибкам, обусловленным многочисленными новыми мутациями вирусных геномов, а кроме того, предъявляет высокие требования к чистоте экспериментов.

Живые вакцины
Живые вакцины – способ стимуляции иммунитета введением в организм ослабленных вирусов, открытый еще в 1796 г. английским врачом Э. Дженнером. С тех пор была получена живая вакцина против вируса желтой лихорадки, отличающаяся от высокопатогенных штаммов многочисленными заменами нуклеотидов в геноме; продолжаются поиски ослабленных штаммов флавивирусов Денге, Западного Нила и Лангат для разработки на их основе живых вакцин.
Были предприняты попытки создания живой вакцины и против вируса клещевого энцефалита. В 1957 г. в качестве такой живой вакцины было решено использовать ослабленный штамм флавивируса Лангат, вызывающий в организме выработку антител, подобных антителам к ВКЭ. Однако выяснилось, что при внутримозговом введении этот штамм сам становится патогенным и вызывает энцефалиты и атрофию участков мозга без внешних клинических проявлений. В дальнейшем были обнаружены ослабленные штаммы самого ВКЭ, но, к сожалению, все они оказались генетически нестабильными.
Вот трагический пример использования живых вакцин против ВКЭ. В 1969 г. от больного, у которого после укуса клеща в течение 4 лет не было клинических проявлений заболевания, но в крови сохранялись высокие титры антител, был выделен ослабленный штамм вируса клещевого энцефалита. Лабораторные исследования выявили его низкую нейровирулентность, после чего были проведены клинические испытания на добровольцах, давшие положительные результаты. В конечном счете ослабленным штаммом ВКЭ было иммунизировано около 650 тыс. человек. Однако 35 вакцинированных получили тяжелые осложнения в виде менингитов и менингоэнцефалитов, причем у 22 из них тяжелые последствия заболевания остались на всю жизнь, а один человек умер. Использование этого штамма в качестве живой вакцины было прекращено (Timofeev, Karganova, 2003).
ДНК-копии
С помощью подобных манипуляций были созданы живые химерные вакцины, содержащие, например, часть генов вируса желтой лихорадки и часть генов других флавивирусов. При этом в функционально важные участки их геномов были введены точечные мутации, вызывающие ослабление патогенности (Pletnev et al., 2006).
Тем не менее в настоящее время применение ослабленных живых вакцин, в том числе и против ВКЭ, ограничено, поскольку существует вероятность превращения ослабленных штаммов в высокопатогенные штаммы дикого типа. Это происходит потому, что в клетке-хозяине отсутствуют системы коррекции мутаций, которые могут возникнуть в вирусной РНК. Гарантией безопасности таких вакцин могла бы служить утрата больших фрагментов вирусных геномов, однако это приводит к значительному снижению жизнеспособности самих вирусов-мутантов.
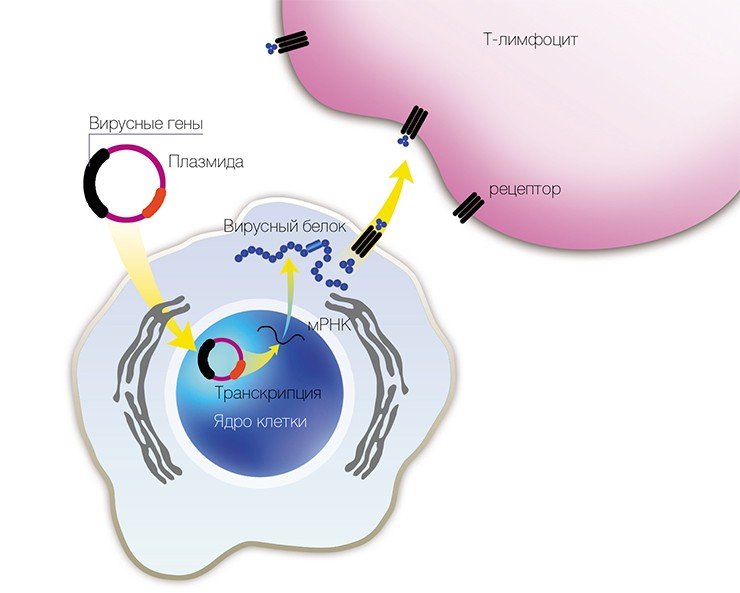
Нужно отметить, что исследования флавивирусов, как и многих других патогенов, осложняются их высокой инфекционностью, следствием которой являются строгие требования безопасности, а также дороговизной самих вирусных препаратов. И в этом смысле использование неинфекционных ДНК-копий генома ВКЭ является очень перспективным направлением.
В ИХБФМ был получен ряд генно-инженерных ДНК, содержащих в том числе и полноразмерную ДНК-копию генома вируса клещевого энцефалита (Dobrikova et al., 1996). Конструирование подобных стабильных ДНК-копий вирусных геномов открывает широкие возможности для исследования хода размножения вируса в клетках, изучения функций отдельных вирусных белков и их комплексов.
Иммунизация генами
В 1993 г. появился новый подход к профилактике инфекционных заболеваний – генная иммунизация, основанная на прямом введении в организм генно-инженерной ДНК, рекомбинантных плазмид (векторов-переносчиков), содержащих не весь геном, но отдельные гены возбудителя заболевания.
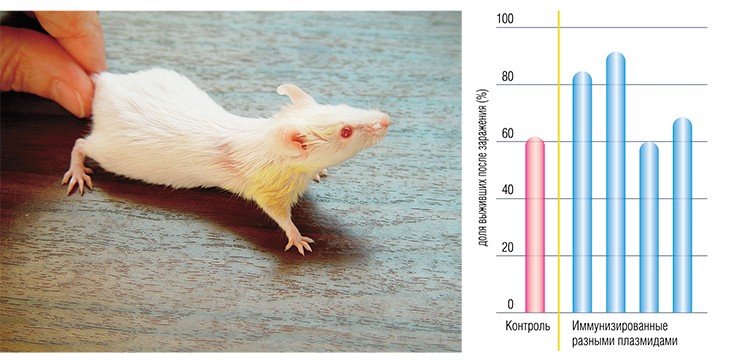
Учеными из ИХБФМ были сконструированы четыре таких плазмиды, содержащие различные гены одного из штаммов вируса клещевого энцефалита. Для оценки эффекта генной иммунизации привитых мышей заражали летальными дозами того же штамма ВКЭ. В результате оказалось, что некоторые плазмиды обладают определенным защитным эффектом.
В качестве вакцин против вирусных заболеваний ученые предполагают использовать генно-инженерные плазмиды, в которые встроены отдельные гены вирусов
Чтобы изучить возможные нежелательные эффекты этих вакцин, плазмиды вводили в различные клеточные культуры. В результате выяснилось, что при увеличении времени культивирования клеток до нескольких месяцев наблюдалась существенная модификация плазмид и встраивание их в хозяйский геном.
Таким образом, несмотря на положительные результаты генной вакцинации, вопрос о применении ДНК-вакцин в настоящее время остается открытым, поскольку препятствием к их использованию также является проблема безопасности. Возможно, преодолеть это препятствие удастся созданием РНК-вакцин с аналогичным принципом действия, для которых не существует риска интеграции в ДНК-геном хозяйской клетки. Но это уже задачи будущих исследований.
Возможно ли полностью избавиться от ВКЭ, например, уничтожив его основных переносчиков, иксодовых клещей? В свое время такая попытка была сделана с использованием печально известного ДДТ, но последствия массовой обработки лесов сильнейшим ядом были поистине ужасающими.
Читайте также:


