Взаимодействие нервной и иммунной систем молекулярно-клеточные аспекты
- 12124
- 9,9
- 0
- 12
![]()
Ольга Матвеева
![]()
Антон Чугунов![]()
Андрей Панов

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Дао гомеостаза
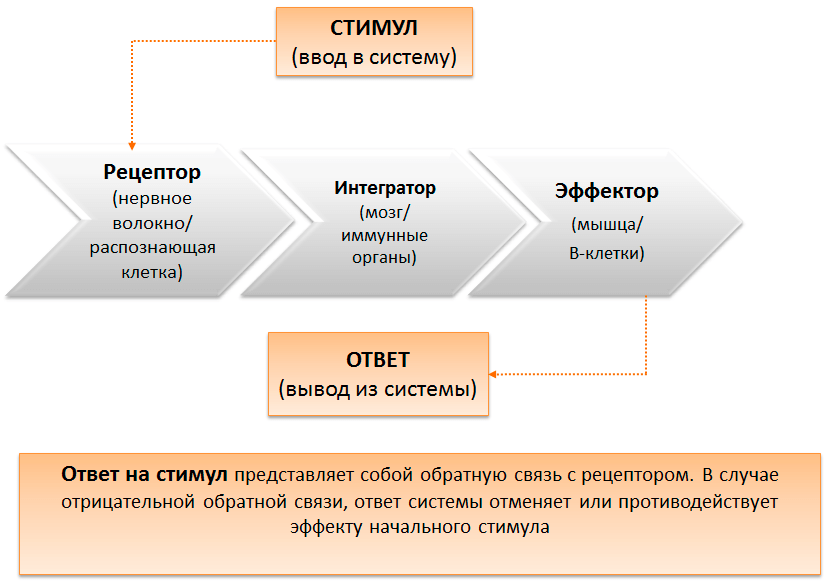
Рисунок 1. Гомеостáз (др.-греч. ομοιος — подобный, одинаковый + στασις — стояние, неподвижность) — это способность организма поддерживать функционально значимые переменные в пределах, обеспечивающих его оптимальную жизнедеятельность. Регуляторные механизмы, поддерживающие физиологическое состояние или свойства клеток, органов и систем целостного организма на уровне, соответствующем его текущим потребностям, называются гомеостатическими. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991–1996 гг.
Сходства больше, чем различия?
Давно было отмечено, что нервная и иммунная системы имеют некоторые общие черты в принципах функционирования (рис. 2), а именно:
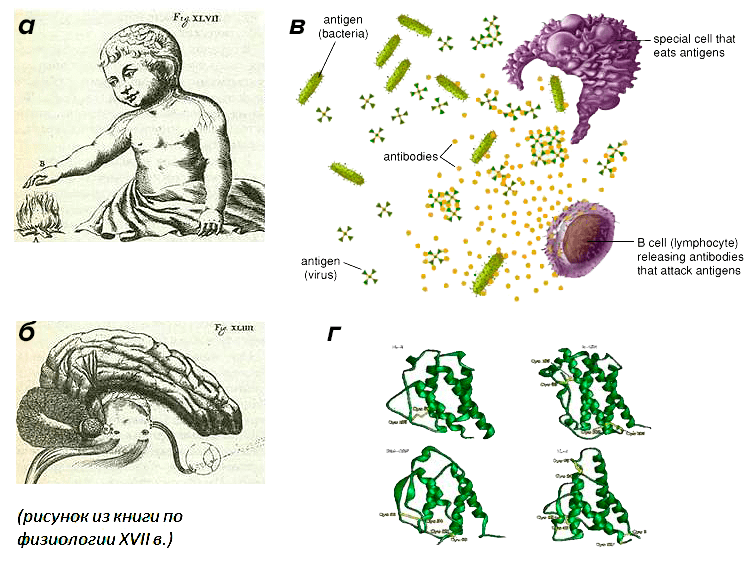
Рисунок 2. Параллели в работе нервной и иммунной систем. а — осязание; б — зрение; в — распознавание антигена; г — цитокины. Нервная система воспринимает сенсорные сигналы (физические, химические, эмоциональные), а иммунная — чужеродные субстанции (антигены, опухолевые клетки), которые не могут распознать нервная и эндокринная системы. При этом иммунная система использует эндокрин-подобные механизмы взаимодействия с нервной системой, а именно химические сигналы, где медиаторами служат цитокины.
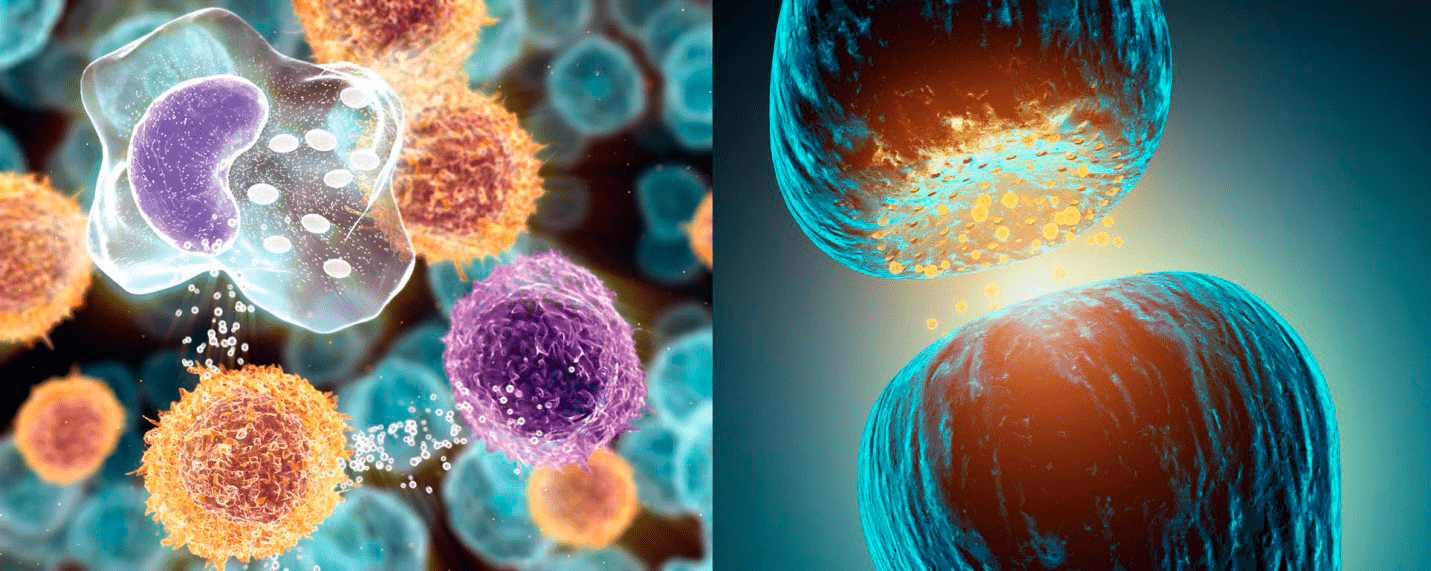
Рисунок 3. Цитокины и нейромедиаторы. Слева: Цитокины — группа гормоноподобных белков и пептидов — синтезируются и секретируются клетками иммунной системы и другими типами клеток. Цитокины принимают участие в регуляции роста, дифференцировки и продолжительности жизни клеток, а также в управлении апоптозом. Справа: Нейромедиаторы — физиологически активные вещества, вырабатываемые нервными клетками. С помощью нейромедиаторов нервные импульсы передаются от одного нервного волокна другому волокну или другим клеткам через пространство, разделяющее мембраны контактирующих клеток; это пространство, называемое синаптической щелью, является составной частью синапса.
Лавина научных открытий
После прохождения первого рубежа исследований данные о тесной взаимосвязи нервной и иммунной систем стали появляться регулярно. Было установлено, что иммунная система способна отвечать на активность клеток в ряде мозговых структур (рис. 4), таких как гипоталамус, гипофиз, гиппокамп, миндалина, вентральное поле покрышки и др., а также чувствительна к изменениям в нейрохимических системах мозга — дофаминергической, серотонинергической и др. [7].
Рисунок 4. Ключевым звеном центрального аппарата нервной регуляции функций иммунной системы является гипоталамус. Он связан со всеми звеньями центрального аппарата нервной регуляции и дает начало сложному эфферентному пути передачи центральных нейрорегуляторных влияний на иммунокомпетентные клетки, которые обладают соответствующими рецепторами к нейротрансмиттерам, нейропептидам, а также к гормонам эндокринных желёз.
Были открыты иммуномодулирующие свойства нейропептидов, что позволило существенно дополнить представления о механизмах передачи сигналов от нервной системы к иммунной. На иммунокомпетентных клетках обнаружены рецепторы ко многим известным нейропептидам, что доказывает их участие в реализации эфферентного звена нейроиммунного взаимодействия (рис. 1). Выявлены конкретные медиаторы, с помощью которых реализуется взаимосвязь между иммунокомпетентными и нервными клетками. Так, была открыта продукция опиоидных пептидов иммунокомпетентными клетками и доказана возможность действия медиаторов иммунитета на нервные клетки.
В то же время долго оставался неясным вопрос о механизмах обратной связи от иммунной системы к нервной.
Недостающее звено коммуникации
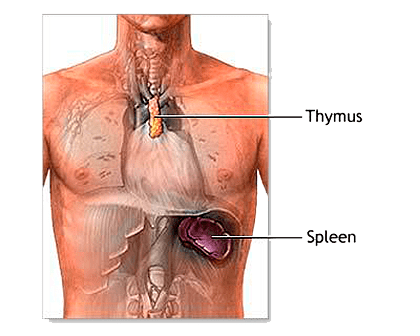
Наконец, в 80-е годы была обнаружена продукция ряда гормонов и опиоидных пептидов иммунокомпетентными клетками и доказана возможность действия медиаторов иммунитета на нервные клетки [2]. Группа опиоидных пептидов была впервые обнаружена среди миелопептидов; в костном мозге выявлен предшественник эндорфинов — проопиомеланокортин.
Опиоидные пептиды и их предшественник были затем найдены и в вилочковой железе (тимусе) — рисунок 5. Принципиально важными стали также работы по изучению нейротропной активности цитокинов, которые, как оказалось, обладают способностью регулировать функции структур ЦНС, включая гипоталамус (центр гормональной регуляции!) и гиппокамп (ключевая структура процессов памяти), и влиять на состояние основных нейромедиаторных систем (норадреналина, серотонина и дофамина). Оказалось, что стресс и эмоциональное напряжение приводят к гомеостатическим сдвигам в иммунной и нейроэндокринной системах [8].
В преддверии новых открытий
Все это в свою очередь привело исследователей к предположению о том, что ряд иммунных расстройств может быть обусловлен нарушением работы в структурах нервной системы и наоборот. Все эти предположения еще предстояло проверить на практике. И одной из наиболее строгих проверок должны были стать испытания, полученные в клиниках. Особый интерес представлял анализ психотропного эффекта препаратов, обладающих способностью модулировать иммунный ответ (рис. 6).
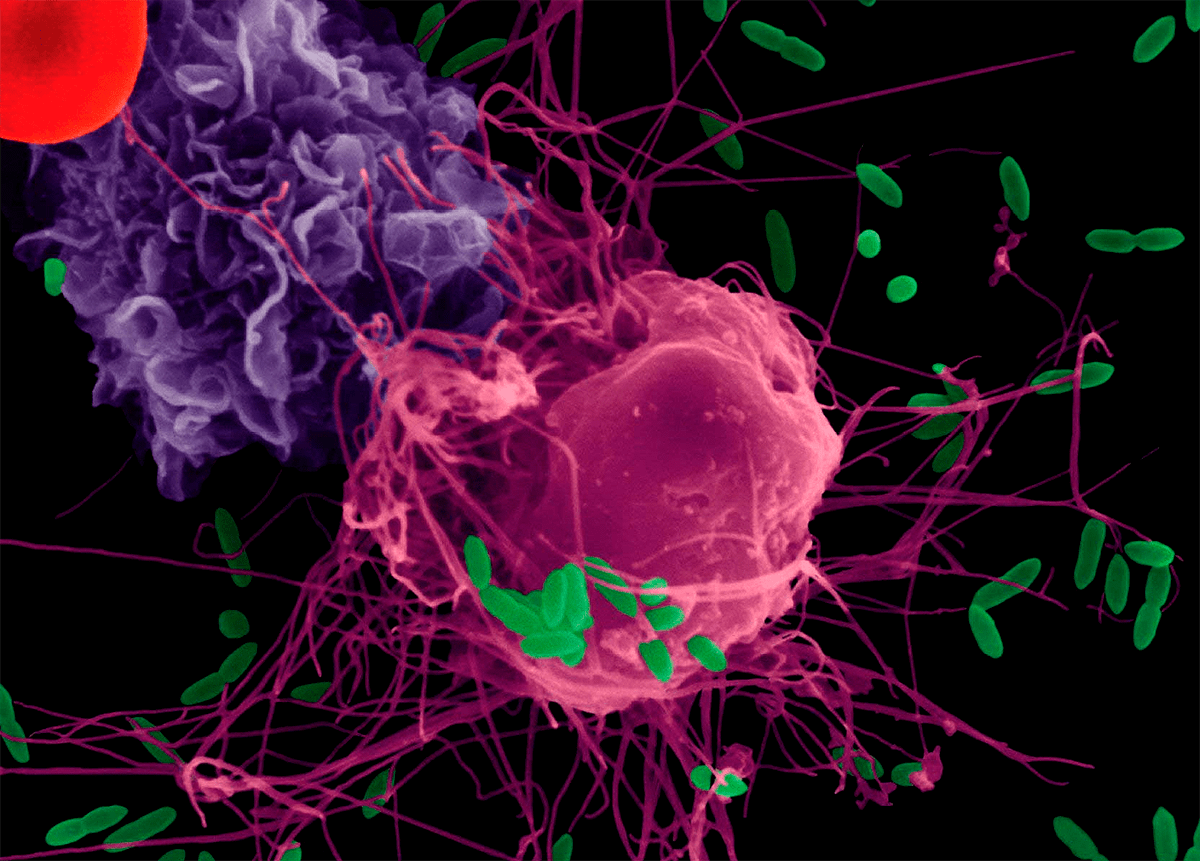
Рисунок 6. Цитокины влияют на выделение и обмен норадреналина и серотонина в головном мозге, в особенности в гипоталамусе и гиппокампе, оказывая как стимулирующее, так и тормозящее воздействия на основные медиаторные системы, приводя, в конечном итоге, к модуляции эмоционального состояния и процессов памяти, влияя на мотивацию поведения.
От теории к практике: новые подходы к эффективной терапии и диагностике
Интерес к проблеме повторно возник в связи с клиническими исследованиями. Первоначально в экспериментальных работах было замечено, что изменение поведения у лабораторных животных приводит к изменению параметров иммунной системы [2]. После чего, в последние десятилетия, тема нервно-иммунных взаимодействий перестала быть исключительно теоретической и нашла свое клиническое применение, вначале в соматической и неврологической практике, а затем и в психиатрии. Появились новые возможности диагностики психических расстройств на основе объективных данных и кардинально новые методы оценки эффективности терапии, в том числе и психофармакотерапии. При этом особое внимание уделяется изучению взаимодействий иммунной, нервной и эндокринной систем при стрессовых воздействиях, при тревожных расстройствах и депрессии [2].
Доклинические оценки монотерапии иммуномодуляторами (а именно, деринатом и тактивином) были проведены автором данной статьи и коллективом лаборатории эволюции механизмов обучения и памяти на кафедре физиологии высшей нервной деятельности в МГУ им. М.В. Ломоносова. В нашей работе оценивалось влияние иммуномодуляторов на коррекцию нарушений, вызванных хронической алкоголизацией [9], [10], острым и хроническим стрессом [11–13], а также на восстановление нормальных когнитивных функций (а именно, обучения и памяти), сниженных после воздействия повреждающих факторов [14]. По результатам работы были сделаны выводы о том, что данные иммуномодуляторы сами по себе способны оказывать корректирующее и протекторное действие на когнитивные функции. В нашей работе оценивалось изменение уровня обучения и памяти в разных условиях — как в норме, так и при искусственно созданной патологии, вызванной действием таких факторов как стресс и хроническая алкоголизация. Нами показано, что препарат пептидов тимуса проявляет ноотропный эффект (его сравнивали с классическим ноотропом — пирацетамом), что сказывается на темпах обучения. Также ему свойственен анксиолитический и общий протекторный эффект, что позволило животным эффективно обучаться и быстро адаптироваться в условиях давления стресса и токсичного действия алкоголя. Отдельно оценивалась способность иммуномодуляторов повышать устойчивость организма к стрессу как таковому — физическому (удары током), эмоциональному (резкое изменение условий опыта), острому (кратковременная иммобилизация), хроническому (долговременная иммобилизация). Нами получены данные о том, что иммуномодулятор тактивин оказывает эффективное стресс-протекторное действие, которое снижает пагубные последствия жесткого стресса. (У людей, как известно, стресс может явиться причиной большого ряда заболеваний, в числе которых инсульты, инфаркты, снижение иммунитета, депрессия и прочие.) При этом заметно улучшались показатели физического состояния животных, подвергшихся стрессу [13].
Данные, полученные в клинических и доклинических исследованиях, обосновывают возможность разрабатывать новые терапевтические подходы при диагностике и лечении психических заболеваний. Для психофармакологии поиск новых безопасных средств или способов снизить побочный эффект терапии особенно важен, т.к. на сегодняшний день большинство психотропных препаратов обладают выраженными побочными эффектами (например, метадоновая терапия героиновых наркоманов), либо недостаточно эффективны (хронические формы депрессии и шизофрения).
Расширенная диагностика
К настоящему времени исследованию иммунологических нарушений при тревожных и тревожно-депрессивных расстройствах посвящено достаточно большое число работ [16–18]. Для тревожных расстройств в настоящее время установлено, что при их развитии происходит активация Т-лимфоцитов, которые являются одними из основных источников и регуляторов секреции и продукции цитокинов [17].
Для ряда психических расстройств отмечалась связь между наличием и характером психопатологической симптоматики и уровнями интерферонов α и γ (то есть в патологический процесс также вовлекается иммунная система). Эти данные получены для таких заболеваний, как шизофрения, аутизм, синдром нарушенного внимания, депрессивные расстройства, навязчивые расстройства, рассеянный склероз, системная красная волчанка, ревматоидный артрит, что в свою очередь оправдывает применение иммуномодуляторов в клинике психических расстройств (рис. 7).
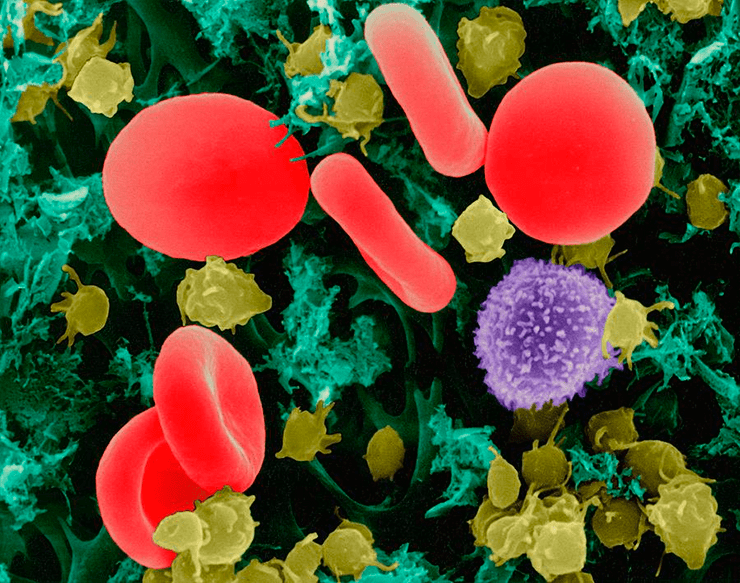
Рисунок 7. Иммуномодуляторы — это лекарственные препараты, восстанавливающие при применении в терапевтических дозах функции иммунной системы (эффективную иммунную защиту). В группу иммуномодуляторов выделяют препараты животного, микробного, дрожжевого и синтетического происхождения, обладающие специфической способностью стимулировать иммунные процессы и активировать иммунокомпетентные клетки (Т- и В-лимфоциты) и дополнительные факторы иммунитета (макрофаги).
Особенно интересными эти данные выглядят в свете того, что разные классы нейролептиков и антидепрессантов [15], применяющихся в клинике, обладают иммуномодулирующей активностью и способностью влиять на цитокиновую систему [18].
Новые методы лечения
С середины 1970-х годов в терапии психических расстройств применяются иммуномодуляторы и другие иммунотропные препараты. Одной из причин применения иммунотропных препаратов при психических расстройствах считается терапевтическая резистентность больных, в развитии которой важную роль играют иммунные нарушения.
Иммуннотропные препараты нормализуют иммунологические показатели в случае их отклонения от нормы в ту или иную сторону, не вызывая критических нарушений. В настоящее время существует успешная история применения иммунотропных препаратов и интерферонов в комплексной терапии. Примеры приведены в приложении в конце статьи.
Единичные исследования эффективности иммуномодуляторов в составе монотерапии (т.е. без использования традиционных для данных случаев психотропных средств) проводились при лечении шизофрении, терапии навязчивых состояний, нервной анорексии и других заболеваний ЦНС, однако в настоящее время данных для оценки эффективности такой терапии недостаточно. Таким образом, перспективы применения иммуномодулирующих пептидов в качестве монотерапии на новом поле, а именно в клинике психических расстройств и состояний зависимости (наркоманий), а также появление новых терапевтических комбинаций и диагностических методов — это перспективная задача будущих исследований. Ее успешное решение должно привести к появлению нового типа лекарств и новых методов терапии, воздействующих не на одно (в отдельности), а сразу на несколько ключевых звеньев гомеостаза. Предположительно, это позволит найти новые и более безопасные методы лечения ряда заболеваний, которые на настоящий день не имеют эффективного лечения, например, шизофрении, героиновой наркомании и алкоголизма.
В клинических исследованиях при включении в традиционное лечение иммуномодуляторов наблюдались благоприятные эффекты, такие как снижение клинической симптоматики, снижение побочных эффектов традиционного лечения, преодоление резистивности, более стойкий и быстрый прогресс лечения. Примеры группа пациентов, успешно принимавших иммуномодуляторы в комплексной терапии:
Тактивин больные наркоманией и алкоголизмом [20]. Миелопид больные со смешанным тревожно-депрессивным расстройством; редукция психопатологической симптоматики наступает быстрее; значительно снижает риск возникновения нежелательных побочных эффектов психофармакотерапии и уменьшает их интенсивность [21]. Галавит больные с астеническим расстройством; оказывает более выраженное воздействие в сравнении с монотерапией ноотропами [22]. Ликопид больные с генерализованным тревожным расстройством; частота и степень выраженности соматических и вегетативных симптомов снижалась в сравнении с монотерапией психотропными препаратами [23]. Пропротен купирует основные соматовегетативные и психопатологические нарушения и устраняет эмоциональное напряжение у больных при алкогольном абстинентном синдроме; стресспротектор, анксиолитик [24]. Интерферон-β лечение рассеянного склероза [25]. Реаферон экспериментальный нейротоксический паркинсонизм, профилактическое введение реаферона предупреждает развитие паркинсонизма [17]. Тимусные пептиды эффективны для коррекции психоневрологического статуса больных шизофренией и больных психогенной депрессией [26]. Копаксон используется в терапии при рассеянном склерозе [25]. Левамизол снижает симптоматику приступообразной и непрерывно прогрессирующей шизофрении и других, в том числе резистентных, форм этого заболевания [27]. Бромантан и кемактан предупреждают развитие экспериментальной трифазиновой каталепсии; приводит к повышению умственной и физической работоспособности, физической выносливости, также при этом происходит коррекция иммунологического статуса [17].

Установлено, что взаимодействие иммунной и нервной систем имеет комплексный характер, начиная от индуцирования их афферентных отделов на ранних этапах иммуногенеза и кончая последующей активацией эфферентных звеньев указанных систем. В основе этого взаимодействия лежит способность цитокинов выступать в качестве как иммунорегулятора, так и нейропептида. Показано, что взаимодействию иммунной и нервной систем присущи системные интегративные признаки - способность иммуноактивных веществ воздействовать на афферентные анализаторы и изменять интенсивность иммунного ответа в крови, способность иммуномодуляторов изменять базисные параметры функционирования нервной системы.
Отмечено наличие в иммуноактивных препаратах нейропептидной активности. Доказаны: участие ОП в регуляции функций ИС и возможность направленной активации эндогенной опиоидной системы путём транскраниальной электростимуляции (ТЭС). Под ТЭС понимают воздействие через покровы черепа импульсного тока определённых параметров. При этом активируется антиноцицептивная система, что приводит к развитию аналгезии и увеличению в крови концентрации ОП (b-эндорфина, мет-энкефалина) (В.П. Лебедев, 1983-1986). Установлено, что синтетические ОП и ТЭС оказывают широкий спектр влияний на различные субпопуляции ИКК и способны регулировать реакции гуморального и клеточного иммунитета. Выраженность и направленность иммунотропных эффектов ОП обусловлены их концентрацией, типом клеток, их способностью взаимодействовать с рецепторами разных классов, в различной степени экспрессирующихся клетками ИС определённых субпопуляций.
Активация опиоидэргической эндогенной системы при помощи ТЭС нормализует функционирование ИС, предотвращает патологические изменения в организме, обусловленные стрессом или введением преднизолона. Это формирует определенный пространственно-временной паттерн перестройки активности иммунной и ноцицептивной систем, изменяет динамическое взаимодействие регуляторных систем организма, делает возможным нейроэндокринную коррекцию его адаптивных механизмов. Приоритетная роль в координации болевой чувствительности и иммунокомпетентности принадлежит опиоидэргической системе.
Итак, ТЭС обладает широким спектром воздействия на ноцицептивную систему и ИС, и претендует на роль иммуномодулятора для внедрения в практическое здравоохранение, так как активирует широкий спектр биологических эффектов ОП, включающий аналгетический, иммуномодулирующий, противовоспалительный. Включение ТЭС в комплексную терапию пациентов с термической травмой и послеоперационных больных оказывает выраженное модулирующее влияние на иммунную систему, проявляющееся в количественной и качественной нормализации субпопуляций лимфоцитов, сывороточных Ig М и G и увеличении функциональной активности нейтрофилов. Практическое применение ТЭС в клинике даёт возможность производить нейроэндокринную коррекцию функционирования ИС организма, открывает перспективы для профилактики и терапии различных патологических состояний, связанных с иммунодефицитами. Использование ТЭС способствует повышению клинической эффективности базисной терапии у хирургических больных, что проявляется улучшением общего состояния, ранним устранением симптомов интоксикации, снижением интенсивности болевого синдрома, очищением раневой поверхности, снижением частоты инфекционных осложнений. Полученные результаты дополняют представления о взаимодействии нервной и эндокринной систем в их влиянии на ИС.
Таким образом, теоретически обоснован и экспериментально разработан новый подход к решению проблемы регуляции иммунного ответа, базирующийся на том, что взаимодействие иммунной и нервной систем характеризуется комплексностью, включающей: многообразие каналов, по которым осуществляется это взаимодействие; последовательность их функционирования; наличие в нервной системе антиген- специфического и антиген-неспецифического звеньев иммунорегуляции, её зависимость от интенсивности иммунного ответа, дозы регулирующего субстрата, времени его воздействия и проявляющейся в способности иммуноактивных препаратов изменять базисные функции нервной системы.
Все органы иммунной системы (тимус, костный мозг, селезенка, лимфатические узлы) обладают двумя вариантами иннервации — симпатической и парасимпатической. В настоящее время изучены основные нервные пути и структуры ЦНС, связанные с иннервацией органов иммунной системы.
Различными исследователями описаны изменения иммунологических процессов при локальном повреждении глубоких структур мозга, изменения интенсивности иммунного ответа при стимуляции определенных структур ЦНС, условно-рефлекторная модуляция интенсивности иммунологических реакций, нейрофизиологические процессы в мозге в динамике развития иммунных реакций (импульсивная активность нейронов, реакции на иммунизацию и др.), роль важнейших нейромедиаторов в регуляции функций иммунной системы, а также связь между стрессом и иммунитетом.
Новейшие данные демонстрируют, что ЦНС, взаимодействующая с иммунной системой, не является ни изолированной, ни пассивной:
1) периферические иммунные клетки могут пересекать ГЭБ;
2) нейроны ЦНС и глия активно регулируют реакции лимфоцитов и макрофагов;
3) клетки микроглии иммунокомпетентны, хотя и отличаются от других макрофагов/дендритных клеток по способности направлять нейропротективные лимфоцитарные реакции.
ЦНС демонстририует признаки вовлеченности в воспалительный процесс; при повреждении, инфекции или ином поражении резидентные клетки ЦНС генерируют воспалительные медиаторы (провоспалительные цитокины, простагландины, свободные радикалы и комплемент), которые, в свою очередь, индуцируют хемокины и молекулы адгезии, рекрутируют иммунные клетки, а также активируют клетки глии.
Практически любое повреждение тканей ЦНС, включая процессы дегенерации, инфекции, образования опухолей и аутоиммунные реакции, сопряжено с наличием значительного клеточного воспалительного компонента. Хотя ГЭБ препятствует диффузии гидрофильных (иммунных) молекул через капилляры головного мозга, активированные лимфоциты без затруднений проходят через эндотелиальный слой посткапиллярных венул.
Нервной и иммунной системам присущ ряд общих свойств и функций. Они обеспечивают взаимодействие организма со средой, обладают способностью воспринимать сигналы из внешней и внутренней среды (при этом нервная система воспринимает сенсорные сигналы, а иммунная — генетически чуждые), поддерживают постоянство внутренней среды организма, сохранение его гомеостаза. Для различных нозологических форм патологии нервной и иммунной систем у новорожденных характерны именно сочетанные неврологические и иммунологические расстройства.
Дифференциация стволовых клеток крови
Среди систем иммунного надзора (наряду с кожной и др.) рассматривается подсистема головного мозга. В качестве материального субстрата ткани головного мозга, ответственного за иммунный биологический надзор, выступают клетки микроглии (клетки системы мононуклеарных фагоцитов) и астроциты (клетки нейроглии). Не исключено, что в систему иммунобиологического надзора входят Т- и В-лимфоциты, а также иные типы клеток.
На мембране Т-лимфоцитов и нейронов имеется общий антиген Тх-1, подтверждающий общность ЦНС и иммунной системы. В крови и лимфе обнаруживается немало нейропептидов (нейротензин, субстанция Р, энкефалины, эндорфины, пептид-дельта сна и т.д.), которым предположительно принадлежит ведущая роль в интегративной деятельности нервной, иммунной и эндокринной систем. Это обусловлено наличием на их клетках одинаковых рецепторов, через которые осуществляется описываемая взаимосвязь.
Уникальное иммунологическое окружение ЦНС регулирует основную часть местных воспалительных реакций, хотя в ряде случаев происходит иммунно-опосредованное поражение головного мозга. Экспериментальные данные свидетельствуют, что Т-клетки ЦНС вырабатывают интерферон гамма (ИФН-у), ИЛ-4, ИЛ-10, но продукция ИЛ-2 у них дефицитарна (по сравнению с периферическими Т-клетками).
Эндогенные клетки самой ЦНС (микроглия, астроглия, периваскулярные клетки и др.) могут инициировать, регулировать и поддерживать реакции иммунного ответа: представление антигена Т-лимфоцитам, поляризация цитокинового ответа этих клеток и т.д. Помимо фагоцитарной функции, клетки микроглии (внутренние макрофаги ЦНС) участвуют в регуляции неспецифического воспаления, а также в реакциях адаптивного иммунитета. Контроль глиальных иммунных функций осуществляется нейронами.
Периваскулярные клетки центральной и периферической нервной системы (гетерогенная популяция) являются иммунорегуляторами, обеспечивающими взаимодействие между этими двумя отделами нервной системы.
В частности, наряду с изменениями со стороны показателей гуморального иммунитета (наличием аутоантител), в иммунологическом статусе у детей с миастенией присутствуют и другие изменения (лимфоидные субпопуляции, продукция ИЛ), т.е. цитокины играют немаловажную роль в иммунопатогенезе миастении.
Нейромедиаторные системы активно участвуют в регуляции функций иммунной системы. Так, серотонинергическая система при ее стимуляции приводит к снижению интенсивности иммунного ответа, оказывая тормозное действие на функции иммунной системы. При этом ингибирующие эффекты центрального генеза реализуются через ось гипоталамус-гипофиз-надпочечники. Дофаминергическая система, напротив, характеризуется стимулирующим влиянием на иммунные функции, для реализации которого необходимы гипоталамус-гипофиз-вилочковая железа. ГАМК-эргическая система обладает двунаправленным иммуномодулирующим действием (усиление или ослабление иммунных реакций).
Е.А. Корнева подчеркивает, что взаимодействие перечисленных нейромедиаторных систем (серотонин-, дофамин- и ГАМК-эргической), имеющее значение для конечного результата нейромодуляции иммунного ответа, осуществляется в центральных нейрохимических структурах мозга.
Общеизвестно влияние стресса на иммунные процессы. Разнонаправленность указанных эффектов у детей первого месяца жизни обусловлена различиями в нейрогуморальных компонентах стрессорных реакций и особенностями иммунного ответа со стороны клеточных (лимфоидных) популяций в различных ситуациях. Имеются веские основания констатировать позитивные и негативные изменения в формировании и осуществлении клеточного и гуморального иммунного ответа, которые зависят от происхождения стрессорных факторов, интенсивности и продолжительности его воздействия на ЦНС и организм в целом. Стрессы небольшой выраженности способствуют у новорожденных стимуляции активности иммунной системы, а глубокий хронический стресс (дистресс) обычно приводит к угнетению иммунологических функций.
Аутоиммунитет нервной системы имеет прямое отношение к нейроиммунопатологии. Аутоиммунитет характеризуется частичной или полной утратой толерантности (или естественным отсутствием реакции) по отношению к собственным антигенам организма, вследствие чего вырабатывающиеся аутоантитела и/или цитотоксичные клетки могут приводить к развитию заболеваний. Именно формирование иммунотолерантности в ЦНС (in situ) выполняет роль механизма, который предотвращает феномен аутоиммунитета. Инициация аутоиммунного процесса требует комплексного взаимодействия нейроэндокринной системы со специфическими факторами иммунной системы.
Воспалительные цитокины ИФН-у и ФНО-а (цитопатический цитокин, цитотоксичный по отношению к олигодендроцитам in vitro) обнаруживаются при различных аутоиммунных заболеваниях, и предполагается, что они участвуют в индукции и патогенезе этих форм патологии.
Нейроиммунные процессы чаще не индуцируют патологию ЦНС, а возникают на стадии прогрессирующей неврологической патологии неиммунного генеза и становятся одним из компонентов ее патогенеза, поскольку для формирования истинной нейроимунопатологии необходимы такие патофизиологические предпосылки, как повреждение нейрональных структур и нарушение ГЭБ или их сочетание.
Аутоиммунные заболевания представляют разнородную группу нарушений преимущественно неизвестной этиологии с плохо изученным патогенезом. При многих системных аутоиммунных заболеваниях может наблюдаться демиелинизация ЦНС, являющаяся следствием сосудистых, гранулематозных или постинфекционных поражений нервной системы. Следует помнить, что у новорожденного может быть более одного органоспецифического или системного аутоиммунного заболевания.
Аутоиммунные заболевания могут поражать любые органы и системы у пациентов всех возрастов, при этом их мишенями нередко оказываются центральная и периферическая нервная система. В соответствии с современными представлениями, аутоиммунные болезни представлены двумя группами патологии: органоспецифические и системные заболевания. В подавляющем большинстве случаев заболевания, рассматриваемые с позиций нейроиммунологии, относятся к числу системных.
Гормональная регуляция иммунного ответа обычно рассматривается с позиций влияния гормонов эндокринной системы на иммунитет и касается роли гормонов и медиаторов, вырабатаваемых самой иммунной системой (для регуляции созревания, взаимодействия и функционирования ее клеток). Имеются все основания констатировать существование единой регуляторной системы организма, объединяющей нервную, иммунную и эндокринную системы.
Иммунная система, как и ЦНС, способна распознавать, запоминать и извлекать информацию из памяти. Нейроны анализаторной и лимбической систем головного мозга являются носителями функций неврологической памяти. К носителям функции иммунологической памяти относятся определенные субпопуляции Т- и В-лимфоцитов (лимфоциты памяти).
Помимо других влияний, иммунная система новорожденных находится также под контролем эндокринной (нейроэндокринной) системы. Гормоны и нейротрансмиттеры взаимодействуют с иммунокомпетентными клетками посредством соответствующих рецепторов. На лимфоцитах, моноцитах, гранулоцитах и тучных клетках имеются опиоидные рецепторы, которые также влияют на иммунный ответ. Так, предполагается, что опиоидные пептиды, выделяемые при стрессе, способны оказывать супрессивное действие на иммунологическую функцию клеток, могут влиять на натуральные киллеры опосредованно — модулируя выделение ряда гормонов (АКТГ, адренокортикоидов), подавляющих различные иммунологические реакции (в том числе активность NK).
Иммунная система распознает внешние и внутренние антигенные сигналы разной природы, запоминая и передавая полученную информацию через кровоток в ЦНС при помощи цитокинов. ЦНС, обработав поступивший сигнал, оказывает регуляторное влияние на иммунную систему при помощи нейропептидов и ряда гормонов гипоталамо-гипофизарно-адреналовой оси.
Цитокиновая система в ЦНС является не аномалией, а важным компонентом ее нормального функционирования. Цитокины способны оказывать влияние на поведение, память, стрессорные реакции, повреждение мозга. Гормоны, пептиды и нейротрансмиттеры принимают участие в регуляции иммунной системы, во врожденном и адаптивном иммунитете.
На мембранах лимфоцитов обнаружены рецепторы к медиаторам — b-эндорфину, метэнкефалину, белку Р, адренергическим веществам. Установлено, что иммунокомпетентные клетки способны продуцировать эндорфин, энкефалин и кортикотропин.
Читайте также:





