Моноклональные антитела при мигрени
Профилактика Мигрени: Моноклональные антитела могут стать дополнительным вариантом лечения

На конгрессе европейской академии неврологии в Копенгагене были обсуждены новые методы лечения, которые позволяли бы предотвращать или сокращать продолжительность приступов мигрени.
Мигрень встречается у 6-8 процентов мужчин и у 10-12 процентов женщин, и является одним из наиболее распространенных неврологических заболеваний. По данным Всемирной организации здравоохранения (ВОЗ), мигрень является одним из пяти ведущих неврологических расстройств, и у пациентов периоды головной боли занимают, в общей сложности, несколько лет. "В 2015 году около 109 здоровых лет жизни были потеряны в расчете на 100000 человек из-за мигрени. Эта цифра может быть изменена к лучшему в будущем, благодаря появлению новых методов лечения. Достижения в области профилактики мигрени дают надежду на то, что мы сможем в будущем улучшить качество жизни для людей, страдающих мигренью ", объяснил проф. До. Шпренгер из клиники DKD HELIOS Висбаден, Германия, на втором съезде Европейской Академии неврологии (EAN) в Копенгагене.
Механизмы профилактического лечения остаются неясными
"Существует еще мало исследований того, каким образом действуют методы профилактического лечения. Одним из потенциальных механизмов может быть подавление коркового распространения депрессии (CSD) -волна, которая движется по всей коре головного мозга со снижением возбудимости нейронов," объяснил профессор Шпренгер . Эксперименты на моделях животных позволили предположить ,что CSD лежит в основе визуальной ауры при мигрени у человека . Многие профилактические препараты способны подавлять этот процесс. Вообще говоря, снижение примерно на 50 процентов дней с мигренью, по крайней мере, у половины пациентов рассматривается, как реалистичная цель профилактической терапии. Профилактическое лечение должно также значительно уменьшить интенсивность боли и гарантировать, что можно будет также снизить продолжительность приступов мигрени .
Препараты с доказанной эффективностью
"Как правило, препаратами первого выбора являются: бета-блокаторы, такие как пропранолол и метопролол, противосудорожные, такие как вальпроат и топирамат, и блокатор каналов кальция флунаризин. Несколько рандомизированных плацебо-контролируемых исследований показали, что эти препараты могут уменьшить частоту приступов мигрени, несмотря на то, что большинство из них первоначально были разработаны для лечения других состояний, " говорит профессор Шпренгер. Определенные надежды также возлагаются на использование для профилактики приступов мигрени новых препаратов, таких как ангиотензин-конвертирующий фермент и антагонистов рецепторов ангиотензина II - особенно кандесартана. "Кандесартан доказал свою эффективность в двух плацебо-контролируемых исследованиях, в которых 16 мг кандесартана сравнивали с плацебо и 160 мг пропранолола. Кандесартан показал свою эффективность аналогичную пропранололу, и оба были выше плацебо", подтвердил эксперт.
Новые методы лечения: моноклональные антитела, таргетированные на CGRP
Определенные надежды в настоящее время связывают с моноклональными антителами, которые нацелены на нейропептид, под названием CGRP (Кальцитонин геномный пептид). CGRP играет ключевую роль в патогенезе первичной головной боли. Антагонисты рецепторов CGRP уже используются для лечения острой мигрени и профилактики. Несмотря на то, что они являются весьма эффективными, они также имеют многочисленные недостатки: в некоторых случаях лечение приходилось прекращать из-за острых побочных эффектов, в том числе, таких как заметное увеличение ферментов печени, в результате чего антагонисты рецепторов CGRP не применяются широко в клинической практике. По данным исследований, опубликованных на сегодняшний день, новое моноклональное антитело против CGRP, или его рецептора, по-видимому, лучше переносится. "Хотя безопасность и эффективность при лечении эпизодической и хронической мигрени еще предстоит подтвердить в ходе трех исследований, я уверен, что мы будем иметь доступ к новым лекарственным средствам, которые были специально разработаны для этого состояния, что поможет нам решить проблему первичной головной боли, "добавил профессор Шпренгер.
Ботулинотоксин укорачивает приступы мигрени
Применение ботулинического токсина типа А (BTX-A; onabotulinumtoxinA) также используется для лечения хронической мигрени. Хронические мигрени связаны с частым развитием головной боли, что приводит к значительному снижению качества жизни пациентов из-за интенсивных головных болей. Положительный эффект от этой терапии был констатирован в ходе крупных исследований, и ботулинотоксин также продемонстрировал свою эффективность при лечении хронических мигреней в клинической практике.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В статье приведены данные об инновационных методах лечения мигрени

Для цитирования. Азимова Ю.Э., Рачин А.П., Ищенко К.А., Данилов А.Б. Инновационные методы лечения мигрени // РМЖ. Болевой синдром. 2015. С. 27–30.
Мигрень – распространенное заболевание, а ее сложная нейробиология привлекает и интересует врачей и исследователей на протяжении столетий. Типичные приступы мигрени характеризуются интенсивной пульсирующей головной болью, усиливающейся при движении и сопровождающейся тошнотой и/или рвотой, свето- и звукобоязнью.
Одной из первых теорий возникновения мигрени была сосудистая теория, которая появилась в результате революционной экспериментальной работы Г. Вольфа и коллег. Они показали, что внутривенное введение эрготамина, обладающего сосудосуживающим действием, приводило к уменьшению головной боли. С другой стороны, было показано, что дигидроэрготамин подавляет активность нейронов второго порядка в тригеминоцервикальном комплексе, что позволило предположить нейрогенный механизм действия этих препаратов. В настоящее время известно, что изменения кровотока во время приступов мигрени не являются клинически значимыми, не запускают мигренозную атаку, а диаметр сосудов не коррелирует с проводимой терапией. Согласно современной теории, в основе мигрени лежит дисфункция нейромодулирующих структур ствола головного мозга, что подтверждается данными позитронно-эмиссионной томографии, показавшей активацию в дорсолатеральных отделах моста. Таким образом, признание мигрени как первичного заболевания головного мозга имеет важное значение в понимании механизмов развития болезни и поиске новых терапевтических подходов [21].
Было доказано, что среди всех заболеваний мигрень занимает 3-е место по степени нарушения трудоспособности, опережая онкологические заболевания, инсульт и ишемическую болезнь сердца [24]. Кроме того, в недавно опубликованном Оксфордском популяционном исследовании выявлено, что мигрень является фактором риска развития транзиторной ишемической атаки (ТИА) и инсульта в старшем возрасте [17]. Учитывая распространенность мигрени, а также медицинскую и социальную значимость этого заболевания, исследователи активно занимаются поиском средств эффективной терапии мигрени.
Фармакотерапия
Доступные на сегодняшний день препараты для купирования приступа мигрени разделяются на специфические и неспецифические. Неспецифические средства, такие как парацетамол, ацетилсалициловая кислота, ибупрофен, напроксен, эффективны при легких и умеренных приступах [1]. Кодеин-содержащие анальгетики могут быть эффективны у некоторых пациентов, но их использование должно быть ограничено из-за возможности развития абузусной (лекарственно-индуцированной) головной боли и лекарственной зависимости. Прием барбитурат-содержащих препаратов также не несет клинической пользы. Эрготамин и дигидроэрготамин, а также триптаны являются специфическими противомигренозными средствами с продолжительной историей изучения эффективности, однако эффект развивается не в каждом приступе, имеются ограничения по безопасности [2].
Поскольку мигрень существенно влияет на повседневную активность, по-прежнему актуально улучшение эффективности противомигренозных средств. Эффективность препаратов для купирования мигрени оценивается клинически при помощи дневника головной боли. Эффективным считается средство, купирующее боль или значительно уменьшающее ее в течение 2 ч после приема и обеспечивающее отсутствие возврата головной боли в течение 24 ч без значимых побочных эффектов.
Потребность в новых препаратах для лечения мигрени по-прежнему существует. Так, имеются ограничения применения триптанов у пациентов с сердечно-сосудистой патологией, инсультом, инфарктом миокарда в анамнезе, ишемической болезнью сердца (ИБС). В настоящее время на различных стадиях клинических исследований находятся несколько групп препаратов.
Препараты, воздействующие на кальцитонин-ген родственный пептид (CGRP)
Являются наиболее перспективной группой. CGRP представляет собой нейропептид, а рецепторы к нему обнаружены в стенке менингеальных артерий, тройничном ганглии, окончании тройничного нерва, в околоводопроводном сером веществе, а также в других областях мозга, участвующих в патогенезе мигрени. Приступ мигрени сопровождается значительным выбросом CGRP. Эти данные легли в основу создания нового класса препаратов – джепантов. На сегодняшний день синтезированы 2 препарата: ольцеджепант (BIBN4096BS, вводится внутривенно) и телкаджепант (МК-0974, перорально). Ольцеджепант показал эффективность купирования мигренозного приступа и хорошую переносимость во II фазе клинических исследований, а телкаджепант – в III фазе. В крупном многоцентровом рандомизированном контролируемом исследовании телкаджепант (300 мг) был эффективнее, чем золмитриптан (5 мг) и плацебо. К сожалению, телкаджепант не может использоваться с профилактической целью для лечения мигрени, т. к. повышает уровень печеночных трансаминаз [9].
Моноклональные антитела к CGRP
Весьма перспективным направлением является создание моноклональных антител к CGRP. В настоящее время активно изучаются 4 препарата на основе моноклональных антител. Эти препараты используются как для профилактики эпизодической, так и для лечения хронической мигрени. LY2951742, ALD403, AMG 334, LBR-101 прошли II и III фазы клинических исследований, показав высокую эффективность, а также приемлемый профиль безопасности, и, по-видимому, войдут в рутинную практику в ближайшее время [25].
Антагонисты глутамата
Глутамат является важнейшим активирующим нейромедиатором и играет ключевую роль в передаче сенсорной и болевой информации в головном и спинном мозге. Глутамат действует через ионотропные рецепторы (iGluR) и G–белок семейства метаботропных рецепторов. Рецепторы iGluR делятся на 3 подтипа: N-метил-D-аспартатные (NMDA), α–амино-3-гидрокси-5-метил-4-изоазолепропионовые (АМРА) и каинатные. Глутаматергические нейроны расположены в тригеминальном ганглии и модулируют активность 5–HT1B / 1D / 1F-рецепторов. Также глутамат играет ключевую роль в активации тригеминоваскулярной системы, развитии центральной сенситизации и распространяющейся корковой депрессии. Было показано, что неселективная блокада АМРА и каинатных рецепторов снижает активацию тригемино-цервикальной системы.
В небольшом клиническом исследовании антагонист АМРА и каинатных рецепторов LY-293558 (тезампанел) был эффективнее плацебо и сопоставим по эффективности с суматриптаном по всем основным показателям. В исследовании с использованием модели нейрогенной вазодилатации активация рецептора iGluR5 подавляла расширение сосудов твердой мозговой оболочки, следовательно, антагонист каинатных рецепторов может оказывать центральное антиноцицептивное действие. Другой блокатор глутаматных рецепторов, BGG492, проходит II фазу клинических исследований [13].
Антагонисты ваниллоидных рецепторов (TRPV1)
Стимулируют неселективные ионные каналы, которые активируются капсаицином. Эти рецепторы расположены в центральной и периферической части тригеминальной системы. Ингибирование TRPV1 блокирует центральную сенсибилизацию. Тем не менее во II фазе исследований антогониста ваниллоидных рецепторов SB-705498 различий с плацебо получено не было [5].
Ингибиторы NO-синтазы
Доказано, что оксид азота (NO) активирует тригемино-васкулярную систему и опосредует выброс CGRP. Кроме этого, через NO происходит регуляция тонуса церебральных и экстрацеребральных сосудов. Расширение церебральных сосудов в классической теории мигрени считалось ключевым звеном патогенеза заболевания. Следовательно, согласно этой теории, ингибиторы NO-синтазы могли бы быть эффективны при мигрени. Тем не менее современными методами исследования мигрени показано, что вазодилатация при мигрени является всего лишь эпифеноменом. В небольшом когортном исследовании высокоселективный ингибитор NO-синтетазы GW274150 показал обезболивающее действие, однако эффективность не была подтверждена в рандомизированном двойном слепом плацебо-контролируемом исследовании [16].
Комбинации уже использующихся препаратов и их новые лекарственные формы
Комбинации противомигренозных средств – еще один путь повышения их эффективности. В основе более высокой эффективности комбинированных препаратов лежит феномен фармакологической синергии. Так, действуя на различные рецепторы и различные звенья патогенеза мигрени, комбинированные препараты обладают большим эффектом, чем отдельные компоненты. Однако немаловажным свойством комбинированных препаратов должна быть их безопасность. Так, барбитураты и кодеин, входящие в состав комбинированных анальгетиков, обладают аддиктивным потенциалом и способны спровоцировать развитие хронической абузусной головной боли. Прием триптанов и кофеин-содержащих анальгетиков может быть ограничен у пациентов пожилого возраста с неконтролируемой артериальной гипертензией.
Среди комбинированных препаратов существует средство для лечения мигрени – Нурофен Мультисимптом, содержащий 400 мг ибупрофена и 325 мг парацетамола. Такое сочетание не присутствует ни в одном из представленных на рынке препаратов. Ибупрофен является НПВС и оказывает анальгетическое, противовоспалительное, жаропонижающее действие, блокирует фермент циклооксигеназу (ЦОГ-1 и ЦОГ-2), нарушает метаболизм арахидоновой кислоты, уменьшает количество простагландинов. Парацетамол неизбирательно блокирует ЦОГ, преимущественно в ЦНС, т. к. в воспаленных тканях пероксидазы нейтрализуют влияние парацетамола на ЦОГ-1 и ЦОГ-2, что объясняет низкий противовоспалительный эффект. Таким образом, во время приступа мигрени ибупрофен подавляет нейрогенное воспаление, а парацетамол – центральную и периферическую сенситизацию. Так, в одном из исследований [20] были показаны преимущества комбинации ибупрофена и парацетамола, прежде всего в отношении купирования болевого синдрома (рис. 1). Парное сравнение при помощи теста ANOVA показало достоверные различия между следующими группами: ибупрофен 400 мг / парацетамол 1000 мг с плацебо во всех временных точках (р Литература

Этот пост из рубрики Радар продолжает тему нового класса лекарств для профилактики мигрени. На этот раз речь пойдет про моноклональное антитело против рецептора CGRP. Сейчас идет исследование III фазы с этим препаратом, которое включает пациентов в России и еще нескольких странах.
Мигрень – это очень распространенное хроническое нейроваскулярное заболевание, от которого страдает около 12% населения развитых стран. У большинства людей атаки мигрени случаются до 3 раз в месяц, плюс к этому – до 8 случаев аур ежемесячно.
Что такое ауры мигрени можете прочитать в статье Медиатор мигрени.
Существует и несколько классов лекарств для профилактики мигрени, но их применение ограничено скромной эффективностью и неудобствами, понижающими качество жизни. Сравнительные исследования показывают, что эффект существующих препаратов для профилактики мигрени, после удаления эффекта плацебо, составляет снижение на 1.2-1.8 дней с мигренью в месяц, по сравнению с моментом до начала профилактики.
Минимального эффекта от профилактических лекарств приходится ждать 2-3 месяца, а максимальной эффективности они достигают только через 8-13 месяцев. Универсальных рекомендаций по длительности применения профилактических препаратов нет, но, в любом случае, принимать их нужно очень долго и при этом ежедневно. Такой режим выдерживают максимум 25% пациентов, начинающих профилактику. Плюс еще 20% бросают эти лекарства из-за побочных эффектов, ведь для этих целей используют серьезные препараты: противоэпилептические, антидепрессанты, ингибиторы обратного захвата серотонина, антигипертензивные, бета-блокаторы, кальциевые блокаторы, триптаны и другие.
Они не всем подходят, в том числе и по безопасности. Так что, на этом фронте есть, что улучшать. Людям нужны лекарства, которые будут обладать хорошей эффективностью и безопасностью, а еще такие, чтобы их было удобно принимать.
Новая мишень
В предыдущей статье я упоминал мишень, которую сейчас разрабатывают для новых препаратов для профилактики и купирования приступов мигрени. Эта мишень – рецептор Calcitonin Gene-Related Peptide (CGRP).
Сейчас в разработке два класса новых лекарств – антагонистов CGPR: это низкомолекулярные ингибиторы и моноклональные антитела против этого рецептора. В прошлый раз я говорил про низкомолекулярные MK-1602 и MK-8031 производства Merck, а сегодня расскажу про моноклональное антитело AMG 334 производства компании AMGEN.
Причины мигрени, как и ее механизмы, изучены пока лишь частично, но многие исследователи сходятся во мнении, что в ее основе лежат два ключевых элемента – это локальное расширение сосудов головного мозга и следующее за этим локальное воспаление.
На каком-то этапе развития мигрени происходит активация ганглия тройничного нерва, приводящая к выбросу различных медиаторов из его волокон. Один из медиаторов, высвобождающийся из чувствительных волокон тройничного нерва – это пептид CGRP.
Этот пептид обладает очень мощным сосудорасширяющим эффектом. Предположительно усиление его выброса и приводит к локальной вазодилатации и отеку. Это, в свою очередь, вызывает повреждение окружающей ткани и реакцию иммунной системы. Повышенная проницаемость стенок расширенных сосудов способствует миграции воспалительных клеток в зону повреждения и развитию локального воспаления.
Эти события приводят к раздражению и повышению чувствительности рецепторов и нервов, участвующих в болевой иннервации, в том числе и через чувствительные волокна тройничного нерва. Вероятно, это способствует дальнейшему выбросу CGRP и замыканию порочного круга.

Все это – пока гипотезы, но роль CGRP в механизмах мигрени доказана косвенно – в экспериментах на животных и людях. Во-первых, хорошо известно, что в момент приступа мигрени в крови сосудов головного мозга и слюне повышается содержание CGRP. Во-вторых, клинический эффект от триптановых препаратов коррелирует со снижением уровня этого пептида. В-третьих, введение этого медиатора может вызвать приступ мигрени, а антагонист его рецептора – погасить этот приступ.
По этой причине, антагонисты CGRP-рецепторов сформировали новый класс, пока еще экспериментальных, препаратов. Merck делает ставку на маленькие молекулы, а AMGEN (и некоторые другие производители) – на антитела. Адепты иммунотерапии объясняют свой выбор более высокой специфичностью моноклональных антител к конкретному рецептору (а следовательно, теоретически, меньшим количество побочных эффектов от действия не на те рецепторы), а также длительным периодом депонирования антитела в организме, что может позволить реже вводить лекарство.
AMG 334 – это моноклональное антитело, обладающее антагонистическим эффектом в отношении CGRP-рецептора. В мае на 17 Конгрессе International Headache Society в Валенсии AMGEN поделилась результатами плацебо-контролируемого исследования II фазы у пациентов с мигренью.
Исследование NCT01952574 сравнило AMG 334 против плацебо в качестве меры профилактики у пациентов с частотой приступов от 4 до 14 в месяц. Исследование состояло из двух частей. В первой пациенты получали 12-недельное лечение препаратом или плацебо. Во второй части всех пациентов перевели на AMG 334. Ожидается, что вторая часть продлится до 2020 года.
483 пациента были рандомизированы в соотношении 3:2:2:2 в следующие группы:
- AMG 334, 7 мг
- AMG 334, 21 мг
- AMG 334, 70 мг
- Плацебо
Препарат и плацебо давали в виде подкожных инъекций, один раз в месяц. Таким образом за 12 недель каждый пациент получил только 3 инъекции. Есть разница по сравнению с ежедневным применением, не так ли?
Эффективность AMG 334 и плацебо оценили по трем стандартным критериям:
- Уменьшение количества дней в месяц, в которые у пациента была мигрень
- Сравнение % пациентов в группах, у которых количество дней с мигренью уменьшилось вдвое
- Уменьшение количества дней в месяц, в которые пациентам пришлось применять лекарства для купирования приступов
До начала лечения у всех пациентов медианное значение количества дней с мигренью было 8.7 дней в месяц. Уже после трех инъекций возникла достоверная разница между группами AMG 334 70 мг и плацебо –

В группе с дозой препарата 70 мг через 3 месяца среднее количество дней с мигренью уменьшилось на 3.4 дня, а в группе плацебо – только на 2.88 дня. Разница было достоверной, p = 0.021. Процент пациентов, у которых количество дней с мигренью уменьшилось вдвое, составил 46.5% в группе AMG 334 70 мг и 29.9% в группе плацебо. Эта разница тоже была достоверной, p = 0.011. И, наконец, количество дней, в которые пациентам пришлось принимать лекарства для купирования приступов, уменьшилось на 1.64 дня в месяц в группе препарата в дозе 70 мг и на 0.69 дня в месяц в группе плацебо. И эта разница тоже была достоверной, p = 0.004.
Что было с пациентами после 12 недель?
В июне 2015 Amgen опубликовал предварительные результаты второй части исследования. Разработчики проанализировали эффективность AMG 334 после 52 недель приема, то есть после 13 ежемесячных инъекций.
Результаты получились такие:
- У 62% пациентов количество дней с мигренью уменьшилось вдвое по сравнению с началом исследования
- У 38% пациентов – на три четверти
- У 20% — приступов к концу 52 недель мигрени больше не было
В среднем у тех, кто получил 52 недели лечения количество дней с мигренью уменьшилось на 4.9 дней в месяц по сравнению с началом исследования.
Статистики по побочным эффектам пока нет. Известно только, что серьезные побочные эффекты (SAE) были отмечены только у 13 пациентов, и лишь одно из них было связано с препаратом. Какое именно – неизвестно. Исследование II фазы продолжается.
Что дальше?
Воодушевившись этим результатами, разработчики запустили в июле 2015 года исследование III фазы, NCT02483585, которое уже сейчас набирает пациентов в США, Дании, Франции, Португалии, России и Испании.
Это исследование продлится до октября 2017. Amgen планирует включить в него 540 человек. Квота России составит 150, если я правильно понял сайт Минздрава.
Критерии включения такие:
- Возраст от 18 до 65 лет
- Мигрени с аурой или без, как минимум 12 месяце в анамнезе
- От 4 до 15 дней с мигренью в месяц
- Способность заполнять электронный дневник
- Первые мигрени появились до возраста 50 лет
К сожалению, более конкретных критериев пока нет.
Тех, кто подойдет по критериям, рандомизируют в одну из двух групп:
- AMG 334, один раз в месяц, в виде подкожной инъекции
- Плацебо, один раз в месяц, в виде подкожной инъекции
Длительность плацебо-контролируемой части составит 12 недель, то есть 3 месяца, за которые пациенты получат три инъекции препарата или плацебо. Затем последует продолжение, в которое все участники из обеих групп будут получать AMG 334 еще 28 недель.
По данным сайта Минздрава набор пациентов предполагается здесь:
Буду обновлять этот пост, если появится какая-нибудь новая информация. Что-нибудь узнаете – сигнализируйте, пожалуйста.
Показалось интересным или полезным — подпишитесь на анонсы новых статей в наших пабликах ВКонтакте и Фейсбуке.

Одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, препарат Aimovig помогает предотвращать приступы мигрени.
Approuvé par l’Agence américaine du médicament (FDA), le médicament Aimovig permet de prévenir la migraine.
От мигрени страдает каждый десятый житель на планете, чаще – женщины. При этом хроническом неврологическом заболевании регулярно (несколько раз в месяц) возникают приступы сильной головной боли, сопровождающиеся тошнотой, рвотой, нарушениями зрительного восприятия, повышенной чувствительностью к свету, шуму и запахам. Мигрень ухудшает качество жизни, провоцирует развитие депрессии, влияет на отношения в семье и на работе. Во время приступа 90% людей не могут ни работать, ни сконцентрироваться на элементарных ежедневных делах. Треть людей, подверженных этому недугу, стараются не строить долгосрочных планов, опасаясь, что их придется отменить в последнюю минуту из-за внезапной боли.
- Novartis предложил революционное лекарство против рака груди?
- Генная терапия против рака, разработанная Novartis, одобрена в США
- Вакцина от гриппа производства Novartis попала под запрет
- Связь с коррупционным делом в Китае обойдется Novartis в 25 млн франков
- Novartis инвестирует в российскую фармацевтику
- 15 суток фармахолдингу Novartis
Речь идет о принципиально новом методе борьбы с мигренью, который должен ознаменовать собой начало новой эры в профилактике этого заболевания. Препарат Aimovig представляет собой моноклональные антитела, воздействующие на рецепторы кальцитонин ген-родственного пептида (КГРП). Блокировка этого нейропептида, уровень которого повышается при мигрени, может предотвратить возникновение приступа. Препарат вводится с помощью шприца-ручки SureClick один раз в месяц и доступен в двух дозировках – по 70 и 140 мг.
Эффективность, переносимость и безопасность лекарства была оценена в клинических испытаниях, в которых участвовали более 3 000 человек. Выяснилось, что люди, принимающие Aimovig, значительно реже страдали от мигрени по сравнению, с теми, кто принимал плацебо: у многих испытуемых количество приступов снизилось как минимум на 50%. Кроме этого, средство помогло даже тем пациентам, на которых не подействовали другие методы лечения. Самые распространенные побочные эффекты – реакции в месте инъекции и констипация. 2% пациентов прекратили испытания средства из-за побочных эффектов.
В мае использование Aimovig для профилактики мигрени у взрослых было одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Одна инъекция многообещающего лекарства обойдется в 575 долларов в месяц или почти 7 000 долларов в год. В ближайшее время ожидается, что Aimovig получит одобрение и в ЕС. Сотрудничество Novartis и Amgen началось в августе 2015 года. Сейчас обе компании работают над терапией, способной замедлить развитие болезни Альцгеймера.
Возможно, сообщение о новом лекарственном средстве улучшит имидж Novartis после недавнего скандала. Напомним, что в последнее время концерн со штаб-квартирой в Базеле упоминался в прессе в связи с Essential Consultants – консалтинговой компанией, принадлежащей адвокату Дональда Трампа Майклу Коэну. По информации американских СМИ, именно через Essential Consultants Коэн заплатил порноактрисе Сторми Дэниелс за молчание о ее предполагаемой связи с Трампом. В феврале 2017 года, вскоре после президентских выборов в США, Novartis и Essential Consultants заключили соглашение, согласно которому Майкл Коэн должен был консультировать фармаконцерн по поводу возможных решений администрации нового американского президента в сфере здравоохранения, в частности, речь шла о проекте Obamacare. После первой встречи представители Novartis отказались от услуг Коэна, но соглашение было составлено таким образом, что разорвать его в любое время было невозможно. В итоге, концерн в течение года ежемесячно перечислял американскому адвокату 100 000 долларов и заплатил ему в общей сложности 1,2 млн долларов – ни за что. История спровоцировала многочисленные дискуссии в швейцарских газетах и привела к отставке главного юриста Novartis Феликса Эрата, который назвал соглашение ошибкой. Он покинет свой пост 1 июня.
11 декабря 2019
- 1641
- 1,3
- 0
- 3
Когда в голове война
![]()
Илья Ясный![]()
Андрей Панов
- Медицина
- Нейробиология
- Рецепторы
- Фармакология

Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Партнер спецпроекта — компания GE Healthcare Life Sciences — производит высокотехнологичное оборудование и обладает всеми биотехнологическими, инженерными и производственными возможностями. Компания воплощает опыт, инновационные решения и широкий спектр услуг для создания крупносерийного биофармацевтического производства, разработки новых лекарств и вакцин, исследования клеток и белков. Это позволяет заказчикам GE по всему миру занимать лидирующие позиции, быть более эффективными и прогрессивными. Компания поддерживает исследователей, фармацевтические компании и врачей в разработке, производстве и использовании новых препаратов и методов лечения.
Как велика проблема?
Мигрень — неврологическое заболевание, характерное в первую очередь сильными приступами головной боли, — известно уже более 3000 лет [3]. Однако несмотря на хорошую изученность симптомов и проявлений, причины мигрени до конца не установлены до сих пор. Ранее считали, что мигрень вызывается изменениями мозгового кровообращения, но сейчас многие исследователи предполагают, что это не главная причина [4].
Современное понимание патогенеза мигрени связано с вовлечением определенных нервных путей и нейропептидов, в особенности тройничного нерва и CGRP — пептида, связанного с геном кальцитонина (calcitonin gene-related peptide). Исследования показали, что возбужденные нервные клетки могут активировать тройничный нерв, что приводит к выделению CGRP и других нейропептидов. CGRP сильно расширяет сосуды, вызывая локальный отек, а это привлекает клетки, участвующие в процессе воспаления. При воспалении сосудов черепа и твердой мозговой оболочки провоспалительные молекулы стимулируют болевые окончания мозговых оболочек, что и приводит к мигрени (рис. 1) [5–8].
Такое возбуждение нервных клеток, запускающее мигрень, связано с наследственностью и физиологией, однако сегодня его причины определены далеко не точно [3]. Известно только, что этот процесс может провоцироваться самыми разными факторами: от банальных стрессов, усталости и недостаточного сна до текущего гормонального фона, депрессивных состояний и приема медикаментов [9].
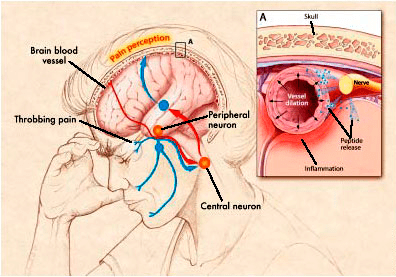
Рисунок 1. Патогенез мигрени
При этом мигрень проявляется не только головной болью: симптомы этой серьезной болезни гораздо разнообразнее, а зачастую и более болезненны. Изнурительные приступы мигрени могут быть мучительными и невыносимыми и подчас продолжаются от нескольких часов до нескольких дней, сопровождаясь тошнотой, рвотой и повышенной чувствительностью к свету, звукам и запахам [3], [10]. Такие приступы лишают возможности нормально мыслить, жить и работать миллионы людей во всем мире. Считается, что от мигрени сегодня страдает каждый седьмой житель планеты, а в рейтинге причин, ограничивающих трудоспособность, это заболевание заняло второе место в мире (по данным 2016 года) [11], [12].
Неудивительно, что мигрень была включена Всемирной организацией здравоохранения в список заболеваний, в наибольшей степени нарушающих социальную адаптацию пациентов [3].
Лечение мигрени сегодня
К сожалению, сегодня не существует лекарства , позволяющего раз и навсегда избавиться от мигрени. Применяющиеся препараты позволяют в основном снизить интенсивность и количество приступов или уменьшить симптомы и облегчить возникшую боль. В связи с этим терапию такими препаратами делят на две группы:
- Абортивная (острая) терапия — для снятия или уменьшения симптомов при уже появившейся мигрени.
- Профилактическое лечение — для снижения интенсивности, продолжительности или частоты возникновения приступов.
При лечении легкой и средней мигрени назначают различные анальгетики и НПВП (нестероидные противовоспалительные препараты), в том числе и широко известные парацетомол, ацетилсалициловая кислота и ибупрофен, иногда в сочетании с кофеином, кодеином или психотропными веществами в составе комбинированных лекарств [14], [15]. Существенный недостаток — возможный обратный эффект при неконтролируемом использовании анальгетиков: усугубление головной боли, которая в таких условиях может стать ежедневной [8], [15].
В отличие от своего знаменитого производного — ЛСД, — сам эрготамин не обладает галлюциногенными свойствами.
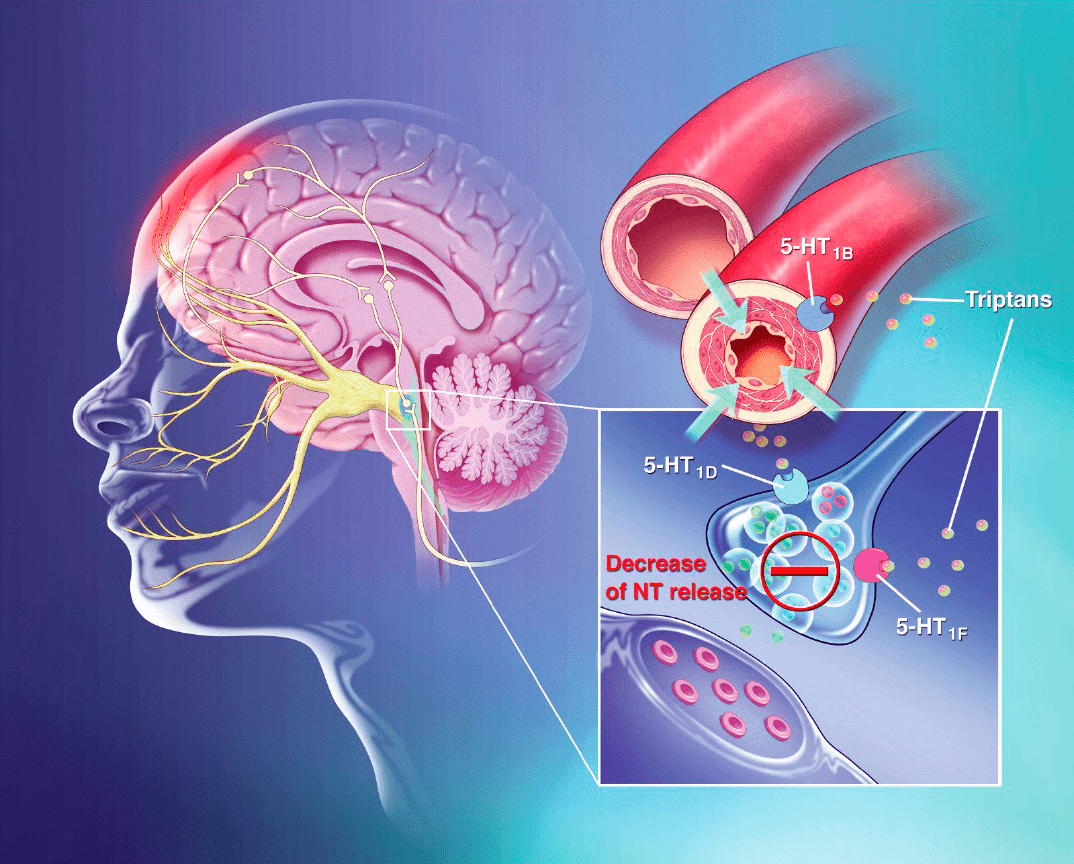
Однако несмотря на хороший профиль эффективности и безопасности, триптаны теоретически могут быть опасны для пациентов с ишемической болезнью сердца из-за своего сосудосуживающего действия, что сдерживает их широкое назначение в качестве терапии при мигрени [16].
Медикаментозная профилактика показана, когда мигрени регулярны (более 2–3 раз в месяц), и надо сказать, что сегодня такая терапия не совсем безопасна и эффективна: ее связывают со значительными побочными эффектами и развитием быстрой толерантности к лечению (тахифилаксией) [14]. При этом используют несколько классов лекарств, изначально разработанных для других показаний, и пока что во многом с неясным механизмом действия при мигрени. Из этих лекарств можно отметить: трициклические антидепрессанты, противоэпилептические препараты, бета-блокаторы, блокаторы кальциевых каналов, ингибиторы АПФ и некоторые другие [14], [19].
Таргетная терапия мигрени: решение проблемы?
Поскольку мигрень — хроническое заболевание, а эффективность и безопасность используемых для профилактики препаратов оставляет желать лучшего, очевидно, что в этой области есть неудовлетворенная потребность; при этом специально разработанных для этого показания новых лекарств существует немного [14].

Очищать биотехнологически полученные антитела можно с помощью хроматографического оборудования партнера этого материала — компании GE Healthcare. Это делается в режиме непрерывной противоточной хроматографии (periodic counter-current chromatography, PCC) на установке ÄKTA pcc. В сочетании с минимальными габаритами системы технология непрерывной хроматографии обеспечивает максимально эффективное использование хроматографического сорбента (смолы). Этот метод особенно удобен для очистки нестабильных молекул, так как быстрый процесс обеспечивает стабильность целевого продукта. Система ÄKTA pcc разработана на основе хорошо зарекомендовавшей себя и широко используемой учеными во всем мире платформы для хроматографических систем ÄKTA. Ключевые характеристики системы ÄKTA pcc:
- Скорость потока: 0,5–75 мл/мин.
- Максимальное рабочее давление: 20 бар.
- Поддержка трех- и четырехколоночной конфигурации PCC (3C и 4C PCC).
- Интегрированные УФ-детекторы: один с перестраиваемой длиной волны (три значения) и три с фиксированной длиной волны (280 нм).
- Мониторы для отслеживания показателей pH и проводимости.
- Интерактивная визуализация, непрерывно отображающая состояние колонок и ход выполнения процесса.
- Линии трендов, позволяющие моментально приступить к анализу получаемой информации о процессе.
Хроматографические системы ÄKTA можно использовать вместе с колонками AxiChrom, хотя они подходят и для более крупных масштабов очистки белка. Широкий спектр размеров колонок одного типа (рис. 4) позволяет масштабировать очистку белков с минимальными изменениями параметров.

Рисунок 4. AxiChrom — семейство колонок для очистки белка от пилотных до промышленных масштабов с внутренним диаметров 50–1600 мм. Колонки AxiChrom удачно сочетают стандартизацию и возможности индивидуальной настройки и совместимы со множеством современных носителей, например, со смолой для очистки антител MabSelect SuRe™.
Проведенные компанией GE Healthcare исследования подтвердили сходство характеристик белка, очищенного в лаборатории и на производстве. При этом объем препарата был масштабирован в 294 раза (рис. 5).
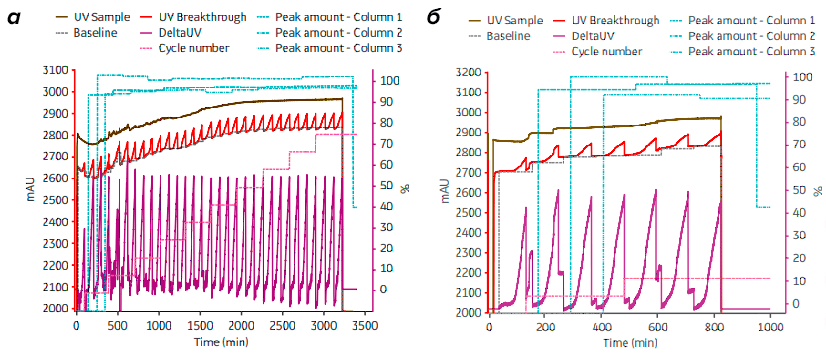
Рисунок 5. Сравнение хроматограмм, полученных с помощью ÄKTA pcc на колонках HiTrap (а) и на колонках AxiChrom 50 (б)
Материал предоставлен партнёром — компанией GE Healthcare
Заключение
Мигрень сегодня — серьезнейшая проблема: эта болезнь нарушает трудоспособность и снижает качество жизни огромного числа людей во всем мире. При этом ее лечение остается непростой задачей: длительное изучение болезни и испытания множества лекарств и нефармакологических средств лечения пока не привело к победе над недугом. Однако появление на рынке современных таргетных препаратов уже вывело лечение многих болезней на совершенно новый уровень [23], и потому создание точечно действующего лекарства против мигрени — определенно, шаг в верном направлении.
Читайте также:




