Атрофия мозолистого тела при рассеянном склерозе
Роль атрофических изменений ЦНС в развитии инвалидизации у больных рассеянным склерозом. Основные методики оценки степени атрофии ЦНС с помощью МРТ
В настоящее время атрофия головного мозга рассматривается, как наиболее специфический маркер тяжести заболевания (Miller D.H. et al., 2002). Исследователи считают, что общий объем очагов демиелинизации при рассеянном склерозе не позволяет достоверно оценить суммарную истинную потерю мозговой ткани, так как не обнаружено взаимосвязи между общим объемом очагов и степенью атрофии. Это позволяет предположить, что процессы, приводящие к атрофии, могут развиваться независимо от фокальной демиелинизации (Ge Y. et al., 2000).
Для корректного измерения атрофии и использования полученных результатов в качестве адекватного параклинического маркера степени нетрудоспособности и прогноза заболевания необходимо понимать, как атрофия проявляется на изображениях мозга, белое или серое вещества ЦНС страдает преимущественно. Кроме того, необходимо представлять какие процессы и механизмы лежат в основе атрофических изменений, визуализируемых с помощью различных радиологических методик (Simon J.H., 2006).
Наличие общей (тотальной) атрофии головного мозга на МРТ у больных рассеянным склерозом первоначально было показано качественно (Huber S.J. et al., 1988; Fox N.C. et al., 2000). Описаны расширение желудочков, субарахноидальных пространств, уменьшение объема мозговой паренхимы (Dietemann J.L. et al., 1988). Simon H. и др. отметили, что потеря мозговой ткани выявляется уже на ранних стадиях заболевания. При измерении диаметра третьего и боковых желудочков головного мозга и площади мозолистого тела с интервалом один и два года отмечено увеличение размера желудочков соответственно уменьшению площади мозолистого тела. Нарастание площади очагов строго предшествовало прогрессирующему увеличению третьего желудочка, позволяя предположить, что активное воспаление способствует развитию атрофии головного мозга (Simon J.H. et al., 1999; Dalton С.M. et al., 2002).
Современные методы измерения выраженности атрофии головного мозга у больных рассеянным склерозом можно разделить на две основные группы: основанные на регистрации и основанные на сегментации, однако большинство методик измерения атрофии используют оба эти подхода. К основным методам, основанным на регистрации относятся: BBSI (the brain boundary shift integral - интегральное изменение границы мозга), SIENA (structural image evaluation using normalization of atrophy - изображения с использованием нормализации атрофии), SPM (statistical parametric mapping - статистическое параметрическое картирование), TDS (template-driven segmentation - сегментация, выполненная по шаблону) и VBM (voxel-based morphometry - воксель-зависимая морфометрия).
BBSI - высоко автоматизированный, чувствительный и воспроизводимый метод, позволяющий сократить время анализа, зависимость от эксперта и эффект от ошибки при сегментации (Fox N.C. et al., 1996; Fox N.C. et al., 1997) - использует ко-регистрацию серийных МРТ-изображений для непосредственного измерения объема мозга. Вслед за цифровой субтракцией проводится точное позиционное приведение в соответствие серийных изображений. Изменения объема мозга измеряются интегрированием латеральных перемещений границ мозга и желудочков, которые являются результатом атрофии. При изучении скорости нарастания атрофии мозговой паренхимы больных рассеянным склерозом в течение года было показано, что она в три раза выше показателей в группе здорового, сходного по возрасту контроля, а скорость увеличения размеров желудочков выше соответственно в 5 раз. Корреляции между степенью атрофии и инвалидизацией больных, однако, обнаружено не было (Fox N.C. et al., 2000).
SIENA – полностью автоматизированный метод, позволяющий анализировать изменения головного мозга, развивающиеся с течением времени. SIENA дает возможность при получении серийных изображений сегментировать головной мозг от не мозговых тканей и оценивать наружную поверхность черепа по определенной шкале, осуществляя нормализацию. Miller D.H. и др., используя метод SIENA, показали наличие достоверной атрофии у больных рассеянным склерозом и обнаружили строгую взаимосвязь между объемом мозга и тяжестью инвалидизации по шкале EDSS (Miller D.H. et al., 2002).
Метод SPM разработан для измерения объема мозга, как фракции внутричерепного объема. При SPM используется стереотаксический атлас нормализации для классификации вокселей ЦСЖ, белого и серого вещества в соответствии с их локализацией и интенсивностью сигнала (Ashburner J., Friston K.J., 2000). SPM может использоваться как для проведения межсубъектного анализа, так и для исследований нарастания атрофии с течением времени (Chard D.T. et al., 2002a). С помощью SPM была выявлена достоверная атрофия белого и серого вещества уже на ранних клинических стадиях развития рассеянного склероза после нивелирования эффектов связанных с полом и возрастом (Chard D.T. et al., 2002b; Kassubek J. et al., 2003).
VBM для измерения объема мозга использует нейроанатомические характеристики. Метод основан на оценке локальной структуры мозгового вещества после нивелирования макроскопических различий формы. VBM включает воксельный метод сравнения изображений после деформации полей для частичной нормализации изображений. Затем отличия в объеме мозга и концентрации ткани измеряются на структурных МРТ снимках для всего мозга в целом. В результате получается статистическая параметрическая карта, где наиболее яркими являются регионы с выраженным отличием концентрации вещества (серого или белого) между группами. VBM позволяет проводить объективную оценку при проведении серийных исследований и изучать изменения объема, произошедшие в течение определенного времени (Good C.D. et al., 2001; Morgen K. et al., 2006; Sepulcre J. et al., 2006; Esteban F.J. et al., 2007).
Методы основанные на сегментации: BPF (brain parenchymal fraction - фракция мозговой паренхимы), IBA (index of brain atrophy - индекс атрофии мозга), BICCR (brain to intracranial capacity ratio - отношение объема мозга к внутричерепному объему), WBR (whole brain ratio – мозговой коэффициент), метод Удупа, метод Альфано и др.
Что это такое
Подобно химическим элементам, которые соединяются различными видами связей, левое и правое полушарие конечного мозга соединяются между собой мозолистым телом. Эта структура выступает связывающим мостом между двумя отделами мозга.
Мозолистое тело это структура, состоящая из скоплений нервных волокон – аксонов (до 300 миллионов), и располагается под корой полушарий. Это образование присуще только млекопитающим. Тело состоит из трех частей: задний отдел – валик, передний отдел – это колено, переходящее в дальнейшем в ключ; между валиком и коленом располагается ствол.
История открытия
Несмотря на активное изучение структур мозга в прошлом столетии, функции мозолистого тела долго оставались в тени от научного микроскопа исследователей. Пристальное внимание волокнистое образование получило от американского нейропсихолога Роджера Сперри, получившего в дальнейшем Нобелевскую премию за его изучение.
Ученый провел серию оперативных вмешательств на мозолистом теле: как всякий нейропсихолог, Сперри перерезал контакты, удалял структуру и наблюдал за работой мозга после операций. Он заметил закономерность: при удалении нейронной сети, соединяющей оба полушария, пациент, ранее страдавший эпилепсией, избавлялся от своего недуга. Исследователь сделал вывод: мозолистое тело активно участвует в эпилептическом процессе и распространении патологического возбуждения по разным отделам мозга. В 1981 году Роджер Сперри за результаты своих трудов удостоился престижнейшей международной премии в области физиологии и медицины.
Тем не менее, несмотря на подобные изучения, полный функциональный набор этой структуры все еще не открыт, и с его деятельностью связывают множество загадок в работе головного мозга, в том числе и развитие шизофренического процесса.


За что отвечает мозолистое тело
Обладая колоссальным количеством аксонов (структуры, отвечающие за передачу электрического импульса к нервным клеткам), мозолистое тело в буквальном смысле соединяет два полушария головного мозга. Его волокна связывают аналогичные участки коры (например: теменная кора левого полушария соединяется с таковой правого). Таким образом, волокнистое скопление отвечает за координацию и совместную работу обеих частей мозга. Исключением является височная кора, так как за ее соединение отвечает соседняя мозолистому телу структура – передняя спайка.
К функциям этой структуры также относится поддержание интеллектуальной деятельности человека: осуществляя синтез информации двух отделов мозга, мозолистое тело обеспечивает более глубокое осмысление полученных извне данных. В поддержание этой позиции свидетельствует эксперимент (вся нейрофизиология базируется на экспериментальных данных): рассекая и извлекая скопление соединяющих нервных волокон, ученые заметили, что исследуемые обретают сложности в понимании письменной и устной речи.
К самым интересным и загадочным функциям относится единство сознания и эмоциональной реакции на раздражитель. При удалении мозолистого тела, люди, как правило, проявляли двоякое отношение к явлению или объекту (амбивалентность). То есть у них наблюдалось наличие двух диаметрально противоположных мыслей или эмоций одновременно, как-то: ненависть и любовь, страх и удовольствие, отвращение и заинтересованность. Подобный феномен наблюдается в психопатологии шизофрении, когда больные, сами того не осознавая, проявляли любовь и ненавистную вражду к чему-то. Речь идет не о поочередном проявлении противоположных чувств: эмоции располагаются на параллельных прямых и в одном отрезке времени.
Мозолистое тело у мужчин и женщин
Мужской и женский мозг развивается по-разному: начиная от внутриутробного формирования нервной трубки по половым признакам и заканчивая пожизненным действием гормонов. В последнее время часто можно услышать, что женский организм не отличается от мужского. Однако это неправда: нейрофизиология, психофизиология и нейропсихология предоставляет множество экспериментальных данных в пользу отличия мужского мозга и женского.
Заболевания
Дисгенезия, она же – дисплазия мозолистого тела головного мозга – это врожденная патология нервной структуры, проявляющаяся в аномальном ее развитии отдельных участков и тканей. Заболевания является результатом дефекта некоторых хромосом. Болезнь сопровождается нарушением тканевого состава мозолистого тела и влечет за собой нарушение его функций.
Последствия дисгенезии мозолистого тела головного мозга проявляются в виде расстройств неврологической и психической сферы человека. К ним относится:
- замедление реакции на внешние раздражители;
- замедление развития интеллектуальных свойств психики;
- нарушение распознавания и понимания письменной речи;
- дислексия;
- затруднение и заторможенность в обработке световых сигналов головным мозгом.
Кроме этого, существует так же еще одна патология – отсутствие мозолистого тела головного мозга у новорожденного – агенезия.
Данная патология распространяется в среднем до 3% в популяции, что является довольно высоким показателем. Агенезия мозолистого тела – это болезнью, которая часто сопровождается с другими недугами. Врожденное отсутствие связывающей полушария структуры имеет свои симптомы:
- Hзамедление психологического и неврологического развития ребенка;
- лицевой дисморфизм – нарушение кровотока мимических мышц лица;
- патология желудочно-кишечного тракта, почек и наличие опухолей;
- чрезмерно быстрое половое развитие;
- эпилептические припадки;
- грубые нарушения развития внутренних органов;
- дефекты в развитии зрительной системы;
- болезни опорно-двигательного аппарата;H
Эта патология характеризуется неполным развитием тканей мозолистого тела. В отличие от предыдущего недуга, гипоплазия проявляется недоразвитием, а не полным отсутствием структуры. Гипоплазия мозолистого тела головного мозга у ребенка диагностируется врачами на протяжении первых месяцев жизни, потому что проявления болезни отличительны:
- спазмы неочевидного происхождения;
- эпилептические состояния (припадки, локальные судороги);
- слабый крик младенца;
- отсутствие или нарушение чувствительной сферы, то есть ребенок может не слышать, не видеть или не ощущать запахи;
- ослабления мышечной силы или ее отсутствие, следственно, атрофия или очень слабые мышцы.
Последствия гипоплазии мозолистого тела головного мозга недоброжелательны, и при отсутствии должной диагностики прогноз неблагоприятен. В 70% дети, с такой патологией, страдают серьезной умственной отсталостью.
Мозолистое тело может страдать очагами демиелинизации – заболеванием, при котором разрушается внешняя оболочка аксона. Миелин играет крайне важную роль в работе мозга: благодаря ему скорость передачи электрического импульса по просторам серого вещества достигает сотни метров в секунду, без миелина же – до 5 м/с. Наличие очагов в тканях тела вызывает торможение хода нервного сигнала и, следовательно, ухудшается взаимосвязь между полушариями. Кроме собственно демиелинизации, возникновение очагов является предпосылкой к развитию рассеянного склероза.
Аннотация научной статьи по клинической медицине, автор научной работы — Джапаралиева Н.Т., Лорина Л.В.
Проанализированы изменения параметров мозолистого тела в зависимости от типа течения, срока заболевания и степени инвалидизации при рассеянном склерозе . Наиболее чувствительным по отношению к исследуемым показателям оказался ствол мозолистого тела , в меньшей степени колено. Атрофические изменения колена и ствола мозолистого тела прогрессируют с утяжелением типа течения заболевания, увеличением срока болезни и нарастанием степени инвалидизации. При одинаковом сроке заболевания атрофия мозолистого тела у больных с первично-прогредиентным течением рассеянного склероза выражена гораздо сильнее, чем при других типах течения. Уменьшение размеров мозолистого тела при прогрессирующих типах течения свидетельствует о продолжающейся вторичной дегенерации волокон.
Похожие темы научных работ по клинической медицине , автор научной работы — Джапаралиева Н.Т., Лорина Л.В.
ATROPHIC CHANGES OF THE CORPUS CALLOSUM IN MULTIPLE SCLEROSIS
The changes in the parameters of the corpus callosum , depending on the type of flow, duration of disease and degree disability in multiple saclerosis. Most sensitive with respect to the investigated indices proved trunk of the corpus callosum , to a lesser extent the knee. For the same period of the disease atrophy of the corpus callosum in patients with primary progressive course of multiple sclerosis is much more pronounced than in other types of flow. Reducing the size of the corpus callosum in progressive types of flow suggests ongoing secondary degeneration of fibers.
АТРОФИЧЕСКИЕ ИЗМЕНЕНИЯ МОЗОЛИСТОГО ТЕЛА ПРИ РАССЕЯННОМ СКЛЕРОЗЕ
Н.Т. Джапаралиева, Л.В. Лорина Рязанский государственный медицинский университет им. акад. И.П. Павлова, г. Рязань
Проанализированы изменения параметров мозолистого тела в зависимости от типа течения, срока заболевания и степени инвалидизации при рассеянном склерозе. Наиболее чувствительным по отношению к исследуемым показателям оказался ствол мозолистого тела, в меньшей степени колено. Атрофические изменения колена и ствола мозолистого тела прогрессируют с утяжелением типа течения заболевания, увеличением срока болезни и нарастанием степени инвалидизации. При одинаковом сроке заболевания атрофия мозолистого тела у больных с первично-прогредиентным течением рассеянного склероза выражена гораздо сильнее, чем при других типах течения. Уменьшение размеров мозолистого тела при прогрессирующих типах течения свидетельствует о продолжающейся вторичной дегенерации волокон.
Ключевые слова: мозолистое тело, МРТ-морфометрия, атрофия, рассеянный склероз.
Рассеянный склероз (РС) - заболевание с аутоиммунными механизмами, характеризующееся появлением ограниченных зон воспаления, демиелинизации и аксонального повреждения в центральной нервной системе, которые могут быть выявлены морфологически и с помощью магнитно-резонансной томографии (МРТ). Общепризнанным является диффузное поражение белого и серого вещества центральной нервной системы, приводящее к развитию атрофии головного и спинного мозга [1, 5].
Выраженность неврологических симптомов при РС в большой степени связана с общей атрофией головного мозга [11]. В настоящее время атрофия головного мозга рассматривается, как наиболее специфический маркер тяжести заболевания [4]. В морфологических и МРТ исследованиях была показана относительно ранняя и быстро нарастающая атрофия мозолистого тела (МТ) [7]. На более поздних стадиях болезни отмечено
уменьшение объема мозолистого тела, развивающееся по мере прогрессирования заболевания [6]. Объем мозолистого тела коррелировал с тяжестью заболевания, при этом отсутствовали корреляции между выраженностью атрофии и полом, возрастом больных, длительностью и возрастом начала заболевания, типом течения рассеянного склероза [7]. Недостаточность сведений о скорости и временном интервале развития каллозальной атрофии с момента поражения вещества головного мозга уменьшает достоверность подобных исследований [8]. Кроме того, отмечается противоречивость данных о связи атрофии спайки с клиническими симптомами при рассеянном склерозе [7]. Исследования, продемонстрировавшие важную роль атрофии в развитии нетрудоспособности больных РС, ставят вопрос о необходимости точного измерения выраженности атрофических изменений мозолистого тела. Современные методи-
ческие подходы требуют специальной аппаратуры, компьютерных программ и обученного персонала, что возможно только в некоторых специализированных центрах. В связи с этим большой интерес представляют простые линейные методы оценки атрофии [3, 4].
Цель работы: с помощью методики МРТ-морфометрии выявить изменения мозолистого тела, наблюдающиеся на МРТ у больных рассеянным склерозом, и установить взаимосвязь данных изменений с типом течения, сроком заболевания и степенью инвалидизации больных.
Материалы и методы
Обследовано 120 пациентов, из них 46 мужчин (38,3%) и 74 женщины (61,7%) в возрасте от 19 до 65 лет, средний возраст 39,74±11,96. На момент обследования в возрастной группе до 30 лет находился 31 человек (25,8 %), в группе 31-40 лет - 30 больных (25%), в возрасте 41-50 лет - 35 пациентов (29,2%), старше 51 года - 24 человека (20%). Всем больным был выставлен диагноз достоверный рассеянный склероз согласно критериям Макдональда (2005). Дебют рассеянного склероза (ДРС) диагностирован у 12 человек (10%), ремиттирующий РС (РРС) -у 53 пациентов (44,2%), вторично-прогредиентный РС (ВПРС) - у 43 больных (35,8%), первично-прогредиентный РС (ППРС) - у 12 человек (10%). Срок заболевания составил от 1 до 20 лет, в среднем 7,89±5,22, при этом 2/3 пациентов (66,7%) болели менее 10 лет.
Оценка неврологического статуса пациентов проводилась по шкале функциональных систем Куртцке и шкале инвалиди-зации EDSS. Средний балл обследованной группы больных по шкале EDSS составил 4,11±1,48 балла (от 2,0 до 8,0). На основании степени инвалидизации выделено 3 группы пациентов: EDSS Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
1 13,0 (11,0-13,0) 6,5 (6,0-7,0) 10,0 (10,0-12,0)
Срок болез- 2-5 11,0 (10,0-12,0) 6,0 (5,0-6,0) 10,5 (9,0-12,5)
ни 6-10 10,0 (8,7-11,0) 5,0 (4,0-5,0) 11,0 (9,0-11,0)
11-20 8,0 (6,0-9,0) 4,0 (3,0-5,0) 10,0 (7,3-11,0)
EDSS (баллы) 1-3 8,0 (6,0-9,0) 5,0 (4,0-5,9) 9,0 (8,0-11,0)
3,5-5 10,0 (9,0-11,0) 5,0 (4,0-6,0) 1,10 (9,0-12,0)
5,5-8 8,0 (6,0-10,0) 4,0 (3,0-5,0) 9,0 (8,0-11,0)
При анализе параметров мозолистого тела между группами в зависимости от типа течения получены следующие результаты. В группе пациентов с дебютом РС выявлены достоверные различия (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
2-5 - 6-10 297,5 0,021 242,0 0,001 448,0 0,976
2-5 - 11-20 207,5 0,000 205,5 0,000 437,0 0,181
6-10 - 11-20 359,0 0,019 367,5 0,022 434,5 0,170
В связи с особенностями течения и скорости прогрессирования группа пациентов с первично-прогрессирующим РС анализировалась отдельно. Средний срок заболевания у пациентов с первично -прогредиентным течением составил 7,25±4,33 лет, т.е. практически совпадал с общим средним сроком заболевания. При этом выявлена статистически достоверная разница (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Срок болезни ,373 (**) - ,586 (**) -,504 (**) -,562 (**) -,196 (*)
,449 (**) ,586 (**) - -,371 (**) -455 (**) -,150
Колено МТ ,001 -,504 (**) -,371 (**) - ,656 (**) ,588 (**)
Ствол МТ -,095 -,562 (**) -455 (**) ,656 (**) - ,562 (**)
Валик МТ ,123 -,196 (*) -,150 ,588 (**) ,562 (**) -
Примечание. Статистическая значимость корреляций: * - р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
ATROPHIC CHANGES OF THE CORPUS CALLOSUM IN MULTIPLE SCLEROSIS
N.T. Dzhaparalieva, L. V. Lorina
The changes in the parameters of the corpus callosum, depending on the type of flow, duration of disease and degree disability in multiple saclerosis. Most sensitive with respect to the investigated indices proved trunk of the corpus callosum, to a lesser extent the knee. For the same period of the disease atrophy of the corpus callosum in patients with primary progressive course of multiple sclerosis is much more pronounced than in other types of flow. Reducing the size of the corpus callosum in progressive types of flow suggests ongoing secondary degeneration of fibers.
Keywords: the corpus callosum, MRI morphometric, atrophy, multiple sclerosis.
Лорина Л.В. - к.м.н., доц. кафедры неврологии, нейрохирургии и медицинской генетики ГБОУ ВПО РязГМУ Минздрава России.
Джапаралиева Н.Т. - очный аспирант кафедры неврологии, нейрохирургии и медицинской генетики ГБОУ ВПО РязГМУ Минздрава России.

Рассеянный склероз – хроническое аутоиммунное заболевание центральной нервной системы (ЦНС), характеризующееся недостаточно изученным этиопатогенезом, вариабельностью неврологической картины и малопредсказуемым прогнозом. Весомый вклад в понимание природы РС внес метод магнитно-резонансной томографии (МРТ), позволяющий проследить in vivo динамику повреждения головного и спинного мозга. Стало ясно, что очаги в белом веществе – это только часть всего спектра нейровизуализационных проявлений РС. Данные МР-спектроскопии подтвердили более ранние наблюдения о том, что не только миелиновая оболочка, но и аксоны и нейроны поражаются при РС [1]. Новые сведения о нейродегенеративном компоненте первично демиелинизирующего заболевания способствовали поиску новых клинико-радиологических взаимосвязей. Было показано, что развитие необратимой инвалидизации связано с дегенеративным процессом 4. Eshanghi A. и соавт. в своем исследовании пришли к выводу, что уменьшение объема глубокого (а не коркового) серого вещества связано с нарастанием степени инвалидизации, оцениваемой по шкале EDSS [5]. В настоящее время церебральная атрофия считается суррогатным маркером прогрессирования РС и отражает деструктивный необратимый процесс. Основу атрофии мозга при РС предположительно составляют как потеря миелина, олигодендроцитов, так и дегенерация аксонов и нейронов [6, 7].
Различают общую (увеличение желудочков мозга и субарахноидальных пространств) и регионарную (уменьшение отдельных структур мозга) церебральную атрофию. Для оценки атрофического процесса используют планиметрические (линейные измерения) и волюметрические (измерение объемов) подходы. В повседневной клинической практике дифференцированно оценить поражение серого и белого вещества затруднительно в силу материальных, временных и технических причин. По мнению F. Barkhof и соавт., оценка общей атрофии головного мозга является одним из наиболее перспективных направлений для клинических исследований нейропротективных и репаративных стратегий при рассеянном склерозе, мишенью которых является нейродегенеративный компонент заболевания [8]. Таким образом, необходимость оценки атрофии ЦНС продиктована ее прогностической значимостью. Однако оценке церебральной атрофии в рутинной клинической практике отводится недостаточное внимание.
Цель исследования – изучить взаимосвязь атрофического процесса головного мозга и степени инвалидизации пациентов с рассеянным склерозом.
Материал и методы
В исследование были включены 135 пациентов с установленным диагнозом РС согласно критериям MAGNIMS 2016 и 55 здоровых добровольцев. Оценка клинического статуса у больных рассеянным склерозом проводилась по общепринятой методике с использованием шкалы неврологического дефицита Курцке для оценки нарушений основных неврологических функций. Степень инвалидизации определена по шкале EDSS (expanded disability status scalе). Пациенты, страдающие заболеваниями, сопровождающимися многоочаговым поражением ЦНС, исключались из исследования.
– ширина третьего желудочка (ШТЖ) в его середине;
– индекс третьего желудочка (ИТЖ) – отношение ШТЖ к расстоянию между наиболее удаленными внутренними поверхностями костей черепа;
– ширина передних рогов боковых желудочков (ШПР) на уровне хвостатых ядер;
– ширина боковых желудочков на уровне тел (ШТБЖ);
– индекс боковых желудочков (ИБЖ) – отношение расстояния между наружными стенками боковых желудочков к расстоянию между наиболее удаленными внутренними поверхностями костей черепа;
– межъядерный показатель (МП) – отношение наименьшего расстояния между медиальными границами хвостатых ядер к расстоянию между границами мозга вдоль той же линии.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
1. Barnard R. O., Trigg M. Corpus callosum in multiple sclerosis // J. Neurol Neurosurg Psychiatry.- 1974.- Vol. 37.- Р 1259-1264.
2. Simon J. H., Schiffer R. B., Rudick R. A. et al. Quantitative determination of MS induced corpus callosum atrophy in vivo using MR imaging // Am. J. Neuroradiol.- 1987.- Vol. 8.- Р 599-604.
3. Dietemann J. L., Beigelman C., Rumbach L. et al. Multiple sclerosis and corpus callosum atrophy: relationship of MRI findings to clinical data // Neuroradiology.- 1988.- Vol. 30.- Р 478-480.
4. Wahl M., Lauterbach-Soon B., Hattingen E. et al. Human motor corpus callosum: topography, somatotopy, and link between microstructure and function // J. Neurosci.- 2007.- Vol. 27.- Р 12132-12138.
5. Llufriu S., Blanco Y., Martinez-Heras E. et al. Influence of corpus callosum damage on cognition and physical disability in multiple sclerosis: a multimodal study // PLoS One.- 2012.- Vol. 7 (5).- e37167.
6. Fabri M., Pierpaoli C., Barbaresi P. et al. Functional topography of the corpus callosum investigated by DTI and fMRI // World J. Radiol.- 2014.- Vol. 6.- Р 895-906.
7. Gean-Marton A. D., Vezina L. G., Marton K. I. et al. Abnormal corpus callosum: a sensitive and specific indicator of multiple sclerosis // Radiology.- 1991.- Vol. 180.- Р 215-221.
8. Pelletier J., Suchet L., Witjas T. et al. Alongitudinal study of callosal atrophy and interhemispheric dysfunction in relapsing-remitting multiple sclerosis // Arch Neurol.- 2001.- Vol. 58.- Р 105-111.
9. Yaldizli O., Atefy R., Gass A. et al. Corpus callosum index and long-term disability in multiple sclerosis patients // J. Neurol.- 2010.- Vol. 257.- P 1256-1264.
10. Ozturk A., Smith S. A., Gordon-Lipkin E. M. et al. MRI of the corpus callosum in multiple sclerosis: association with disability // Mult Scler.- 2010.- Vol. 16.- Р 166-177.
11. Lin X., Tench C. R., Morgan P. S. et al. Use of combined conventional and quantitative MRI to quantify pathology related to cognitive impairment in multiple sclerosis // J. Neurol Neurosurg Psychiatry - 2008 - Vol. 79.- Р 437-441.
13. Магонов Е. П., Прахова Л. Н., Ильвес А. Г., Катаева Г. В., Трофимова Т. Н. Автоматическая сегментация МРТ-изображений головного мозга: методы и программное обеспечение // ВИЧ-инфекция и иммуносупрессии.- 2014.- Т. 6, № 3.- С. 73-77.
14. Прахова Л. Н., Ильвес А. Г., Магонов Е. П. и др. Атрофия коры головного мозга при рассеянном склерозе // Журнал неврологии и психиатрии им. С. С. Корсакова.- 2014.- Т. 10.- С. 43-49.
15. Прахова Л. Н., Магонов Е. П., Ильвес А. Г. и др. Влияние нейродегенеративных изменений в головном мозге на формирование клинической картины заболевания у больных рассеянным склерозом // Бюллетень сибирской медицины.- 2013.- Т. 12, № 3.- С. 52-60.
16. Прахова Л. Н., Богдан А. А., Ильвес А. Г., Магонов Е. П. Савинцева Ж. И., Трофимова Т. Н. Особенности развития нейродегенерации таламуса у больных рассеянным склерозом // Лучевая диагностика и терапия.- 2015.- Т. 6, № 4.- С. 35-41

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Мозолистое тело представляет собой плотную группу нервных волокон, которая делит кору больших полушарий на правое и левое. Оно соединяет правую и левую половины, тем самым обеспечивая связь между полушариями. Данная структура передает моторную (двигательную), сенсорную и познавательную информацию между полушариями головного мозга.
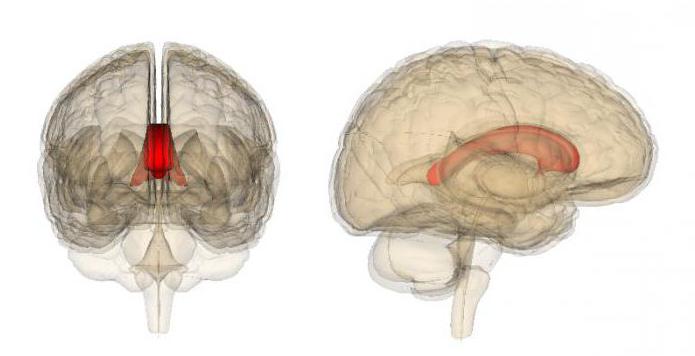
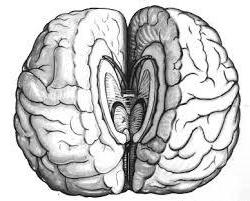
История изучения
Мозолистое тело долгое время оставалось загадкой анатомии человека. Ученые никак не могли определить, какую именно функцию несет этот участок головного мозга. Кстати, в 1981 году ученый, открывший мозолистое тело, получил за это Нобелевскую премию. Звали его Роджер Сперри.
Первые операции на мозолистом теле преследовали своей целью лечение эпилепсии. Так, нарушая связь между полушариями, многих пациентов врачи действительно излечивали от эпилептических припадков. Но со временем ученые обратили внимание на возникновение у таких больных специфических побочных эффектов – изменялись поведенческие реакции, способности. Так, в результате экспериментов было установлено, что после операции, затронувшей мозолистое тело, человек мог писать исключительно правой рукой, а рисовать только левой. Так мозолистое тело, функции которого были все еще неизвестны ученым, перестали рассекать в хирургии для лечения эпилепсии.
Спустя несколько лет ученые обнаружили связь между очагом мозолистого тела и развитием рассеянного склероза.
Мозолистое тело: функции
Функции данного участка мозга довольно разнообразны и важны. Мозолистое тело является самым крупным пучком нервных волокон в головном мозге. Оно содержит около 200 миллионов аксонов и осуществляет несколько важнейших функций в организме:
- Связь между полушариями головного мозга.
- Движение глазных яблок.
- Поддержание баланса между процессами возбуждения и торможения в коре головного мозга.
- Тактильное восприятие.
Локализация
Пространственно эта часть мозга расположена под полушариями по срединной линии. От передней к задней части в мозолистом теле можно выделить несколько различных зон: колено, средняя часть, тело, задний конец и валик. Колено, загибаясь вниз, образует клюв, а также ростральную пластину. Сверху мозолистое тело покрыто тонким слоем серого вещества.
Еще одна структура этого участка мозга – лучистость. Тяжи нейронов, имеющих вид веера, тянутся к лобным, теменным, височным и затылочным долям больших полушарий.
Агенезия мозолистого тела
При агенезии мозолистое тело головного мозга полностью или частично отсутствует. Данная аномалия мозга может быть вызвана целым рядом всевозможных факторов, в числе которых хромосомные мутации, генетическая наследственность, внутриутробные инфекции, а также другие причины, еще не до конца изученные учеными. Лица с агенезией мозолистого тела могут испытывать когнитивные и коммуникационные расстройства. Также они имеют трудности с пониманием устной речи и социальных ориентиров.

Но, учитывая функции, которое выполняет мозолистое тело головного мозга, как же люди, не имеющие его с рождения, вообще могут жить? Как осуществляется у них взаимодействие между правым и левым полушариями мозга? Ученые выяснили, что в состоянии покоя активность мозга здорового человека практически не отличается от таковой человека с диагнозом "агенезия мозолистого тела". Этот факт указывает на то, что мозг в данных условиях перестраивается, и функции отсутствующего мозолистого тела выполняют другие участки, здоровые. Как именно и за счет каких структур осуществляется этот процесс, ученые на сегодняшний день не выяснили.
Симптомы агенезии мозолистого тела
Несмотря на чрезвычайно малую встречаемость данного диагноза, ученые неплохо изучили его симптомы. Одни из наиболее распространенных проявлений агенезии мозолистого тела:
- Атрофия (полная или частичная) слухового и (или) зрительного нерва.
- Кистозные образования в тканях головного мозга (порэнцефалия).
- Соединительнотканные опухоли – липомы.
- Редчайшее нарушение внутриутробного развития плода шизэнцефалия – расщелина головного мозга.
- Существенное уменьшение размера мозга и черепа в целом – микроэнцефалия.
- Множественные патологии пищеварительной системы.
- Расщепление позвоночника.
- Нарушения структуры сетчатки глаз (синдром Экарди).
- Раннее половое созревание.
- Отставание в психомоторном развитии.
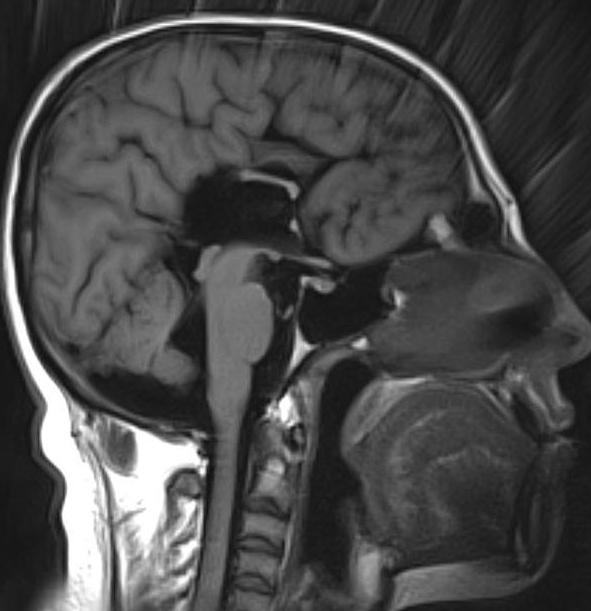
Эти и многие другие нарушения тем или иным образом тесно взаимосвязаны с отсутствием мозолистого тела. Как правило, они позволяют поставить диагноз в первые 1-2 года жизни ребенка. Окончательным подтверждением диагноза считается снимок МРТ головного мозга.
Гипоплазия мозолистого тела
Гипоплазия – это серьезный, но, к счастью, довольно редкий диагноз. По сути, это, как и агенезия, нарушение внутриутробного развития ткани головного мозга. Если при агенезии мозолистое тело мозга полностью отсутствует, то при гопоплазии оно недоразвито. Разумеется, лечение данного заболевания средствами современной медицины невозможно. Терапия предусматривает комплекс мероприятий, которые сводят к минимуму отклонения в развитии пациента. Нейропсихологи рекомендуют пациентам регулярно выполнять специально разработанный комплекс физических упражнений, способствующих восстановлению связей между полушариями, а также информационно-волновую терапию.
Половой диморфизм
Ряд российских и зарубежных ученых считают, что разница мышления и поведенческих реакций между мужчинами и женщинами связана с различным строением и размерами мозолистого тела. Так, в издании "Ньюсвик" вышла статья, объясняющая природу женской интуиции: у женщин мозолистое тело несколько шире, чем у мужчин. Этот факт, по мнению все тех же ученых, поясняет и то, что женщины, в отличие от мужчин, способны справляться с несколькими различными задачами одновременно.
Через некоторое время группа французских ученых сообщила, что в процентном соотношении к размерам мозга у мужчин мозолистое тело крупнее, чем у женщин, но никаких однозначных выводов ученые делать не стали. Как бы то ни было, все ученые согласны лишь с тем, что мозолистое тело – один из важнейших структурных компонентов, выполняющих ряд жизненно важных функций.
Читайте также:


